Способ получения 1, 3-диамино-2-гидроксипропан-n, n'-диметилфосфоновой-n, n'-диуксусной кислоты
Иллюстрации
Показать всеИзобретение относится к способу получения 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты, которая может быть применена в качестве ингибитора отложения минеральных солей в системах водопользования промышленных предприятий, предприятий большой и малой энергетики и коммунального хозяйства. Сущность предлагаемого способа заключается в получении 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты через синтез промежуточного продукта - 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты реакцией карбоксиметилирования 1,3-диамино-2-пропанола с последующим метилфосфорилированием данной кислоты формальдегидом и фосфористой кислотой, причем карбоксиметилирование осуществляют кальциевой солью монохлоруксусной кислоты, при мольном соотношении монохлоруксусной кислоты к 1,3-диамино-2-пропанолу 2.0-2.2:1.0 в присутствии оксида кальция при рН 9-11 и 60-65°С с последующим выделением 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты в форме дигидрохлорида, после чего проводят метилфосфорилирование обработкой формальдегидом и фосфористой кислотой при мольном соотношении 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты к формальдегиду и к фосфористой кислоте 1:2-2.1:2-2.1 и выделяют целевой продукт осаждением путем добавления метанола к упаренной реакционной смеси. Предложен новый эффективный способ получения ценного химического соединения. 2 з.п. ф-лы, 3 пр.
Реферат
Предлагаемое изобретение относится к химии аминофосфонокарбоновых кислот и непосредственно касается 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты, которая может использоваться в качестве ингибитора отложения минеральных солей в системах водопользования промышленных предприятий, предприятий большой и малой энергетики и коммунального хозяйства.
1,3-Диамино-2-гидроксипропан-N,N′-диметилфосфоновая-N,N′-диуксусная кислота имеет следующую формулу:
Согласно принятой в данной области химии классификации данную кислоту относят к классу полифункциональных комплексообразующих соединений, поскольку она сочетает в своей структуре амино-, фосфоновые, ацетатные и гидроксильную группы.
Известно, что фосфорсодержащие производные алифатических аминов, к каковым относится рассматриваемая кислота, способны ингибировать отложения минеральных солей в системах водопользования [Wang L., Yan J., Lu Z., Wu S. Study on compounding and synergistic effect of phosphono carboxylic acid with other corrosion and scale inhibitors // Chemistry & Bioengineering. 2009. № 1. P. 71-74].
1,3-Диамино-2-гидроксипропан-N,N′-диметилфосфоновую-N,N′-диуксусную кислоту получают известным методом нуклеофильного замещения хлора в 1,3-дихлор-2-пропаноле на аминогруппу глицина в щелочной среде и выделяют в виде дигидробромида с выходом 33% после подкисления реакционной массы бромистоводородной кислотой до рН 5 (Kanamori K., Yamomoto K., Okayasu Т., Matsui N., Okamoto K., Mori W. // Bull. Chem. Soc. Jpn. 1997. Vol. 70. P. 3031). Однако структура полученного данным способом соединения не подтверждена и, кроме того, приведенные в статье данные о существовании кислоты в виде дигидробромида при рН 4.5-5.0 противоречат известным сведениям о кислотах подобного типа, которые при рН 4.5-5.0 существуют в виде кислот, в виде дигидро-бромида(-хлорида) подобные кислоты существуют при рН 1.5-2.0 (Majer J., Kotoucek М., Dvorakova Е. // Chemicke Zvesti. 1966. Vol. 20. № 4. P. 242; Courtney R.C., Chabereck S.Jr., Martell A.E. // J. Am. Chem. Soc. 1953. Vol. 75. P. 4814).
Данная кислота и два способа ее получения впервые описаны ранее коллективом отечественных исследователей (Барсуков А.В., Ярошенко Г.Ф., Дятлова Н.М. // ЖОХ, 1984, Т. 54, №4, С. 763-768).
1,3-Диамино-2-гидроксипропан-N,N′-диметилфосфоновую-N,N′-диуксусную кислоту, согласно представленному в данной статье способу (А) получают по следующей схеме:
водный раствор глицин-N-метилфосфоновой кислоты (18,6 г) нейтрализуют 40%-ным раствором гидроксида натрия до рН 9.5-10.0;
к реакционной массе прикапывают эпихлоргидрин (9,3 г), поддерживая температуру не выше 20°С;
полученную реакционную массу нагревают до 85-90°С и выдерживают при этой температуре 5 часов, поддерживая рН 9.5-10.0 добавлением раствора гидроксида натрия; охлажденный раствор подкисляют концентрированной соляной кислотой до рН 1.5 и отфильтровывают выпавший осадок хлорида натрия;
фильтрат упаривают на 1/2 первоначального объема и выливают в 1000 мл метанола;
образовавшийся осадок дважды перекристаллизовывают из смеси метанол-вода (3:1 объемных).
Однако, как показали дополнительно проведенные экспериментальные исследования по воспроизведению данного синтеза, эпихлогидрин в щелочной среде (рН 9.5-10.0) при температуре 85-90°С за 15 минут гидролизуется на 30%. Совершенно очевидно, что в условиях синтеза продолжительностью 5 часов значительная часть эпихлоргидрина выводится из основного взаимодействия в связи с гидролизом, что приводит к снижению выхода целевого продукта. К снижению выхода целевого продукта приводит и применение двойной перекристаллизации на стадии его очистки. В результате достижение указанного в статье высокого выхода (65%) является невозможным. Кроме того, глицин-N-метилфосфоновая кислота не является доступным реагентом, что связано со сложностью и многостадийностью его получения.
В цитированной выше статье описан также двухстадийный синтез 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты (способ Б), включающий предварительный синтез промежуточного продукта - 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты, осуществляемый карбоксиметилированием исходного 1,3-диамино-2-пропанола, и синтез конечного продукта метилфосфорилированием 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты формальдегидом и треххлористым фосфором. На стадии карбоксиметилирования к водному раствору 1,3-диамино-2-пропанола (23 г в 120 мл воды) прибавляют последовательно водный раствор цианистого натрия (32,5 г в 250 мл воды) и при нагревании до 65°С, и при перемешивании по каплям формалин (50 г), после чего реакционную массу выдерживают при 85°С в течение 3-4 часов, отфильтровывают, охлаждают до 20°С, нейтрализуют фильтрат 30%-ным раствором серной кислоты до рН 6.5 и отделяют фильтрацией осадок сульфата натрия.
На второй стадии (метилфосфорилирования) к 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоте, присутствующей в фильтрате, полученном после фильтрации нейтрализованной серной кислотой реакционной массы, последовательно добавляют по каплям треххлористый фосфор (65 г) при температуре не выше 20°С и медленно формалин (38 г), поддерживая температуру на уровне 20-25°С. Затем реакционную массу нагревают до 85°С и выдерживают при этой температуре в течение 6 часов, после чего упаривают до 1/5 первоначального объема, охлаждают и осаждают метанолом 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновую-N,N′-диуксусную кислоту. Выход очищенного продукта составляет 40%.
Основным недостатком рассмотренного способа, выбранного в качестве прототипа заявляемому способу, является, прежде всего, использование высокотоксичных веществ, а именно цианистого натрия, в количестве, превышающем стехиометрическое на 28,5%, а также треххлористого фосфора, относящегося к веществам II класса опасности. Данный процесс неэкономичен, поскольку при его осуществлении в результате сильно экзотермического процесса гидролиза треххлористого фосфора необходимо вести интенсивное охлаждение реакционной массы при продолжительной операции его загрузки во избежание перегрева и выброса реакционной массы из реактора. Кроме того, в процессе образуются большие количества хлористого водорода, что, в свою очередь, приводит к необходимости применения больших количеств нейтрализующих реагентов для утилизации кислых маточников.
Для создания технологически доступного и безопасного процесса, исключающего использование токсичного сырья, предлагается способ получения 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты, включающий получение промежуточного продукта - 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты реакцией карбоксиметилирования 1,3-диамино-2-пропанола кальциевой солью монохлоруксусной кислоты, используемой в количествах, соответствующих мольному соотношению монохлоруксусной кислоты к 1,3-диамино-2-пропанолу, равному 2.0-2.2:1.0, и проводимой в присутствии оксида кальция, взятого в количестве, обеспечивающем поддержание рН реакционной массы на уровне 9-11, и при температуре 60-65°С, с последующим охлаждением реакционной массы до 50-55°С, добавлением концентрированной соляной кислоты до рН 1.5-2.0, повторным охлаждением до 10-15°С и выделением 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты в форме дигидрохлорида, который подвергают метилфосфорилированию формальдегидом и фосфористой кислотой, используемыми в количествах, соответствующих мольному соотношению 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты к формальдегиду и к фосфористой кислоте, равному 1:2-2.1:2-2.1, при этом фосфористую кислоту в виде водного раствора прикапывают к дигидрохлориду 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты и в нагретую до кипения реакционную смесь вводят водный раствор формальдегида и перемешивают реакционную массу при кипении, частично упаривают, высаживают 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновую-N,N′-диуксусную кислоту метанолом, отфильтровывают, промывают на фильтре метанолом и сушат.
Частичное упаривание полученного на стадии метилфосфорилирования раствора проводят предпочтительно на 2/3 объема.
Выпавший на первой стадии осадок дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты отфильтровывают, промывают на фильтре метанолом и сушат.
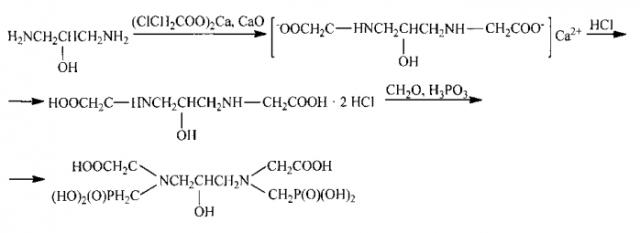
Предлагаемый способ получения 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты протекает по следующей схеме:
Основными техническими отличиями предлагаемого способа от прототипа на первой стадии карбоксиметилирования 1,3-диамино-2-пропанола в водном растворе является использование в качестве исходного продукта кальциевой соли монохлоруксусной кислоты, а в качестве нейтрализующего и конденсирующего агента оксида кальция. Благодаря присутствию оксида кальция реакция нуклеофильного замещения атома хлора в монохлоруксусной кислоте на аминогруппу 1,3-диамино-2-пропанола останавливается на стадии получения промежуточного продукта - 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты. В случае же проведения аналогичной реакции в присутствии гидроксида натрия образуется 1,3-диамино-2-гидроксипропан-N,N,N′,N′-тетрауксусная кислота (О.И. Самойлова, В.Г. Яшунский, Г.П. Сырова, Ю.Н. Шейнкер // Журн. органической химии. 1970. Т. 6. №8. С. 1574).
Согласно приведенной выше схеме механизма реакции видно, что Са(2+) участвует в образовании промежуточного комплексного соединения - кальциевого комплекса 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты. Выбор в качестве рН регулятора оксида кальция, являющегося комплексообразователем, обуславливается тем, что Са(2+) способен взаимодействовать с исходными компонентами реакции с образованием неустойчивых комплексов, благодаря чему становится возможным, хотя и в небольшой степени, изменить геометрическую ориентацию этих исходных компонентов, в частности 1,3-диамино-2-пропанола и монохлоруксусной кислоты.
В то же время кальциевый комплекс, образующейся при взаимодействии Са(2+) с 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислотой, являющейся продуктом данной реакции, обладает по сравнению с исходными комплексами повышенной прочностью, благодаря чему процесс карбоксиалкилирования останавливается на стадии образования промежуточного продукта - 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты.
Проведение процесса при определенных режимах, а именно основной реакции взаимодействия исходных продуктов при температуре не выше 85°С и рН 9-11, является непременным условием осуществления реакции в нужном направлении. Другие последующие стадии процесса идут при иных режимах, в частности при более низких температурах, например при 55-60°С на стадии разрушения промежуточного кальциевого комплекса кислоты и при 10-15°С при выделении дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты из реакционной массы.
Существенным признаком является использование определенных мольных соотношений компонентов, в частности применение кальциевой соли монохлоруксусной кислоты, полученной при взаимодействии СаО с монохлоруксусной кислотой в количестве, соответствующем мольному соотношению монохлоруксусной кислоты к 1,3-диамино-2-пропанолу, равному 2.0-2.2:1.0.
Использование в качестве исходного продукта метилфосфорилирования дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты, а не самой кислоты, как в прототипе, обеспечивает создание солянокислой среды, необходимой для протекания процесса, не требует специального дополнительного введения соляной кислоты и позволяет использовать фосфористую кислоту взамен PCl3 в качестве фосфорилирующего агента. Существенным признаком в этом процессе также, как и на стадии карбоксиалкилирования 1,3-диамино-2-пропанола, является использование формальдегида и фосфористой кислоты в количествах, соответствующих мольному соотношению 1,3-диамино-2-гидроксипропан-N,N′-диуксусная кислота: формальдегид: фосфористая кислота, равному 1:2-2.1:2-2.1.
Таким образом, в основе предлагаемого способа получения 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты лежит технологически доступный и безопасный процесс, позволяющий исключить использование высокотоксичных соединений, а также значительных количеств нейтрализующих щелочных реагентов и утилизируемых отходов. В результате данного способа получают как 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновую-N,N′-диуксусную кислоту с выходом 68% (считая на дигидрохлорид 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты).
Строение полученных продуктов (дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты и 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты) подтверждено данными 1Н, 13С, 31Р ЯМР-спектроскопии и элементного анализа.
Предлагаемый способ получения 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты иллюстрируется следующими примерами:
Пример 1
Получение дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты (мольное соотношение монохлоруксусной кислоты к 1,3-диамино-2-пропанола 2.1:1).
Монохлоруксусную кислоту в количестве 13,2 г (0,1397 моль) растворяют в 3 мл воды и при перемешивании нейтрализуют оксидом кальция до рН 9-11. К полученной суспензии образовавшейся кальциевой соли монохлоруксусной кислоты в воде добавляют 6 г (0,0667 моль) 1,3-диамино-2-пропанола, поддерживая температуру реакционной массы на уровне 60-65°С и рН 9-11. По окончании загрузки 1,3-диамино-2-пропанола реакционную массу выдерживают при размешивании при тех же значениях рН и температуры, охлаждают до 50-55°С, добавляют концентрированной соляной кислоты до рН 1,5-2. Полученный раствор охлаждают до 10-15°С. Выпавший осадок дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты через 12 часов отфильтровывают, промывают на фильтре метанолом и сушат. Выход составляет 40%. Строение продукта подтверждено методами 1Н, 13С ЯМР-спектроскопии и данными элементного анализа. Спектр ЯМР 1Н, δ, м. д.: 3.22 д. д (СН2, 2JHH 13.10 Гц, 3JHH 9.61 Гц, 2Н), 3.37 д. д (СН2, 2JHH 13.10 Гц, 3JHH 3.11 Гц, 2Н), 4.03 с (СН2СО, 4Н), 4.41 т.т (СН, 3JHH 9.60 Гц, 3JHH 3.09 Гц, 1Н). Спектр ЯМР 13С, δ, м. д.: 47.52 с (СН2), 49.73 с (СН2СО), 62.77 с (СН), 168.75 с (СО). Найдено, %: С 29.9; Н 5.98; N 9.87; Cl 25.5. C7H16N2O5Cl2. Вычислено, %: С 30.12; Н 5.78; N 10.03; Cl 25.4.
Пример 2 проводят аналогично примеру 1.
Получение дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты (мольное соотношение монохлоруксусной кислоты к 1,3-диамино-2-пропанолу 2:1).
Условия осуществления реакции аналогичны условиям, представленным в примере 1. При этом изменив только соотношение исходных реагентов: в реакцию вводят 12,6 г (0,1334) и 6 г (0,0667 моль) 1,3-диамино-2-пропанола, что соответствует мольному соотношению 2:1. Выход составляет 29%. Строение промежуточного продукта подтверждено методами Н, С ЯМР-спектроскопии и данными элементного анализа. Спектр ЯМР 1Н, δ, м. д.: 3.22 д. д (СН2, 2JHH 13.10 Гц, 3JHH 9.61 Гц, 2Н), 3.37 д. д (СН2, 2JHH 13.10 Гц, 3JHH 3.11 Гц, 2Н), 4.03 с (СН2СО, 4Н), 4.41 т.т (СН, 3JHH 9.60 Гц, 3JHH 3.09 Гц, 1H). Спектр ЯМР 13С, δ, м. д.: 47.52 с (СН2), 49.73 с (СН2СО), 62.77 с (СН), 168.75 с (СО). Найдено, %: С 29.9; Н 5.98; N 9.87; Cl 25.5. C7H16N2O5Cl2. Вычислено, %: С 30.12; Н 5.78; N 10.03; Cl 25.4.
Пример 3
Получение 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты (мольное соотношение 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты к формальдегиду и к фосфористой кислоте 1:2.1:2.1).
К 5,58 г (0,02 моль) дигидрохлориду 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты прикапывают 3,4 мл (0,042 моль) 61,8% водного раствора фосфористой кислоты и нагревают до 106°С. В реакционную массу вводят 3,1 мл (0,042 моль) формалина (водного 37% раствора формальдегида) и выдерживают при перемешивании в течение 3 часов. По окончании реакции раствор упаривают на 2/3 объема и осаждают продукт метанолом. Выпавший осадок 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты отфильтровывают, промывают на фильтре метанолом и сушат. Выход составляет 68% (считая на дигидрохлорид 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты). Спектр ЯМР 1Н, δ, м. д.: 3.42-3.64 м (СН2, СН2Р, 8Н), 4.25 с (СН2СО, 4Н), 4.60 т.т (СН, 3JHH 9.81 Гц, 3JHH 2.38 Гц, 1Н). Спектр ЯМР 13С, δ, м. д.: 50.91 д (СН2Р, 3JCP 135.90 Гц), 56.06 д (СН2СО, 3JCP 2.75 Гц), 57.93 д (СН2, 3JCP 3.30 Гц), 168.32 с (СО). Спектр ЯМР 31Р, δ, м. д.: 6.72 т (2JPH 12.16 Гц). Найдено, %: С 27.34; Н 5.19; N 7.03. C9H20N2O11P2. Вычислено, %: С 27.42; Н 5.11; N 7.11.
Пример 4 проводят аналогично примеру 3.
Получение 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты (мольное соотношение 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты к формальдегиду и к фосфористой кислоте 1:2:2).
Условия осуществления реакции аналогичны условиям, представленным в примере 1. При этом изменив только соотношение исходных реагентов: в реакцию вводят 5,58 г (0,04 моль) дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты, 3,2 мл (0,04 моль) 61,8% водного раствора фосфористой кислоты и 3 мл (0,04 моль) формалина (водного 37% раствора формальдегида). Выход составляет 63% (считая на дигидрохлорид 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты). Спектр ЯМР 1Н, δ, м. д.: 3.42-3.64 м (СН2, СН2Р, 8Н), 4.25 с (СН2СО, 4Н), 4.60 т.т (СН, 3JHH 9.81 Гц, 3JHH 2.38 Гц, 1H). Спектр ЯМР 13С, δ, м. д.: 50.91 д (СН2Р, lJCP 135.90 Гц), 56.06 д (СН2СО, 3JCP 2.75 Гц), 57.93 д (СН2, 3JCP 3.30 Гц), 168.32 с (СО). Спектр ЯМР 31Р, δ, м. д.: 6.72 т (2JPH 12.16 Гц). Найдено, %: С 27.34; Н 5.19; N 7.03.
Синтезированная 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновая-N,N′-диуксусная кислота по аналогии с другими известными фосфорсодержащими производными алифатических аминов, например 1,3-диамино-2-гидроксипропан-N,N,N,N′-тетраметилфосфоновой кислотой (ДПТФ), может использоваться в качестве ингибитора отложения минеральных солей в системах водопользования промышленных предприятий, предприятий большой и малой энергетики и коммунального хозяйства. Использование 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты для стабилизационной обработки воды систем водопользования по сравнению с 1,3-диамино-2-гидроксипропан-N,N,N′,N′-тетра(метилфосфоновой кислотой) способствует замедленному росту микроорганизмов в обрабатываемой воде и тормозит степень биообрастания трубопроводов и технологического оборудования.
1. Способ получения 1,3-диамино-2-гидроксипропан-N,N′-диметилфосфоновой-N,N′-диуксусной кислоты, включающий получение промежуточного продукта - 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты реакцией карбоксиметилирования 1,3-диамино-2-пропанола, последующее метилфосфорилирование данной кислоты формальдегидом и фосфорилирующим агентом и выделение конечного продукта частичным упариванием реакционной массы, охлаждением и осаждением продукта метанолом, отличающийся тем, что карбоксиметилирование 1,3-диамино-2-пропанола осуществляют кальциевой солью монохлоруксусной кислоты, используемой в количествах, соответствующих мольному соотношению монохлоруксусной кислоты к 1,3-диамино-2-пропанолу, равному 2.0-2.2:1.0, а также в присутствии оксида кальция, взятого в количестве, обеспечивающем поддержание рН реакционной массы на уровне 9-11, и при температуре 60-65°С, после чего реакционную массу охлаждают до 50-55°С, добавляют концентрированную соляную кислоту до рН 1.5-2.0, повторно охлаждают до 10-15°С и выделяют 1,3-диамино-2-гидроксипропан-N,N′-диуксусную кислоту в виде дигидрохлорида, который подвергают метилфосфорилированию формальдегидом и фосфористой кислотой, используемыми в количествах, соответствующих мольному соотношению 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты к формальдегиду и к фосфористой кислоте, равному 1:2-2.1:2-2.1, при этом фосфористую кислоту в виде водного раствора прикапывают к дигидрохлориду 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты, а в нагретую до кипения реакционную смесь вводят водный раствор формальдегида и перемешивают реакционную массу при кипении.
2. Способ по п. 1, отличающийся тем, что выпавший осадок дигидрохлорида 1,3-диамино-2-гидроксипропан-N,N′-диуксусной кислоты отфильтровывают, промывают на фильтре метанолом и сушат.
3. Способ по п. 1, отличающийся тем, что частичное упаривание полученного на стадии метилфосфорилирования раствора проводят предпочтительно на 2/3 объема.