Метабиотическая композиция для обеспечения колонизационной резистентности микробиоценоза кишечника человека
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано для получения метабиотической композиции для обеспечения колонизационной резистентности микробиоценоза кишечника человека. Метабиотическая составляющая представляет собой рациональную комбинацию метаболитов пробиотических штаммов микроорганизмов и дополнительно включает стерилизованные высушенные культуральные жидкости, содержащие метаболиты Enterococcus faecium L-3, Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06. В качестве пребиотической составляющей используют овсяные хлопья. Композиция выполнена при этом в твердой дозированной форме в виде капсул, а количество ингредиентов в одной капсуле составляет, мас.%: стерилизованная высушенная культуральная жидкость, содержащая метаболиты пробиотического штамма бактерий Bacillus subtilis ВКПМ № В-2335 - 1,9; стерилизованная высушенная культуральная жидкость, содержащая метаболиты пробиотического штамма бактерий Enterococcus faecium L-3 - 4,5; стерилизованная высушенная культуральная жидкость, содержащая метаболиты пробиотического штамма бактерий Lactobacillus delbrueckii TS1-06 - 4,5; стерилизованная высушенная культуральная жидкость, содержащая метаболиты пробиотического штамма бактерий Lactobacillus fermentum TS3-06 - 4,5; цеолит - 64,3; овсяные хлопья - 20,0; стеарат кальция или аэросил - 0,3. Использование данной композиции позволяет нормализовать микробиоценоз кишечника за счет селективного стимулирования роста и размножения лактобацилл и бифидобактерий индигенной составляющей нормофлоры биотопа и обеспечения специфической антагонистической активности в отношении широкого спектра патогенных и условно-патогенных микроорганизмов. 4 ил, 19 табл.
Реферат
Изобретение относится к области медицины и касается средства для обеспечения колонизационной резистентности микробиоценоза кишечника человека при дисбиотических нарушениях, ассоциированных с воздействием антибиотиков, за счет благотворного влияния на составляющие индигенной микрофлоры биотопа, обеспечения антагонистического эффекта в отношении патогенов бактериальной и вирусной природы и неспецифической резистентности организма.
Актуальная проблема современной медицинской науки связана с изучением возможных нарушений микроэкологии человека, и в первую очередь, нарушений очень важной системы организма - микробиоценоза кишечника. Микроэкологические изменения в микрофлоре кишечника регистрируют практически у 90% населения [1] и многие исследователи наблюдаемое увеличение частоты и тяжести острых инфекционных заболеваний, торпидное течение и хронизацию воспалительных процессов объясняют развивающимися или уже имевшими место нарушениями микробиоты, сопровождающими основную болезнь. Представляя экстракорпоральный орган, микрофлора организма человека выполняет или регулирует многообразные функции по поддержанию нормального гомеостаза [2]. Изменения в составе нормальной микрофлоры ведут к развитию процессов, сказывающихся на состоянии здоровья людей [3-5].
Значение микрофлоры кишечника в жизнедеятельности организма человека связано с тем, что она оказывает непосредственное влияние на его состояние, выполняя ряд жизненно важных функций: обеспечение колонизационной резистентности, формирование иммунного ответа, переваривание пищи, регуляция моторной функции кишечника, дезинтоксикация.
Одной из важнейших функций нормальной микрофлоры является обеспечение колонизационной резистентности - совокупности механизмов, обеспечивающих способность микробиоты и макроорганизма, кооперативно взаимодействуя, защищать экосистему от воздействия патогенной микрофлоры, придающих стабильность нормальной микрофлоре, предотвращающих заселение организма посторонними микроорганизмами и обеспечивающих его противоинфекционную защиту [5-7].
Отсутствие колонизационной резистентности, обусловленное различными причинами, приводит к значительному ослаблению противоинфекционной защиты организма, увеличению численности и спектра патогенных и условно-патогенных микробов, их транслокации из мест первичной локализации, а, следовательно, к повышению восприимчивости организма к возникновению инфекционных заболеваний бактериальной и вирусной природы [5, 8, 9], развитию эндогенных инфекций, суперинфекций различных локализаций [10-12]. Отсутствие колонизационной резистентности является одним из пусковых факторов возникновения различных заболеваний.
Колонизационная резистентность микробиоценоза кишечника определяется множеством факторов и, прежде всего, зависит от количества и качества нормальной микрофлоры, антагонистической активности составляющих ее микробов, условий их обитания, в том числе конкуренции за факторы питания и другие. К основным механизмам обеспечения колонизационной резистентности относится и активация иммунной системы [4].
Поэтому колонизационная резистентность микробиоценоза кишечника, главным образом, связана с состоянием микробиоценоза биотопа и механизмами местной неспецифической иммунологической резистентности организма [1, 9]. В свою очередь, нарушение механизмов иммунологического гомеостаза является одной из важных причин развития дисбиотических нарушений микробиоценоза кишечника. Защитные реакции против вирусных и бактериальных патогенов могут быть усилены путем активации иммунной системы [13], когда стимулирующий сигнал носит неспецифический характер, направленный не избирательно против вызвавшего инфекцию патогена, а повышающий общую иммунологическую резистентность.
Разнообразные неблагоприятные воздействия на организм человека вызывают изменения иммунного ответа и могут влиять на качественные и количественные характеристики нормальной микрофлоры кишечника. При дисбиотических нарушениях микробиоценоза кишечника возникают клинические состояния, связанные с отсутствием колонизационной резистентности, расстройствами пищеварения, нарушением детоксицирующей функции кишечной микрофлоры и изменениями иммунного ответа.
Развитию дисбактериоза кишечника способствуют разнообразные факторы экзогенного и эндогенного характера [4, 5, 15]. Достаточно распространенными в настоящее время являются: стресс и переутомление, физические и психоэмоциональные нагрузки, курение, несбалансированное питание, нарушение режима питания, переедание или перекусы на бегу, экологическое неблагополучие, многие хронические заболевания и ряд других патологических состояний. В подобных случаях, ввиду того, что микробиоценоз является эволюционно сложившейся и четко интегрированной системой, которая обеспечивает слаженную работу всех органов и систем и базируется до известной степени на принципе саморегуляции, возникающие изменения симбиотической микрофлоры в большинстве случаев восстанавливаются самопроизвольно.
Все складывается совершенно иначе после нерационального применения антибиотиков. В клинической практике подобная ситуация, при которой, прежде всего, и возникают дисбиотические нарушения микробиоценоза кишечника, в настоящее время является распространенной. Лечение с назначением антибиотиков зачастую является стандартным решением при самых различных заболеваниях, в том числе и таких распространенных, как ангина, бактериальные инфекции верхних и нижних дыхательных путей (тонзиллит, верхне-челюстной синусит (гайморит), фарингит, бронхит, пневмонии и другие), урогенитальные инфекции, острые кишечные инфекции и многие другие патологические состояния. На использовании антибиотиков основываются известные базовые схемы экстренной профилактики и лечения инфекционных заболеваний бактериальной природы [16-19].
При этом нельзя не отметить, что для достижения адекватного антибактериального эффекта подобные препараты, как правило, принимаются часто, длительно и в больших дозировках. Антибиотики, с одной стороны, позволяют эффективно ингибировать избыточный рост патогенных и условно-патогенных микроорганизмов, но с другой, при обычно применяемых схемах их дозирования нередко становятся причиной развития целого ряда побочных явлений со стороны различных органов и систем организма. Прежде всего, они оказывают негативное влияние на состояние микробиоценоза кишечника человека ввиду отсутствия селективности их действия на микроорганизмы. Под воздействием антибиотиков, как правило, у 2/3 пациентов возникают относительно длительные (в течение 2-3 мес) нарушения кишечного микробиоценоза и, прежде всего, баланса качественного и количественного состава микрофлоры, вследствие чего появляются симптомы дисбактериоза.
Следует учитывать и то, что антибиотики токсичны, обладают неспецифичным бактерицидным действием и могут спровоцировать появление патогенных микроорганизмов, устойчивых к действию традиционно используемых антибактериальных средств, вследствие чего антибиотикотерапия требует в обязательном порядке последующее восстановление микробиоценоза кишечника (дисбаланса в системе «макроорганизм и нормальная микрофлора»).
Таким образом, практическая важность адекватной коррекции нарушений микробиоценоза кишечника у больных, получающих антибиотики, не вызывает сомнения. При коррекции дисбиотических нарушений микрофлоры кишечника проводят комплекс мероприятий с учетом клинических проявлений основного заболевания и степени выраженности дисбиотических нарушений кишечного микробиоценоза, а также данных лабораторных исследований микрофлоры биотопа и состояния реактивности организма
Для обеспечения эффективной коррекции нарушений микробиоценоза кишечника человека выполняют такие мероприятия, как:
- селективная деконтаминация патогенной и условно-патогенной микрофлоры;
- нормализация индигенной микрофлоры кишечника;
- коррекция иммунологической реактивности организма.
Коррекцию дисбиотических нарушений проводят в соответствии с Отраслевым стандартом [20] и выполняют поэтапно (в 2 этапа) и в соответствии со степенью их выраженности. В случаях дисбактериоза 2 и 3 степени выраженности возникших нарушений коррекцию начинают с назначения на первом этапе средств, обладающих избирательной антибактериальной активностью и обеспечивающих селективную деконтаминацию патогенной и условно-патогенной микрофлоры. Это различные бактериофаги - стафилококковый, клебсиеллезный, пиобактериофаг, интестибактериофаг, синегнойный и другие. При низкой чувствительности к бактериофагам используют антибактериальные препараты (фуразолидон, хлорофилипт, метронидазол, нифуроксазид, интетрикс и другие) и антигрибковые средства (кетоконазол, флюконазол, натамицин и другие). На втором же этапе в обязательном порядке рекомендуют проведение курса заместительной терапии для нормализации собственной индигенной микрофлоры кишечника. Значимую роль при этом играет дифференцированное применение различных иммунобиологических препаратов.
Спектр иммунобиологических препаратов, рекомендуемых в настоящее время для коррекции дисбиотических нарушений микробиоценоза кишечника достаточно широк. Из их числа наиболее широкое применение находят пробиотики, включающие специально отобранные штаммы живых микроорганизмов или специфические субстанции микробного, растительного или животного происхождения, которые проявляют антагонистическую активность в отношении патогенной и условно-патогенной микрофлоры, стимулируют репаративные процессы в слизистой оболочке кишечника и повышают иммунологическую реактивность организма за счет гфодукции кислот, антибиотических веществ, выделения различных ферментов, витаминов и других. Микроорганизмы, входящие в состав пробиотиков, способны синтезировать вещества, обладающие противомикробными свойствами, конкурировать с патогенными микроорганизмами за питательные вещества и участки микробной адгезии, модифицировать токсины или рецепторы токсинов. Определенные виды непатогенных для человека микроорганизмов и вещества микробного происхождения оказывают при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию и стабилизацию его микроэкологического статуса [21]. К их числу относятся, прежде всего, бифидо- и лактосодержащие средства для регулирования равновесия кишечной микрофлоры.
Бифидо- и лактобактерии представляют основу кишечной микрофлоры и играют решающую роль в обеспечении нормального функционирования биотопа. Бифидобактерии, являясь сахаролитическими микробами, выделяют большое количество кислых продуктов. Образующиеся молочная и уксусная кислоты способствуют усилению всасывания ионов кальция, железа, витамина D. Продукция бифидобактериями лизоцима, бактериоцинов, спиртов и высокая антагонистическая активность в отношении различных патогенов препятствуют их проникновению в верхние отделы желудочно-кишечного тракта (ЖКТ). Бифидобактерии отличаются высокой способностью к синтезу аминокислот, белков, многих витаминов группы В, которые впоследствии всасываются в кишечнике. Поэтому при стойких, тяжелых нарушениях функций бифидобактерий может развиваться комплекс белково-витаминно-минеральной недостаточности. При снижении уровня бифидобактерий исчезает колонизационная резистентность микробиоценоза кишечника, происходит транслокация патогенов в верхние отделы кишечника и их избыточный рост.
Основными из заселяющих ЖКТ лактобактерий являются Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus plantarum, Lactobacillus fermentum. Подавление гнилостных и гноеродных микробов и антагонистическая активность лактобактерий связаны с выработкой молочной кислоты, спирта и лизоцима, продуктов с высокой антибактериальной активностью, интерферонов, интерлейкина 1 и ряда других. Исчезновение лактобактерий приводит к сдвигу реакции среды в щелочную сторону и резкому ухудшению функционального состояния ЖКТ.
При возникновении дисбиотических состояний качественный и количественный состав анаэробных бифидо- и лактобактерий претерпевает нарушения в первую очередь. Поэтому препараты на их основе получили широкое распространение в практике врачей различных специальностей. Из их числа в ряде клинических ситуаций препаратами выбора являются пробиотические комплексы Линекс и Бифиформ [22, 23], действующим началом которых являются живые бактерии. Так, в состав Линекса, производимого фармацевтической фирмой «Лек» (Словения), включен сбалансированный комплекс молочнокислых бактерий: лактобактерий Lactobacillus acidophilus, бифидобактерии Bifidobacterium infantis и энтерококки Enterococcus faecium. В отличие от Линекса в состав Бифиформа, гфоизводимого датской фармацевтической компанией «Ферросан Интернейшнл А/С», помимо бифидобактерий Bifidobacterium longum (штамм АТСС 15707) и энтерококков Enterococcus faecium (штамм SF68) от микробиологической лаборатории «Кристиан Хансен» (Дания) включена особая питательная среда для их питания, роста и размножения. Кроме того, Бифиформ не содержит лактозу, вследствие чего показан пациентам с ее непереносимостью. Входящие в состав препаратов бактерии предназначены для регулирования физиологического равновесия кишечной микрофлоры путем продукции молочной кислоты, в меньшей степени уксусной и пропионовой кислот. Создаваемая в результате кислая среда является неблагоприятной для развития патогенных и условно-патогенных микроорганизмов. Полезные бактерии лиофильно высушены и расфасованы в специальные защитные капсулы, что обеспечивает их надежную защиту от разрушения под воздействием желудочного сока и позволяет донести в мало измененном виде непосредственно до кишечника и там высвободить.
Однако, помимо благоприятных эффектов препаратам Линекс и Бифиформ характерен ряд существенных недостатков, ограничивающих возможности их широкого применения в клинической практике. Прежде всего, нельзя считать, что входящие в их состав бактерии эквивалентны собственной индигенной микрофлоре и способны колонизировать и размножаться в пристеночном слое кишечника. Одной из основных причин этого является их недостаточная, вернее, непредсказуемая биосовместимость с резидентными бактериями кишечника человека. Индивидуальная биосовместимость микроорганизмов, вносимых в составе указанных препаратов, и их приживаемость не гарантированы. Соответственно, практически исключена вероятность выполнения указанными бактериями, внесенными в макроорганизм извне, своей основной функции (заместительной) и тем более за короткий промежуток времени.
Следует также учитывать, что механизм действия входящих в состав указанных препаратов микроорганизмов носит транзиторный характер, они не колонизируют в кишечнике, в связи с чем их благоприятный эффект продолжается практически только в период курсового приема. Поэтому, как правило, назначают их достаточно длительно (не менее 3-4 недель) и рекомендуют прием по 1-2 капсулы не реже 3 раз в день. А так как стоимость указанных коммерческих препаратов достаточно велика, то это также существенно ограничивает доступность Линекса и Бифиформа для широких слоев населения.
Линекс и Бифиформ рекомендуют для профилактики и лечения дисбактериозов различной этиологии. При этом используют их преимущественно в схемах коррекции дисбактериоза кишечника лишь на 2 этапе с целью заместительной терапии. В составы указанных препаратов включены штаммы бактерий с достаточно высоким уровнем антибиотикорезистентности и зачастую рекомендуют их применение одновременно с антибиотиками. Однако, опыт использования указанных средств в клинической практике с широким спектром антибиотиков при рекомендуемых схемах их назначения показал, что большая часть бактерий при таком сочетанном назначении гибнет, а активность попавших в кишечник в жизнеспособном состоянии чрезвычайно низка.
Вместе с тем, в настоящее время известно, что одним из перспективных направлений преодоления негативного воздействия антибиотиков на состав микробиоты кишечника является не самостоятельное их использование, а в комбинации с пробиотиками. При этом установлено, что в случае сочетанного назначения с антибиотиками приоритет следует отдавать таким пробиотикам, которые в своем составе содержат не живые микроорганизмы (Бифидобактерии, Лактобактерин, Споробактерин, Ламинолакт, Линекс, Бифиформ и другие), зачастую чужеродные для естественной индигенной микрофлоры ЖКТ человека, которые, к тому же, могут разрушаться антибиотиками, оказывая негативное воздействие на иммунную систему и макроорганизм в целом, а метаболиты пробиотических штаммов микроорганизмов - метабиотики [4, 24, 25].
Современным представителем таких метабиотических средств является композиция, которая по составу, механизму воздействия на организм и достигаемому благоприятному эффекту наиболее близка к заявляемой метабиотической композиции и принята в качестве композиции-прототипа [26].
Композиция-прототип представляет собой сбалансированный комплекс с выраженной антимикробной, антивирусной и иммуномодулирующей активностью, в состав которого включены метабиотический и пребиотический агенты, адсорбент-носитель и вспомогательная технологическая добавка при следующем соотношении ингредиентов, мас.%:
| стерилизованная культуральная жидкость, содержащая метаболиты | |
| штамма бактерий Bacillus subtilis ВКПМ № В-2335 | - 1,6-2,3; |
| цеолит | - 43,0-46,0; |
| комплекс полисахаридов (β-глюкан и маннан) | - 51,0-54,0; |
| стеарат кальция или аэросил | - 0,5-1,5. |
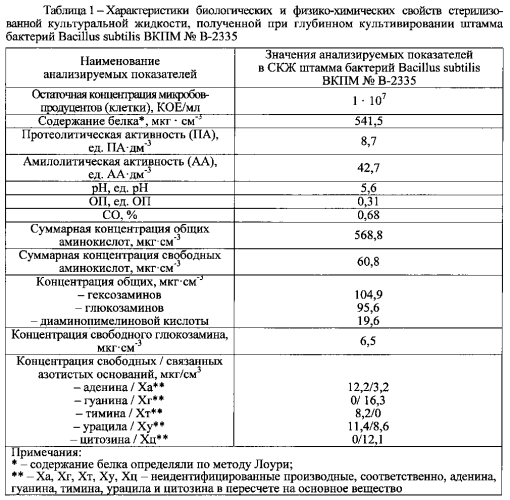
В составе композиции-прототипа метабиотический агент представлен стерилизованной культуральной жидкостью (СКЖ), содержащей метаболиты, полученные в ходе культивирования и стерилизации бактерий вида Bacillus subtilis. Неотъемлемой составляющей композиции-прототипа, обеспечивающей ее лечебно-профилактические свойства, являются биологически активные вещества (БАВ), синтезируемые Bacillus subtilis ВКПМ № В-2335 при глубинном выращивании, в том числе различные природные антибактериальные субстанции (бактериоцины, лизоцим, катал азы), которые селективно подавляют рост и размножение патогенных и условно-патогенных микроорганизмов в кишечнике, не влияя при этом на симбионтную микрофлору. Микробы-продуценты синтезируют азотистые основания (пуриновые и пиримидиновые производные), которые представляют отдельную группу иммуномодулирующих веществ и содержатся в СКЖ в значительных количествах. Данное обстоятельство для композиции-прототипа имеет важное значение, так как азотистые основания и их производные восстанавливают функциональную активность единой макрофагальной системы организма и существенно повышают эффективность неспецифической и специфической защиты.
Основное предназначение цеолита, входящего в состав композиции-прототипа и выполняющего функции адсорбента и носителя метаболитов бацилл Bacillus subtilis, заключается в иммобилизации метаболитов, синтезируемых бациллами при культивировании и сконцентрированных в СКЖ, и доставке их в качестве носителя по всему протяжению кишечника. Постепенное высвобождение иммобилизованных на цеолите БАВ позволяет поддерживать высокий уровень активности композиции-прототипа.
В состав композиции-прототипа введен высокоактивный иммуномодулирующий агент, представляющий собой комплекс полисахаридов - продуктов ферментативного гидролиза полимеров внутреннего и внешнего слоев клеточной оболочки пивных дрожжей, а именно, β-глюкана и маннана. Действие данных легко усваиваемых в организме БАВ заключается, прежде всего, в том, что β-глюкан активизируют основные клетки иммунной системы - макрофаги.
Для улучшения технологичности процесса получения композиции-прототипа в твердой лекарственной форме для перорального введения в ее состав введена вспомогательная добавка - стеарат кальция или аэросил.
Важной особенностью композиции-прототипа является способность эффективно повышать неспецифическую и специфическую иммунную резистентность организма, которая реализуется посредством комплексного воздействия на иммунную систему всех входящих в ее состав компонентов, проявляющих иммуномодулирующую активность. Основным предназначением композиции-прототипа является поддержание оптимальных микроэкологических параметров в кишечнике путем введения в организм БАВ, сдерживающих развитие патогенов. Отсутствие в составе композиции-прототипа живых микроорганизмов позволяет применять его совместно с антибиотиками для улучшения микроэкологических условий, что способствует восстановлению качественных и количественных характеристик симбиотических микроорганизмов.
Вместе с тем, наряду с указанными благоприятными эффектами для композиции-прототипа характерен ряд недостатков:
- ограниченная биологическая активность, выражающаяся в недостаточных уровнях специфической антагонистической активности в отношении ряда патогенных и условно-патогенных микроорганизмов, что связано с использованием в его составе только одного вида микроорганизмов (Bacillus subtilis);
- обеспечение возможности эффективной коррекции нарушений только одной составляющей индигенной микрофлоры кишечника - лактобацилл;
-отсутствие сведений о возможности благоприятного воздействия на такую важную составляющую нормофлоры кишечника как бифидобактерии и стимулирования роста и размножения этих полезных микроорганизмов.
Отмеченные недостатки существенно ограничивают возможности широкого использования композиции-прототипа в клинической практике с целью коррекции колонизационной резистентности кишечника, сниженной вследствие дисбиотических нарушений микробиоценоза биотопа при назначении антибиотиков для осуществления терапии патологических состояний.
Целью изобретения явилось повышение эффективности коррекции дисбиотических нарушений микробиоценоза кишечника, обусловленных применением антибиотиков и приводящих к снижению колонизационной резистентности биотопа, за счет использования поликомпонентной метабиотической композиции на основе сбалансированного комплекса биологически активных веществ, обеспечивающих благоприятное влияние на основные составляющие индигенной микрофлоры кишечника, специфическую антагонистическую активность в отношении широкого спектра патогенных и условно-патогенных микроорганизмов, неспецифическую иммунологическую резистентность организма за счет стимулирования функциональной активности иммунокомпетентаых клеток, не содержащей опасные для здоровья вещества, нетоксичной, не обладающей сенсибилизирующим действием, способностью к кумуляции, токсическим влиянием на репродуктивную функцию, мутагенным эффектом и отдаленными негативными последствиями, стабильной при хранении.
Достижение поставленной цели возможно за счет создания поликомпонентной метабиотической композиции, качественный и количественный состав которой позволит нормализовать микробиоценоз кишечника как за счет селективного стимулирования роста и размножения лактобацилл и бифидобактерий индигенной составляющей нормофлоры биотопа и обеспечения специфической антагонистической активности в отношении широкого спектра патогенных и условно-патогенных микроорганизмов, так и путем стимулирующего влияния на систему неспецифической иммунологической резистентности и повышения неспецифической резистентности организма.
При формировании качественного и количественного состава заявляемой метабиотической композиции, предназначенной для обеспечения колонизационной резистентности микробиоценоза кишечника человека, исходили из того, что основные ее компоненты должны:
- оказывать эффективное благоприятное влияние на основные составляющие индигенной микрофлоры кишечника - лакто- и бифидобактерии, способствуя их росту и размножению;
- обеспечивать колонизационную резистентность микробиоценоза биотопа, оказывая эффективное воздействие на микрофлору кишечника за счет проявления специфической антагонистической активности в отношении широкого спектра патогенных и условно-патогенных микроорганизмов бактериальной природы, с которыми, как правило, ассоциирована антибиотикотерапия, обеспечивая их селективную деконтаминацию;
- повышать противовирусную защиту организма за счет активации продукции в клетках макрофагальной системы такого цитокина, как интерферон;
- оказывать влияние на факторы неспецифической резистентности организма и стимулировать функциональную активность иммунокомпетентных клеток для устранения дисфункциональных изменений в иммунной системе, развивающихся под воздействием патогенов, а также вследствие назначения антибиотиков.
Для этого в состав заявляемой метабиотической композиции включены: метабиотическая составляющая, представляющая собой рациональную комбинацию метаболитов, продуцируемых пробиотическими штаммами четырех микроорганизмов, пребиотическая составляющая с иммуномодулирующей активностью, адсорбент-носитель и вспомогательная технологическая добавка.
В отличие от композиции-прототипа в обеспечении комплексного воздействия на состояние кишечного микробиоценоза кишечника как за счет благоприятного воздействия на индигенную составляющую микрофлоры биотопа, так и обеспечения специфического антагонистического эффекта по отношению к широкому спектру патогенов участвуют БАВ не одного вида микроорганизмов (Bacillus subtilis), а дополнительно еще трех - Enterococcus faecium, Lactobacillus delbrueckii и Lactobacillus fermentum. Метабиотическая составляющая представляет рациональную комбинацию метаболитов пробиотических штаммов бактерий Bacillus subtilis ВКПМ № В-2335, Enterococcus faecium L-3, Lactobacillus delbrueckii TS1-06, Lactobacillus fermentum TS3-06.
При этом штамм бактерий Bacillus subtilis ВКПМ № В-2335 введен в виде стерилизованной высушенной культуральной жидкости, так как именно в ней сконцентрирован уникальный набор БАВ, синтезируемых бациллами в процессе их выращивания. Из числа БАВ особую ценность представляют природные антибактериальные субстанции (бактериоцины, лизоцим и другие), которые селективно подавляют рост и размножение патогенных и условно-патогенных микроорганизмов в кишечнике, не влияя при этом на симбионтную микрофлору, а также вносят весомый вклад в способность заявляемой метабиотической композиции оказывать влияние на факторы неспецифической резистентности организма и стимулировать функциональную активность иммунокомпетентных клеток.
Способность Bacillus subtilis повышать фагоцитарную активность макрофагов и тем самым проявлять иммуномодулируюший эффект связана с синтезом при их глубинном выращивании азотистых оснований и их производных (аденин, гуанин, тимин, урацил, цитозин), которые представляют отдельную группу иммуномодулирующих веществ и содержатся в СКЖ в значительных количествах (таблица 1). Для заявляемой метабиотической композиции это имеет большое значение, так как указанные БАВ способствуют восстановлению функциональной активности единой макрофагальной системы организма, угнетенной вследствие воздействия патогенов и антибиотиков, и существенному повышению эффективности неспецифической защиты.
Особо значимо и то, что метаболиты Bacillus subtilis ВКПМ № В-2335 представляют лактогенный фактор и проявляют лактогенный эффект, что выражается в стимулировании роста и размножения лактобацилл индигенной микрофлоры кишечника. Данное обусловливает благоприятные последствия за счет нормализации микрофлоры кишечника и способствует обеспечению колонизационной резистентности биотопа
Метаболиты пробиотического штамма энтерококков Enterococcus faecium L-3 включены в состав заявляемой метабиотической композиции в виде стерилизованной высушенной культуральной жидкости. В составе заявляемой метабиотической композиции метаболиты пробиотического штамма энтерококков Enterococcus faecium L-3 (энтероцины А и В) [27], представляют бифидогенный фактор и оказывают благоприятное воздействие на бифидобактерии индигенной микрофлоры кишечника, стимулируя их рост и размножение.
Пробиотические штаммы бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 при культивировании активно синтезируют метаболиты (бактериоцины) с протеиновым компонентом - лактоцин В [28, 29]. В состав заявляемой метабиотической композиции метаболиты введены в виде стерилизованных высушенных культуральных жидкостей и обусловливают существенный вклад в обеспечение специфической антагонистической активности заявляемой метабиотической композиции к широкому спектру патогенов.
В составе заявляемой метабиотической композиции пребиотическая составляющая представлена овсяными хлопьями и выполняет основное свое предназначение, заключающееся в обеспечении питательной потребности представителей индигенной микрофлоры кишечника, а также клеток макроорганизма, и проявляет иммуномодулирующую активность.
Овсяные хлопья способны оптимально обеспечить восстановление микрофлоры кишечника, так как доля пищевой клетчатки в них составляет 11%, которая, к тому же, содержит 35% очень ценных для человеческого организма β-глюканов. При коррекции дисбиотических состояний кишечника несомненна роль средств, отличающихся высоким содержанием пищевых волокон и позволяющих оптимизировать условия вегетирования симбионтов. Пищевые волокна (совокупность различных водорастворимых полисахаридов) не перевариваются (не расщепляются на моносахариды) эндогенными секретами ЖКТ человека и в неизмененном виде достигают толстой кишки, где метаболизируются анаэробной симбионтной микрофлорой до короткоцепочечных жирных кислот. В свою очередь, короткоцепочечные жирные кислоты (ацетат, пропионат, бутират, валерат) являются основным энергетическим субстратом для эпителиоцитов слизистой оболочки толстой кишки [30], стимулирующим пролиферацию, дифференциацию клеток и образование муциновой слизи. Помимо этого, пищевые волокна, фиксируя на своей обширной поверхности симбионтные микроорганизмы, способствуют резкому увеличению их содержания в единице внутрикишечного объема и возрастанию метаболической активности внутрикишечной среды.
Иммуномодулирующее действие β-глюкана, поступающего в организм в составе пребиотической составляющей, обусловлено тем, что он транспортируется через эпителиальный барьер клеток кишечного тракта в лимфу, в которой взаимодействует с ключевыми клетками иммунной системы (макрофагами) путем прикрепления к специфическим рецепторам, находящимся на их клеточных мембранах. Воздействуя на макрофаги, β-глюкан усиливает их фагоцитарную активность, а именно, подвижность и способность находить и устранять чужеродные, в том числе патогенные и условно-патогенные микроорганизмы. Кроме того, β-глюкан стимулирует и такие клетки как нейтрофилы NK (натуральные клетки-киллеры) и LAK (лимфокиноактивированные клетки-киллеры), за счет чего дополнительно повышает антибактериальную активность заявляемой метабиотической композиции. Также β-глюкан позволяет активизировать продукцию в клетках макрофагальной системы такого цитокина, как интерферон, повышая тем самым противовирусную активность заявляемой метабиотической композиции.
Адсорбент в составе заявляемой метабиотической композиции предназначен, прежде всего, для иммобилизации метаболитов, продуцируемых Bacillus subtilis в процессе их культивирования и сконцентрированных в СКЖ. Целесообразность использования цеолита в качестве компонента заявляемой метабиотической композиции определена уникальным химическим строением его молекул, в результате чего цеолит обладает высокой сорбирующей активностью по отношению к метаболитам бактерий Bacillus subtilis. Возникают оптимальные условия для выполнения цеолитом основных функций - адсорбента и носителя метаболитов Bacillus subtilis. Не всасываясь в ЖКТ и проходя транзитом, цеолит выполняет транспортировку иммобилизованных на нем метаболитов по всему протяжению кишечника. Высвобождение метаболитов происходит постепенно и позволяет достаточно длительный промежуток времени (до 1 суток) поддерживать необходимый уровень активности заявляемой метабиотической композиции. Частицы используемого цеолита имеют размеры не более 500 мкм и овальную форму кристалла, что исключает образование микротравм в кишечнике и полностью безопасно [31-33].
Для улучшения технологичности процесса получения заявляемой метабиотической композиции в качестве вспомогательной технологической добавки используют СК или аэросил.
Действие заявляемой метабиотической композиции, выполненной в капсулированной форме, начинается уже в желудке, где происходит растворение защитной капсулы под воздействием желудочного сока Входящие в состав заявляемой метабиотической композиции метаболиты пробиотических штаммов бактерий, деградация которых в ходе транзита по ЖКТ практически исключена, попадают в кишечник, где и проявляется их благоприятное воздействие.
Как видно, ингредиенты подобраны таким образом, что заявляемая метабиотическая композиция включает сбалансированный комплекс БАВ, способствующих обеспечению колонизационной резистентности микробиоценоза кишечника человека за счет эффективного благоприятного влияния на основные составляющие индигенной микрофлоры биотопа, обеспечения достаточного уровня антагонистической активности в отношении широкого спектра патогенов, а также неспецифической иммунобиологической резистентности организма, а количество их в одной капсуле составляет, масс.%:
| стерилизованная высушенная культуральная жидкость, | |
| содержащая метаболиты пробиотического штамма | |
| бактерий Bacillus subtilis ВКПМ № В-2335 | - 1,9; |
| стерилизованная высушенная культуральная жидкость, | |
| содержащая метаболиты пробиотического штамма | |
| бактерий Enterococcus faecium L-3 | - 4,5; |
| стерилизованная высушенная культуральная жидкость, | |
| содержащая метаболиты пробиотического штамма | |
| бактерий Lactobacillus delbrueckii TS1-06 | - 4,5; |
| стерилизованная высушенная культуральная жидкость, | |
| содержащая метаболиты пробиотического штамма | |
| бактерий Lactobacillus fermentum TS3-06 | - 4,5; |
| цеолит | - 64,3; |
| овсяные хлопья | - 20,0; |
| стеарат кальция или аэросил | - 0,3. |
Возможность достижения цели изобретения подтверждается результатами проведенных исследований, представленными в следующих примерах.
Пример 1. Получение заявляемой метабиотической композиции в виде капсулированной твердой дозированной формы для перорального введения.
Заявляемая метабиотическая композиция выполнена в виде капсулированной твердой дозированной формы для перорального введения, что не только существенно упрощает ее использование, но и обеспечивает надежную защиту входящих в ее состав БАВ от воздействия факторов, которые могут вызвать их деградацию.
Получают заявляемую метабиотическую композицию вначале в виде порошка, для чего выполняют следующий алгоритм действий. Выращивают микроорганизмы Bacillus subtilis ВКПМ № В-2335 методом глубинного культивирования в биологическом реакторе. После окончания процесса культивирования СКЖ с микроорганизмами подвергают центрифугированию для отделения и последующего удаления живых клеток микроорганизмов, а затем стерилизуют. Перед стерилизацией СКЖ смешивают с адсорбентом - цеолитом, предварительно измельченным до частиц размером не более 500 мкм. Полученную массу подвергают лиофилизации, при которой происходит иммобилизация биологически активных метаболитов продуцента на частицах цеолита. Далее в массу добавляют смесь, включающую овсяные хлопья и стерилизованные высушенные культуральные жидкости, содержащие метаболиты пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06, Lactobacillus delbrueckii TS1-06 и Enterococcus faecium L-3, затем добавляют CK или аэросил и помещают в резервуар установки для гранулиро