Способ получения тест-системы "ханта-n" для определения специфической активности вакцины против геморрагической лихорадки с почечным синдромом
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описан способ получения иммуноферментной тест-системы для оценки содержания иммуноспецифических белков хантавирусов Пуумала, Добрава, Хантаан и Сеул в вакцинных препаратах против геморрагической лихорадки с почечным синдромом (ГЛПС). Способ предусматривает получение моноклональных антител к вирусам Пуумала и Добрава с одинаковой чувствительностью, в соответствии с титром вируса, выявляющих антигены каждого из 4-х хантавирусов - возбудителей ГЛПС, и их последующую сорбцию на поверхность полистироловой панели. 3 табл., 2 пр.
Реферат
Геморрагическая лихорадка с почечным синдромом - острое, вирусное заболевание зоонозной природы, характеризующееся системным поражением мелких кровеносных сосудов, геморрагическим диатезом и своеобразным поражением почек, высоким уровнем заболеваемости, тяжелым течением (нередко с летальным исходом) и стойкой потерей трудоспособности. Отсутствие специфических средств лечения и профилактики обусловливают высокую социальную и медицинскую значимость ГЛПС как в России, так и во многих странах мира. Случаи заболевания ГЛПС выявлены в 57 административных регионах Российской Федерации и составляют ежегодно 8-10 тысяч больных, при этом 98% заболеваемости регистрируется в Европейской части России.
Наиболее эффективным методом борьбы с ГЛПС является вакцинопрофилактика, что было продемонстрировано в Китае и Южной Корее. В настоящее время коммерческие вакцины против ГЛПС производятся только в Китае, однако ни одна из этих вакцин не может применяться в европейских регионах России, так как не обеспечивает защиты от вирусов Пуумала и Добрава - возбудителей ГЛПС в этих регионах.
Для изготовления и контроля вакцины против вирусов, возбудителей ГЛПС, необходимо решить проблему разработки эффективных методов контроля содержания специфических антигенов - индукторов иммунного ответа в вакцинных препаратах, в том числе на технологических этапах их производства. Одним из способов иммунохимического определения вирусных белков является метод иммуноферментного анализа. Для повышения специфичности и чувствительности анализа в качестве основы такого метода было решено использовать моноклональные антитела.
Целью предлагаемого изобретения является получение универсальной иммуноферментной тест-системы определения иммуногенных белков хантавирусов - возбудителей ГЛПС.
Процесс конструирования иммуноферментной тест-системы «XAHTA-N» включает:
получение очищенных моноклональных антител к хантавирусам Пуумала и Добрава, отбор антител, перекрестно-реагирующих с вирусами Пуумала, Добрава, Хантаан, Сеул, и приготовление конъюгата моноклональных антител с пероксидазой хрена (далее пероксидазный конъюгат), комплектация набора тест-системы.
Более подробно получение тест-системы осуществляют следующим образом.
I. Получение моноклональных антител. Мышей линии BALB/c иммунизируют очищенными препаратами инактивированных вирусов (Пуумала, штамм К-27/Уфа-85 и Добрава, штамм Аа 1854/Липецк-06) в дозе 100мкг/мышь. Иммунизацию проводят в подушечки задних лап дважды с двухнедельным интервалом. Клетки подколенных лимфоузлов иммунных мышей гибридизуют с клетками мышиной миеломы линии SP2/0 по стандартной методике, используя полиэтиленгликоль 4000. Гибридомные клетки, продуцирующие специфические антитела, подвергают 2-4-кратному клонированию методом предельных разведений. Клоны гибридомы с устойчивой продукцией антител нарабатывают в культуре в среде DMEM (HyClone) с добавлением 5% фетальной телячьей сыворотки. Для наработки антител гибридомные клетки вводят в перитонеальную полость мышей, через 7-14 дней регистрируют развитие асцитных опухолей.
Асцитные жидкости проверяют на содержание специфических антител методом иммуноферментного анализа. Для этого образцы, содержащие очищенные антигены хантавирусов в концентрации 100 нг/мл в фосфатносолевом буфере (ФСБ), вносят в лунки иммунопанели (Costar, 3018), с последующей инкубацией при 6±2°С - 18 часов. Далее в лунки вносят 3% бычий сывороточный альбумин (БСА) (Sigma, 8159) и панели оставляют в течение 1 ч при комнатной температуре (22±3°С). После отмывания панели (здесь и далее: 5 раз по 5 мин раствором 0,01 М ФСБ+0,05% Tween-20) в лунки вносят культуральную жидкость гибридомы. После 1 ч контакта при 37°С лунки отмывают и вносят меченные пероксидазой хрена IgG против иммуноглобулинов мыши (Sigma, A 4416). В качестве индикатора используют тетраметиленбензидин (ТМБ, Sigma, T8665). Антитела (IgG) выделяют из асцитных жидкостей аффинной хроматографией на колонке с HiTeap ProteinG (GE Healthcare, 17-0405-03). Очищенные моноклональные антитела стандартизуют по белку (до 1 мг/мл) и далее определяют их специфическую активность методом иммунофлюоресценции.
II. Отбор перекрестно-реагирующих антител проводят методом непрямой иммунофлюоресценции с использованием моновалентных культуральных антигенов хантавирусов Пуумала, Добрава, Хантаан и Сеул. Антигены хантавирусов Пуумала, Добрава, Хантаан и Сеул для метода иммунофлюоресценции получают путем заражения культуры клеток VеrоЕ6 с множественностью 0,1-0,5 ФОЕ/кл при объеме инокулята 15 мл на 1-литровую роллерную бутыль. Сбор клеток, содержащих вирусные антигены, проводят на 10-11 сутки инкубации зараженных клеток при 37±1°С. Клетки снимают со стекла смесью 0,02% версена и 0,5% трипсина, 5-кратно отмывают 0,85% раствором NaCl, готовят суспензию инфицированных клеток (450-550 тыс.кл/мл) и наносят ее по 0,005 мл на предметные стекла для иммунофлюоресценции. После высушивания стекла помещают на 30 минут в охлажденный ацетон для фиксации клеток и инактивации вируса и затем высушивают при комнатной температуре. Аналогично готовят контрольные антигены из незараженных клеток VеrоЕ6. Образцы мАТ титруют на 0,85% растворе NaCl и наносят на антигенные препараты. Для индикации мАТ, связавшихся с антигеном, используют антитела к иммуноглобулинам мыши, конъюгированные с флюоресцеинизотиоционатом. Опыт учитывают с помощью люминесцентного микроскопа под водно-иммерсионным объективом (×60 или ×65).
Отбирают клоны антител Пуумала и Добрава, в равной степени перекрестно реагирующие с антигенами вирусов Пуумала, Добрава, Хантаан и Сеул. Нами использованы 2 клона антител, соответствующие этим характеристикам: моноклональные антитела к вирусу Пуумала - ПУУ/Н6 и к вирусу Добрава - ДОБ/А4.
| Таблица 1 | ||||||
| Характеристики моноклональных антител | ||||||
| мАТ | Субизотип | АНТИГЕНЫ | ||||
| ПУУ | ХАН | СЕУЛ | ДОБ | Vero-Е6 | ||
| ПУУ/Н6 | IgG1 | 4096 | 4096 | 4096 | 4096 | <32 |
| ДОБ/А4 | IgG2a | 1024 | 512 | 512 | 4096 | <32 |
III. Конъюгация моноклональных антител ДОБ/А4 с пероксидазой хрена. Растворяют 5 мг пероксидазы хрена с RZ 3,0 в 1 мл 0,3 М бикарбонатного раствора и после полного растворения пероксидазы добавляют 0,025 мл 0,32% раствора формальдегида (1:100). Осторожно перемешивают на магнитной мешалке в течение 30 минут при температуре от 15 до 25°С, затем к смеси добавляют 1 мл 0,04 М раствора периодата натрия. По истечении 30 минут перемешивания цвет смеси (коричневый) приобретает зеленоватый оттенок. Добавляют 1 мл 0,16 М раствора этиленгликоля, перемешивают в течение 1 часа. Смесь диализуют против 1 л 0,01 М карбонатно-бикарбонатного буферного раствора (КББ) в течение 16-20 час при температуре (6±2)°С. Параллельно диализуют против 1 л КББ мАТ ДОБ/А4 (1,5 мл) в концентрации 10 мг/мл в тех же условиях. После диализа активированную пероксидазу переносят в тот же флакон, добавляют 1 мл мАТ ДОБ/А4, диализованных против КББ, смесь осторожно перемешивают при температуре 18-25°С в течение 2 часов. Добавляют 5 мг NaBH4 и оставляют на 2 часа при температуре (6±2)°С. Смесь диализуют против 1 л 0,01М ФСБ в течение 16-20 час при температуре 18-25°С. После диализа коньюгат извлекают из мешка и наносят на колонку (1,6×90 см) с сефадексом G-100, уравновешенную 1М ФСБ. Элюируют тем же буфером (скорость элюции свободная) при температуре (6±2)°С, собирая фракции по 3 мл. Окрашенные фракции фотометрируют при 280 нм и 403 нм. Определяют отношение оптической плотности (ОП) каждой фракции при 403 нм к 280 нм (показатель RZ - ОП 403/ОП 280) и отбирают 1-2 пиковые фракции с RZ 0,45-0,6 (оптимум - 0,5). Коньюгат разводят 1:10 в 1%-ном растворе бычьего сывороточного альбумина на 0,1 М ФСБ, для хранения в жидком виде разводят 1:2 в глицерине и разливают в зависимости от величины рабочего разведения в инсулиновые флаконы.
Определение специфических вирусных белков вирусов Пуумала, Добрава, Хантаан и Сеул с помощью иммуноферментной системы «XAHTA-N». В лунки иммунопанели вносят мАТ ПУУ/Н6 в концентрации 1 мкг/мл в КББ. После контакта в течение 12-18 часов при температуре (6±2)°С или 3-х часов при 37°С в лунки вносят 3% БСА и панели оставляют в течение 1 ч при комнатной температуре. После отмывания панели (здесь и далее 5 раз по 5 мин раствором 0,01 М ФСБ+0,05% Tween-20) в лунки вносят исследуемые образцы. После 2-часового контакта при 37°С лунки отмывают и вносят пероксидазный конъюгат мАТ ДОБ/А4 и инкубируют панели 1 ч при 37°С. В качестве индикаторной системы используют тетраметиленбензидин (ТМБ) по инструкции производителя (Sigma, T8665). Положительной считают пробу, для которой отношение оптической плотности в лунке со специфическим иммуноглобулином превышает показатель оптической плотности с нормальным иммуноглобулином в 2,1 раза (индекс P/N).
Предлагаемый способ позволяет получить иммуноферментную тест-систему, обладающую следующими достоинствами:
1) универсальностью, проявляющейся в том, что ИФ тест-система «XAHTA-N» выявляет антигены всех 4-х хантавирусов - возбудителей ГЛПС, что позволяет унифицировать методы контроля специфической активности поливалентных вакцинных препаратов против ГЛПС;
2) с одинаковой чувствительностью (в соответствии с титром вируса) определяются антигены каждого из 4-х хантавирусов - возбудителей ГЛПС, что обеспечивается использованием моноклональных антител, полученных к 2-м филогенетически различным хантавирусам Пуумала и Добрава (для сенсибилизации панели и приготовления конъюгата) и отобранных по принципу перекрестного реагирования с вирусами Пуумала, Добрава, Хантаан, Сеул.
3) с одинаковой чувствительностью выявляются антигены как живого, так и инактивированного формалином вируса, что важно с точки зрения их применения для оценки специфической и протективной активности инактивированных вакцинных
препаратов на технологических этапах их производства.
Пример 1.
Для определения хантавирусных антигенов в образцах культуральной жидкости после
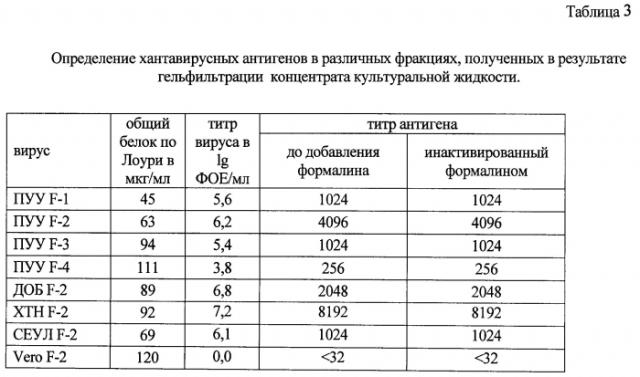
заражения вирусами Пуумала, Добрава, Хантаан и Сеул применяют тест-систему «XAHTA-N». В лунки иммунопанели вносят мАТ ПУУ/Н6 в концентрации 1 мкг/мл в КББ. После контакта в течение 12-18 часов при температуре (6±2)°С в лунки вносят 3% БСА и панели оставляют в течение 1 ч при комнатной температуре. Во вспомогательной панели готовят двукратные разведения исследуемых образцов на ФСБ. После отмывания панели (как описано выше) в лунки вносят исследуемые образцы. После 2-часового контакта при 37°С лунки отмывают, вносят пероксидазный конъюгат мАТ ДОБ/А4 и инкубируют панели 1 ч при 37°С. После отмывки в лунки панели вносится ТМБ и через 20 мин проводят учет опыта, определяя оптическую плотность в лунках панели с помощью спектрофотометра (при длине волны 450). За титр антигена принимают конечное разведение образца, для которого отношение оптической плотности в лунке со специфическим иммуноглобулином превышает показатель оптической плотности с нормальным иммуноглобулином в 2,1. С целью определения чувствительности метода приводятся данные по содержанию живого вируса в образцах. Для контроля специфичности тест-системы использована культуральная жидкость клеток VеrоЕ6, являющихся субстратом для размножения вируса. Результаты, приведенные в таблице 1, свидетельствуют о том, что антигены каждого из 4-х хантавирусов - возбудителей ГЛПС определяются с одинаковой чувствительностью, в соответствии с титром вируса.
| Таблица 2. | |||
| Определение хантавирусных антигенов в первичных и очищенных концентратах культуральной жидкости. | |||
| материал | общий белок по Лоури в мкг/мл | титр вируса в lg ФОЕ/мл | титр антигена |
| ПУУ-I* | 6800 | 6,6 | 8192 |
| ПУУ-II** | 0,086 | 6,4 | 4096 |
| ДОБ-I | 9400 | 7,2 | 8192 |
| ДОБ-II | 0,056 | 6,8 | 4096 |
| XTH-I | 10120 | 7,1 | 4096 |
| ХТН-II | 0,072 | 6,6 | 2048 |
| СЕУЛ-I | 9800 | 6,2 | 2048 |
| СЕУЛ -II | 0,048 | 5,8 | 512 |
| VeroE6-I | 12800 | 0,0 | <64 |
| VeroE6-II | 0,101 | 0,0 | <8 |
Примечание. * - неочищенный концентрат культуральной жидкости; ** - очищенный гельфильтрацией концентрат культуральной жидкости.
Пример 2.
Проводят определение хантавирусных антигенов во фракциях культуральной жидкости после заражения вирусами Пуумала, Добрава, Хантаан и Сеул, очищенных в результате гельфильтрации, и в этих же образцах после инактивирования в них вируса 0,25% формалином при температуре 8±2°С в течение 20 суток. Тест-систему «XAHTA-N» используют, как описано в примере №1. Результаты этого опыта, представленные в таблице 2, показывают, что инактивирование вируса формалином (0,25%) не влияет на чувствительность и специфичность определения хантавирусных антигенов.
Способ получения иммуноферментной тест-системы «ХАНТА-N» для оценки содержания иммуноспецифических белков хантавирусов Пуумала, Добрава, Хантаан и Сеул в вакцинных препаратах против геморрагической лихорадки с почечным синдромом (ГЛПС), отличающийся тем, что получают моноклональные антитела к вирусам Пуумала и Добрава с одинаковой чувствительностью, в соответствии с титром вируса, выявляющие антигены каждого из 4-х хантавирусов - возбудителей ГЛПС (Пуумала, Добрава, Хантаан, Сеул), сорбируют их на поверхность полистироловой панели, а также используют для приготовления конъюгата с пероксидазой хрена.