Пептиды и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к пептидам, обладающим противомикробной активностью, и может быть использовано в медицине. Получены пептиды RRRFRFFFRFRRR, HHHFRFFFRFRRR, KKFPWRLRLRYGRR, RRRRRFFFRFRRR, RRRFRFRFRFRRR, RRRFRFPFRFRRR, RRFRRFFFRRFRR, RRRRFFFRRRR, RRRRFRFRRRR, RRRRFPFRRRR, RRFRRRFRRFR, RRFRRRFRRFG, RRFGRRFRRFG, RRFRRFRRRFG, RRFRRFRRRFR, FRRRRFFFRFRRR, RRRRRFFFRRRRF, FFFFRRRRRFRRR, RRRRFFFFFRRRR, FRRRRFFFRRRRF, RRRYRYYYRYRRR, RRRARAAARARRR, RRRFRRRRRFFFF, RRRFFFFFFFRRR, которые могут быть использованы в составе противомикробной композиции. Изобретение позволяет получить пептиды, обладающие широким спектром антибактериальной активности как против грамположительных, так и против грамотрицательных бактерий. 2 н. и 8 з.п. ф-лы, 11 ил., 2 пр.
Реферат
Область изобретения
Настоящее изобретение относится к пептидам и их применению в лечении микробных инфекций, в частности бактериальных инфекций. Также предложен способ лечения.
Предшествующий уровень техники
Противомикробные пептиды представляют собой ключевые эффекторные молекулы врожденной иммунной системы и интегральные компоненты первой линии защиты против микробных инфекций всех эукариотических организмов. Ряд прокариотических организмов также использует Противомикробные пептиды в качестве средств для борьбы против заражения другими микроорганизмами. Многие Противомикробные пептиды характеризуются катионными свойствами, которые способствуют взаимодействиям с отрицательно заряженными фосфолипидами микробной мембраны, что затем приводит к микробному лизису и гибели после пермеабилизации мембраны. Например, было показано, что Противомикробные пептидные молекулы могут агрегировать и образовывать потенциалозависимые каналы в липидном бислое, приводя в результате к пермеабилизации как внутренней, так и внешней мембраны микроорганизма (Lehrer, R. I., J. Clin. Investigation, 84:553 (1989)). Амфифильная природа этих молекул также может способствовать включению гидрофобного остатка в липидный бислой посредством электростатического притяжения, в то время как полярные остатки вдаются внутрь и выше мембраны.
Устойчивые к лекарствам микроорганизмы, особенно бактерии, становятся все более проблематичными, так как степень инфицирования продолжает увеличиваться, и эффективные способы контроля становятся все более и более ограниченными. Интенсивное использование антибиотиков в последние 50 лет или около того, в сочетании с бессистемным назначением антибиотиков и несоблюдением пациентами режимов лечения, выделило микроорганизмы, которые развивались или приобрели средство противостоять эффектам антибиотиков. Передача инфекции и контроль за лекарственно-устойчивыми организмами становятся одной из наиболее значимых проблем здравоохранения.
Все грамположительные виды, включая Staphylococcus spp., Enterococcus spp., Listeria spp., Clostridium spp., Corynebacterium spp., Nocardia spp., Bacillus spp.и Streptococcus spp., в том числе те, которые развивались или получили варьирующие уровни устойчивости к антибиотикам, таким как метициллин (meticillin), представляют особый интерес, также как и грамотрицательные виды Eschehchia spp., Pseudomonas spp., Klebsiella spp.и Acetinobacter spp.Другие грамотрицательные патогены, представляющие интерес, включают Enterobacteriaceae (особенно те, которые продуцируют β-лактамазу (ESBL) или карбапенемазу расширенного спектра). Коагулазонегативные Staphylococci, такие как S. epidermidis, также появились как важные лекарственно-устойчивые внутрибольничные патогены. Возможности лечения инфекций, в которые вносят вклад или которые вызываются метициллин-устойчивыми бактериями или бактериями со множественной лекарственной устойчивостью, в настоящее время ограничены, и существует острая необходимость в разработке новых терапий, которые ингибируют или уничтожают такие организмы. Другие бактериальные патогены, представляющие особый интерес, включают Mycobacterium spp., например Mycobacterium tuberculosis; Enterobacter spp.; Campylobacter spp.; Salmonella spp.; Helicobacter spp., например Helicobacter pylori; Neisseria spp., например Neisseria gonorrhea, Neisseria meningitidis; Borrelia burgdorferi; Shigella spp., например Shigella flexnerii; Haemophilus spp., например Haemophilus influenzae; Chlamydia spp., например Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci; Francisella tularensis; Yersinia spp., например Yersinia pestis; Treponema spp.; Burkholderia spp.; например Burkholderia mallei и В. pseudomallei.
Pseudomonas aeruginosa представляет собой оппортунистический патоген, который вызывает инфекции дыхательных путей, инфекции мочевыводящей системы, дерматит, инфекции мягких тканей, бактериемию и ряд системных инфекций, особенно у пациентов с тяжелыми ожогами и пациентов, страдающих раком и СПИД, у которых иммунная система подавлена. Респираторные инфекции, вызываемые Pseudomonas aeruginosa, возникают почти исключительно у индивидуумов с нарушениями нижних дыхательных путей или нарушенным механизмом системной защиты (например, у пациентов с муковисцидозом или хронической обструктивной болезнью легких). Первичная пневмония возникает у пациентов с хроническим легочным заболеванием и застойной сердечной недостаточностью. Бактериемическая пневмония наиболее часто возникает у раковых пациентов с нейтропенией, подвергающихся химиотерапии. Колонизация нижних дыхательных путей пациентов с муковисцидозом мукоидными штаммами Pseudomonas aeruginosa является распространенной и трудно поддается лечению. Существует необходимость в разработке эффективного средства лечения инфекций Pseudomonas aeruginosa.
Staphylococcus aureus представляет собой оппортунистический патоген, который в обычных условиях встречается на коже и в носу многих здоровых людей, где он живет абсолютно безвредно. Однако, S. aureus может вызывать проблемы, когда он способен проникнуть в организм, вызывая абсцессы, нарывы, прыщи, импетиго и раневые инфекции, независимо от того получены ли они случайно или в результате хирургического вмешательства. Если инфекция попадает в кровоток и разносится в разные части тела, она может вызвать заражение крови (септицемию), костную инфекцию (остеомиелит), инфекцию сердечного клапана (эндокардит) и легочную инфекцию (пневмонию). Метициллин-устойчивый S.aureus (MRSA) представляет собой тип S. aureus, который является устойчивым ко многим распространенным прописываемым антибиотикам, включая метициллин (примерно 40% инфекций S. aureus в UK являются устойчивыми к метициллину и другим антибиотикам), и часто на него ссылаются в популярной прессе как на "сверхинфект". MRSA является одним из наиболее превалирующих микробов, вовлеченных в инфекции, связанные с здравоохранением. Инфекции обычно имеют место в госпиталях, и в частности у восприимчивых и/или ослабленных пациентов, включая пациентов в палатах интенсивной терапии, Ожеговых отделениях и ортопедических отделениях. MRSA тяжелее поддается лечению, так как многие антибиотики являются неэффективными, а те, которые эффективны, часто необходимо давать в более высоких дозах внутривенно в течение продолжительных периодов времени (несколько недель), тем самым подчеркивая необходимость в разработке альтернативных противомикробных терапий.
Поскольку микробные патогены не приобретают быстро устойчивость к катионным пептидам, вопреки эволюционному давлению миллионов лет совместного существования, они остаются привлекательными терапевтическими мишенями. В заявках авторов настоящего изобретения WO 2006/018652 и WO 2008/093058, находящихся на одновременном рассмотрении, описана идентификация пептидов, которые могут быть использованы для лечения микробных инфекций, включая бактериальные инфекции.
Микробная биопленка представляет сообщество микробных клеток, заключенных во внеклеточную матрицу полимерных веществ и прикрепленных к биологической или неживой поверхности. Ряд микроорганизмов (бактерии, грибы и/или простейшие, с ассоциированными бактериофагами и другими вирусами) может быть обнаружен в этих биопленках. Биопленки повсеместно распространены в природе и наиболее часто обнаруживаются в разнообразных окружениях. Биопленки все более признаются учеными и медицинским сообществом как вовлеченные во многие инфекции, и особенно их вклад в неподдаваемость противоинфекционному лечению.
Образование биопленки не ограничено только способностью микробов прикрепляться к поверхности. Микробы, растущие на биопленке, способны взаимодействовать друг с другом в большей степени, чем с фактическим физическим субстратом, на котором биопленка исходно развивалась. Например, этот феномен благоприятствует конъюгативному переносу генов, который возникает в большей степени между клетками в биопленке, чем между планктонными клетками. Это увеличивает возможность горизонтального переноса генов между бактериями и является важным, поскольку способствует переносу генов устойчивости к антибиотикам или генов, определяющих вирулентность, от устойчивых микробов к чувствительным. Бактерии могут взаимодействовать друг с другом посредством системы, известной как бактериальное чувство кворума, через которую молекулы передачи сигнала высвобождаются в среду, и их концентрация может быть детектирована окружающими микробами. Бактериальное чувство кворума дает возможность бактериям координировать свое поведение, таким образом усиливая их способность к выживанию. Реакции на бактериальное чувство кворума включают адаптацию к доступности питательных веществ, защиту от других микроорганизмов, которые могут конкурировать за те же питательные вещества, и избегание токсических соединений, потенциально опасных для бактерий. При инфицировании хозяина (например людей, других животных или растений) важным для патогенных бактерий является координирование их вирулентности, для того чтобы ускользать от иммунного ответа хозяина с целью обеспечения способности установления успешного инфицирования.
Образование биопленки играет ключевую роль во многих инфекционных заболеваниях, таких как муковисцидоз и периодонтит, в инфекциях крови и мочевыделительной системы, а также как следствие наличия постоянных медицинских устройств. Подтвержденные механизмы, с помощью которых ассоциированные с биопленкой микроорганизмы вызывают заболевания у их хозяина, включают следующие: (1) замедленное проникновение противомикробного агента через биопленочную матрицу, (2) открепление клеток или клеточных агрегатов от биопленок на постоянных медицинских устройствах, (3) продуцирование эндотоксинов, (4) устойчивость к иммунной системе хозяина, (5) предоставление ниши для генерирования устойчивых организмов через горизонтальный перенос генов противомикробной устойчивости и/или генов, определяющих вирулентность, и (6) изменение скорости роста (а именно, метаболический покой) (Donlan and Costerton, Clin Microbiol Rev 15: 167-193, 2002; Parsek and Singh, Annu Rev Microbiol 57: 677-701, 2003; Costerton JW, Resistance of biofilms to stress. In The biofilm primer'. (Springer Berlin Heidelberg), pp.56-64.2007).
Экспериментальные свидетельства последнего времени указывают на существование в биопленках небольшой субпопуляции специализированных неметаболизирующих персистирующих клеток (покоящиеся клетки). Считают, что эти клетки могут быть ответственными за высокую устойчивость/толерантность биопленки к противомикробным агентам. Персистирующие клетки с множественной устойчивостью к лекарствам и толерантностью присутствуют как в планктонных популяциях, так и в биопленках, и, по-видимому, дрожжи и бактерии проявляли аналогичные стратегии, которые направляют функцию выживания для этой субпопуляции. Защита, обеспечиваемая полимерной матрицей, дает возможность персистирующим клеткам избегать элиминации и служит в качестве источника репопуляции. Есть доказательство того, что персистеры могут быть в большой степени ответственными за множественную лекарственную устойчивость микробных биопленок (LaFleur et al., Antimicrob Agents Chemother. 50: 3839-46, 2006; Lewis, Nature Reviews Microbiology 5, 48-56 2007).
Таким образом, существует потребность в дополнительных агентах, которые могут быть использованы для лечения микробных инфекций. В частности, сохраняется острая необходимость в дополнительных противомикробных активных веществах, которые могут быть использованы в лечении бактериальных инфекций, таких как те, которые вызываются Staphylococci, Streptococci, Acinetobacter spp., Klebsiella spp., E. соli и Pseudomonas spp.Также имеется острая необходимость в лучших терапиях для предупреждения образования биопленки и лечения состояний, ассоциированных с микробными биопленками.
Авторы настоящего изобретения идентифицировали пептиды, которые неожиданно проявляли улучшенную противомикробную активность по сравнению с природными противомикробными пептидами, такими как дефензины, кателицидины и другие. Заявленные соединения имеют сильные противомикробные свойства, в то же время проявляя низкую токсичность in vitro и in vivo у животных и людей.
Краткое изложение сущности изобретения
Согласно первому аспекту настоящего изобретения предложен пептид, где по меньшей мере 75% аминокислот пептида представляют собой аминокислоты аргинин и фенилаланин, причем по меньшей мере 50% аминокислот представляют собой аминокислоту аргинин и по меньшей мере 15% аминокислот представляют собой аминокислоту фенилаланин.
Пептиды по изобретению полезны среди прочего в лечении или предупреждении микробных инфекций, в частности бактериальных инфекций, таких как инфекции, вызываемые Staphylococcus spp. и Pseudomonas spp., но не ограниченных ими. Пептиды по настоящему изобретению также полезны в предупреждении и лечении биопленочных инфекций, вызванных этими и другими бактериями.
В общем, по меньшей мере 80% аминокислот в пептиде представляют собой аминокислоты аргинин и фенилаланин, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, типично около 99% аминокислот в пептиде представляют собой аминокислоты аргинин и фенилаланин. Согласно одному из воплощений все аминокислоты в пептиде представляют собой аргинин и фенилаланин.
В общем, по меньшей мере 55% аминокислот в пептиде представляют собой аминокислоту аргинин, предпочтительно по меньшей мере 60% (например 61%), более предпочтительно по меньшей мере 65%, типично около 70% аминокислот в пептиде представляют собой аминокислоту аргинин.
В общем, по меньшей мере 20% аминокислот в пептиде представляют собой аминокислоту фенилаланин, предпочтительно по меньшей мере 25%, более предпочтительно по меньшей мере 30%, типично около 30-40% (например 38%) аминокислот в пептиде представляют собой аминокислоту фенилаланин.
Аминокислоты пептида по настоящему изобретению могут быть D- или L-аминокислотами. Аминокислоты могут быть оптическими изомерами катионных аминокислот, как определено здесь, например D- или L-аминокислот. Аминокислоты могут быть природными или синтетическими. Изобретение также включает известные изомеры (структурные, стерео-, конформационные и конфигурационные) и структурные аналоги вышеуказанных аминокислот, и те, которые модифицированы естественным путем (например посттрансляционной модификацией) или химическим путем, включая, но не исключительно, фосфорилирование, гликозилирование, сульфонилирование и/или гидроксилирование.
Согласно одному из воплощений настоящего изобретения пептид состоит из аминокислот аргинина и фенилаланина, возможно с неаргининовыми и нефенилаланиновыми заменами в количестве вплоть до пяти. В общем, пептид состоит из аминокислот аргинина и фенилаланина с неаргининовыми и нефенилаланиновыми заменами в количестве ноль, одна, две или три, типично ноль, одна или две замены, преимущественно ноль или одна замена.
Согласно одному из воплощений пептид состоит из аминокислот аргинина и фенилаланина.
Типично, пептид по настоящему изобретению может содержать 1-5 замен, предпочтительно 1-3 замены, как правило одну замену. Замена(ы) могут быть концевыми или неконцевыми.
Замены могут состоять из аминокислот или не являться аминокислотами. Замены могут быть заряженными или незаряженными. Типично, одна или более замен представляют собой незаряженные аминокислоты. Альтернативно или дополнительно, одна или более замен могут представлять собой заряженные аминокислоты, в частности катионные аминокислоты. Одна или более аминокислотных замен могут быть гидрофобными.
Когда одна или более замен являются аминокислотными заменами, они могут быть заряженными или незаряженными аминокислотами. Аминокислотные замены могут быть существующими в природе либо не существующими в природе, синтезированными аминокислотными заменами.
В общем, замены состоят из одной или более гидрофобной аминокислоты и/или одной или более катионной аминокислоты.
Термин "гидрофобный", как он использован здесь, относится к аминокислоте, имеющей боковую цепь, которая является незаряженной при физиологическом рН, которая является неполярной и которая в общем отталкивается водным раствором.
В общем, гидрофобный аминоостаток имеет гидрофобность не ниже -1,10 и заряд не выше 0.
Термин "катионный", как он использован здесь, относится к аминокислотам, имеющим суммарный заряд не ниже 0. В общем, термин "катионный" относится к аминокислотам, имеющим суммарный заряд выше нуля.
Типичные гидрофобные аминокислотные замены включают глицин, лейцин, пролин, аланин, триптофан, валин, изолейцин, метионин, тирозин и треонин.
Типичные катионные аминокислотные замены включают орнитин, гистидин и лизин.
Согласно одному из воплощений пептид содержит одну или более аминокислот цистеина, в частности один или два концевых остатка цистеина.
Согласно одному из воплощений пептид содержит одну или более замен, выбранных из группы лизин, пролин, глицин и гистидин.
Преимущественно, пептид состоит из аргинина, фенилаланина и одной из группы, состоящей из лизина, пролина, глицина и гистидина. Преимущественно, группа состоит из пролина и глицина.
В общем, пептид не содержит аминокислоты аспарагиновую кислоту, глутаминовую кислоту, аспарагины, глутамин или серин, но некоторые пептиды по изобретению могут иметь активность, даже если эти аминокислоты присутствуют.
В дополнение, аминокислотная последовательность пептида может быть модифицирована таким образом, чтобы привести в результате к варианту пептида, который включает замену по меньшей мере одного аминокислотного остатка в пептиде на другой аминокислотный остаток, включая замены, которые используют D-, а не L-форму.
Один или более остатков пептида могут быть заменены на другой для изменения, усиления или сохранения биологической активности пептида. Такой вариант может иметь, например, по меньшей мере приблизительно 10% биологической активности соответствующего невариантного пептида. Часто используют консервативные аминокислоты, то есть замены аминокислот с подобными химическими и физическими свойствами, как описано выше.
Так, например, консервативные аминокислотные замены могут включать замену одной катионной аминокислоты на другую, например аргинин на лизин, орнитин или гистидин. Альтернативно или дополнительно, фенилаланин может быть заменен на глицин, лейцин, пролин, аланин, триптофан, валин, изолейцин, метионин, тирозин или треонин. После введения замен варианты подвергают скринингу на биологическую активность.
Пептид по настоящему изобретению может содержать от 2 до 200 аминокислот, например от 3, 4, 5, 6 или 7 вплоть до 100 аминокислот, включая от 3, 4, 5, 6 или 7 вплоть до 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот.
Согласно одному из воплощений противомикробный пептид содержит от 3 или 4 до 50 аминокислот.
Пептид может содержать от 100 до 200 аминокислот, от 20 до 100, от 20 до 45 аминокислот, например 20, 25, 30, 35, 40, 42 или 45 аминокислот. Пептид может содержать от 3 до 15 аминокислот, например от 5 до 15 аминокислот, например 13-15 аминокислот.
Типично, пептид содержит от 5 до 20 аминокислот, предпочтительно от 5 до 15, более предпочтительно от 7 до 15, в общем от 10 до 15 аминокислот, включая от 11 до 13 аминокислот.
Согласно одному из воплощений пептид состоит из 10-15 аминокислот, в частности 11-13 аминокислот.
Пептид может типично содержать от 5 до 50 аминокислот аргинина, предпочтительно от 5 до 30, более предпочтительно от 5 до 20, в общем от 7 до 10 аминокислот аргинина.
Пептид может содержать от 1 до 20 аминокислот фенилаланина, типично от 1 до 15, предпочтительно от 2 до 10, более предпочтительно от 2 до 5 аминокислот фенилаланина.
В общем, пептид содержит аргининовый каркас, в котором присутствуют фенилаланиновые замены.
В общем, пептид содержит по меньшей мере один непрерывный участок из 3-20 аминокислот аргинина, типично по меньшей мере один непрерывный участок из 3-10 аминокислот аргинина, предпочтительно по меньшей мере один непрерывный участок из 3-5 аминокислот аргинина. Альтернативно или дополнительно, пептид может содержать по меньшей мере один непрерывный участок из 5-10 аминокислот аргинина.
В общем, пептид содержит по меньшей мере один непрерывный участок из 1-5 аминокислот фенилаланина, типично по меньшей мере один непрерывный участок из 3-5 аминокислот фенилаланина, предпочтительно пептид содержит по меньшей мере один непрерывный участок из 3 аминокислот фенилаланина.
Согласно одному из воплощений пептид содержит более одного фенилаланинового участка, каждый из которых содержит одну или более аминокислот фенилаланина. В общем, пептид содержит два или три фенилаланиновых участка.
Согласно одному из воплощений пептид не содержит концевую аминокислоту фенилаланин.
Согласно одному из воплощений пептид содержит одну концевую аминокислоту фенилаланин, только в качестве примера, М-концевой фенилаланин. Предпочтительно пептид не содержит концевую аминокислоту фенилаланин на обоих концах пептида.
Типично, пептид содержит аргининовые аминокислотные участки на одном или обоих концах, предпочтительно аргининовые аминокислотные участки, имеющие 1-5 аминокислот аргинина. Альтернативно, пептид может содержать одну или две концевые неаргининовые и нефенилаланиновые замены. Подходящие концевые замены включают описанные выше замены, в частности гистидин, цистеамин и лизин.
Пептид может содержать аминокислоту фенилаланин на С- или N-конце и аминокислоту аргинин на соответствующем N- или С-конце.
Согласно одному из воплощений пептид содержит С-концевую аминокислоту аргинин и N-концевую аминокислоту фенилаланин.
Согласно одному из воплощений пептид не содержит последовательность (например 2 или более) аминокислот фенилаланина на N-конце.
Пептид по настоящему изобретению может быть симметричным или несимметричным.
Предпочтительно пептид является ациклическим. Пептид может быть прямоцепочечным, то есть линейным, или разветвленным. Термин "пептид", как он использован здесь, означает в общем смысле множество аминокислотных остатков, соединенных вместе пептидными связями. Его используют взаимозаменяемо, и он означает то же самое, что и полипептид и белок.
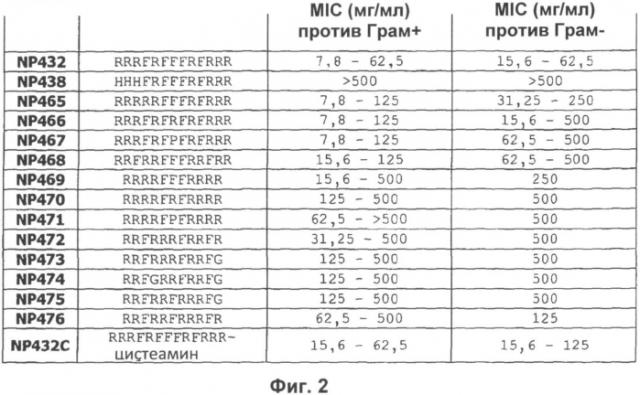
Согласно одному из воплощений настоящего изобретения пептид содержит аминокислотную последовательность, выбранную из группы RRRFRFFFRFRRR, HHHFRFFFRFRRR, KKFPWRLRLRYGRR, RRRRRFFFRFRRR, RRRFRFRFRFRRR, RRRFRFPFRFRRR, RRFRRFFFRRFRR, RRRRFFFRRRR, RRRRFRFRRRR, RRRRFPFRRRR, RRFRRRFRRFR RRFRRRFRRFG, RRFGRRFRRFG, RRFRRFRRRFG, RRFRRFRRRFR, FRRRRFFFRFRRR, RRRRRFFFRRRRF, FFFFRRRRRFRRR, RRRRFFFFFRRRR, FRRRRFFFRRRRF, RRRYRYYYRYRRR, RRRARAAARARRR, RRRFRRRRRFFFF, RRRFFFFFFFRRR и RRRFRFFFRFRRR-цистеамин. Пептиды могут состоять по существу из этих аминокислотных последовательностей.
Согласно одному из воплощений настоящего изобретения пептид содержит аминокислотную последовательность, выбранную из группы RRRFRFFFRFRRR (NP432), FRRRRFFFRFRRR (NP490), RRRRFFFFFRRRR (NP493) и RRRFRRRRRFFFF (NP497).
Согласно второму аспекту настоящего изобретения пептид содержит смесь гидрофобных и катионных аминокислот. В частности, гидрофобные аминокислоты выбраны из группы, состоящей из глицина, лейцина, фенилаланина, пролина, аланина, триптофана, валина, изолейцина, метионина,тирозина и треонина.
Пептид по этому воплощению в общем содержит аминокислоту аргинин, но не обязательно содержит аминокислоту фенилаланин.
Типично гидрофобные аминокислоты выбраны из группы, состоящей из фенилаланина, триптофана, тирозина и глицина.
В частности, катионные аминокислоты выбраны из группы, состоящей из орнитина, гистидина, аргинина и лизина. Типично катионные аминокислоты выбраны из группы, состоящей из аргинина и лизина.
Согласно одному из воплощений пептид содержит аминокислоты лизин, фенилаланин и аргинин.
Согласно дополнительному воплощению пептид содержит аминокислоты лизин, аргинин, фенилаланин, пролин, триптофан, тирозин и глицин. Хотя пептиды по настоящему изобретению не включают в общем аминокислоту глутамин, некоторые такие пептиды могут проявлять активность. Такой пептид может включать одну или две аминокислоты глутамин.
Согласно одному из воплощений описанные выше пептиды могут состоять из этих конкретных аминокислот с заменами в количестве ноль, одна или две. В общем пептиды по настоящему изобретению состоят из этих конкретных аминокислот. Альтернативно, пептиды по этому воплощению настоящего изобретения могут содержать замены, как подробно описано выше.
Пептиды по второму воплощению могут содержать аминокислотную последовательность, выбранную из группы, состоящей из KKPRRKPRRPKRKK (NP449) и KKFPWRLRLRYGRR (NP445).
Пептиды по изобретению являются в общем синтетическими пептидами. Пептиды могут быть выделенными, очищенными пептидами или их вариантами, которые могут быть синтезированы in vitro, например, способом твердофазного пептидного синтеза, катализируемого ферментами пептидного синтеза, или с помощью технологии рекомбинантной ДНК.
Для идентификации активных пептидов, которые имеют небольшую или не имеют нежелательной токсичности для клеток млекопитающих, индивидуальные пептиды или библиотеки пептидов могут быть получены, и эти индивидуальные пептиды или пептиды из этих библиотек могут быть подвергнуты скринингу на противомикробную активность и токсичность, включая противогрибковую, антибактериальную, противовирусную, противопротозойную, противопаразитарную активность и токсичность, но не ограничиваясь ими.
Пептиды по изобретению могут существовать в разных формах, таких как свободные кислоты, свободные основания, сложные эфиры и другие пролекарства, соли и таутомеры, например, и изобретение включает все вариантные формы соединений.
Таким образом, изобретение охватывает соль или пролекарство пептида или варианта пептида по изобретению.
Композиция
Согласно еще одному аспекту настоящего изобретения предложена композиция, содержащая один или более пептидов, как они описаны выше, вместе с одним или более адъювантами или эксципиентами.
Согласно одному из воплощений, композиция может содержать два или более пептидов по настоящему изобретению. Предпочтительно композиция содержит один, два или три пептида по настоящему изобретению.
Агенты по изобретению могут быть введены в форме фармацевтически приемлемых солей. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группировку, традиционными химическими способами. В общем, такие соли могут быть получены путем взаимодействия этих соединений в форме свободной кислоты или свободного основания со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в их смеси; как правило, предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечни подходящих солей можно найти в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., US, 1985, p.1418, описание которой включено в данное описание ссылкой; см. также Stahl et al, Eds, "Handbook of Pharmaceutical Salts Properties Selection and Use", Verlag Helvetica Chimica Acta and Wiley-VCH, 2002. Фраза "фармацевтически приемлемый" использована здесь для ссылки на те соединения, материалы, композиции и/или дозированные формы, которые, по результатам тщательной медицинской оценки, подходят для применения в контакте с тканями человека или животного, не вызывая излишней токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримо с обоснованным соотношением польза/риск.
Таким образом, изобретение включает фармацевтически приемлемые соли раскрытых соединений, где исходное соединение модифицировано путем получения их кислых или основных солей, например традиционных нетоксичных солей четвертичного аммония, которые образованы, например, из неорганических или органических кислот или оснований. Примеры таких солей присоединения кислоты включают ацетат, адипинат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Основные соли включают соли аммония, соли щелочных металлов, такие как соли натрия и соли калия, соли щелочноземельных металлов, такие как соли кальция и соли магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-О-глюкамина, и соли с аминокислотами, такими как аргинин, лизин и так далее. Кроме того, основные азотсодержащие группы могут быть кватернизированы с такими агентами, как галогениды низших алкилов, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -иодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутилсульфаты; и диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -иодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды, и другие.
Соли карбоксильных групп пептида или варианта пептида по изобретению могут быть получены традиционно путем взаимодействия пептида с одним или более эквивалентов желаемого основания, такого как, например, соль гидроксида металла, например гидроксид натрия; карбонат или бикарбонат металла, такие как, например, карбонат или бикарбонат натрия; или аминного основания, такого как, например, триэтиламин, триэтаноламин и тому подобное.
N-Ацилпроизводные аминогруппы пептида или варианта пептида по изобретению могут быть получены путем использования N-ацил-защищенной аминокислоты для конечной конденсации или путем ацилирования защищенной или незащищенной аминокислоты. O-Ацилпроизводные могут быть получены, например, путем ацилирования свободной гидроксигруппы пептида или пептидного полимера. Или ацилирование может быть осуществлено с использованием стандартных ацилирующих реагентов, таких как ацил галоген иды, ангидриды, ацилимидазолы и тому подобное.
Изобретение включает пролекарства для активных фармацевтических видов описанных пептидов, например, в которых одна или более функциональных групп защищены или дериватизированы, но могут превращаться in vivo в функциональную группу, как в случае сложных эфиров карбоновых кислот, превращаемых in vivo в свободную кислоту, или, в случае защищенных аминов, в свободную аминогруппу. Термин "пролекарство", как он использован здесь, представляет собой конкретные структуры, которые легко превращаются in vivo в родительскую структуру, например, путем гидролиза в крови. Подробное обсуждение предложено в Т. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol.14 of the A.C.S. Symposium Series, Edward B. Roche, ed, Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987; H Bundgaard, ed, Design of Prodrugs, Elsevier, 1985; и Judkins, et al. Synthetic Communications, 26(23), 4351-4367 (1996), каждая из которых включена в данное описание посредством ссылки.
Таким образом, пролекарства включают лекарственные средства, имеющие функциональную группу, которая была преобразована в ее обратимое производное. Как правило, такие пролекарства превращаются в активное лекарственное средство путем гидролиза. Пролекарства также включают соединения, превращаемые в активное лекарственное средство путем окислительной или восстановительной реакции. В качестве примеров можно упомянуть следующие: окислительная активация, N- и O-деалкилирование, окислительное дезаминирование, N-окисление, эпоксилирование, восстановительная активация, азо-восстановление, восстановление сульфоксида, дисульфидное восстановление, биовосстановительное алкилирование и нитровосстановление.
Также следует упомянуть в качестве метаболических активации пролекарств нуклеотидную активацию, активацию фосфорилированием и активацию декарбоксилированием.
Использование защитных групп полностью описано в "Protective Groups in Organic Chemistry", под редакцией J W F McOmie, Plenum Press (1973), и "Protective Groups in Organic Synthesis", 2-е издание, Т W Greene & P и М Wutz, Wiley-lnterscience (1991).
Таким образом, специалистам в данной области техники понятно, что, хотя защищенные производные описанных пептидов сами по себе могут не обладать фармакологической активностью, они могут быть введены, например парентерально или перорально, и затем метаболизированы в организме с образованием соединений, которые являются фармакологически активными. Такие производные являются, таким образом, примерами "пролекарств". AU пролекарства описанных соединений включены в объем данного изобретения.
Композиция по настоящему изобретению также включает один или более фармацевтически приемлемых носителей, эксципиентов, адъювантов или разбавителей. Фразу "фармацевтически приемлемый" используют в данном описании для ссылки на те соединения, вещества, композиции и/или лекарственные формы, которые, по результатам тщательной медицинской оценки, подходят для использования в контакте с тканями человека, или возможно животного, не вызывая излишнюю токсичность, раздражение, аллергическую реакцию или другую проблему или осложнение, соизмеримо разумному соотношению польза/риск.
Когда терапевтические пептиды по изобретению изготавливают для перорального введения, их как правило объединяют с фармацевтически приемлемым носителем, разбавителем или эксципиентом с образованием фармацевтического препарата или стандартной лекарственной формы. Для перорального введения пептиды могут быть представлены в форме порошка, гранулярного образования, раствора, суспензии, эмульсии или в природном или синтетическом полимере или смоле для всасывания активных ингредиентов из жевательной резинки. Активные пептиды также могут быть представлены в виде болюса, электуария или пасты. Перорально вводимые терапевтические пептиды по изобретению также могут быть приготовлены в виде препарата с непрерывным высвобождением, например, пептиды могут быть покрыты оболочкой, инкапсулированы в микрокапсулы или иным образом помещены в устройство для непрерывной доставки. Суммарное содержание активных ингредиентов в таких препаратах составляет от 0,1 до 99,9% по массе препарата.
Таким образом, одна или более подходящих стандартных лекарственных форм, содержащих терапевтические пептиды по изобретению, могут быть введены различными путями, включая пероральный, парентеральный (в том числе подкожный, внутривенный, внутримышечный и внутрибрюшинный), ректальный, дермальный, трансдермальный, внутригрудинный, внутрилегочный, мукозальный, внутриглазной и интраназальный (респираторный) пути. Терапевтические пептиды также могут быть приготовлены в виде липидного препарата или для непрерывного высвобождения (например, с использованием микроинкапсулирования, см. WO 94/07529 и патент США 4962091, включенные в данное описание посредством ссылки). Когда подходит, препараты могут быть удобным образом представлены в дискретных стандартных лекарственных формах и могут быть изготовлены любым из способов, хорошо известных в области фармацевтики. Такие способы могут включать стадию смешивания терапевтического агента с жидкими носителями, твердыми матрицами, полутвердыми матрицами, тонкоизмельченными твердыми носителями или их комбинациями и затем, при необходимости, включения в форму или придания формы продукта в желаемую систему доставки.
Фармацевтические препараты, содержащие терапевтические пептиды по изобретению, могут быть изготовлены методиками, известными в данной области техники с использованием хорошо известных и легко доступных ингредиентов. Например, пептид может быть приготовлен в виде препарата с общепринятыми эксципиентами, разбавителями или носителями и преобразован в таблетки, капсулы, растворы, суспензии, порошки, аэрозоли и тому подобное. Примеры эксципиентов, разбавителей и носителей, которые являются подходящими для таких препаратов, включают буферы, а также наполнители и добавки, такие как крахмал, целлюлоза, сахара, маннит и кремниевые производные. Также могут быть включены связывающие агенты, например карбоксиметилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон. Могут быть включены увлажняющие агенты, например глицерин, разрыхлители, такие как карбонат кальция и бикарбонат натрия. Также могут быть добавлены агенты для пролонгированного растворения, например парафин. Усилители всасывания, такие как соединения четвертичного аммония, также могут быть включены. Поверхностно-активные агенты, такие как цетиловы