Новое антитело против dr5
Иллюстрации
Показать всеИзобретение относится к области биохимии. Заявлено антитело, связывающееся с рецептором клеточной поверхности DR5. Антитело проявляет цитотоксическую активность против клеток, экспрессирующих содержащий домен гибели рецептор, посредством апоптоза. Также изобретение относится к полинуклеотиду, вектору, клеткам-хозяевам для получения указанного антитела, а также к фармацевтическим композициям и способам лечения и профилактики злокачественного новообразования, аутоиммунного заболевания или воспалительного заболевания. Изобретение позволяет усилить цитотоксическую активность антитела против DR5 и индуцировать апоптоз в клетках, а также позволяет достичь эффективного терапевтического действия при лечении пациента антителом по изобретению. 11 н. и 33 з. п. ф-лы, 58 ил., 14 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителу, которое связывается с рецептором клеточной поверхности, участвующим в индукции апоптоза, и которое может использоваться в качестве терапевтического и/или профилактического средства для опухолей, а также к способу лечения и/или профилактики злокачественного новообразования, аутоиммунного заболевания или воспалительного заболевания с помощью указанного антитела.
Уровень техники
Апоптоз является феноменом, необходимым для физиологического процесса удаления ненужных клеток или поврежденных клеток и поддержания количества нормальных клеток in vivo. Благодаря прогрессу в понимании того факта, что регуляторный механизм апоптоза часто является поврежденным при злокачественных заболеваниях или иммунных нарушениях, а также благодаря пониманию регуляторного пути апоптоза, были достигнуты успехи в развитии нового индуктора апоптоза, который может быть использован в лечении злокачественных заболеваний или иммунных нарушений. В частности, предполагают, что антитело, которое имеет аффинность связывания в отношении лиганда рецептора клеточной поверхности, участвующего в индукции апоптоза, по типу рецептора гибели, может оказывать терапевтический эффект на эти заболевания (см., например, непатентный документ 1). Известен рецептор гибели 5 (DR5), который является одним из рецепторов гибели, иногда называемый также KILLER, TRICK 2A, TRAIL-R2, TRICK B или CD262, и множество агонистических антител, которые индуцируют апоптоз в клетках (см., например, непатентный документ 2 или 3, или патентные документы 1-6). Некоторые из антител проходят в настоящее время клинические испытания в качестве возможных терапевтических средств, и предполагается, что они обладают терапевтическим эффектом, таким, что антитела специфически действуют агонистическим образом на клетки (на раковые клетки или на клетки, относящиеся к иммунному заболеванию), которые экспрессируют рецептор, для уничтожения этих клеток. Для того, чтобы такое антитело проявляло противоопухолевый эффект, существенно, что эти клетки экспрессируют DR5, однако, было выявлено, что не существует корреляции между этим действием и уровнем экспрессии DR5 в преклиническом испытании (непатентный документ 4). Полагают, что это связано с тем, что клеточная реакция находится под контролем большого числа факторов, таких как уровень экспрессии внутриклеточных переносящих сигнал молекул (таких как каспаза-8 или Bcl-2), участвующих в путях апоптоза (непатентный документ 5).
Документ известного уровня техники
Патентный документ 1
WO 98/51793
Патентный документ 2
WO 2001/83560
Патентный документ 3
WO 2002/94880
Патентный документ 4
WO 2003/54216
Патентный документ 5
WO 2006/83971
Патентный документ 6
WO 2007/22157
Непатентный документ 1
Cell Death and Differentiation, 10: 66-75 (2003)
Непатентный документ 2
Journal of Immunology, 162: 2597-2605 (1999)
Непатентный документ 3
Nature Medicine, 7(8): 954-960 (2001)
Непатентный документ 4
Cell Death and Differentiation, 10: 66-75 (2003)
Непатентный документ 5
Journal of Clinical Oncology, 26: 3621-3630 (2008)
Сущность изобретения
Задачи, решаемые настоящим изобретением
Целью настоящего изобретения является получение антитела или функционального фрагмента антитела для использования в фармацевтическом препарате с терапевтическим эффектом в отношении злокачественного новообразования, и получение полинуклеотида, кодирующего антитело или функциональный фрагмент антитела.
Способы решения этих задач
Авторы настоящего изобретения провели интенсивные исследования для достижения вышеуказанной цели, и в результате обнаружили антитело, которое проявляет сильную апоптоз-индуцирующую активность в клетках и на этом основании было создано настоящее изобретение. Антитело также вызывает эффективное терапевтическое действие у пациента, у которого не может быть достигнут достаточный терапевтический эффект с использованием доступных в настоящее время антител.
Таким образом, настоящее изобретение включает следующие изобретения.
(1) Антитело, отличающееся тем, что:
последовательность тяжелой цепи содержит вариабельный домен с CDRH1, CDRH2 и CDRH3, и CDRH1 содержит аминокислотную последовательность SEQ ID NO:82, CDRH2 содержит любую аминокислотную последовательность из SEQ ID NO:83 и 89, и CDRH3 содержит аминокислотную последовательность SEQ ID NO:84; и
последовательность легкой цепи содержит вариабельный домен с CDRL1, CDRL2 и CDRL3, и CDRL1 содержит любую аминокислотную последовательность из SEQ ID NO:79, 85, 86, 87 и 88, CDRL2 содержит аминокислотную последовательность SEQ ID NO:80, и CDRL3 содержит аминокислотную последовательность SEQ ID NO:81, или функциональный фрагмент антитела.
(2) Антитело, или функциональный фрагмент антитела, по (1), отличающееся тем, что содержит последовательность вариабельного домена тяжелой цепи, содержащую аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:20, и последовательность вариабельного домена легкой цепи, содержащую аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:16.
(3) Антитело, или функциональный фрагмент антитела, по (1) или (2), отличающееся тем, что антитело является химерным антителом.
(4) Антитело, или функциональный фрагмент антитела, по (3), отличающееся тем, что содержит последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:20, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:16.
(5) Антитело, или функциональный фрагмент антитела, по (1), отличающееся тем, что антитело является гуманизированным.
(6) Антитело, или функциональный фрагмент антитела, по (5), отличающееся тем, что содержит:
(а) последовательность вариабельного домена тяжелой цепи, выбранную из группы, состоящей из следующих аминокислотных последовательностей:
а1) аминокислотной последовательности, содержащей аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:42;
а2) аминокислотной последовательности, содержащей аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:70;
а3) аминокислотной последовательности, которая гомологична по меньшей мере на 95% аминокислотной последовательности, выбранной из а1) и а2);
а4) аминокислотной последовательности, которая гомологична по меньшей мере на 99% аминокислотной последовательности, выбранной из а1) и а2); и
а5) аминокислотной последовательности, включающей замену, делецию или добавление одной-нескольких аминокислотных остатков в любой из аминокислотных последовательностей, выбранных из а1) и а2); и
(b) последовательность вариабельного домена легкой цепи, выбранную из группы, состоящей из следующих аминокислотных последовательностей:
b1) аминокислотной последовательности, содержащей аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:28;
b2) аминокислотной последовательности, содержащей аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:52;
b3) аминокислотной последовательности, содержащей аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:58;
b4) аминокислотной последовательности, содержащей аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:62;
b5) аминокислотной последовательности, содержащей аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:66;
b6) аминокислотной последовательности, которая гомологична по меньшей мере на 95% любой аминокислотной последовательности, выбранной из b1)-b5);
b7) аминокислотной последовательности, которая гомологична по меньшей мере на 99% любой аминокислотной последовательности, выбранной из b1)-b5); и
b8) аминокислотной последовательности, содержащей замену, делецию или добавление одной-нескольких аминокислотных остатков в любой из аминокислотных последовательностей, выбранных из b1)-b5).
(7) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность вариабельного домена тяжелой цепи, содержащую аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:42, и последовательность вариабельного домена легкой цепи, содержащую аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:28.
(8) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность вариабельного домена тяжелой цепи, содержащую аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:70, и последовательность вариабельного домена легкой цепи, содержащую аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:52.
(9) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность вариабельного домена тяжелой цепи, содержащую аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:70, и последовательность вариабельного домена легкой цепи, содержащую аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:58.
(10) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность вариабельного домена тяжелой цепи, содержащую аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:70, и последовательность вариабельного домена легкой цепи, содержащую аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:62.
(11) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность вариабельного домена тяжелой цепи, содержащую аминокислотные остатки 20-141 аминокислотной последовательности SEQ ID NO:70, и последовательность вариабельного домена легкой цепи, содержащую аминокислотные остатки 21-134 аминокислотной последовательности SEQ ID NO:66.
(12) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:42, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:28.
(13) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:70, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:52.
(14) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:70, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:58.
(15) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:70, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:62.
(16) Антитело, или функциональный фрагмент антитела, по (6), отличающееся тем, что содержит последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:70, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:66.
(17) Функциональный фрагмент антитела по любому из (1)-(16), который выбран из группы, состоящей из Fab, F(ab')2, Fab' и Fv.
(18) Фармацевтическая композиция, отличающаяся тем, что содержит по меньшей мере одно из антител или функциональных фрагментов антител по (1)-(17).
(19) Фармацевтическая композиция по (18), отличающаяся тем, что представляет собой фармацевтическую композицию для лечения и/или профилактики злокачественного новообразования.
(20) Фармацевтическая композиция для лечения и/или профилактики злокачественного новообразования, отличающаяся тем, что содержит по меньшей мере одно из антител или функциональных фрагментов антител по (1)-(17) и по меньшей мере один представитель, выбранный из группы, состоящей из паклитаксела, карбоплатина, СРТ-11 и винбластина.
(21) Фармацевтическая композиция по (19) или (20), где злокачественное новообразование выбрано из группы, состоящей из рака легкого, рака предстательной железы, рака щитовидной железы, рака желудка, рака печени, рака ободочной кишки, рака молочной железы, рака поджелудочной железы, рака почки, рака матки, меланомы, фибросаркомы, глиобластомы и рака клеток крови.
(22) Способ лечения и/или профилактики злокачественного новообразования, отличающийся тем, что вводят по меньшей мере одно из антител или функциональных фрагментов антител по (1)-(17).
(23) Способ лечения и/или профилактики злокачественного новообразования, отличающийся тем, что может быть одновременным или последовательным введение по меньшей мере одного из антител или функциональных фрагментов антител по (1)-(17) и по меньшей мере одного представителя, выбранного из группы, состоящей из паклитаксела, карбоплатина, СРТ-11, винбластина и 5-FU.
(24) Способ лечения и/или профилактики по (22) или (23), где злокачественное новообразование выбрано из группы, состоящей из рака легкого, рака предстательной железы, рака щитовидной железы, рака желудка, рака печени, рака яичника, рака ободочной кишки, рака молочной железы, рака поджелудочной железы, рака почки, рака матки, меланомы, фибросаркомы, глиобластомы и рака клеток крови.
(25) Полинуклеотид, кодирующий антитело по любому из (2), (4) и (6)-(16).
(26) Полинуклеотид по (25), отличающийся тем, что содержит нуклеотидную последовательность, содержащую нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:19, и нуклеотидную последовательность, содержащую нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:15.
(27) Полинуклеотид по (25), отличающийся тем, что содержит нуклеотидную последовательность, содержащую нуклеотиды 58-1413 нуклеотидной последовательности SEQ ID NO:19, и нуклеотидную последовательность, содержащую нуклеотиды 61-717 нуклеотидной последовательности SEQ ID NO:15.
(28) Полинуклеотид по (25), отличающийся тем, что содержит:
(а) полинуклеотид, выбранный из группы, состоящей из следующих нуклеотидных последовательностей:
а1) нуклеотидной последовательности, содержащей нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:41;
а2) нуклеотидной последовательности, содержащей нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:69;
а3) нуклеотидной последовательности полинуклеотида, которая гибридизуется с полинуклеотидом, содержащим нуклеотидную последовательность, комплементарную нуклеотидной последовательности, выбранной из а1) и а2), при жестких условиях; и
а4) нуклеотидной последовательности, включающей замену, делецию или добавление одного-нескольких нуклеотидов в нуклеотидной последовательности, выбранной из а1) и а2); и
(b) полинуклеотид, выбранный из группы, состоящей из следующих нуклеотидных последовательностей:
b1) нуклеотидной последовательности, содержащей нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:27;
b2) нуклеотидной последовательности, содержащей нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:51;
b3) нуклеотидной последовательности, содержащей нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:57;
b4) нуклеотидной последовательности, содержащей нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:61;
b5) нуклеотидной последовательности, содержащей нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:65;
b6) нуклеотидной последовательности полинуклеотида, которая гибридизуется с полинуклеотидом, содержащим нуклеотидную последовательность, комплементарную любой из нуклеотидных последовательностей, выбранных из b1)-а5), при жестких условиях; и
b7) нуклеотидной последовательности, содержащей замену, делецию или добавление любого одного-нескольких нуклеотидов, выбранных из b1)-b5).
(29) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:41, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:27.
(30) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:51.
(31) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:57.
(32) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:61.
(33) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-423 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-402 нуклеотидной последовательности SEQ ID NO:65.
(34) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-1413 нуклеотидной последовательности SEQ ID NO:41, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-717 нуклеотидной последовательности SEQ ID NO:27.
(35) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-1413 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-717 нуклеотидной последовательности SEQ ID NO:51.
(36) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-1413 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-717 нуклеотидной последовательности SEQ ID NO:57.
(37) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-1413 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-717 нуклеотидной последовательности SEQ ID NO:61.
(38) Полинуклеотид по (28), отличающийся тем, что содержит полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 58-1413 нуклеотидной последовательности SEQ ID NO:69, и полинуклеотид, содержащий нуклеотидную последовательность, содержащую нуклеотиды 61-717 нуклеотидной последовательности SEQ ID NO:65.
(39) Вектор, содержащий любой из полинуклеотидов по (25)-(38).
(40) Трансформированная клетка-хозяин, содержащая любой из полинуклеотидов по (25)-(38).
(41) Трансформированная клетка-хозяин, содержащая вектор по (39).
(42) Способ получения антитела по любому из (2), (4) и (6)-(16), предусматривающий стадию культивирования клетки-хозяина по (40) или (41) и очистки антитела из полученного культивированного продукта.
(43) Антитело, или функциональный фрагмент антитела, отличающееся тем, что связывает тот же самый эпитоп, который связывает антитело, содержащее последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:20, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:16.
(44) Антитело, или функциональный фрагмент антитела, отличающееся тем, что конкурирует с антителом, содержащим последовательность тяжелой цепи, содержащую аминокислотные остатки 20-471 аминокислотной последовательности SEQ ID NO:20, и последовательность легкой цепи, содержащую аминокислотные остатки 21-239 аминокислотной последовательности SEQ ID NO:16.
(45) Антитело, или функциональный фрагмент антитела, по (43) или (44), отличающееся тем, что Fab-фрагмент антитела, полученный расщеплением папаином, при связывании рекомбинантного белка SEQ ID NO:23, находится рядом с остатком глицина в положении 26, остатком изолейцина в положении 34, остатком глутаминовой кислоты в положении 36, остатком аспарагиновой кислоты в положении 37, остатком глицина в положении 38, остатком аспарагиновой кислоты в положении 56, остатком лейцина в положении 57, остатком лейцина в положении 58, остатком фенилаланина в положении 59, остатком лейцина в положении 61 и остатком аргинина в положении 62 рекомбинантного белка SEQ ID NO:23, при расстоянии 4 ангстрем или менее.
(46) Антитело или функциональный фрагмент антитела по (45), отличающиеся тем, что расстояние между каждым аминокислотным остатком, составляющим рекомбинантный белок SEQ ID NO:23, и Fab-фрагментом определяют комплексным структурным анализом с использованием данных дифракции рентгеновских лучей.
Преимущество изобретения
В соответствии с изобретением, может быть получено терапевтическое средство для лечения злокачественного новообразования, механизм действия которого связан прежде всего с индукцией апоптоза в клетках.
Краткое описание фигур
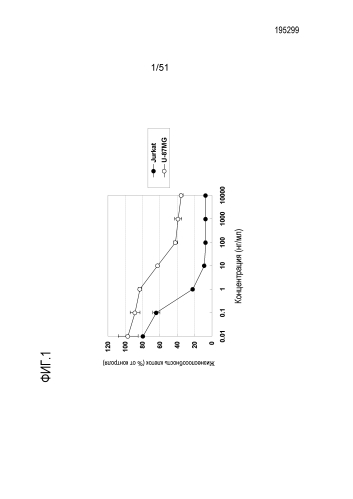
Фиг 1 является фигурой, показывающей разрушающий клетки эффект В273-антитела мыши.
Фиг. 2 является фигурой, показывающей активности связывания cB273-антитела и sTRAIL с белком внеклеточного домена DR5.
Фигура 3 является фигурой, показывающей активность связывания cB273-антитела с DR5 человека с использованием Biacore. На верхней части фигуры, показана диаграмма, в которой ордината представляет единицы резонанса (RU), и абсцисса представляет время (секунды). На нижней части фигуры показаны величины Kon, Koff и KD cB273-антитела, рассчитанные с использованием анализа при помощи программного обеспечения.
Фиг. 4 является фигурой, показывающей in vitro разрушающий клетки эффект cB273-антитела на линиях раковых клеток человека. А) показывает результаты для клеточной линии рака яичника человека, В) показывает результаты для клеточной линии рака ободочной кишки человека, С) показывает результаты для клеточной линии рака легкого человека и D) показывает результаты для клеточной линии рака молочной железы человека.
Фиг. 5 является фигурой, показывающей in vitro разрушающий клетки эффект cB273-антитела на линиях раковых клеток человека. А) показывает результаты для клеточной линии рака поджелудочной железы человека. В) показывает результаты клеточной линии меланомы человека, С) показывает результаты для клеточной линии глиобластомы человека и D) показывает результаты клеточной линии рака эндометрия человека.
Фиг. 6 является видом, показывающим структуру комплекса DR5-cB273 Fab.
Фиг. 7 является видом, показывающим взаимодействие между DR5 и H- или L-цепью cB273 Fab. А) является видом, иллюстрирущим аминокислотные остатки Н-цепи cB273 Fab, которые находятся на расстоянии 4 ангстрем или менее от DR5 и vice versa в качестве stick модели. Ile34, Glu36, Asp37, Gly38, Asp56, Leu57, Leu58, Phe59, Leu61 и Arg62, показанные на левой сторон рисунка, являются аминокислотными остатками, полученными из DR5, и соответствующие номера аминокислотных остатков соответствуют номерам в аминокислотной последовательности SEQ ID NO:23 в Списке последовательностей. Далее, Phe33, Arg50, Asn52, Tyr54, Asn55, Phe59, Tyr101, Tyr102, Phe103 и Asp104 на правой стороне этого рисунка являются аминокислотными остатками, полученными из тяжелой цепи cB273, и соответствующие номера аминокислотных остатков даются с использованием остатка глутаминовой кислоты в положении 20 SEQ ID NO:20 в Списке последовательностей в качестве исходной точки. В) является видом, иллюстрирующим аминокислотные остатки L-цепи cB273 Fab, которые находятся при расстоянии 4 ангстрем или менее от DR5 и vice versa с некоторыми в виде stick модели и другими в виде ленточной модели. Gly26, Glu36, Asp37 и Gly38 на левой стороне рисунка являются аминокислотными остатками, полученными из DR5, и соответствующие номера аминокислотных остатков соответствуют номерам в аминокислотной последовательности SEQ ID NO:23 в Списке последовательностей. Далее, His31, Asn33, Val99 и Trp101 на правой стороне рисунка являются аминокислотными остатками, полученными из легкой цепи cB273, и соответствующие номера аминокислотных остатков даются с использованием остатка аспарагиновой кислоты в положении 21 SEQ ID NO:16 в Списке последовательностей в качестве исходной точки. Аминокислотные остатки DR5, которые находятся на расстоянии 4 ангстрем или менее от Fab-фрагмента cB273, были остатком глицина в положении 26, остатком изолейцина в положении 34, остатком глутаминовой кислоты в положении 36, остатком аспарагиновой кислоты в положении 37, остатком глицина в положении 38, остатком аспарагиновой кислоты в положении 56, остатком лейцина в положении 57, остатком лейцина в положении 58, остатком фенилаланина в положении 59, остатком лейцина в положении 61 и остатком аргинина в положении 62 аминокислотной последовательности SEQ ID NO:23 в Списке последовательностей.
Фиг. 8-1 является фигурой, показывающей активность связывания hB273-антител с DR5 человека, с использованием Biacore, и показывает графики измерения для соответствующих антител.
Фиш. 8-2 является таблицей, показывающей активность связывания hB273-антител с DR5 человека с использованием Biacore, и показывает величины Kon, Koff и KD соответствующих антител, рассчитанные с использованием анализа при помощи программного обеспечения. В данном случае, число, конкретное для каждой диаграммы на фиг. 8-1, соответствует номеру ввода таблицы на фиг. 8-2.
Фиг. 9 является фигурой, показывающей in vitro разрушающие клетки активность hB273-антител против клеток Jurkat, которые являются полученной из Т-лимфомы человека клеточной линией.
Фиг. 10-1 является фигурой, показывающей активность связывания hB273-антитела с DR5 человека с использованием Biacore, и показывает графики измерений для соответствующих антител.
Фиг. 10-2 является таблицей, показывающей активность связывания hB273-антител с DR5 человека с использованием Biacore, и показывает величины Kon, Koff и KD соответствующих антител, рассчитанные с использованием анализа при помощи программного обеспечения. В данном случае, число, конкретное для каждой диаграммы на фиг. 10-1, соответствует номеру ввода в таблице на фиг. 10-2.
Фиг. 11 является фигурой, показывающей in vitro разрушающую клетки активность hB273-антител против клеток Jurkat, которые являются полученной из Т-лимфомы человека клеточной линией.
Фиг. 12-1 является видом, показывающим активность связывания CDR-модифицированных hB273-антител с DR5 человека с использованием Biacore, и показывает графики измерения для соответствующих антител.
Фиг. 12-2 является таблицей, показывающей активность связывания CDR-модифицированных hB273-антител с DR5 человека с использованием Biacore, и показывает величины Kon, Koff и KD соответствующих антител, рассчитанные с использованием анализа при помощи программного обеспечения. В данном случае, число, конкретное для каждой диаграммы на фиг. 12-1, соответствует номеру введения в таблице на фиг. 12-2.
Фиг. 13-1 является фигурой, показывающей оценку термостабильности CDR-модифицированных hB273-антител с использованием дифференциальной сканирующей калориметрии (DSC), и показывает графики измерения для соответствующих антител.
Фиг. 13-2 является фигурой, показывающей оценку термостабильности CDR-модифицированных hB273-антител с использованием дифференциальной сканирующей калориметрии (DSC), и показывает графики измерения для соответствующих антител.
Фиг. 13-3 показывает величины Tm соответствующих антител, рассчитанные из графиков, показанных на фиг. 13-1 и 13-2. В данном случае, число, конкретное для каждого графика на фиг. 13-1 и 13-2, соответствует № ввода на фиг. 13-3.
Фиг. 14 является фигурой, показывающей in vitro разрушающие клетки активности CDR-модифицированных hB273-антител против клеток Jurkat, которые являются полученной из Т-лимфомы человека клеточной линией.
Фиг. 15 является видом, показывающим эффект активации каспазы-3/7 и in vitro разрушающую клетки активность hB273_H2-1-NE/L1-NK-антитела на клеточных линиях рака человека. А) показывает результаты для клеточной линии HCT-15 рака ободочной кишки человека и В) показывает результаты для клеточной линии U-87MG глиобластомы человека.
Фиг. 16 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией COLO 205 рака ободочной кишки человека.
Фиг. 17 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией MIAPaCa-2 рака поджелудочной железы человека.
Фиг. 18 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией U-87MG глиобластомы человека.
Фиг. 19 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией NCI-H2122 рака легкого человека (в комбинации с паклитакселом и карбоплатином).
Фиг. 20 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией NCI-H460 рака легкого человека (в комбинации с паклитакселом и карбоплатином).
Фиг. 21 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией DLD-1 рака ободочной кишки человека (в комбинации с CPT-11).
Фиг. 22 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией HCT-15 рака ободочной кишки человека (в комбинации с CPT-11).
Фиг. 23 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией HCT-116 рака ободочной кишки человека (в комбинации с CPT-11).
Фиг. 24 является фигурой, показывающей in vivo противоопухолевую активность cB273-антитела в мышах “nude”, имплантированных клеточной линией A375 меланомы человека (в комбинации с винбластином).
Фиг. 25 является фигурой, показывающей сравнение in vivo противоопухолевой активности в мышах “nude”, имплантированных клеточной линией HCT-15 рака ободочной кишки человека, между cB273-антителом и конатумумабом.
Фиг. 26 является фигурой, показывающей сравнение in vivo противоопухолевой активности в мышах “nude”, имплантированных клеточной линией NCI-H1975 рака легкого человека, между cB273-антителом и конатумумабом.
Фиг. 27 является фигурой, показывающей in vivo противоопухолевую активность hB273_H2-1-NE/L1-NK-антитела (обозначенного как “hB273” на этом рисунке) в мышах “nude”, имплантированных клеточной линией COLO 205 рака ободочной кишки человека.
Фиг. 28 является фигурой, показывающей нуклеотидную последовательность кДНК, кодирующей тяжелую цепь антитела В273 мыши, и аминокислотную последовательность тяжелой цепи антитела В273 мыши.
Фиг. 29 является фигурой, показывающей нуклеотидную последовательность кДНК, кодирующей легкую цепь антитела В273 мыши, и аминокислотную последовательность легкой цепи антитела В273 мыши.
Фиг. 30 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь В273-химера-типа, и аминокислотную последовательность легкой цепи В273-химера типа.
Фиг. 31 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь В273-химера типа, и аминокислотную последовательность тяжелой цепи В273-химера типа.
Фиг. 32 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь hB273_L1-типа, и аминокислотную последовательность легкой цепи hB273_L1-типа.
Фиг. 33 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь hB273_L2-типа, и аминокислотную последовательность легкой цепи hB273_L2-типа.
Фиг. 34 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь hB273_L3-типа, и аминокислотную последовательность легкой цепи hB273_L3-типа.
Фиг. 35 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н1-типа, и аминокислотную последовательность тяжелой цепи hB273_Н1-типа.
Фиг. 36 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н2-типа, и аминокислотную последовательность тяжелой цепи hB273_Н2-типа.
Фиг. 37 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н3-типа, и аминокислотную последовательность тяжелой цепи hB273_Н3-типа.
Фиг. 38 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н1-1-типа, и аминокислотную последовательность тяжелой цепи hB273_Н1-1-типа.
Фиг. 39 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н2-1-типа, и аминокислотную последовательность тяжелой цепи hB273_Н2-1-типа.
Фиг. 40 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н2-2-типа, и аминокислотную последовательность тяжелой цепи hB273_Н2-2-типа.
Фиг. 41 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н2-3-типа, и аминокислотную последовательность тяжелой цепи hB273_Н2-3-типа.
Фиг. 42 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н2-4-типа, и аминокислотную последовательность тяжелой цепи hB273_Н2-4-типа.
Фиг. 43 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н2-5-типа, и аминокислотную последовательность тяжелой цепи hB273_Н2-5-типа.
Фиг. 44 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь hB273_L1-NE-типа, и аминокислотную последовательность легкой цепи hB273_L1-NE-типа.
Фиг. 45 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь hB273_L1-NF-типа, и аминокислотную последовательность легкой цепи hB273_L1-NF-типа.
Фиг. 46 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь hB273_L1-NK-типа, и аминокислотную последовательность легкой цепи hB273_L1-NK-типа.
Фиг. 47 является фигурой, показывающей нуклеотидную последовательность, кодирующую легкую цепь hB273_L1-NL-типа, и аминокислотную последовательность легкой цепи hB273_L1-NL-типа.
Фиг. 48 является фигурой, показывающей нуклеотидную последовательность, кодирующую тяжелую цепь hB273_Н2-1-NE-типа, и аминокислотную последовательность тяжелой цепи hB273_Н2-1-NE-типа.
Фиг. 49 является фигурой, показывающей нуклеотидную последовательность кДНК, кодирующей легкую цепь конатумумаба, и аминокислотную последовательность легкой цепи конатумумаба.
Фиг. 50 является фигурой, показывающей нуклеотидную последовательность кДНК, кодирующей тяжелую цепь конатумумаба, и аминокислотную последовательность тяжелой цепи конатумумаба.
Фиг. 51 является фигурой, показывающей in vitro разрушающую клетки активность hB273_H2-1-NE/hB273_L1-NK-антитела против клеточных линий рака человека. А) показывает результаты для клеточной линии рака желудка человека, В) показывает результаты для клеточной линии рака почки человека, С) показывает результаты для клеточной линии рака печени человека и D) показывает результаты клеточной линии фибросаркомы человека.
Фиг. 52 является фигурой, показывающей in vivo противоопухолевую активность hB273_H2-1-NE/hB273_L1-NK-антитела (обозначенного как “hB273” на фигуре), в комбинации с 5-FU в мышах “nude”, имплантированных клеточной линией HST-15 рака ободочной кишки человека, и сравнение активности с конатумумабом.
Фиг. 53 является фигурой, показывающей in vivo противоопухолевую активность hB273_H2-1-NE/hB273_L1-NK-антитела (обозначенного как “hB273” на фигуре), в комбинации с паклитакселом в мышах “nude”, имплантированных клеточной линией NCI-H1975 немелкоклеточного рака легкого человека, и сравнение активности с конатумумабом.
Варианты осуществления изобретения
В данном контексте термины “злокачественное новообразование” и “опухоль” используются в одном и том же значении.
В данном контексте термин “ген” включает не только ДНК, н