Способ получения лилий, содержащих в лепестках делфинидин
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения лилий, содержащих в лепестках делфинидин. При этом способ включает введение в лилии гена флавоноид-3′,5′-гидроксилазы (F3′5′H) из колокольчиков, введение фрагмента гена флавоноид-3′-гидроксилазы (F3′H) из лилий, введение фрагмента гена дигидрофлавонол 4-редуктазы (DFR) из лилий, синтез делфинидина в результате деятельности введенного гена F3′5′H, с подавлением при этом экспрессии эндогенного гена F3′H, который участвует в синтезе цианидина в лепестках лилий, и получение лилий, которые содержат дельфинидин в лепестках. Изобретение позволяет эффективно получать лилии, содержащие в лепестках делфинидин. 4 з.п. ф-лы, 3 ил., 6 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения лилий, содержащих синий пигмент (делфинидин) в лепестках, путем введения в лилии инородного гена. Конкретнее, настоящее изобретение относится к способу получения лилий, содержащих синий пигмент в лепестках, путем введения гена флавоноид 3',5'-гидроксилазы (F3'5'H), полученного из колокольчика, который необходим для синтеза делфинидина, в лилии, и введения фрагмента гена флавоноид 3'-гидроксилазы (F3'H) лилии в целях подавления экспрессии эндогенного F3'H, который действует на синтез красного пигмента (цианидина), и индукции синтеза делфинидина в лепестках лилии; и к лилии, полученной данным способом.
Предшествующий уровень техники
Ранее сообщалось о способах индукции выработки делфинидина в растительных клетках путем введения инородного гена в гвоздики (см. Патентный Документ 1), хризантемы (см. Патентный Документ 1), розы (см. Патентный Документ 1 и Патентный Документ 2), фаленопсисы (см. Патентный Документ 3) и цимбидиумы (см. Патентный Документ 3).
Однако еще не сообщалось о случаях успешно полученных лилий с синими лепестками путем синтеза делфинидина в лепестках лилий под действием введенного инородного гена.
Примеры способов, которые используют для улучшения сортов растений, включают (1) перекрестное скрещивание, путем скрещивания пестика и тычинки, (2) спонтанную искусственную мутацию, и (3) генетическую рекомбинацию. Применение технологии генетической рекомбинации позволяет экспрессировать полезный ген в растении без стеснения генетическими ограничениями, имеющимися у видов-мишеней, что позволяет придать новый признак растению, которым растение исходно не обладало. Генетически модифицированные растения, полученные технологией генетической рекомбинации, в настоящее время широко культивируются по всему миру.
Примеры компонентов растительных пигментов включают антоцианин, каротеноид и беталаин.
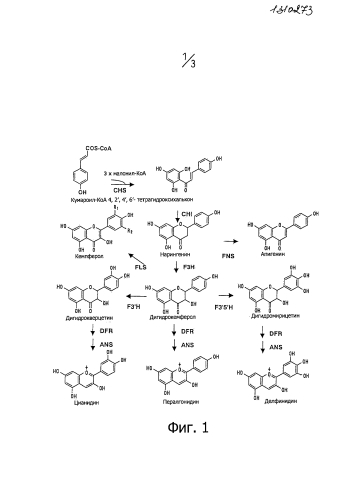
Антоцианины являются представителями группы вторичных метаболитов, которые называются флавоноидами, и, как показано на фиг.1, синтез которых проходит начиная с фенилаланина до кумароил-КоА под действием множества ферментов. Цвет антоцианинов зависит от их структуры. То есть, при увеличении количества гидроксильных групп В кольца антоцианидинов, которое является хромофором антоцианинов, синий цвет становиться более интенсивным, и основные антоцианидины в форме делфинидинов, цианидинов, и пералгонидинов имеют увеличенное количество гидроксильных групп, в указанном порядке.
Антоцианины, полученные из делфинидина, накапливаются во многих цветах голубого цвета. Кроме того, известно, что при увеличении количества ароматических ацильных групп (таких как кумароильные группы или кафеольные группы), которые модифицируют антоцианины, цвет антоцианинов становится все более и более синим (то есть, максимальное поглощение сдвигается в более длинную длину волны), а стабильность антоцианов растет. В частности, антоцианины, в которых связаны множественные ароматические ацильные группы, называемые ацилированными антоцианинами, содержатся в синих лепестках горечавки и мотылькового горошка (см. непатентный документ 1).
Ферменты, вовлеченные в биосинтез антоцианина и гены, которые кодируют эти ферменты, ранее были выделены из множества растений (см. непатентный документ 1). Цвет антоцианинов зависит от таких факторов, как рН вакуолей, в которых они локализованы, наличия других флавоноидов и ионов металлов. То есть, антоцианины выглядят красными, если рН вакуолей низкий, и становятся синими, если рН вакуолей становится нейтральным. Кроме того, флавоны и флавонолы, известные как ко-пигменты для антоцианинов, оказывают воздействие, которое делает антоцианины синими. Также, ионы железа и алюминия, как известно, являются причиной того, что антоцианины становятся синими, так как координируют гидроксильные группы В-кольца антоцианинов.
Хотя растения образуют цветы различных расцветок, только несколько видов способны давать цветы всех расцветок. Это происходит потому, что пигменты, которые могут быть синтезированы видами, задаются генетически. Например, нет синих или фиолетовых сортов роз, гвоздик, хризантем, лилий и гербер. Основная причина этого заключается в том, что эти растения не имеют гена флавоноид 3',5'-гидроксилазы (F3'5'H) необходимого для синтеза делфинидина. По этой причине уже было несколько попыток получения голубых цветов путем индукции выработки делфинидина вследствие экспрессии гена F3'5'H.
При экспрессии гена F3'5'H в петуниях, утративших F3'5'H, выросло количество антоцианинов, полученных из делфинидина (см. непатентный документ 2 и непатентный документ 3). Кроме того, при экспрессии гена F3'5'H в табаке (Nicotiana tabacum), который накапливает цианидин, синтезируется делфинидин и цветы принимают голубоватый оттенок (см. непатентный документ 3). В случае экспрессии в табаке гена F3'5'H, выделенного из колокольчика, эустомы или петунии, ген F3'5'H, полученный из колокольчика, вырабатывает делфинидин с наилучшей эффективностью (см. непатентный документ 4). Кроме того, в случае экспрессии гена в F3'5'H мотылькового горошка или вербены в вербене, в случае экспрессии гена, выделенного из мотылькового горошка, получается больший объем выработки, и цвет цветка подвергается четко выраженному изменению (см. непатентный документ 5). При экспрессии в розах гена, выделенного из петунии, горечавки, мотылькового горошка, цинерарии, эустомы, анютиных глазок и лаванды, только в случае экспрессии гена F3'5'H, выделенного из анютиных глазок делфинидин вырабатывался на уровне, равном 10% общего количества антоцианидинов, что говорит о том, что выделенный из анютиных глазок ген F3'5'H подходящим образом функционирует в розах (см. Патентный Документ 4).
Генетически модифицированная хризантема, которая накапливает 50% и большее количество делфинидина, и в которой цвет цветка изменился на синий путем транскрипции выделенного из анютиных глазок гена F3'5'H с промотора хальконсинтазы розы, была получена для сортов хризантем «Improved Reagan» и «Dark Splendid Reagan» (см. Патентный Документ 5). При экспрессии гена F3'5'H, выделенного из таких растений как колокольчик, вербена, цинерария, анютины глазки, петуния или лобелия, с промотора, выделенного из гена флавонон 3-гидроксилазы хризантемы и 5'-нетранслируемой области гена алкогольдегидрогеназы табака, гены F3'5'H из колокольчика, вербены, цинерарии и анютиных глазок функционировали сравнительно хорошо, и делфинидин вырабатывался на уровне, равном 25% от общего количества антоцианидинов. В хризантемах выделенный из колокольчика ген F3'5'H функционирует наилучшим образом, и делфинидин вырабатывался на уровне 75% от общего количества антоцианидинов (см. непатентный документ 16).
Из этих описанных в литературе примеров очевидно, что несмотря на то, что уже были описаны примеры выработки делфинидина путем экспрессии гетерологичного (инородного) гена в растениях, для выработки делфинидина в лепестках потребуется изрядное количество экспериментов методом проб и ошибок и повторных экспериментов, поскольку трудно спрогнозировать какой из генов F3'5'H в действительности будет экспрессироваться в лепестках представляющего интерес растения, при введении гена F3'5'H, выделенного из определенного растения, в представляющее интерес растение под контролем определенного промотора.
Кроме того, результаты всех исследований, представленные в вышеупомянутых примерах, были получены для двудольных растений. Существуют немалые различия между двудольными и однодольными растений даже среди высших растений.
Во-первых, двудольные и однодольные растения имеют различные морфологические различия. Это говорит о том, что в ходе своего происхождения однодольные растения подвергались значительной морфологической эволюции. Так, однодольные растения характеризуются: наличием одной семядоли, при этом основа семядоли образует оболочку, которая покрывает другие части проростка, сосудисто-волокнистыми тяжами случайно присутствующими в поперечном разрезе стебля, после того как стебель завершает свой рост он не становится толще (камбий не развивается), сосуды имеют форму параллельных линий (параллельные сосуды), стержневой корень не развивается до больших размеров, но скорее имеет форму мочковатых корней, количество листочков околоцветника, тычинок и плодолистиков кратно 3, нет различия между лепестками и чашелистиками (см. http://www.fukuoka-edu.ac.jp/~fukuhara /keitai/9-1.html).
Более того, поскольку однодольные и двудольные растения значимо отличаются по контролю генной экспрессии (см. непатентный документ 6 и непатентный документ 7), возникают трудности при культивировании генетически модифицированных однодольных растений. Однако на однодольных растениях кукурузе и рисе было проведено изрядное количество научных исследований и разработок, а генетически модифицированная кукуруза и уже была коммерциализирована во многих странах.
Таким образом, хотя существует ряд сообщений, описывающих временную экспрессию гетерологичного гена (чужеродного) F3'5'H в лепестках однодольных цветущих растений (см. Патентный Документ 3), и существует несколько сообщений, описывающих разработку генетически модифицированных однодольных цветущих растений, но все еще отсутствуют сообщения, описывающие создание однодольных цветущих растений, в которые был бы введен ген F3'5'H, а именно создание однодольных цветущих растений, в которых цвет цветка был изменен посредством аккумуляции делфинидина в его лепестках в результате введения гетерологичного гена F3'5'H.
Помимо этого в непатентном документе 8 описано, что при выведении синих лилий путем введения гена, относящегося к синтезу синего пигмента, в красные лилии, были получены лилии, в которых содержание синего пигмента составляло половину или больше от всего пигмента. Однако, тканью или частью растения лилии, в которой в непатентном документе 8 был проанализирован синий пигмент, был лишь черешок. Существует множество растений, в которых антоцианины не синтезируются в цветах даже в том случае, когда они синтезируются в листьях (например, в арабидопсисе) и существуют известные случаи, при которых молекулярные виды антоцианинов в листьях и антоцианины в цветках отличаются. Например, хотя антоцианины, которые содержатся только в листьях Sarrecenia purpurea и Sarracenia psitticina, происходят из цианидина, антоцианины содержащиеся в их цветках, происходят из цианидина и делфинидина (см. непатентный документ 17). Кроме того, контроль синтеза антоцианина весьма вероятно отличается в зависимости от ткани. Например, несмотря на то, что ген с, придает белый цвет вьюнкам пурпурным, их стебли окрашиваются антоцианинами, а семена являются черными. С другой стороны, ген c, придает белый цвет цветам, хотя стебли не окрашиваются и семена являются белыми.
Таким образом, сообщение, в котором описывается, что содержание делфинидина составляет половину всех пигментов в черешке лилий в результате введения гетерологичного гена, не означает, что был разработан способ культивирования синих лилий, который позволяет выращивать лилии, в которых накопление делфинидина в лепестках является результатом введения гетерологичного гена.
Кроме того, в целях изменения цвета цветов на синий, требуется содержание делфинидина 50% или больше, предпочтительно 69% или больше, более предпочтительно 70% или больше, еще более предпочтительно 80% или больше, еще более предпочтительно 90% или больше, еще более предпочтительно до 95% или больше, еще более предпочтительно до 99% или больше, и наиболее предпочтительно 100% от общего количества антоцианидинов. Поскольку для достижения этого зачастую недостаточно просто сверхэкспрессировать ген F3'5'H, необходимо дополнительное изобретательство, в том числе дополнительные манипуляции с генами.
Например, в случае гвоздик, при экспрессии как гена F3'5'H, так и гена петунии дигидрофлованол 4-редуктазы (DFR) в белых гвоздиках, дефектных по гену DFR, содержание делфинидина становится почти 100% и получаются генетически модифицированные гвоздики, в которых окраска цветов изменена на синий (см. патентный документ 6 и фиг.1 настоящей заявки). Также при экспрессии в розах выделенного из анютиных глазок гена F3'5'H и выделенного из ириса гена DFR в дополнение к подавлению экспрессии гена DFR розы, содержание делфинидина становится почти 100% и получаются генетически модифицированные розы, в которых окраска цветов изменена на синий (см. Патентный Документ 2). Кроме того, в хризантемах содержание делфинидина повышается сверхэкспрессией выделенного из анютиных глазок гена F3'5'H и подавлением экспрессии эндогенного гена F3'5'H хризантемы (см. Патентный документ 5).
Документы предшествующего уровня техники
Патентные документы
Патентный Документ 1: Международная публикация No. WO 94/28140 (PCT/AU94/00265, Нерассмотренная патентная публикация Японии (Перевод РСТ Заявки) No. H8-511683)
Патентный Документ 2: Международная публикация No. WO 2005/017147 (PCT/JP2004/001958)
Патентный документ 3: Нерассмотренная патентная публикация Японии No. 2008-252250
Патентный Документ 4: Международная публикация No. WO 2004/020637 (PCT/AU03/01111)
Патентный Документ 5: Международная публикация No. WO 2009/062253 (PCT/AU2008/001694)
Патентный Документ 6: Международная публикация No. WO 96/36716 (PCT/AU96/00296)
Патентный Документ 7: Международная публикация No. WO 2007/094521 (PCT/JP2007/053342)
Патентный Документ 8: Международная публикация No. WO 2008/156214 (PCT/JP2008/061603)
Патентный документ 9: Патентная Заявка Японии No. 2008-276029, которая будет опубликована в ближайшее время.
Непатентные документы
Непатентный документ 1: Plant J. (2008) 54, 737-749
Непатентный документ 2: Nature (1993) 366, 276-279
Непатентный документ 3: FEBS Lett. (1999) 461, 241-245
Непатентный документ 4: Biosci. Biotechnol. Biochem. (2003) 67(1), 161-165
Непатентный документ 5: Plant Biotechnology (2006) 23, 5-11
Непатентный документ 6: Protein, Nucleic Acid and Enzyme (1989) 34, 1873-1878
Непатентный документ 7: Trends in Genetics (1988) 4, 13-18
Непатентный документ 8: 2006 Annual Report No. 1-26 of the Niigata Agricultural Research Institute, (32) Project for the Development of Top Brand Agricultural Products, Cultivation of Blue Lilies
Непатентный документ 9: Plant Cell Reports (2004) 22, 415-421
Непатентный документ 10: Plant Cell Reports (2004) 22, 359-364
Непатентный документ 11: Theor. App. Genet. (1999) 99, 383-390
Непатентный документ 12: Plant Cell Physiol. (1996) 37, 49-59
Непатентный документ 13: Clontech, Molecular Breeding (2003) 11, 287-293
Непатентный документ 14: J. Japan Soc. Hort. Sci. (2008) 77, 94-102
Непатентный документ 15: Plant J. (2008) 54, 949-962
Непатентный документ 16: Abstracts of the 2010 Annual Meeting of the Japanese Society of Plant Physiologists, Poster No. P1C012(600),
http://www.jspp.org/13member/2010abstract/pdf/07.pdf
Непатентный документ 17: Hort. Science (2001) 36, 384.
Сущность изобретения
Проблема, решаемая изобретением
Почти во всех растениях в образования синего цвета участвует делфинидин, пигмент на основе антоцианина. Хотя F3'5'H является существенным для синтеза делфинидина, этот фермент отсутствует в лилиях. Следовательно, синих лилий не существует. Для культивирования синих лилий путем введения гена, требуется получение в лилиях высокой экспрессии F3'5'H. С другой стороны, содержание делфинидина не увеличивается в лилиях, синтезирующих цианидин, до тех пор, пока не подавляется синтез цианидина.
Целью настоящего изобретения является предложение способа получения лилий, которые синтезируют в клетках лепестков синий пигмент делфинидин с более высоким относительным содержанием, путем обеспечения высокого уровня экспрессирующего F3'5'H, выделенного из определенных видов, вместе с подавлением эндогенного цианидина лилий.
Способы решения проблем
В результате проведения интенсивных исследований для решения вышеупомянутых задач, авторы настоящего изобретения обнаружили, что при введении выделенного из колокольчика гена F3'5'H в сорт восточной лилии «Acapulco», которая имеет розовый цвет и в которой цианидин отвечает почти за весь присутствующий пигмент на основе антоциана, и при подавлении синтеза цианидина с помощью RNAi путем введения фрагмента гена F3'H лилии, 80% из всего пигмента на основе антоциана в клетках лепестков становится делфинидином, что приводит, таким образом, к осуществлению настоящего изобретения.
Подробнее настоящее изобретение представлено ниже.
[1] Способ получения лилий, содержащих в лепестках делфинидин, который включает следующие стадии:
введение в лилии выделенного из колокольчиков гена флавоноид-3',5'-гидроксилазы (F3'5'H), включающего нуклеотидную последовательность, представленную в SEQ ID NO:1 или SEQ ID NO:11, или нуклеотидную последовательность, идентичную, по меньшей мере, на 90% последовательности с нуклеотидной последовательностью, представленной в SEQ ID NO:1 или SEQ ID NO:11, которая также кодирует полипептид, обладающий активностью F3'5'H,
введение фрагмента гена флавоноид-3'-гидроксилазы (F3'H), выделенного из лилии, включающего нуклеотидную последовательность, представленную в SEQ ID NO:3 или SEQ ID NO:16, или нуклеотидную последовательность, идентичную, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16, которая также кодирует полипептид, обладающий активностью F3'H, и
синтез делфинидина в результате деятельности введенного гена F3'5'H, с одновременным подавлением экспрессии эндогенного гена F3'H, который участвует в синтезе цианидина в лепестках лилий.
[2] Способ, описанный в [1], в котором подавление экспрессии эндогенного F3'H проводится способом RNAL
[3] Способ, описанный в [1] или [2] выше, в котором выделенный из колокольчика ген F3'5'H состоит из нуклеотидной последовательности, идентичной, по меньшей мере, на 95% нуклеотидной последовательности, представленной в SEQ ID NO:1 или SEQ ID NO:11, которая также кодирует полипептид, имеющий активность F3'5'H.
[4] Способ, описанный в [1] или [2], в котором выделенный из колокольчика ген F3'5'H состоит из нуклеотидной последовательности, представленной в SEQ ID NO:1 или SEQ ID NO:11.
[5] Способ, описанный в любом из [1] - [4] выше, в котором фрагмент выделенного из лилии гена F3'H состоит из нуклеотидной последовательности, идентичной, по меньшей мере, на 95% нуклеотидной последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16, которая также кодирует полипептид, имеющий активность F3'H.
[6] Способ, описанный в любом из [1] - [4], в котором фрагмент выделенного из лилии гена F3'H состоит из нуклеотидной последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16.
[7] Способ, описанный в любом из [1] - [6] выше, дополнительно включающий: введение фрагмента выделенного из лилии гена дигидрофлавонол 4-редуктазы (DFR), содержащего нуклеотидную последовательность, представленную в SEQ ID NO:13 или нуклеотидную последовательность, идентичную, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:13, которая также кодирует полипептид, имеющий активность DFR, и подавление экспрессии эндогенного DFR, которая оказывает влияние на синтез цианидина в лепестках лилий, и одновременное введение выделенного из ириса инородного гена DFR.
[8] Способ, описанный в [7] выше, в котором подавление экспрессии эндогенного DFR проводится способом RNAi.
[9] Способ, описанный в любом из [1] - [8], дополнительно включающий: применение последовательности промотора DFR лилий, представленного в SEQ ID NO:24.
[10] Лилия, ее ткань, ее часть, полученное из нее вегетативным размножением растение или ее потомок, которые содержат делфинидин в лепестках, полученные согласно способу, описанному в любом из [1] или [9] выше.
[11] Лилия, ее ткань, ее часть, полученное из нее вегетативным размножением растение, или ее потомок, описанные в [10], где ткань или часть является срезанным цветком.
Осуществления изобретения
Согласно предложенному в настоящем изобретении способу получения лилий, содержащих в лепестках делфинидин, синий пигмент, присутствующий в клетках лепестков лилий в форме делфинидина, может быть аккумулирован с более высоким относительным содержанием, что, таким образом, позволяет получить ранее не существовавшие лилии, которые имеют синие цветы.
Краткое описание чертежей
На фиг.1 изображен путь биосинтеза антоцианинов.
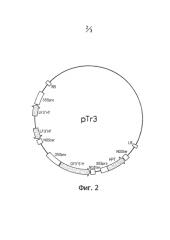
На фиг.2 изображена карта бинарного вектора Tr3.
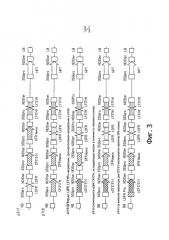
На фиг.3 изображены карты бинарных векторов Tr7 - Tr11.
Воплощения изобретения
Ниже представлено подробное описание настоящего изобретения.
Настоящее изобретение относится к способу получения лилий, содержащих в лепестках делфинидин, включающему следующие стадии:
введение в лилии выделенного из колокольчиков гена флавоноид-3',5'-гидроксилазы (F3'5'H), включающего нуклеотидную последовательность, представленную в SEQ ID NO:1 или SEQ ID NO:11, или нуклеотидную последовательность, идентичную, по меньшей мере, на 90% последовательности с нуклеотидной последовательностью, представленной в SEQ ID NO:1 или SEQ ID NO:11, которая также кодирует полипептид, обладающий активностью F3'5'H,
введение фрагмента выделенного из лилии гена флавоноид-3'-гидроксилазы (F3'H), включающего нуклеотидную последовательность, представленную в SEQ ID NO:3 или SEQ ID NO:16, или нуклеотидную последовательность, идентичную, по меньшей мере, на 90% последовательности с нуклеотидной последовательностью, представленной в SEQ ID NO:3 или SEQ ID NO:16, которая также кодирует полипептид, обладающий активностью F3'H, и
синтез делфинидина в результате действия введенного гена F3'5'H, с одновременным подавлением экспрессии эндогенного гена F3'H, который участвует в синтезе цианидина в лепестках лилий.
Примеры вышеупомянутой нуклеотидной последовательности, идентичной, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:1 или SEQ ID NO:11, которая также кодирует полипептид, обладающий активностью флавоноид-3'5'-гидроксилазы (F3'5'H), включают ДНК, идентичную, по меньшей мере, на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% или более ДНК, состоящей из нуклеотидной последовательности, представленной в SEQ ID NO:1, при расчете с помощью пакета аналитических программ, таких как «BLAST» или «FASTA».
Аналогично, примеры вышеупомянутой нуклеотидной последовательности, идентичной, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16, которая также кодирует полипептид, обладающий активностью флавоноид-3'-гидроксилазы (F3'H), включают ДНК, идентичную, по меньшей мере, на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% или более ДНК, состоящей из нуклеотидной последовательности, представленной в SEQ ID NO:3, при расчете с помощью пакета аналитических программ, таких как «BLAST» или «FASTA».
Нуклеотидная последовательность, идентичная, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:1 или SEQ ID NO:11, которая обладает активностью флавоноид-3',5'-гидроксилазы (F3'5'H), также может представлять собой нуклеотидную последовательность, в которой один или несколько нуклеотидов удалены, заменены или вставлены в нуклеотидную последовательность, представленную в SEQ ID NO:1 или SEQ ID NO:11, которая также кодирует полипептид, обладающий активностью флавоноид-3',5'-гидроксилазы (F3'5'H). В данном документе, «один или несколько» в ДНК или в нуклеотидной последовательности означает, что 1-20, предпочтительно, 1-10, более предпочтительно, 1-5, еще более предпочтительно, 1-4, и еще более предпочтительно, 1-3 оснований в нуклеотидной последовательности, представленной в SEQ ID NO:1, удалены, заменены или вставлены, при условии наличия вышеупомянутой ферментной активности. Кроме того, термины «делеция», «замена» и «вставка» обозначают образование нуклеотидной последовательности, которая кодирует белок, обладающий свойствами, аналогичными свойствам белка (или полипептида) (SEQ ID NO:2), кодируемого нуклеотидной последовательностью, представленной в SEQ ID NO:1.
Аналогично, нуклеотидная последовательность, идентичная, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16, которая кодирует пептид обладающий активностью флавоноид-3'-гидроксилазы (F3'H), также может представлять собой нуклеотидную последовательность, в которой один или несколько нуклеотидов удалены, заменены или вставлены в нуклеотидную последовательность, представленную в SEQ ID NO:3 или SEQ ID NO:16, которая также кодирует полипептид, обладающий активностью флавоноид-3'-гидроксилазы (F3'H). В данном документе, «один или несколько» в ДНК или в нуклеотидной последовательности означает, что 1-20, предпочтительно, 1-10, более предпочтительно, 1-5, еще более предпочтительно, 1-4, и еще более предпочтительно, 1-3 нуклеотидов в нуклеотидной последовательности, представленной в SEQ ID NO:3 или в SEQ ID NO:16, удалены, заменены или вставлены, при условии сохранения в результате вышеупомянутой ферментной активности. Кроме того, термины «делеция», «замена» и «вставка» обозначают образование нуклеотидной последовательности, которая кодирует белок, обладающий свойствами, аналогичными свойствам белка (или полипептида) (SEQ ID NO:4 или SEQ ID NO:17), кодируемого нуклеотидной последовательностью, представленной в SEQ ID NO:1 или в SEQ ID NO:16.
Нуклеотидная последовательность, идентичная, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:1 или SEQ ID NO:11, которая также кодирует полипептид, обладающий активностью флавоноид-3',5'-гидроксилазы (F3'5'H), может представлять собой нуклеотидную последовательность, способную гибридизоваться в жестких условиях с комплементарной цепью нуклеотидной последовательности, представленной в SEQ ID NO:1 или SEQ ID NO:11, которая также кодирует полипептид, обладающий активностью флавоноид-3'5'-гидроксилазы (F3'5'H).
Аналогично, нуклеотидная последовательность, идентичная, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16, которая также кодирует полипептид, обладающий активность флавоноид-3'-гидроксилазы (F3'H), может представлять собой нуклеотидную последовательность, способную гибридизоваться в жестких условиях с комплементарной цепью нуклеотидной последовательности, представленной в SEQ ID NO:3, которая также кодирует полипептид, обладающий активностью флавоноид-3'-гидроксилазы (F3'H).
В данном документе «жесткие условия» по отношению к нуклеотидной последовательности или ДИК (последовательности) обозначают условия, описанные, например, в «Molecular Cloning: A Laboratory Manual (2nd Edition)» edited by Sambrook et al. Cold Spring Harbor Laboratory Press), хотя температура и концентрация солей во время гибридизации, а также, предпочтительно, во время промывки могут соответствующим образом регулироваться в зависимости от ДНК, которая гибридизуется с комплементарной цепью ДНК, состоящей из SEQ ID NO:1 или 11 или SEQ ID NO:3 или 16. Более конкретно, эти условия относится к стадии, состоящей из (i) инкубации в течение ночи при 42°C с зондом в растворе, содержащем 6xSSC (состав 1xSSC: 0,15 М NaCl, 0,015 М цитрата натрия, рН 7), 0,5% SDS, 5х раствор Денхардта, 100 µг/мл денатурированной фрагментированной ДНК спермы лосося и 50% формальдегид, и (ii) удаления неспецифично загибридизовавшегося зонда путем отмывки, где с целью дальнейшего повышения точности проводят отмывку в условиях более низкой ионной силы, например, в 2xSSC и более жестко в 0,1xSSC, и/или отмывку проводят при высокой температуре, например, при 40°С ниже, чем значение Тпл используемой нуклеиновой кислоты, более жестко при температуре на 30°С ниже, еще более жестко при температуре на 25°С ниже, и еще более жестко при температуре на 10°С ниже. Более специфично, хотя и возможны вариации в зависимости от значения Тпл используемой нуклеиновой кислоты, отмывку проводят при 25°С или выше, более жестко при 37°С или выше, еще более жестко при 42°С или выше, еще более жестко при 50°С или выше, и еще более предпочтительно, при 60°С или выше. Например, Тпл определяется из формулы Тпл=81,5+16,6(log[Na+])+0,41(%G+C)-(600/N) (где N обозначает длину олигонуклеотида, и %G+C обозначает содержания остатков гуанина и цитозина в олигонуклеотиде). Условия гибридизации могут быть установлены, например, согласно вышеупомянутой публикации. Кроме того, процедура, приведенная в настоящем описании, может быть подходящим образом проведена с учетом сведений из вышеупомянутой публикации.
Подавление экспрессии эндогенной флавоноид-3'-гидролазы (F3'H), участвующей в синтезе цианидина в лепестках лилий, путем введения фрагмента, выделенного из лилий гена F3'H, состоящего из последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16, или последовательности, идентичной, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:3 или SEQ ID NO:16, которая также кодирует полипептид, обладающий активностью F3'H, может проводиться супрессией антисмысловой последовательностью, супрессией с использованием смысловой последовательности (ко-супрессии) или RNAi и так далее, причем способ RNAi является предпочтительным.
Настоящее изобретение также относится к вышеупомянутому способу, дополнительно включающему введение фрагмента выделенного из лилии гена дигидрофлавонол-4-редуктазы (DFR), содержащего нуклеотидную последовательность, представленную в SEQ ID NO:13 или нуклеотидную последовательность, идентичную, по меньшей мере, на 90% нуклеотидной последовательности, представленной в SEQ ID NO:13, которая также кодирует полипептид, имеющий активность DFR, подавление экспрессии эндогенного DFR, который участвует в синтезе цианидина в лепестках лилий, и одновременное введение выделенного из ириса чужеродного гена DFR. Подавление экспрессии эндогенного DFR предпочтительно проводят способом RNAi.
Настоящее изобретение также относится к вышеупомянутому способу, который дополнительно включает стадию применения промотора DFR из лилий, представленного в последовательности SEQ ID NO:24.
Кроме того, определения делеции, замены или вставки одного или нескольких нуклеотидов в нуклеотидной последовательности, идентичности последовательности и гибридизации, приведенные относительно SEQ ID NO:1, 11, 3 и 16, аналогично применяются к SEQ ID NO:13 и 24, и помимо нуклеотидных последовательностей, представленных в SEQ ID NO:13 и 24, например, нуклеотидная последовательность, идентичная, по меньшей мере, на 90%, 95% или 99%, также входит в объем настоящего изобретения.
Лилия, содержащая в лепестках делфинидин, полученная согласно способу получения лилий, содержащих в лепестках делфинидин по настоящему изобретению, ее ткань, ее часть, вегетативно полученное из нее растение или ее потомство, также входят в объем настоящего изобретения. Предпочтительно, если ее ткань или часть являются срезанным цветком.
Примеры
Хотя нижеследующее представляет более подробное пояснение настоящего изобретения с помощью примеров, подразумевается, что объем настоящего изобретения не ограничен этими примерами.
Справочный пример 1. Экспрессия в лилиях гена F3'5'H из барвинка
Плазмиду pNAVFH (см. Непатентный Документ 9, бинарный вектор для экспрессии гена F3'5'H барвинка в растениях) вводили в штамм агробактерий ЕНА101. Сорт лилий «Acapulco» (розовые цветы), трансформировали с помощью этих генетически модифицированных агробактерий. Хотя трансформацию лилий проводили способом, описанным, например, в Непатентном документе 10, используемый способ этим не ограничивается.
Требуется от двух до трех лет после получения растительной тканевой культуры трансформированных лилий для исследования того, функционирует ли введенный ген F3'5'H в лилиях и индуцирует ли аккумуляцию делфинидина. Анализ присутствия антоцианов в культивируемых черешках, был сфокусирован на наблюдении антоцианового окрашивания в черешках, что, по меньшей мере, позволяло быстро определить, что введенный ген не функционирует или функционирует лишь в небольшой степени. Из полученных растительных тканевых культур трансформированных лилий было получено 19 культиваров. Собирали приблизительно по 0,5 г черешков, в которых наблюдали антоциановое окрашивание, и подвергали анализу антоцианов с использованием способа, описанного в Патентном Документе 2. В результате не обнаружили культиваров, в которых бы детектировался делфинидин.
Справочный пример 2. Экспрессия в лилиях гена F3'5'H из цинерарии Фрагмент ДНК, длиной приблизительно 1,7 тыс.п.о., полученный гидролизом плазмиды pSPB2774, содержащей выделенную из цинерарии F3'5'H кДНК Ci5a18 (см. Патентный документ 9), по SmaI и XhoI, фрагмент ДНК, содержащий 35S-промотор вируса мозаики цветной капусты (также обозначенный как «355-промотор»), полученный гидролизом плазмиды pBI1221 no HindIII и BamHI, и фрагмент ДНК, содержащий репликон фрагмента ДНК, полученного гидролизом плазмиды pSPB176 (см. Патентный документ 7) по HindIII и SalI, лигировали с получением плазмиды pSPB3472. Фрагмент ДНК, полученный гидролизом данной плазмиды по AscI и PacI (содержащей последовательность, в которой лигировали 35S-промотор, Ci5a18 и терминатор нопалин-синтазы), лигировали с фрагментом ДНК, полученным гидролизом #493 по AscI и PacI с получением плазмиды pSPB3376. Затем с помощью агробактерий полученную плазмиду вводили в лилии, как описано в Справочном примере 1, с получением растительной тканевой культуры для 65 культиваров трансформированных лилий. Хотя в 23 из этих культиваров в черешках листьев аккумулировался антоциан, при этом не было получено ни одного культивара, в котором бы аккумулировался делфинидин.
Справочный пример 3. Экспрессия в лилиях гена F3'5'H из горечавки Фрагмент ДНК, длиной приблизительно 1,7 тыс.п.о., полученный гидролизом плазмиды pGHF48, содержащей кДНК F3'5'H из горечавки (см. Патентный Документ 4), лигировали с плазмидой pSPB176, гидролизованной по BamHI и SalI с получением плазмиды pSPB3329. Участок промотора удаляли гидролизом по HindIII и BamHI. Затем введением фрагмента ДНК, полученного гидролизом pBI1221 no HindIII и BamHI (содержащего 35S-промотор), получали плазмиду pSPB3473. Фрагмент ДНК, полученный гидролизом данной плазмиды по AscI и PacI (содержащий последовательность, в которой лигировали 35S-промотор, кДНК F3'5'H горечавки и терминатор нопалин-синтазы), лигировали с фрагментом ДНК, полученным гидролизом pSPB493 по AscI и PacI с получением плазмиды pSPB3378. Затем с помощью агробактерий полученный конструкт вводили в лилии, как описано в Справочном примере 1, с получением растительной тканевой культуры для 65 линий трансформированных лилий. Черешки листьев, в которых аккумулировался антоциан, получали из 26 из этих культиваров. Процент накопления делфинидина (соотношение количества аккумулированного делфинидина к общему количеству антоциана) достигал всего лишь максимум 1%.
Справочный пример 4. Экспрессия в лилиях гена F3'5'H из лаванды
Фрагмент ДНК, длиной приблизительно 1,7 тыс.п.о., полученный гидролизом плазмиды pGHF48, содержащей кДНК F3'5'H из лаванды (см. Патентный Документ 4), по BamHI и XhoI, лигировали с плазмидой pSPB176, гидролизованной по BamHI и SalI с получением плазмиды pSPB2772. Извлекали фрагмент ДНК, полученный гидролизом данной плазмиды по BamHI и PacI, содержащий последовательность, в которой были лигированы кДНК F3'5'H лаванды и терминатор нопалин-синтазы. Данный фрагмент ДНК лигировали с фрагментом, содержащим репликон фрагмента ДНК, полученного гидролизом плазмиды pSPB3472 (3377) по BamHI и PacI, с получением плазмиды pSPB3471. Фрагмент, ДНК полученный гидролизом данной плазмиды по AscI и PacI (содержащий последовательность, в которой были лигированы 35S-промотор, кДНК F3'5'H горечавки и терминатор нопалин-синтазы), лигировали с фрагментом ДНК, полученным гидролизом pSPB493 по AscI и PacI, с получением плазмиды pSPB3376. Затем с помощью агробактерий полученный конструкт вводили в лилии, как описано в Справочном примере 1, с получением растительной тканевой культуры для 23 культиваров трансформированных лилий. Черешки листьев, в которых аккумулировался антоциан, получали из 20 из этих культиваров. Процент накопления делфинидина (соотношение количества аккумулированного делфинидина к общему количеству антоциана) достигал всего лишь максимум 1%.
Справочный пример 5. Экспрессия в лилиях гена F3'5'H из мотылькового горошка
Сообщалось, что ген F3'5'H из мотылькового горошка (учетный номер базы данных ДНК АВ234897), введенный в вербену функционирует лучше и приводит в результате к более высокому содержанию делфинидина и к более существенному изменению цвета цветка, чем в случае введения гена F3'5'H самой вербены (см., например Непатентный Документ 5). Плазмиду pSPB748 (см., Непатентный Документ 5) гидролизовали по EcoRI, затупляли концы и гидролизовали по BamHI с последующим извлечением фрагмента ДНК, содержащего кДНК F3'5'H из мотылькового горошка. С другой стороны получали фрагмент ДНК гидролизом pSPB176 по SalI, затуплением концов и гидролизом по BamHI. Эти два фрагмента ДНК дотировали с получением плазмиды pSPB3166. Фрагмент ДНК, содержащий кДНК F3'5'H, полученный гидролизом pSPB3166 по AscI и PacI, вставляли в фрагмент ДНК, полученный гидролизом бинарного вектора pSBP3166, который содержит ген, обесп