Способ дистантной стимуляции регенерации гепатоцитов
Иллюстрации
Показать всеИзобретение относится к медицине и биологии, в частности касается стимуляции регенерации гепатоцитов. Для этого в экспериментальных условиях животному вводят подкожно или внутримышечно пористый трансплантат в виде кальцийфосфатного матрикса с диаметром пор в диапазоне 150-600 мкм, либо в виде указанного матрикса с предварительно нанесенным сингенным костным мозгом. Способ обеспечивает повышение регенераторного потенциала эндогенных гепатоцитов на протяжении длительного срока при снижении риска возможных осложнений и сокращении затрат. 1 з.п. ф-лы. 2 пр., 2 табл., 4 ил.
Реферат
Изобретение относится к биологии и медицине, конкретно к регенеративной медицине, и касается стимуляции регенерации гепатоцитов и может быть использовано для коррекции структурно-функциональных нарушений печени, прежде всего, ее возрастных изменений.
Печень во взрослом организме, как правило, находится в состоянии покоя, которое сопровождается непролиферирующим состоянием гепатоцитов [Бадер А. Способ регенерации ткани: Патент РФ на изобретение №2392314 от 20.06.2010]. Физиологическая регенерация печени, в отличие от репаративной, слабо выражена. Одним из принципиальных показателей регенерации печени является количество (доля) двуядерных гепатоцитов (делящихся и неделящихся), количество которых невелико в интактной печени и, к тому же, значительно снижается с возрастом [Северин М.В., Б.Г. Юшков, Ястребов А.П. Регенерация тканей при экстремальных воздействиях на организм. Екатеринбург: УрГМИ, 1993. - 187 с - С. 82-91]. Существует обратно пропорциональная зависимость, когда небольшие потери клеток печени восстанавливаются медленно, большие потери клеток печени - значительно быстрее [Северин М.В., Б.Г. Юшков, Ястребов А.П. Регенерация тканей при экстремальных воздействиях на организм. Екатеринбург: УрГМИ, 199. - 187 с - С. 79; Бадер А. Способ регенерации ткан: Патент РФ на изобретение №2392314 от 20.06.2010].
Медленные подпороговые потери гепатоцитов не компенсируются организмом, когда процесс достигает "критического числа" (для печени это число составляет 10% работающих гепатоцитов), это приводит к необратимым процессам и гибели организма [Северин М.В., Б.Г. Юшков, Ястребов А.П. Регенерация тканей при экстремальных воздействиях на организм. Екатеринбург: УрГМИ, 1993. - 187 с - С. 79]. Поэтому разработка методов стимуляции регенерации печени, в первую очередь, ее физиологической компоненты, является одной из важнейших социально-экономических задач антивозрастной (регенеративной) медицины, направленной на сохранение активного долголетия в условиях увеличения среднего возраста населения планеты.
Известен широкий спектр лекарственных препаратов, биотехнологических (гормоны, рекомбинантные факторы роста клеток, цитокины, биологически активные вещества и т.п.) и клеточных составов, способных оказывать стимулирующее влияние на рост и регенерацию гепатоцитов, функциональную активность печени, прежде всего, при репаративной и патологической регенерации органа.
Например, доказаны стимулирующие регенерацию печени эффекты дегидротимина, тимина, метацила, пентоксила, тироксина, преднизолона, пролактина, хориогонина, ДНК и продуктов регенерирующей печени [Карагюлян СР., Сванадзе Н.Л. Усиление регенерации при обширных поражениях печени // Хирургия. - 1985. - №2. - С. 139-143]. Вагосимпатическая новокаиновая блокада сосудисто-нервных пучков на шее при механическом повреждении печени способствует увеличению доли двуядерных гепатоцитов, что является маркером стимуляции репаративной регенерации и гипертрофии органа [Тараско А.Д., Ибатуллин И.А., Итс В.Э., Арефьева А.К. Способ стимуляции репаративной регенерации и гипертрофии печени при моделировании ее механического повреждения в эксперименте: Патент РФ на изобретение №2168336 от 08.09.1999].
Ближе к существу изобретения являются способы, использующие биотехнологические и клеточные композиции и технологии, которые применяются для местного или системного влияния на регенерацию печени.
Один подход базируется на применении комплексных гетерологичных экстрактов тканей, например экстрактов из гипофиза или гипоталамуса, для индукции размножения клеток, например гепатоцитов. Однако применение экстрактов из тканей животных или человека в лаборатории или в клинике проблематично из-за возможности передачи вирусных заболеваний, например, таких как вирус папилломы человека, губчатая энцефалопатия крупного рогатого скота, вирусов свиней или овец. Кроме того, трудно определить и стандартизовать качество экстрактов, так как оно, среди прочего, зависит от источника и условий культивирования [Бадер А. Способ регенерации ткани: Патент РФ на изобретение №2392314 от 20.06.2010].
Другой подход использует индукцию роста клеток посредством введения гормонов (например, соматотропный гормон, СТГ), факторов роста, например, таких как трансформирующий фактор роста бета (TGF-beta, ТФР-бета), эпидермальный фактор роста (EGF, ЭФР), сосудисто-эндотелиальный фактор роста (VEGF, СЭФР) или фактор роста гепатоцитов (HGF, ФРГ), эритропоэтин (ЭПО), тромбопоэтин (ТПО), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF, ГМ-КСФ), гранулоцитарный колониестимулирующий фактор (G-CSF, Г-КСФ) и др. [Бадер А. Способ регенерации ткани: Патент РФ на изобретение №2392314 от 20.06.2010]. Они имитируют гуморальный (паракринный - местный и через кровь) путь регуляторного влияния клеток организма (например, костного мозга) на регенерацию других клеточных систем, включая гепатоциты. В то же время, их применение in vivo не лишено проблем из-за выраженных побочных эффектов, связанных с трудностью индивидуального подбора терапевтической дозы для каждого пациента и широким спектром клеточных и внутриклеточных эффектов, например:
1) развивается лихорадка;
2) активируются онкогены, запускающие деление клеток, но, с другой стороны, приводящие к опухолевой трансформации клеток. Тем более, что в условиях патологии печени и в условиях физиологического старения организма накапливаются мутантные клетки, что можно зафиксировать, в частности, по появлению и накоплению патологических митозов [Северин М.В., Б.Г. Юшков, Ястребов А.П. Регенерация тканей при экстремальных воздействиях на организм. Екатеринбург: УрГМИ, 1993. - 187 с - С. 85-91].
С точки зрения клеточных технологий, известны способ лечения хронических заболеваний, способ получения биотрансплантата, биотрансплантат для лечения любых хронических заболеваний, включая жировую дистрофию печени [Shumakov V.I., Gureev S.V., Onischenko N.A., Temnov A.A. Method for treating chronic illnesses (variants), method for producing a biograft (variants) and a biograft (variants): WO 2007091919 (A1) - 2007-08-16]. До забора стволовых и прогениторных клеток из костного мозга проводят иммунокоррекцию, культивируют клетки с тканеспецифическим антигеном 7-15 суток для получения биотрансплантата. Для получения тканеспецифичекого антигена берут свежевыделенную ткань органа, идентичного поврежденному. В качестве источника может быть использована аллогенная или ксеногенная ткань, при возможности используется биопсийный материал. Биотрансплантат вводят в неизвестное место, что на экспериментальной модели жировой дистрофии печени у морских свинок в 5 раз повышает процент двуядерных гепатоцитов.
Известен похожий на предыдущий способ продукции и применения композиции для стимуляции роста, а также регенерации клеток [Botin A.S., Onischenko N.A., Temnov A.A. Growth stimulating and cell regenerating composition and a method for the production thereof: WO 2008082323 (A1) - 2008-07-10]. Композиция использует лизат, в том числе, стволовых и прогениторных клеток костного мозга. Сами клетки тоже могут входить в состав композиции на фармацевтически приемлемом носителе или без такового. Клетки, забранные у пациента, предварительно культивируют до 60 сут с тканеспецифическим антигеном, соответствующим поврежденному органу, регенерацию клеток которого требуется простимулировать. Фармакологическую композицию можно применять в качестве косметических добавок, пищевых добавок и добавок в корм животных, внутреннего введения, культивирования клеток, фармацевтического применения, а также для стимуляции роста волос. Как результат, на экспериментальной модели жировой дистрофии печени у морских свинок в 5 раз повышается процент двуядерных гепатоцитов.
К недостаткам известных способов относятся:
- 5-7 этапов для получения биотрансплантата или композиции, начиная с забора клеток, свидетельствующие о дороговизне и сложности подготовительных процедур;
- длительные манипуляции с клетками вне организма требуют высококлассного специализированного оборудования и квалифицированного персонала, несут повышенный риск инфицирования клеточного материала;
- иммунокоррекция не всегда приемлема при аутоиммунных и эссенциальных заболеваниях печени;
- не обозначен путь введения композиции в организм морских свинок для регенерации печени. Назначение композиции стволовых клеток через желудочно-кишечный тракт дорого и нецелесообразно, поскольку слабое усвоение введенного материала требует назначения больших доз композиции, эффект сомнителен; парентеральное введение клеточного лизата, содержащего внутриклеточные органеллы, которые являются антигеном, в сочетании с тканеспецифическим антигеном могут провоцировать развитие аллергических и аутоиммунных заболеваний;
- отсутствие универсальности способов, так как в каждом конкретном случае подбирается тканеспецифический антиген и донорский материал (аутологичный, аллогенный, ксеногенный).
Регенерация ткани печени является одним из важнейших показателей в хирургической гепатологии. Важным разделом является внедрение и разработка новых способов и методов стимуляции регенераторных процессов в печени.
Выделяют различные способы стимуляции регенерации печени, такие как перевязка печеночной артерии, ветвей воротной вены, гепатофреникопексия [Дударев В.А., Фокин Д.В. Экспериментально морфологическое обоснование стимуляции регенерации печени // INTERNATIONAL JOURNAL OF EXPERIMENTAL EDUCATION. 2014. №8. C. l12-113; C. 112], денервация печеночной артерии [P. Mallet-Guy P. Effects de La neurectomien periartere hepatigue sur L, evolution de L, hepatiti toxigue experimentale. - Lyon Hir., 1962, V. 58. - p. 242-258], резекция печени [Нарциссов T.B. Резекция печени при циррозе // Хирургия. - 1973. - №5. - С. 79-84]. Подобные травматичные вмешательства в организм, вызывающие осложнения в 20% случаев, неприемлемы для стимуляции физиологических процессов, лежащих в основе регенерации гепатоцитов.
Существует группа способов лечения печеночной недостаточности, основанных на использовании "вне организма"- экстракорпорально:
- суспензии изолированных ксеногенных гепатоцитов в экстракорпоральной системе «вспомогательная печень», через которую перфузируется кровь реципиента с пораженной печенью [Шумаков В.И. и соавторы. Очерки по физиологическим проблемам трансплантологии и применения искусственных органов // Тула. - Репрорникс. - 1998. - с. 343-362];
- микрофрагментов ткани печени [Соловьев В.В., Онищенко Н.А., Акатов B.C., Лежнев Э.И. Функциональная активность гепатоцитов в фрагментах печени in vitro: зависимость от размеров фрагментов и длительности их культивирования. // Бюл. Экспер. Биол. и Мед., - 1997, - №10, - с. 406-408];
- изолированных гепатоцитов с микроносителями (например, цитодексом-3), которые предварительно покрывают коллагеном [Dimetriou А.А., Rozga J., Podesta L. Early clinical experience with a hybrid bioartificial liver // Scan. J. gastroenterol. - 1995. - 30. - Suppl. 208. - p. 111-117; Chen S., Eguchi S. Watanabe Hepatic support strategies // Transplant. Proc. - 1996. - 28, №4. - p. 2036-2038];
- экстракорпоральных систем, заполненных коллагеновым гелем с гепатоцитами [Naka S., Takeshita К., Yamamoto Т. Bioartificial liver support system using porcine hepatocytes entrapped in a three-dimensional hollow fiber module with collagen gel: an evaluation in the swine acute liver failure model // Artif. Organs. - 1999. - V. 23. - Р. 822-828].
Основными недостатками способов, использующих гепатоциты вне организма (экстракорпорально), для коррекции печеночной недостаточности, являются:
- малый срок работы изолированных гепатоцитов (не более 1-2 дня);
- необходимость регулярно осуществлять сеансы подключения к перфузионным системам «биоискусственная печень»;
- дороговизна.
Так, для стимуляции регенерации печени при фиброзных изменениях различного генеза на модели цирроза печени в эксперименте с помощью иглы-инжектора в ткань печени вводят препарат «EMBRYOBLASTE» на глубину до 0,1 см. Как отмечают авторы, препарат вызывает увеличение объема гепатоцитов (гипертрофию) [Дударев В.А., Киргизов И.В., Якимова С.И., Фокин Д.В., Воробьева Е.Л., Складнева В.О. Способ стимуляции регенерации печени при фиброзных изменениях в эксперименте: Патент РФ на изобретение №2455701 от 10.07.2012]. Данные о стимуляции регенерации гепатоцитов не представлены.
Для стимуляции регенерации гепатоцитов проводят курсовое (до 5 раз) введение диспергированного биоматериала "Аллоплант" посредством эндоскопического канюлирования пупочной вены [Галимов О.В., Нуртдинов М.А., Шумкин A.M., Зиангиров Р.А., Хафизов Н.Х., Хафизов Т.Н., Тимербулатов М.В., Гарифуллин Б.М., Сендерович Е.И., Булгаков В.Р., Зиганшин И.М. Способ лечения токсического гепатита и цирроза печени: Патент РФ на изобретение №2205647 от 10.06.2003].
Для стимуляции регенерации проводят аутотрансплантацию фрагментов печени, которые, однако, погибают, если не обеспечить отвод ядовитой желчи, продуцируемой гепатоцитами [Северин М.В., Б.Г. Юшков, Ястребов А.П. Регенерация тканей при экстремальных воздействиях на организм. Екатеринбург: УрГМИ, 1993. - 187 с - С. 70-71]. Создание отвода (анастомозов) является микрохирургической операцией, которая требуют высококлассных специалистов. Происходит рассасывание основой части пересаженного материала. У пересаженных фрагментов ткани низкая функциональная и регенерирующая активность.
Известен способ, заключающийся во введении ксеногенных гепатоцитов: подкожно в переднюю брюшную стенку до операции и под капсулу почки во время частичной резекции печени. Метод повышает регенерацию печени [Чикотеев С.П., Плеханов А.Н., Товаршинов А.И., Гольдберг О.А., Лепехова С.А., Корнилов Н.Г. Способ пострезекционной регенерации печени в эксперименте: Патент РФ на изобретение №2232550 от 20.07.2004].
Показан способ лечения хронических диффузных заболеваний печени, предусматривающий инъекционное введение суспензии фетальных клеток, тканей человека, причем введение осуществляют подкожно в 4-5 точках передней брюшной стенки, а курс содержит 2-4 инъекции [Трансплантация фетальных тканей и клеток человека/под ред. Г.Т. Сухих.- М., Международный институт биологической медицины, 1996 г., стр. 84-86]. Альтернативой рассматривают внутрибрюшинное назначение суспензии фетальных клеток печени и/или селезенки, и/или тимуса [Курбатова Г.Р., Гиниатуллин Р.У., Козель А.И., Игнатьева Е.Н. Способ патогенетической терапии хронических заболеваний печени: Патент РФ на изобретение №2203675 от 10.05.2003]. Однако инородные по своим антигенам клетки в брюшной полости активируют резидентные макрофаги, которые быстро утилизируют чужеродные клетки и способны провоцировать развитие воспаления (перитонита), что и было подтверждено заявителями.
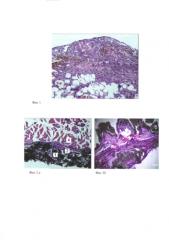
Проведенные авторами эксперименты на мышах показали, что подкожное введение даже сингенных (от животных одной линии) гепатоцитов с использованием подложки неэффективно для длительной стимуляции регенерации печени, поскольку через 45 суток после имплантации происходит их гибель и полная утилизация макрофагами. На препаратах взамен клеток печени обнаруживаются гемосидерофаги, кровеносные сосуды, соединительная и жировая ткани, замещающие ткань печени (Фиг. 1).
Известен способ лечения печеночной недостаточности с использованием полимерного матрикса, в качестве которого применяют гель и аллогенные клетки донора. Трансплантируют гель с клеточным материалом в паренхиму печени и/или брыжейку тонкой кишки. Сразу после трансплантации аллогенных клеток печени и прогениторных клеток костного мозга на геле назначают иммуносупрессанты в профилактической дозе, что позволяет увеличить срок выживания клеток, активизировать их пролиферацию [Готье С.В., Шагидулин М.Ю., Онищенко Н.А., Крашенинников М.Е., Севастьянов В.И. Способ и трансплантат для лечения печеночной недостаточности: Патент РФ на изобретение №2425647 от 10.08.2011].
Наиболее близким к предлагаемому является способ лечения печеночной недостаточности [Готье С.В., Шагидулин М.Ю., Онищенко Н.А., Крашенинников М.Е., Севастьянов В.И. Способ и трансплантат для лечения печеночной недостаточности: Патент РФ на изобретение №2425648 от 10.08.2011], использующий аутологичные прогениторные клетки костного мозга, предварительно культивируемые in vitro в течение 7 суток. Осуществляют также забор аутологичных клеток печени. Проводят сокультивирование аутологичных клеток печени и прогениторных клеток костного мозга в течение 2-3 суток. Только после этого проводят иммобилизацию смеси аутологичных клеток печени и прогениторных клеток костного мозга на носитель - биодеградируемый полимерный трехмерный матрикс. После этого обеспечивают трансплантацию носителя с клетками, вводя его в брыжейку тонкой кишки. После трансплантации аутологичных клеток печени и прогениторных клеток костного мозга на матриксе назначают антикоагулянты и антиагреганты в профилактической дозе.
Однако вышеописанный способ недостаточно эффективен, использование ксеногенного и фетального материала нежелательно.
К недостаткам использования известных хирургических способов, в том числе и прототипа, относятся:
- дороговизна и сложность подготовительных процедур вне организма (до 7-10 этапов манипуляций с клетками), требующих высококлассного специализированного оборудования и квалифицированного персонала, повышенный риск инфицирования клеточного материала;
- воспалительная реакция на трансплантат. Полимерные материалы подвергаются биоразрушению, вызванному гигантскими многоядерными клетками инородных тел [Biomaterials Science: an introduction to Materials in Medicine / ed. by B.D. Ratner, A.S. Hoffman, F.J. Schoen, J.E. Lemons. - 2nd ed. - Elsevier Inc., 2004. P. 296-304; Хлусов И.А., Нечаев K.A., Дворниченко M.B., Хлусова М.Ю., Саприна Т.В., Твердохлебов С.И. Влияние гибридных имплантатов на основе трехмерной полимерной матрицы на динамику старения лейкозньгх мышей // Биотехносфера. 2010. №5-6(11-12). С. 15-19], которые способствуют развитию хронического гранулематозного воспаления [Biomaterials Science: an introduction to Materials in Medicine / ed. by B.D. Ratner, A.S. Hoffman, F.J. Schoen, J.E. Lemons. - 2nd ed. - Elsevier Inc., 2004. P. 296-304];
- малая выживаемость введенных гепатоцитов или других клеток вследствие нарушения кровообращения в трансплантате, особенно на фоне фиброза печени;
- использование фармакологических препаратов (антикоагулянтов и антиагрегантов), увеличивающих нагрузку на восстанавливающуюся печень;
- травматичность полостной операции, эндоскопического или лапароскопического введения трансплантата в брыжейку тонкой кишки или паренхиму печени, возможность осложнений (кровотечение, тромбообразование, нагноение, риск опухолевой трансформации и т.п.), необходимость навигации для доставки трансплантата (под контролем УЗИ или эндоскопа), что обусловливает применение способа только в специализированных отделениях, занимающихся лечением и коррекцией печеночной недостаточности, с привлечением высококвалифицированных специалистов;
- коррекция печеночной недостаточности за счет пролиферации и функционирования введенных извне гепатоцитов (заместительная терапия), при этом не доказана стимуляция регенерации гепатоцитов в поврежденной печени;
- практически не представлены геометрические параметры применяемых матриксов-носителей клеток и препаратов, хотя в литературе известны многочисленные факты существенного влияния характеристик носителей, например параметров их пористости, на жизнедеятельность клеток и тканей [Gauthier О., Bouler J.-M., Aguado Е. е.а. Macroporous biphasic calcium phosphate ceramics: influence macropore diameter and macroporosity percentage on bone ingrowth // Biomaterials. 1998. V. 19 (1-3). P. 133-139; Sous M., Bareille R., Rouais F. et al. Cellular biocompatibility and resistance to compression of macroporous beta-tricalcium phosphate ceramics // Biomaterials. 1998. V. 19. Р. 2147-2153].
Подобных недостатков лишен предлагаемый способ дистантной стимуляции регенерации гепатоцитов.
Новый технический результат - повышение регенераторного потенциала эндогенных гепатоцитов на протяжении длительного срока, расширение области применения, снижение риска возможных осложнений, повышение удобства пользования и сокращение затрат.
Для достижении нового технического результата в способе дистантной стимуляции регенерации гепатоцитов, включающем введение в организм трансплантата, вводят подкожно трансплантат, в состав которого входит кальцийфосфатный матрикс, обладающим пористой структурой с диаметром пор материала в диапазоне 150-600 мкм, несущий предварительно нанесенный сингенный костный мозг.
Также, в случае отсутствия возможности забора клеточного материала, подкожно вводят трансплантат без предварительно нанесенного костного мозга.
Также вводят трансплантат, выполненный в виде параллелепипеда или цилиндра.
Для дистантной стимуляции регенерации гепатоцитов способ применяется впервые.
Способ осуществляют следующим образом
1) В качестве матрикса трансплантата используют матрикс, выполненный из фосфатов кальция, с диаметром пор материала в диапазоне от 150 до 600 мкм. Наиболее оптимальной является геометрическая форма матрикса, например в виде параллелепипеда или цилиндра, с размерами, подходящими для подкожного или внутримышечного малоинвазивного введения через разрез кожи, например, троакаром. Выбор технических параметров (диаметр пор) основан на сохранении прочности при довольно значительной пористости материала матрикса трансплантата.
2) Костный мозг выделяют из костей (бедренной, берцовой, подвздошной, грудины и т.п.) известными способами (аспирация, трепанобиопсия, стернальная пункция, при операциях на костях и т.п.), вводят в пористую структуру материала (шприцем, автоматическим дозатором и т.п.), при возможности культивируют не более 1 часа при 35-37°C в синтетической питательной среде для культивирования клеток (например, ДМЕМ, MEM, RPMI-1640, F12 и т.п.) [Введение в методы культуры клеток, биоинженерии органов и тканей / Под ред. В.В. Новицкого, В.П. Шахова, И.А. Хлусова. - Томск: STT, 2004. - 386 с - С. 37-40; С. 141-143; с. 297-300].
3) экспериментальному животному вводят трансплантат в виде матрикса-носителя, предварительно насыщенного клетками костного мозга, либо в виде матрикса-носителя, подкожно (внутримышечно), любыми из известных малотравматичных способов (троакар, малый разрез) под местным или системным обезболиванием.
Предлагаемый способ основан на анализе результатов экспериментальных исследований. Сущность способа иллюстрируется следующими примерами.
Пример 1
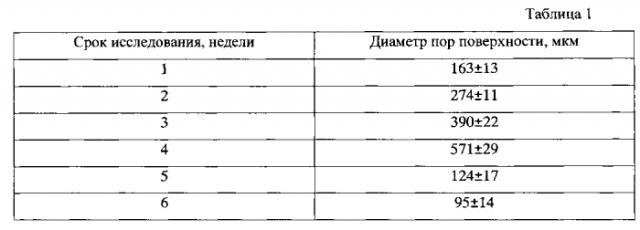
Изготавливали трансплантат - параллелепипеды с линейным размером (5×5×1 мм3), прессовали из порошка формовым способом при давлении 130 килограммов силы на 1 квадратный сантиметр, отжигали при 600°C. Фазовый состав исходного порошка соответствовал формуле гидроксилапатита Са10(PO4)6(ОН)2 с карбоксильными группами. Для получения в параллелепипедах пор различного диаметра (в диапазоне 150-600 мкм) применяли частицы гидроксилапатита соответствующего линейного размера. Объемная пористость материала составила 50-70%. [Karlov A.V., Khlusov I.A. Mikrostrukturische charakteristiken der poren, die osteoinduktiven eigenschaften der kalziumphosphatkeramik bilden // Biomedizinische Technik. - 2000. - Band 45. - Erganzungsband 1. - Р. 123-124]. Пористые образцы состояли из фосфатов кальция, преимущественно, гидроксилапатита и трикальцийфосфата, с примесью карбоксильных групп, натрия и хлора, что соответствует природным минералам костной ткани. В Таблице 1 представлены данные о распределении кальцийфосфатных образцов с различным линейным размером пор в динамике эксперимента, М±m, где М - среднее значение, m - ошибка среднего.
Мышам линии CBA/CaLac под эфирным наркозом подкожно, через срединный разрез кожи, вводили по 1 трансплантату в форме параллелепипеда. До введения животным в поры подложек вносили в асептических условиях взвесь сингенного костного мозга, выделенного из бедренной (берцовой) кости мышей по известной методике [Шахов В.П., Хлусов И.А., Дамбаев Г.Ц., Зайцев К.В., Егорова А.Б., Шахова С.С., Загребин Л.В., Волгушев С.А. Введение в методы культуры клеток, биоинженерии органов и тканей / Под ред. В.В. Новицкого, В.П. Шахова, И.А. Хлусова. - Томск: STT, 2004. - 386 с. - С. 141-143]. Костный мозг служил источником стволовых клеток и ростовых факторов. Для адгезии клеток подложки перед введением животным культивировали в течение 45 мин в культуральной среде DMEM/F12 в асептических условиях.
Использовали по 5 мышей в контрольной и подопытной группах в каждой точке эксперимента. Ложнооперированную группу составили 8 животных.
Через 1-6 недель животных умерщвляли эфирным наркозом, трансплантаты в форме параллелепипедов извлекали. Забирали часть печени для гистологического анализа методом световой микроскопии тонких (толщина менее 10 мкм) срезов. Трансплантаты фиксировали в 10% нейтральном формалине, декальцинировали, затем трансплантаты и части печени заливали парафином и выполняли тонкие (10 мкм) срезы перпендикулярно поверхности трансплантатов, окрашивали гематоксилином-эозином по стандартной методике. Результаты выражали как среднее значение и ошибка среднего (М±m) или как медиана (Me), первый (Q1) и третий квартили (Q3).
В гистологических срезах трансплантатов отмечали рост костного мозга и/или кости (Фиг. 2). Срезы печени фотографировали с разрешением 8 мегапикселей. Количественную оценку регенераторных процессов проводили при помощи компьютерной морфометрии срезов печени на 10 цифровых микрофотографиях различных полей зрения [Автандилов Г.Г. Диагностическая медицинская плоидометрия. М.: Медицина, 2006. - 192 с]. Считали процент двуядерных гепатоцитов от общего количества печеночных клеток в поле зрения.
Результаты показали, что при подкожном введении трансплантатов в порах кальцийфосфатного матрикса даже без предварительно нанесенного костного мозга отмечалось развитие васкуляризированной соединительной ткани, к которой примыкают участки мышечной ткани (фиг. 2а). В пористом материале, засеянном костным мозгом ех vivo, в порах вырастают участки грубоволокнистой кости с лакунами, заполненными красным костным мозгом (фиг. 2б).
Изучение регенераторной активности печени (фиг. 3, на котором показан процент двуядерных гепатоцитов в печени мышей в динамике регенерации после имплантации пористого кальцийфосфатного материала (контроль), несущего костный мозг (опыт)) показало, что введение кальцийфосфатного пористого матрикса без костного мозга (контроль) вызывало статистически значимое (Р<0,05 согласно t-критерию Стьюдента) увеличение (до 128-178% от исходного уровня) показателя на 1-4-й неделях после операции (в интервале диаметра пор материала 150-600 мкм). Добавление костного мозга (опыт) приводило к повышенному уровню (до 127-203% от исходного, Р<0,05 согласно t-критерию Стьюдента) двуядерных гепатоцитов на протяжении всех 6 недель исследования (Р<0,05 согласно Т-критерию Вилкоксона) в сравнении как с исходным значением, так и показателями у контрольных мышей.
Таким образом, на фоне ложнооперированных животных, малоинвазивное подкожное введение трансплантатов, выполненных из пористых кальцийфосфатных матриксов с диаметром пор в диапазоне 150-600 мкм, вызывает отдаленное (дистантное) регуляторное воздействие на печень реципиента, приводящее к длительной стимуляции регенерации гепатоцитов, одним из механизмов которой может быть регенерация капиллярного русла не только в месте имплантации, но и в ткани печени. Также, предварительно нанесенный костный мозг донора усиливает и пролонгирует местные регенераторные процессы, что приводит к формированию на матриксах системы "кость/костный мозг" с характерным для данных тканей богатым кровоснабжением. При этом значительно возрастает, по амплитуде и продолжительности действия, дистантный стимулирующий эффект на регенерацию гепатоцитов.
Для проверки работы указанных в прототипе полимерных материалов-носителей (полилактиды, широко распространенные в медицинской имплантационной практике) в условиях подкожной имплантации, был проведен эксперимент, описанный в примере 2.
Пример 2
Применили полилактидные матриксы (PLA) с линейными размерами 15×15 мм и толщиной не более 1 мм, с сопоставимой пористостью, приготовленные согласно [Tverdokhlebov S.I., Stankevich К.S., Bolbasov Е.N., Khlusov I.А., Kulagina I.V., Zaytsev К.V. Nonwoven Polylactide Scaffolds Obtained by Solution Blow Spinning and the In Vitro Degradation Dynamics // Advanced Materials Research. - 2014 - Vol. 872. - p. 257-263]. В каждой группе было по 9 матриксов. Экспериментальное исследование in vivo выполнено на 27 половозрелых белых крысах-самцах породы Wistar массой 200 г, содержащихся в стандартных условиях вивария. Под эфирным наркозом крысам вводили по 1 трансплантату, выполненному из полимера (PLA), подкожно, в область живота, через кожный разрез по аналогичной схеме, как описано нами в примере 1. В качестве контроля служила группа (9 животных) ложнооперированных крыс, которым выполняли срединный разрез кожи без введения подложек (Таблица 2 - Количество двуядерных гепатоцитов у крыс Wistar через 60 дней после подкожной имплантации полимерных подложек из полимолочной кислоты (PLA-контроль) с костным мозгом (PLA-опыт), Me (Q1-Q3) Примечание: n - число просчитанных полей зрения при компьютерной морфометрии).
В конце опыта (60 дней после введения трансплантатов) крыс выводили из эксперимента под эфирным наркозом. Подготовку препаратов печени и их количественную морфометрию выполняли, как представлено в примере 1. Считали число двуядерных гепатоцитов в поле зрения.
Результаты показали, что подкожная имплантация трансплантатов из полимолочной кислоты как с костным мозгом, так и без него, не вызвала видимых морфологических изменений со стороны печени, связанных с деструктивными процессами. В то же время, количество двуядерных гепатоцитов в контрольной и подопытной группах также статистически значимо не возрастало (табл. 2).
Итак, при подкожном введении именно трансплантаты, выполненные в виде пористого кальцийфосфатного матрикса, несущие предварительно нанесенный костный мозг (или без такового), способствуют дистантной, продолжительной стимуляции регенерации гепатоцитов в печени реципиента.
Продолжительность регенераторного эффекта 1 процедуры введения трансплантата, выполненного из кальцийфосфатного материала, от 4-х до 6-и недель у мышей при пересчете через среднюю продолжительность жизни (70 лет у людей и 2-3 года у мышей) может составить до 210 недель у человека. При этом достигается универсальность, экономичность и удобство пользования.
Предлагаемый способ обладает малой инвазивностью, создает адекватные условия для врастания кровеносных сосудов за счет строения трансплантата, технических параметров его структуры, что пролонгирует адекватные условия жизнеобеспечения подсаженных клеток; условия для пролиферации, дифференцировки и созревания стромальных и кроветворных клеток костного мозга, формирования костной и кроветворной тканей.
Использование аутологичных (сингенных) клеток взрослых доноров предупреждает нежелательную активацию иммунной системы, позволяет этой системе оказывать в организме длительное биорегуляторное воздействие. В предлагаемом изобретении не используются ткани и/или клеточный материал эмбрионов человека.
Использование костного мозга, который в процессе ремоделирования и репаративной регенерации (на матриксе остаются донорские стромальные клетки, стволовые кроветворные клетки реципиента через врастающие кровеносные сосуды постепенно замещают погибающие кроветворные клетки пересаженного костного мозга) способствует установлению системы прямых и обратных связей с организмом хозяина, за счет чего регенерация гепатоцитов становится контролируемой.
Выбор костного мозга определялся следующими фактами:
- высоким содержанием стволовых клеток;
- устойчивостью к гипоксии, способностью клеток выживать до момента врастания кровеносных сосудов в трансплантат;
- высокой активностью регенераторных процессов (быстро пролиферирующая клеточная система) и способностью к ремоделированию. Проведенные нами предварительные эксперименты показали, что на аналогичном матриксе клетки печени, в отличие от костного мозга, не выживают при подкожном введении (фиг. 1);
- активной секрецией многочисленных биологически активных веществ и цитокинов, стимулирующих регенерацию различных клеток, включая гепатоциты (описано выше).
Выбор подложки (матрикса) определяется следующими фактами
- биосовместимостью, так как фосфаты кальция аналогичны таковым в костной ткани;
- многофункциональностью (выполняет одновременно функции матрикса и стимулирует регенерацию костного мозга);
- достаточной механической прочностью для подкожного применения;
- пористой структурой, обеспечивающей неоваскуляризацию структуры имплантата, способствующей врастанию клеток в поры материала ("in-growth"), защищающей клетки от механического повреждения и смывания с материала, активирующей их регенерацию;
- возможностью стерилизации стандартными способами без изменения медико-технических свойств материала;
- способностью к постепенной биодеградации;
- фосфаты кальция разрешены к клиническому применению.
Также, предлагаемый способ можно осуществлять с помощью троакаров различного диаметра для подкожного (внутримышечного) введения трансплантатов, позволяющих легко применять разработанный способ в клинической практике, поскольку троакаром владеет большинство хирургов и травматологов, что расширяет область применения, снижает риск возможных осложнений, повышает удобство пользования и сокращает затраты.
Предлагаемый способ обладает малой инвазивностью, создает адекватные условия для врастания кровеносных сосудов за счет строения трансплантата, технических параметров его структуры, что пролонгирует адекватные условия жизнеобеспечения подсаженных клеток; условия для пролиферации, дифференцировки и созревания стромальных и кроветворных клеток костного мозга, формирования костной и кроветворной тканей.
Таким образом, предлагаемый способ является перспективным для внедрения в клиническую практику.
Приложение
Фиг. 1 Замещение гепатоцитов донора на кальцийфосфатном матриксе соединительной и жировой тканями через 45 суток после подкожного введения. Окраска гематоксилин-эозин. Увеличение 100.
Фиг 2 - Рост соединительной ткани (а), кости и костного мозга (б) в порах трансплантатов. Здесь: 1 - искусственный материал; 2 - соединительная ткань; 3 - костная ткань с костным мозгом; 4 - мышечная ткань. Окраска гематоксилин-эозин. Увеличение 100.
Фиг 3 - Процент двуядерных гепатоцитов в печени мышей в динамике регенерации после имплантации пористого кальцийфосфатного матрикса материала (контроль), несущего костный мозг (опыт).
Таблица 1 - Распределение кальцийфосфатных матриксов с различным линейным размером пор в динамике эксперимента, М±m
Таблица 2 - Количество двуядерных гепатоцитов у крыс Wistar через 60 дней после подкожной имплантации полимерных подложек из полимолочной кислоты (PLA-контроль) с костным мозгом (PLA-опыт), Me (Q1-Q3)
1. Способ дистантной стимуляции регенерации гепатоцитов в эксперименте, отличающийся тем, что животному вводят подкожно или внутримышечно трансплантат в виде кальцийфосфатного матрикса, обладающий пористой структурой с диаметром пор в диапазоне 150-600 мкм, либо в виде указанного матрикса с предварительно нанесенным сингенным костным мозгом.
2. Способ по п. 1, отличающийся тем, что вводят трансплантат, выполненный в виде параллелепипеда или цилиндра.