Трициклические пирроло производные, способ их получения и их применение в качестве ингибиторов киназы
Иллюстрации
Показать всеНастоящее изобретение относится к новым трициклическим производным пиррола формулы (I) или их фармацевтически приемлемым солям, которые модулируют активность протеинкиназ, выбранных из MPS1, PIM-1 и PIM-2. Соединения могут применяться при лечении заболеваний, вызванных нарушением регуляции протеинкиназной активности. Такие заболевания могут быть выбраны из рака яичников, рака молочной железы, меланомы, рака ободочной кишки, лейкемии, рака поджелудочной железы и миеломы. В формуле (I)
,
где R1 обозначает водород, прямой или разветвленный C1-C6алкил, или арил, выбранный из фенила, содержащего заместители, выбранные из атомов галогена, C1-C6алкокси, C1-C6алкила, диС1-C6алкиламино, 6-членный гетероциклил, содержащий один или два атома азота в цикле, и необязательно замещенный в свою очередь C1-C6алкилом, 5-членный гетероциклил, содержащий один атом азота, ди(C1-C6алкил)амино, [ди(C1-C6алкил)аминоС1-C6алкил](C1-C6алкил)амино, гидроксиС1-C6алкил; R2 обозначает группу -NR″R′″, где R″ и R′″ оба обозначают водород или прямой или разветвленный C1-C6 алкил, или один из R″ и R′″ обозначает водород, а другой выбирают из C1-С6алкила, замещенного фенилом и 2,3-диоксо-1,3-дигидро-2Н-изоиндол-2-илом; и арила, представляющего собой фенил, замещенный C1-С6алкилом и С1-С6алкокси; R3 выбирают из водорода; прямого или разветвленного C1-C6алкила, необязательно замещенного амино; гидроксиС1-C6алкила; C1-C6алкоксиС1-C6алкила; 6-7-членного гетероциклила, содержащего атом азота в качестве гетероатома и необязательно замещенного C1-C6алкоксикарбонилом; и C3-C6циклоалкила, необязательно замещенного амино; R4 обозначает водород или прямой или разветвленный C1-C6алкил; X обозначает группу, выбранную из -NR′- и -S-, где R′ обозначает водород; А обозначает группу, выбранную из -(CH2)3-, -(CH2)2- и -CH=CH-. Изобретение также описывает способ получения соединений. 6 н. и 2 з.п. ф-лы, 4 табл., 32 пр.
Реферат
Настоящее изобретение относится к трициклическим производным пиррола, к способу их получения, к фармацевтическим композициям, содержащим их, и к их применению в качестве терапевтических средств, в частности, при лечении рака и расстройств, связанных с клеточной пролиферацией.
Поэтому соединения по изобретению могут применяться при лечении заболеваний, вызванных нарушениями регуляции активности протеинкиназы. Настоящее изобретение также относится к способам получения этих соединений, фармацевтическим композициям, содержащим эти соединения, и к способам лечения заболеваний с использованием фармацевтических композиций, содержащих эти соединения.
Нарушение функции протеинкиназ (PK) является «краеугольным камнем» многочисленных заболеваний. Большой вклад онкогенов и протоонкогенов, вовлеченных в патологические процессы при злокачественных заболеваниях у людей, связан с кодированием PK. Повышенная активность PK также задействована при многих не злокачественных заболеваниях, таких как доброкачественная гиперплазия предстательной железы, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация сосудистых гладкомышечных клеток, связанная с атеросклерозом, легочный фиброз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз.
PK также задействованы при воспалительных состояниях и в размножении вирусов и паразитов. PK могут также играть основную роль в патогенезе и развитии нейродегенеративных расстройств.
Общую ссылку на нарушение функций или нарушение регуляции PK можно найти, например, в публикациях Chemical Biology 1999, 3, 459-465 и Carcinogenesis 2008, 29, 1087-1091.
Применение митотических ингибиторов при лечении рака является широко принятой клинической стратегией для лечения широкого диапазона злокачественных заболеваний людей. Таксаны (паклитаксел и доцетаксел) и алкалоиды винки (винкристин и винбластин) оказывают действие или стабилизацией, или дестабилизацией микротрубочек с катастрофическими последствиями для клеток, проходящих стадии митоза. Они представляют собой терапевтические средства первой линии по поводу нескольких типов опухолей и второй линии при устойчивом к цисплатину раке яичников, молочных желез, легких, мочевого пузыря и пищевода (таксаны). Однако ввиду роли микротрубочек в таких процессах, как движение клеток, фагоцитоз и аксональный транспорт, при применении этих средств часто наблюдаются определенные виды токсичности, такие как периферическая нейропатия. Прохождение стадий митоза является требованием всех пролиферирующих клеток, и, следовательно, способы лечения рака, имеющие мишени в митозе, в целом могут применяться при широком диапазоне типов опухолей.
Несколько протеинкиназ играют ключевые роли в координации клеточного цикла, и некоторые из них уже применяются в способах прицельной терапии в онкологии, включая Cdk-2 и Aurora-A. Точность воспроизведения митоза имеет первостепенное значение, и в нормальных клетках существуют несколько «контрольных пунктов» для поддержании целостности хромосом во время клеточного цикла. Контрольный пункт сборки веретена (SAC), в частности, требуется для должной хромосомной сегрегации в две дочерние клетки после клеточного деления. Он обеспечивает то, что сестринские хроматиды, совмещенные в метафазной пластинке, не разделяются перед биполярным прикреплением всех удвоенных хромосом к митотическому веретену (Обзор см. в публикации Musacchio A. and Salmon D. Nat Rev Mol Cell Biol, May; 8(5): 379-93, 2007).
Даже одна не совмещенная хромосома достаточна для запуска сигнала SAC, это жестко регулируемый путь, который в конечном счете приводит к ингибированию опосредованного стимулирующим анафазу комплексом/цитохромом (APC/C) полиубиквитилирования и разрушению двух ключевых митотических компонентов: циклина B1 и секурина. Секурин, в частности, требуется для получения разделения сестринских хроматид и перехода в анафазу, а вместо этого, циклин B1 инактивирует основную митотическую киназу CDK1, стимулируя выход из митоза. (Обзор см. в публикации Musacchio A. and Salmon D. Nat Rev Mol Cell Biol, May; 8(5): 379-93, 2007).
Уже была идентифицирована большая группа белков, играющих роль в функциях SAC: человеческая MPS1-киназа (монополярная веретенная 1) (также известная как TTK) действительно играет основную роль. MPS1 представляет собой двойную тирозин и серин/треонинкиназу, высоко сохранную от дрожжей до млекопитающих. Человеческий геном кодирует лишь один член семейства генов MPS1, который не имеет высокого подобия последовательностей с другими протеинкиназами.
MPS1 представляет собой фермент, регулирующий клеточный цикл, который подвергается стимулирующей регуляции и активации при митозе после фосфорилирования (Stucke V.M., et al., Embo J. 21 (7): 1723, 2002).
У Saccharomyces cerevisiae MPS1 регулирует дупликацию тела полюса веретена (Winey M. et al., J. Cell Biol 114: 745, 1991), сборку челнока (Jones, M.H. et al., Curr. Biol. 15: 160, 2005) и контрольный пункт сборки веретена (Weiss and Winey, J. Cell. Biol 132: 111, 1996). Вместо этого, у высших эукариот активность киназы MPS1 главным образом вовлечена в регуляцию и функции SAC (Jelluma, N. et al., Cell 132: 233, 2008).
Эксперименты интерференции РНК указывают на то, что в отсутствие MPS1 функции SAC нарушены: длительность митоза уменьшается, и клетки быстро делятся без совмещения метафазной пластинки, что, в конечном счете, вызывает аберрантную анеуплоидизацию, митотическую катастрофу и больше несовместимо с клеточным выживанием (Jelluma N. et al., Cell 132: 233, 2008; Tighe A. et al., J Cell Biol 2008; Jelluma N. et al., Plos ONE 3(6): e2415, 2008). Кроме того, для подтверждения этих результатов, был описан мелкомолекулярный АТФ-конкурентный ингибитор MPS1, и, несмотря на его не чистый профиль селективности, было показано, что он способен инактивировать функции SAC, инактивировать опосредованную нокодазолом и таксолом остановку митоза и стимулировать гибель клеток главным образом в линиях туморигенных клеток (Schmidt et al., EMBO Rep, 6(9): 866, 2005).
Несмотря на то, что большинство опухолей являются анеуплоидными, при раке никогда не обнаруживали мутированный MPS1, вместо этого была обнаружена его стимулирующая регуляция при ряде опухолей различных происхождений, подобных раку мочевого пузыря, анапластической щитовидной железы, молочных желез и предстательной железы (Yuan B. et al., Clin Cancer Res, 12(4): 1121, 2006). Кроме того, он был обнаружен в характерных признаках верхних 25 генов при CIN (внутриэпителиальной неоплазии шейки матки) и при анеуплоидных опухолях, что прогнозирует клинический исход при раке молочных желез и легких, медуллобластоме, глиоме, мезотелиоме и лимфоме (Carter S.L. et al., Nat Genet. 38(9): 1043, 2006). Наконец, его уровень очень повышен при метастатических опухолях, и была обнаружена его сверхэкспрессия при раковых опухолях молочных желез с мутированным p53 (Bertheau P. et al., Plos Med 4(3): e90, 2007).
Вместе с тем фактом, что была обнаружена стимулирующая регуляция других компонентов SAC, подобных MAD2, BUBR1 или BUB1, при различных опухолях (deCarcer G. et al., Curr Med Chem 14(9): 969, 2007), представляется, что функции SAC могут требоваться и являются существенными для поддержания способности сегрегироваться опухолевых клеток с высокой частотой анеуплоидии, и опухолевая селективность ингибиторов SAC предвидится, в частности, для опухолей с высокой частотой анеуплоидии, подобных карциномам ободочной кишки, легких и молочных желез (Kops G.J. et al., Nat. Rev Cancer, 5: 773, 2005).
Наконец, было показано, что индукция массивной анеуплоидии и нарушение регуляции SAC снижают канцерогенез у склонных к образованию опухолей мышей, подтверждая гипотезу, что ингибирование SAC может обеспечивать ингибирование роста опухоли (Weaver et al., Cancer Cell 11(1): 25, 2007). Таким образом, по этим причинам фармакологическое ослабление функции MPS1 может оказывать благоприятное терапевтическое воздействие при лечении нескольких разнообразных видов рака.
Первоначально идентифицированные в качестве активированных генов провирусным мутагенезом на мышиной модели лимфомы, PIM (PIM1, PIM2 и/или PIM-3 по всей настоящей заявке) представляют собой протеин-серин/треонинкиназы. PIM-киназы слабо экспрессированы в нормальных тканях и сверхэкспрессированы или даже мутированы при дискретном числе различных видов рака у людей, включая лимфому, лейкоз, рак предстательной железы и рак желудка [Shah et al. Eur. J. Cancer, 44, 2144-51, (2008)].
PIM-киназы являются конститутивно активными, и их активность поддерживает рост и выживание опухолевых клеток in vitro и in vivo посредством модификации увеличивающегося числа обычных, а также специфических по изоформе субстратов, включая несколько регуляторов клеточного цикла и медиаторы апоптоза. Представляется, что PIM1, но не PIM2, также опосредует хоминг и миграцию нормальных и злокачественных гематопоэтических клеток регуляцией поверхностной экспрессии хемокиновых рецепторов [Brault et al. Haematologica 95: 1004-1015 (2010)].
Имеется все больше доказательств того, что PIM1 и PIM2 киназы могут быть вовлечены в опосредование онкогенных эффектов некоторых онкогенов, связанных с острыми миелогенными лейкозами (AML). В частности, онкогенной роли FLT3-мутаций (мутаций ITD и KD, присутствующих при 30% случаев AML) и/или транслокаций, вовлекающих ген MLL (встречающийся в 20% случаев AML), [Kumar, et al. J. Mol. Biol. 348, 183-193, (2005)]. PIM1 больше экспрессирован в FLT3-ITD-трансформированных клетках AML, чем в клетках WT костного мозга. Данные свидетельствуют о том, что ингибирование PIM1, а также PIM2, может опосредовать FLT3ITD-зависимую гибель клеток AML. Представляет интерес, что клетки, трансформированные мутациями FLT3, которые придают устойчивость к ингибиторам мелкомолекулярной тирозинкиназы, все еще были чувствительны к нокауту PIM2 или PIM-1 и PIM-2 РНКи, [Kim et al., Blood 105, 1759-67, (2005)].
Кроме того, сообщалось, что PIM2 сверхэкспрессирован и связан с прогрессированием нескольких злокачественных заболеваний, которые происходят из B-клеточной линии дифференциации, таких как хронический лимфоцитарный лейкоз (CLL), диффузная B-крупноклеточная лимфома (DLBCL), мантийноклеточная лимфома (MCL) или миелома [Cohen et al. Leuk. Lymphoma 94 51 (2004), Huttmann et al. Leukemia 20 1774 (2006)].
Представляет интерес, что PIM AKT/PKB, как представляется, играют частично чрезмерные роли в опосредовании роста и выживания гематопоэтических клеток, наиболее вероятно, вследствие перекрывающих субстратов, подобных BAD, p21WAF1/CIP1, p27KIP1 или Cot/Tpl-2 [Choudhary et al., Mol Cell. 36: 326-39 (2009)].
Было показано, что PIM-киназы регулируют ингибирование резистентности (рапамицин), пролиферации и выживания mTOR. Поэтому, комбинация мелкомолекулярных ингибиторов, мишенью которых являются несколько киназ выживания, может быть существенна для мощной терапевтической платформы при раке [Amaravadi R., et al. J. Clin. Invect. 2005, 115(10): 2618-24]. Представляется, что синтез онкогенного белка посредством белка 1 (4E-BP1), связывающего elF4E, является независимым от mTOR и регулируемым PIM-2. Эти наблюдения свидетельствуют о том, что комплекс, инициирующий онкогенную трансформацию elF4F, может блокироваться мелкомолекулярными ингибиторами PIM-2 [Tamburini J. et al. Blood 2009, 114(8), 1718-27 и Brault L. et al. Haematologica 2010, 95(6) 1004-1015].
Производные тетрагидробензоциклогептена, известные в данной области в качестве иммуносупрессивных средств и средств для лечения и предотвращения воспалительных состояний, аллергических расстройств и иммунных расстройств, описаны в заявке на международный патент WO2009/089305. Производные тетрагидробензоциклогептена, известные в данной области в качестве ингибиторов протеинкиназы, описаны в заявке на международный патент WO2005/037843.
Производные трициклициндола, обладающие ингибирующей киназу активностью, были описаны в заявке на международный патент WO2008/065054, поданной от имени самого заявителя настоящего изобретения; некоторые определенные соединения указанной выше заявки на международный патент WO2008/065054 исключены из общей формулы по настоящему изобретению.
Несмотря на эти разработки, все еще сохраняется потребность в эффективных средствах для лечения указанных заболеваний.
Заявители в настоящее время обнаружили, что соединения формулы (I), описанные ниже, являются ингибиторами киназы и, таким образом, могут применяться при лечении в качестве противоопухолевых средств, и лишены, с точки зрения и токсичности, и побочных эффектов, указанных выше недостатков, связанных с применением имеющихся в настоящее время противоопухолевых средств.
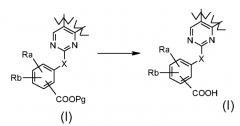
Соответственно, первой целью настоящего изобретения является получение замещенного трициклического соединения формулы (I):
,
где
R1 обозначает водород, галоген или необязательно замещенную группу, выбранную из амино, прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила;
R2 обозначает группу, выбранную из -NR"R"', -N(OR"')R" и OR", где R" и R'" обозначают, каждый независимо, водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила, или вместе с атомом азота, с которым они связаны, R" и R'" могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный среди N, O и S;
R3 обозначает водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила;
R4 обозначает водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила;
X обозначает одиночную связь или двухвалентный радикал, выбранный из -NR'-, -CONR'-, -NH-CO-NH-, -O-, -S-, -SO2- и -OSO2-, где R' обозначает водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила, или вместе с атомом азота, с которым они связаны, R1 и R' могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный среди N, O и S;
A обозначает группу, выбранную из -CH2-, -(CH2)2-, -(CH2)3-, -CH=CH-, -C(CH3)2-CH2- и -CH2-C(CH3)2;
или его фармацевтически приемлемой соли,
при условии, что исключены следующие соединения:
этил-2-амино-9-метил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксилат,
2-амино-9-метил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоновая кислота,
2-амино-9-метил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
этил-2-амино-8-фенил-9H-пирроло[3,2-h]хиназолин-7-карбоксилат,
2-амино-8-фенил-9H-пирроло[3,2-h]хиназолин-7-карбоксамид,
2-амино-9-метил-8-фенил-9H-пирроло[3,2-h]хиназолин-7-карбоксамид и
2-амино-9-метил-8-фенил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид.
Настоящее изобретение также относится к способам синтеза замещенного трициклического соединения, представленного формулой (I), полученного посредством способа, состоящего из стандартных синтетических трансформаций, и изомеров, таутомеров, гидратов, сольватов, комплексов, метаболитов, пролекарств, носителей, N-оксидов.
Настоящее изобретение также относится к способу лечения заболеваний, вызванных и/или связанных с нарушенной регуляцией активности протеинкиназы, в частности, ABL, ACK1, AKT1, ALK, AUR1, AUR2, BRK, BUB1, CDC7/DBF4, CDK2/CYCA, CHK1, CK2, EEF2K, EGFR1, EphA2, EphB4, ERK2, FAK, FGFR1, FLT3, GSK3бета, Haspin, IGFR1, IKK2, IR, JAK1, JAK2, JAK3, KIT, LCK, LYN, MAPKAPK2, MELK, MET, MNK2, MPS1, MST4, NEK6, NIM1, P38альфа, PAK4, PDGFR, PDK1, PERK, PIM1, PIM2, PIM3, РКАальфа, РКСбета, PLK1, RET, ROS1, SULU1, Syk, TLK2, TRKA, TYK, VEGFR2, VEGFR3, ZAP70, конкретнее, MPS1, PIM1, PIM2, PIM3.
Предпочтительный способ по настоящему изобретению представляет собой лечение заболевания, вызванного и/или связанного с нарушением регуляции активности протеинкиназы, выбранного из группы, состоящей из рака, клеточных пролиферативных расстройств, вирусных инфекций, аутоиммунных и нейродегенеративных расстройств.
Другой предпочтительный способ по настоящему изобретению относится к лечению определенных типов рака, включая без ограничения: карциному, такую как карцинома мочевого пузыря, молочных желез, ободочной кишки, почек, печени, легких, включая мелкоклеточный рак легких, пищевода, желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы, предстательной железы и кожи, включая плоскоклеточную карциному; гематопоэтические опухоли лимфоидной линии дифференциации, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластический лейкоз, B-клеточную лимфому, T-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, волосатоклеточную лимфому и лимфому Буркетта; гематопоэтические опухоли миелоидной линии дифференцировки, включая острый и хронический миелогенные лейкозы, миелодиспластический синдром и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванному; другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, пигментозную ксеродермию, кератоксантому, фолликулярный рак щитовидной железы, саркому Капоши и мезотелиому, опухоли с высокой частотой анеуплоидии и опухоли, которые сверхэкспрессируют митотический контрольный пункт.
Другой предпочтительный способ по настоящему изобретению относится к лечению определенных клеточных пролиферативных расстройств, таких как, например, доброкачественная гиперплазия предстательной железы, семейный аденоматозный полипоз, нейрофиброматоз, псориаз, пролиферация сосудистых гладкомышечных клеток, связанная с атеросклерозом, легочный фиброз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз.
Другой предпочтительный способ по настоящему изобретению относится к лечению заболеваний и расстройств, связанных с иммунными клетками, таких как воспалительные и аутоиммунные заболевания, например, рассеянный склероз, системная красная волчанка, воспалительные кишечные заболевания (IBD), болезнь Крона, синдром раздраженного кишечника, панкреатит, язвенный колит, дивертикулез, генерализованная миастения, васкулит, псориаз, склеродермия, астма, аллергия, системный склероз, витилиго, артрит, такой как остеоартрит, ювенильный ревматоидный артрит, анкилозирующий спондилит.
Другой предпочтительный способ по настоящему изобретению относится к лечению вирусных инфекций, в частности, предотвращению развития СПИДа у индивидов, инфицированных ВИЧ.
Другой предпочтительный способ по настоящему изобретению относится к лечению нейродегенеративных расстройств, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона.
Кроме того, способ по настоящему изобретению также относится к ингибированию ангиогенеза и метастазирования опухолей, а также к лечению отторжения трансплантированных органов и болезни хозяин против трансплантата.
Настоящее изобретение также относится к фармацевтической композиции, содержащей одно или более соединений формулы (I) или их фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей соединение формулы (I), в комбинации с известными противораковыми способами лечения, такими как лучевая терапия или схема химиотерапии, в комбинации с цитостатическими или цитотоксическими средствами, средствами типа антибиотиков, алкилирующими средствами, антиметаболитными средствами, гормональными средствами, иммунологическими средствами, средствами типа интерферона, ингибиторами циклооксигеназы (например, ингибиторами COX-2), ингибиторами матричной металлопротеазы, ингибиторами теломеразы, ингибиторами тирозинкиназы, средствами против рецепторов фактора роста, средствами против HER, средствами против EGFR (рецепторов эндотелиального фактора роста), средствами против ангиогенеза (например, ингибиторов ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами пути передачи сигналов ras-raf, ингибиторами клеточного цикла, другими ингибиторами cdks, средствами, связывающими тубулин, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и тому подобными.
Настоящее изобретение, кроме того, относится к способу ингибирования активности протеинкиназы in vitro, который включает обеспечение контакта киназы с эффективным количеством соединения формулы (I), как определено выше.
Кроме того, изобретение относится к продукту или набору, включающему соединение формулы (I) или его фармацевтически приемлемую соль, как определено выше, или его фармацевтические композиции и одно или более химиотерапевтических средств, в качестве комбинированного препарата для одновременного, отдельного или последовательного применения при лечении злокачественных заболеваний.
В другом аспекте изобретение относится к соединению формулы I) или его фармацевтически приемлемой соли, как определено выше, для применения в качестве лекарственного препарата.
Кроме того, изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше, при получении лекарственного препарата с противораковой активностью.
Наконец, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, как определено выше, для применения в способе лечения рака.
Пока нет иных определений, при ссылке на сами соединения формулы (I), а также любую их фармацевтическую композицию или любое терапевтическое лечение, включающее их, настоящее изобретение включает все из гидратов, сольватов, комплексов, метаболитов, пролекарств, носителей, N-оксидов и фармацевтически приемлемых солей соединений по настоящему изобретению.
Другими словами, в случае возможного легкого получения из соединений формулы (I), как определено выше, их изомеры, таутомеры, гидраты, сольваты, комплексы, метаболиты, пролекарства, носители и N-оксиды являются целью настоящего изобретения.
Метаболит соединения формулы (I) представляет собой любое соединение, в которое именно это соединение формулы (I) превращается in vivo, например, после введения нуждающемуся в нем млекопитающему. Обычно, однако без представления ограничивающего примера, после введения соединения формулы (I), указанное производное может быть превращено в разнообразные соединения, например, включая более растворимые производные, подобные гидроксилированным производным, которые легко выделяются. Следовательно, в зависимости от конкретного метаболического пути, любые из этих гидроксилированных производных могут расцениваться как метаболит соединения формулы (I).
Пролекарства представляют собой любые ковалентно связанные соединения, которые высвобождают in vivo активное материнское лекарственное средство в соответствии с формулой (I).
N-оксиды представляют собой соединения формулы (I), где азот и кислород связаны посредством дативной связи.
Если стереогенный центр или другая форма изомерного центра присутствует в соединении по настоящему изобретению, то подразумевается, что настоящее изобретение охватывает все формы такого изомера или изомеров, включая энантиомеры и диастереомеры. Соединения, содержащие стереогенный центр, могут применяться в виде рацемической смеси, энантиомерно обогащенной смеси, или рацемическая смесь может быть разделена с использованием хорошо известных технологий, и отдельный энантиомер может применяться отдельно. В случаях, при которых соединения имеют ненасыщенные межуглеродные двойные связи, и цис (Z), и транс (E) изомеры входят в объем настоящего изобретения.
В случаях, когда соединения могут существовать в таутомерных формах, таких как кето-енольные таутомеры, каждая таутомерная форма предусматривается как включенная в настоящее изобретение, существуя или в равновесии, или преимущественно в одной форме.
Термин «арил» включает карбоциклические или гетероциклические углеводороды с 1-2 кольцевыми составляющими, или конденсированными, или связанными друг с другом одиночными связями, причем по меньшей мере одно из колец является ароматическим; в случае присутствия, любой ароматический гетероциклический углеводород, также именуемый гетероарильной группой, содержит 5-6-членное кольцо с 1-3 гетероатомами, выбранными из N, O и S.
Примерами арильных групп в соответствии с изобретением являются, например, фенил, бифенил, α- или β-нафтил, дигидронафтил, тиенил, бензотиенил, фурил, бензофуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, триазолил и тому подобные.
Под термином «гетероциклил» (также известном как «гетероциклоалкил») подразумевается 3-7-членное, насыщенное или частично ненасыщенное карбоциклическое кольцо, где один или более атомов углерода заменены гетоатомами, такими как азот, кислород или сера. Неограничивающими примерами гетероциклильных групп являются, например, пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диоксолан, пиперидин, пиперазин, морфолин и тому подобные.
Пока нет других указаний, под термином «C3-C7 циклоалкил» подразумевается 3-7-членное, полностью углеродное моноциклическое кольцо, которое может содержать одну или более двойных связей, но не имеет полностью конъюгированную π-электронную систему. Примерами циклоалкильных групп без ограничения являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексен, циклогексадиен, циклоептан, циклоептен, циклоептадиен.
Под термином «прямой или разветвленный C1-C6 алкил», следовательно, охватывающим C1-C4 алкил, подразумевается любая из групп, такая как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, н-гексил и тому подобные.
Под термином «прямой или разветвленный C2-C6 алкенил» подразумевается любая из групп, такая как, например, винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-пентенил, 1-гексенил и тому подобные.
Под термином «прямой или разветвленный C2-C6 алкинил» подразумевается любая из групп, такая как, например, этинил, 2-пропинил, 4-пентинил и тому подобные.
В соответствии с настоящим изобретением и пока нет иных указаний, любая из указанных выше групп R1, R2, R3, R4, R', R" и R'" может быть необязательно замещена в любом из их свободных положений одной или более группами, например 1-6 группами, независимо выбранными из атома галогена, нитро, оксогрупп (=О), циано, C1-C6 алкила, полифторированного алкила, полифторированной алкоксигруппы, алкенила, алкинила, гидроксиалкила, арила, арилалкила, гетероциклила, C3-C7 циклоалкила, гидрокси, алкокси, арилокси, гетероциклилокси, метилендиокси, алкилкарбонилокси, арилкарбонилокси, циклоалкенилокси, гетероциклилкарбонилокси, алкилиденаминоокси, карбокси, алкоксикарбонила, арилоксикарбонила, циклоалкилоксикарбонила, гетероциклилоксикарбонила, амино, уреидо, алкиламино, диалкиламино, ариламино, диариламино, гетероциклиламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, ариламинокарбонила, гетероциклиламинокарбонила, алкоксикарбониламино, гидроксиаминокарбонила, алкоксиимино, алкилсульфониламино, арилсульфониламино, гетероциклилсульфониламино, формила, алкилкарбонила, арилкарбонила, циклоалкилкарбонила, гетероциклилкарбонила, алкилсульфонила, арилсульфонила, аминосульфонила, алкиламиносульфонила, диалкиламиносульфонила, ариламиносульфонила, гетероциклиламиносульфонила, арилтио, алкилтио, фосфоната и алкилфосфоната.
В свою очередь, при целесообразности, каждый из указанных выше заместителей может быть дополнительно замещен одной или более из указанных выше групп.
В этом отношении, под термином «атом галогена» подразумевается атом фтора, хлора, брома или йода.
Под термином «циано» подразумевается остаток -CN.
Под термином «нитро» подразумевается группа -NO2.
Под термином «алкенил» или «алкинил» подразумевается любая из указанных выше прямых или разветвленных C2-C6 алкильных групп, дополнительно несущих двойную или тройную связь. Неограничивающими примерами алкенильных или алкинильных групп являются, например, винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-пентенил, 1-гексенил, этинил, 2-пропинил, 4-пентинил и тому подобные.
Под термином «полифторированный алкил или алкокси» подразумевается любая из указанных выше прямых или разветвленных C1-C6 алкильных или алкокси групп, которые замещены более чем одним атомом фтора, таких как, например, трифторметил, трифторэтил, 1,1,1,3,3,3-гексафторпропил, трифторметокси и тому подобные.
Под термином «алкокси», «арилокси», «гетероциклилокси» и их производными подразумевается любая из указанных выше C1-C6 алкильной, арильной или гетероциклильной групп, связанных с остальной молекулой через атом кислорода (-O-).
Из всего сказанного выше, специалисту в данной области ясно, что любая группа, название которой представляет собой составное название, такое как, например, ариламино, должно подразумевать обычное трактование частями, из которых она происходит, например, аминогруппой, которая дополнительно замещена арилом, где арил представляет, как определено выше.
Аналогичным образом, любой из терминов, таких как, например, алкилтио, алкиламино, диалкиламино, алкоксикарбонил, алкоксикарбониламино, гетероциклилкарбонил, гетероциклилкарбониламино, циклоалкилоксикарбонил и тому подобные, включает группы, где алкильная, алкокси, арильная, C3-C7 циклоалкильная и гетероциклильная части представляют, как определено выше.
Фармацевтически приемлемые соли соединений формулы (I) включают кислотно-аддитивные соли с неорганическими и органическими кислотами, например, азотной, хлористоводородной, бромистоводородной, серной, перхлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой, фумаровой, молочной, щавелевой, малоновой, яблочной, малеиновой, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой, изетионовой и салициловой кислотой. Предпочтительно, кислотно-аддитивная соль соединений по изобретению выбрана между гидрохлоридом и мезилатом.
Фармацевтически приемлемые соли соединений формулы (I) также включают соли с неорганическими и органическими основаниями, например, щелочных и щелочноземельных металлов, в частности, гидроксиды, карбонаты или бикарбонаты натрия, калия, кальция, аммония или магния, ациклические или циклические амины, предпочтительно метиламин, этиламин, диэтиламин, триэтиламин, пиперидин и тому подобные.
Предпочтительные соединения формулы (I) представляют собой соединения, где X обозначает группу -NR'- и R2 обозначает группу, выбранную из -NHR" и -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R', R'", R1, R3, R4 и A обозначают, как определено выше.
Другие предпочтительные соединения представляют собой соединения формулы (I), где X обозначает группу -O- и R2 обозначает группу, выбранную из -NHR" и -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R'", R1, R3, R4 и A обозначают, как определено выше.
Другие предпочтительные соединения представляют собой соединения формулы (I), где X обозначает группу -S- и R2 обозначает группу, выбранную из -NHR" и -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R'", R1, R3, R4 и A обозначают, как определено выше.
Другие предпочтительные соединения представляют собой соединения формулы (I), где X обозначает одиночную связь и R2 обозначает группу, выбранную из -NHR" и -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R'", R1, R3, R4 и A обозначают, как определено выше.
Другие предпочтительные соединения представляют собой соединения формулы (I), где X обозначает группу -NR'-; R2 обозначает группу -NHR" или -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямой или разветвленной C1-C4 алкильной группы и арила; и R1 обозначает необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R', R'", R3, R4 и A обозначают, как определено выше.
Другие предпочтительные соединения представляют собой соединения формулы (I), где X обозначает группу -O-; R2 обозначает группу -NHR" или -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямой или разветвленной C1-C4 алкильной группы и арила; и R1 обозначает необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R'", R3, R4 и A обозначают, как определено выше.
Другие предпочтительные соединения представляют собой соединения формулы (I), где X обозначает группу -S-; R2 обозначает группу -NHR" или -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямой или разветвленной C1-C4 алкильной группы и арила; и R1 обозначает необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R'", R3, R4 и A обозначают, как определено выше.
Другие предпочтительные соединения представляют собой соединения формулы (I), где X обозначает одиночную связь; R2 обозначает группу -NHR" или -N(OR"')R", где R" обозначает водород или необязательно замещенную группу, выбранную из прямой или разветвленной C1-C4 алкильной группы и арила; и R1 обозначает необязательно замещенную группу, выбранную из прямого или разветвленного C1-C6 алкила, C3-C7 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила; и R'", R3, R4 и A обозначают, как определено выше.
Предпочтительными определенными соединениями формулы (I) или их солью являются соединения, перечисленные ниже:
1) N-(2,6-диэтилфенил)-9-(метоксиметил)-2-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-8-метил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
2) 2-[(4-бром-2-метоксифенил)амино]-N-(2,6-диэтилфенил)-8,9-диметил-6,9-дигидро-5H-пирроло[3,2-h]хинозолин-7-карбоксамид,
3) N-(2,6-диэтилфенил)-2-({2-метокси-4-[4-(пирролидин-1-ил)пиперидин-1-ил]фенил}амино)-8,9-диметил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
4) N-(2,6-диэтилфенил)-2-({4-[4-(диметиламино)пиперидин-1-ил]-2-метоксифенил}амино)-8,9-диметил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
5) N-(2,6-диэтилфенил)-2-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-8,9-диметил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
6) N-(2,6-диэтилфенил)-2-({4-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метоксифенил}амино)-8,9-диметил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
7) 2-{[2-метокси-(4-метилпиперазин-1-ил)фенил]амино}-8,9-диметил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
8) 2-[(4-бром-2-метоксифенил)амино]-N-(2,6-диэтилфенил)-9-метил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
9) N-(2,6-диэтилфенил)-2-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-9-метил-6,9-дигидро-5H-пирроло[3,2-h]хиназолин-7-карбоксамид,
10) N-(2,6-диэтилфенил)-2-({4-[4-(диметиламино)пиперидин-1-и