Замещенные 1-(1-трет-бутил-1н-имидазол-4-ил)-1н-1,2,3-триазолы, способ их получения и фунгицидная композиция на их основе
Иллюстрации
Показать всеИзобретение относится к замещенным 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолам общей формулы I, обладающим фунгицидной активностью. В общей формуле I
R означает атом водорода, триметилсилильную группу, циклоалкил (СnH2n-1, с n от 3 до 7), замещенный фенил, содержащий в качестве заместителей фтор, хлор, трифторметильную или метоксигруппу. Изобретение также относится к способу получения замещенного 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазола и к фунгицидной композиции. Технический результат: получены новые соединения, обладающие фунгицидной активностью. 3 н.п. ф-лы, 7 табл., 9 пр.
Реферат
Изобретение относится к химии гетероциклических соединений, а именно к замещенным 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолам общей формулы I:
где R означает атом водорода, триметилсилильную группу, циклоалкил (CnH2n-1 с n от 3 до 7), замещенный фенил, содержащий в качестве заместителей фтор, хлор, трифторметильную или метоксигруппу. Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов.
Изобретение относится также к способам получения соединений общей формулы I, к использованию этих соединений в композициях с другими активными и вспомогательными соединениями для борьбы с грибными болезнями растительных организмов, животных или человека.
Известно, что сочетание 1-замещенного 1,2,3-триазола с различными гетероциклами приводит к высокой противоопухолевой активности. Так, соединения общей формулы II, содержащие в качестве заместителя имидазол ингибируют ароматидазу в наномолярной области (EC50=0.018 мМ) [С.D. Jones, М.A. Winter, K.S. Hirsch, N. Stamm, Н.М. Taylor, Н.Е. Holden, J.D. Davenport, E.V. Krumkalns and R.G. Suhr. Estrogen synthetase inhibitors. 2. Comparison of the in vitro aromatase inhibitory activity for a variety of nitrogen heterocycles substituted with diarylmethane or diarylmethanol groups // J. Med. Chem. - 1990. - Vol. 33. - P. 416].
Известны соединения общей формулы III и IV [Zanirato P., and Cerini S. On the utility of the azido transfer protocol: synthesis of 2- and 5-azido N-methylimidazoles, 1,3-thiazoles and N-methylpyrazole and their conversion to triazole-azole bisheteroaryls // Org. Biomol. Chem. - 2005. - Vol. 3. - P. 1508-1513], получающиеся по реакции 1,3-диполярного циклоприсоединения соответствующих азидоимидазолов к триметилсилилацетилену.
Наиболее близкими к заявленным замещенным 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолам по структуре и биологической активности являются 1,4,5-тризамещенные 1,2,3-триазолы общей формулы V, где Ar означает фенил, пиридил, пиримидил, а X и Z - галоген, или группы CN, NO2, CONH2, SOR, SO2R, SR, OR, которые обладают инсектицидной и акарицидной активностью, показывая CK50<300 м.д. [европейский патент №400842, МКИ C07D 249/06, заявл. 18.05.1989, опубл. 05.12.1990].
Производные (1-алкил-1H-имидазол-4-ил)-1H-1,2,3-триазолов до настоящего времени в литературе не упоминались.
Техническая задача настоящего изобретения состоит в расширении ассортимента фунгицидных препаратов и увеличении их эффективности.
Техническим результатом является получение новых замещенных 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолов общей формулы I, обладающих фунгицидной активностью, способ их получения, а также увеличение эффективности фунгицидных средств за счет применения соединений общей формулы I и расширение ассортимента фунгицидных препаратов.
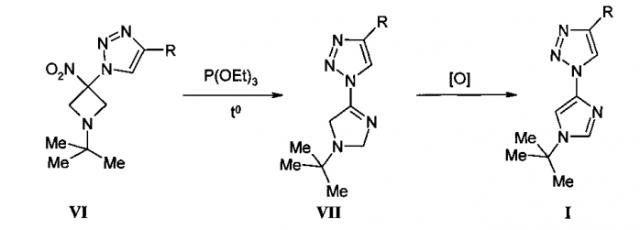
Согласно настоящему изобретению замещенные 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолы общей формулы I, где R означает атом водорода, триметилсилильную группу, циклоалкил (CnH2n-1 с n от 3 до 7), замещенный фенил, содержащий в качестве заместителей фтор, хлор, трифторметильную или метоксигруппу, получают из замещенных 1-(1-трет-бутил-3-нитроазетидин-3-ил)-1H-1,2,3-триазолов VI, где R имеет те же значения, что и в общей формуле I, в две стадии. Вначале при взаимодействии VI с триалкилфосфитами, например триэтилфосфитом или трифенилфосфином, при температуре 70-110°C в неполярных растворителях, таких как, например, бензол или толуол, происходит расширение азетидинового цикла, приводящее к 1-(1-трет-бутил-2,5-дигидро-1H-имидазол-4-ил)-1H-1,2,3-триазолы общей формулы VII.
Образующиеся в результате реакции дезоксигенирования замещенные 1-(1-трет-бутил-2,5-дигидро-1H-имидазол-4-ил)-1H-1,2,3-триазолы общей формулы VII, где R означает атом водорода, триметилсилильную группу, циклоалкил (CnH2n-1 с n от 3 до 7), замещенный фенил, содержащий в качестве заместителей фтор, хлор, трифторметильную или метоксигруппу, легко окисляются различными окислителями, как, например, кислородом воздуха, пероксидом водорода, дихлордицианобензохиноном (DDQ), также при нагревании в полярных апротонных растворителях, как, например, эфире, ацетонитриле и тетрагидрофуране до соответствующих 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолов общей формулы I.
Исходные замещенные 1-(1-трет-бутил-3-нитроазетидин-3-ил)-1H-1,2,3-триазолы общей формулы VI, где R означает атом водорода, триметилсилильную группу, циклоалкил (CnH2n-1, с n от 3 до 7), замещенный фенил, содержащий в качестве заместителей фтор, хлор, трифторметильную или метоксигруппу, получают по реакции [3+2] циклоприсоединения из 3-азидо-1-трет-бутил-3-нитроазетидина VIII и терминальных ацетиленов [Кагоров Д.В., Рудаков Г.Ф., Каторова И.Н., Якушков А.В., Симонов Д.П., Жилин В.Ф. Синтез 1,2,3-триазолов на основе гетероциклических α-нитроазидов // Изв. АН. Серия хим. - 2012. - №11. - C. 2098-2107].
3-Азидо-1-трет-бутил-3-нитроазетидин VIII, в свою очередь, получают реакцией окислительного азидирования (1-трет-бутил-3-нитроазетидин-3-ил)метанола IX в щелочной среде в присутствии одноэлектронного окислителя K3[Fe(CN)6] [Кагоров Д.В., Рудаков Г.Ф., Жилин В.Ф. Синтез гетероциклических геминальных нитроазидов // Изв. АН. Серия хим. - 2009. - №11. - С. 2240-2246].
(1-трет-Бутил-3-нитроазетидин-3-ил)метанол IX получают в три стадии из нитрометана, параформа и трет-бутиламина [патент США №5336784, МКИ C07D 205/04, заявл. 07.06.1993, опубл. 09.08.1994].
Новые замещенные 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолы общей формулой I, обладают фунгицидной активностью.
Техническим результатом изобретения также является разработка фунгицидных композиций, состоящих из замещенных 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолов общей формулы I в концентрации 0.1-99% и вспомогательных веществ, которые успешно могут быть применены для борьбы с вредоносными грибковыми болезнями сельскохозяйственных культур, животных или человека.
Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества могут включать в свой состав наполнители, растворители, поверхностно-активные вещества, смягчители воды, синергические добавки и др. Известен препарат цинеб, который применяют в виде 70- и 80%-ного смачивающегося порошка для борьбы с болезнями яблони, сливы, картофеля томатов, огурцов капусты в период вегетации, а также как протравитель семян [Пестициды и регуляторы роста растений: Справ. изд. / Н.Н. Мельников, К.В. Новожилов, С.Р. Белан. - М.: Химия, 1995, с. 24, с. 316].
Применение соединений общей формулы I, как в индивидуальном виде, так и в композициях с другими активными и вспомогательными соединениями, позволит более эффективно бороться с грибковыми заболеваниями сельскохозяйственных культур.
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1: 1-(1-трет-Бутил-3-нитроазетидин-3-ил)-1H-1,2,3-триазол (1)
В 10 мл воды растворяют 0.863 г (6.25 ммоль) карбоната калия и 0.176 г (1 ммоль) аскорбиновой кислоты. К полученному раствору при перемешивании при комнатной температуре последовательно приливают раствор 0.576 г (6 ммоль) триметилсилилацетилена в 20 мл метанола, раствор 0.125 г (0.5 ммоль) пентагидрата сульфата меди (II) в 10 мл воды и раствор 1.010 г (5 ммоль) 3-азидо-1-трет-бутил-3-нитроазетидина в 20 мл метанола. Реакционную массу перемешивают в течение 24 ч, затем экстрагируют хлористым метиленом (2×50 мл). Объединенный экстракт промывают водой, сушат над сульфатом натрия и упаривают на РПИ в вакууме водоструйного насоса Остаток перекристаллизовывают из этанола, получают 0.787 г (70%) 1-(1-трет-бутил-3-нитроазетидин-3-ил)-1H-1,2,3-триазола (1) с т. пл. 86-89°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 0.97 (9Н, с, (CH3)3С), 4.11 (2Н, д, J=9.8, CH2), 4.33 (2Н, д, J=9.8, CH2), 7.95 (1H, с, Н-4 триазол), 8.66 (1H, с, Н-5 триазол).
ИК-спектр (KBr), ν, см-1: 3129 и 2975 (C-H), 1567 и 1365 (NO2).
Масс-спектр высокого разрешения (ESI): Найдено: m/z: 226.1305 [M+H]+. C9H15N5O2.
Вычислено: m/z: 226.1299 [M+H]+.
Пример 2: 1-(1-трет-Бутил-3-нитроазетидин-3-ил)-4-(2-фторфенил)-1H-1,2,3-триазол (2)
К раствору 0.404 г (2 ммоль) 3-азидо-1-трет-бутил-3-нитроазетидина и 0.252 г (1.05 ммоль) 1-этинил-2-фторбензола в 10 мл ТГФ при комнатной температуре приливают раствор 0.176 г (0.5 ммоль) аскорбиновой кислоты и 0.075 г (0.15 ммоль) пентагидрата сульфата меди (II) в 10 мл воды. Полученную реакционную массу выдерживают при перемешивании в течение 12 ч при комнатной температуре. По окончании реакции смесь экстрагируют хлористым метиленом (2×20 мл). Объединенный экстракт промывают водой, сушат над сульфатом натрия и упаривают на РПИ в вакууме водоструйного насоса. Остаток перекристаллизовывают из этанола, получают 0.478 г (75%) 1-(1-трет-бутил-3-нитроазетадин-3-ил)-4-(2-фторфенил)-1H-1,2,3-триазола (2) с т. пл. 149-151°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 0.98 (9Н, с, (CH3)3C), 4.20 (2Н, д, J=9.9, CH2), 4.36 (2Н, д, J=9.9, CH2), 7.34-7.38 (2Н, м, СНаром), 7.43-7.49 (1Н, м, СНаром), 8.15-8.19 (1H, м, СНаром), 8.97 (1H, д, 5J=3.2 H-5 триазол).
ИК-спектр (KBr), ν, см-1:3168 и 2972 (C-H), 1564 и 1366 (NO2).
Масс-спектр высокого разрешения (ESI): Найдено: m/z: 320.1518 [M+H]+. C15H18FN5O2. Вычислено: m/z: 320.1517 [M+H]+.
Триазол 3 получен согласно литературной методике [Каторов Д.В., Рудаков Г.Ф., Каторова И.Н., Якушков А.В., Симонов Д.П., Жилин В.Ф. Синтез 1,2,3-триазолов на основе гетероциклических α-нитроазидов // Изв. АН. Серия хим. - 2012. - №11. - C. 2098-2107].
Аналогично примеру 2 получены другие замещенные 1-(1-трет-бутил-3-нитроазетидин-3-ил)-1H-1,2,3-триазолы 4-11 (Таблица 1).
Температуры плавления определены на нагревательном столике Boetius. ИК-спектры зарегистрированы на приборе Thermo Nicolet 360 FTIR в таблетках KBr. Спектры ЯМР 1H записаны на приборе Varian Mercury Plus (400 МГц) в ДМСО-d6, внутренний стандарт - ТМС.
Пример 3: 1-(1-трет-Бутил-2,5-дигидро-1H-имидазол-4-ил)-4-фенил-1H-1,2,3-триазол (12)
К интенсивно перемешиваемой смеси 0.300 г (1 ммоль) 1-(1-трет-бутил-3-нитроазетидин-3-ил)-4-(фенил)-1H-1,2,3-триазола в 3 мл толуола присыпают 0.525 г (2 ммоль) трифенилфосфина. Реакционную массу выдерживают при 110°C в течение 16 ч. Затем растворитель отгоняют на вакуумной центрифуге в вакууме масляного насоса. Продукт выделяют с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и н-гексана (1:3). Получают 0.110 г (41%) 1-(1-трет-бутил-2,5-дигидро-1H-имидазол-4-ил)-4-фенил-1H-1,2,3-триазола (12) с т. пл. 83-86°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 1.18 (9Н, с, (СН3)3С) 4.38 (2Н, т, J=4.8, Н-5 имидазолин), 4.90 (2Н, т, J=4.8, H-2 имидазолин), 7.46-7.38 (3H, м, СНаром), 7.90-7.88 (2Н, м, СНаром), 8.52 (1H, с, Н-5 триазол).
ИК-спектр (KBr), ν, см-1: 1683 (N=C).
Найдено, %: C 66.80; Н 7.05; N 26.05. C15H19N5. Вычислено, %: C 66.89; H 7.11; N 26.00.
Пример 4: 1-(1-трет-Бутил-2,5-дигидро-1H-имидазол-4-ил)-4-(2-фторфенил)-1H-1,2,3-триазол (13)
К интенсивно перемешиваемой смеси 0.320 г (1 ммоль) 1-(1-трет-бутил-3-нитроазетидин-3-ил)-4-(2-фторфенил)-1H-1,2,3-триазола в 3 мл бензола приливают 1.328 г (8 ммоль) триэтилфосфита. Реакционную массу выдерживают при 70°C в течение 16 ч. Затем растворитель отгоняют на вакуумной центрифуге в вакууме масляного насоса. Продукт выделяют с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и н-гексана (1:3). Получают 0.190 г (62%) 1-(1-трет-бутил-2,5-дигидро-1Н-имидазол-4-ил)-4-(2-фторфенил)-1H-1,2,3-триазола (13) с т. пл. 91-95°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 1.10 (9Н, с, (CH3)3C), 4.28 (2Н, т, J=4.8, Н-5 имидазолин), 4.82 (2Н, т, J=4.8, Н-2 имидазолин), 7.33-7.38 (2Н, м, СНаром), 7.44-7.50 (1H, м, СНаром), 8.14 (1H, т, J=7.7, СНаром), 8.76 (1H, д, 5J=3.3, Н-5 триазол).
ИК-спектр (KBr), ν, см-1: 1683 (N=C).
Найдено, %: C 62.75; H 6.38; F 6.69; N 24.40. C15H18FN5. Вычислено, %: C 62.7; H 6.31; F 6.61; N 24.37.
Аналогично примеру 4 получены другие замещенные 1-(1-трет-бутил-2,5-дигидро-1H-имидазол-4-ил)-1H-1,2,3-триазолы (14-22) (Таблица 3).
Пример 5: 1-(1-трет-Бутил-1H-имидазол-4-ил)-1H-1,2,3-триазол (23)
К 0.193 г (1 ммоль) 1-(1-трет-бутил-2,5-дигидро-1H-имидазол-4-ил)-1H-1,2,3-триазола в 2 мл диэтилового эфира добавляют 100 мкл (2 ммоль) 30% пероксида водорода и полученный раствор кипятят в течение 20 минут. Растворитель отгоняют на РПИ в вакууме водоструйного насоса. Получают 0.185 г (96%) 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазола (23) с т. пл. 80-83°C.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 1.56 (9Н, с, (CH3)3С), 7.82 (1H, с, Н-5 имидазол), 7.84 (1H, с, Н-2 имидазол), 7.86 (1Н, с, Н-4 триазол), 8.39 (1Н, с, Н-5 триазол).
ИК-спектр (KBr), ν, см-1: 3133 (C-H), 1592 (C=N).
Найдено, %: C 56.50; H 6.87; N 36.69. C9H13N5. Вычислено, %: C 56.53; H 6.85; N 36.62.
Пример 6: 1-(1-трет-Бутил-1H-имидазол-4-ил)-4-фенил-1H-1,2,3-триазол (24)
В раствор 0.269 г (1 ммоль) 1-(1-трет-бутил-2,5-дигидро-1H-имидазол-4-ил)-4-фенил-1H-1,2,3-триазола в 5 мл ацетонитрила в течение 24 ч барботируют воздух. Растворитель отгоняют на РПИ в вакууме водоструйного насоса. Получают 0.135 г (50%) 1-(1-трет-Бутил-1H-имидазол-4-ил)-4-фенил-1H-1,2,3-триазола (24) с т. пл. 99-101°C.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 1.58 (9Н, с, (CH3)3С), 7.34 (1H, т, J=7.4, СНаром, 7.45 (2Н, т, J=7.6, СНаром), 7,94 (2Н, д, J=7.2, СНаром), 7.86 (1Н, д, J=1.4, Н-5 имидазол), 7.89 (1H, д, J=1.4, Н-2 имидазол), 8.88 (1H, с, Н-5 триазол).
ИК-спектр (KBr), ν, см-1: 3118 (C-H), 1598 (C=N).
Найдено, %: C 67.37; H 6.42; N 26.15. C15H17N5. Вычислено, %: C 67.39; H 6.41; N 26.20.
Пример 7: 1-(1-трет-Бутил-1H-имидазол-4-ил)-4-(2-фторфенил)-1H-1,2,3-триазол (25)
К интенсивно перемешиваемому раствору 0.100 г (0.35 ммоль) 1-(1-трет-бутил-2,5-дигидро-1H-имидазол-4-ил)-4-(2-фторфенил)-1H-1,2,3-триазола в сухом хлористом метилене порциями (3×33 мг) дозируют 0.100 г (0.45 ммоль) 2,3-дихлоро-5,6-дициано-1,4-бензохинон (DDQ). Реакционную массу выдерживают при комнатной температуре в течение 2 ч, растворитель отгоняют на РПИ в вакууме водоструйного насоса. Продукт выделяют с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и н-гексана (1:3). Получают 0.085 г (85%) 1-(1-трет-бутил-1H-имидазол-4-ил)-4-(2-фторфенил)-1H-1,2,3-триазола (25) с т. пл. 138-140°C.
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 1.58 (9Н, с, (CH3)3С), 7.31-7.36 (2Н, м, СНаром), 7.40-7.46 (1Н, м, СНаром), 7.89 (1H, д, J=1.6, Н-5 имидазол), 7.91 (1H, д, J=1.6, Н-2 имидазол), 8.13-8.19 (1Н, м, СНаром), 8.59 (1Н, д, 5J=3.5, Н-5 триазол).
ИК-спектр (KBr), ν, см-1: 3116 (C-H), 1602 (C=N).
Найдено, %: C 63.13; H 5.67; F 6.70; N 24.50. C15H16FN5. Вычислено, %: C 63.14; H 5.65; F 6.66; N 24.55.
Аналогично примеру 7 получены другие замещенные 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолы (26-33) (Таблица 5).
Пример 8. Композиция концентрата эмульсии
Действующее вещество: (замещенные 1-(1-трет-бутил-1H-имидазол-4-ил)-1H-1,2,3-триазолы) - 70 г
Алкилбензолсульфокислоты кальциевая соль (АБСК) - 15 г
Оксиэтилированный октилфенол (ОП-7) - 70 г
Циклогексанон - 280 г
Смесь ксилолов - 110 г
1-Метилнафталин - 45 г
Керосин в количестве, достаточном для получения 1 л раствора
Пример 9. Испытания на фунгицидную активность соединений проводили в экспериментах in vitro [Методические рекомендации по определению фунгицидной активности новых соединений. Черкассы: НИИТЭХИМ. 1984. 34 с.].
Действие препаратов на радиальный рост мицелия определяли растворением соединения в ацетоне и внесением аликвоты в картофелесахарозный агар при 50°C до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах и в растворах с действующими веществами составила 1%. В чашки Петри, содержащие 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в инкубаторе при 25°C и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 7.
Применение соединений общей формулы I, как в индивидуальном виде, так и в композициях с другими активными и вспомогательными соединениями, позволяет в случае применения соединений 24, 25, 26, 29, 30, 31, 32 более эффективно бороться с грибковыми заболеваниями сельскохозяйственных культур в сравнении с применяющимся сельскохозяйственным фунгицидом - триадимефоном.
1. Замещенный 1-(1-трет-бутил-1Н-имидазол-4-ил)-1Н-1,2,3-триазол общей формулы I: где R означает атом водорода, триметилсилильную группу, циклоалкил (CnH2n-1 с n от 3 до 7), замещенный фенил, содержащий в качестве заместителей фтор, хлор, трифторметильную или метоксигруппу.
2. Способ получения замещенного 1-(1-трет-бутил-1Н-имидазол-4-ил)-1Н-1,2,3-триазола общей формулы I, где R означает атом водорода, триметилсилильную группу, циклоалкил (CnH2n-1 с n от 3 до 7), замещенный фенил, содержащий в качестве заместителей фтор, хлор, трифторметильную или метоксигруппу, заключающийся в том, что замещенный 1-(1-трет-бутил-3-нитроазетидин-3-ил)-1Н-1,2,3-триазол формулы VI, где R имеет те же значения, что и в общей формуле I, вводят во взаимодействие с триалкилфосфитом или трифенилфосфином при температуре 70-110°С в неполярном растворителе, таком как бензол, толуол, ксилол, с образованием замещенного 1-(1-трет-бутил-2,5-дигидро-1 Н-имидазол-4-ил)-1Н-1,2,3-триазола общей формулы VII, где R имеет те же значения, что и в общей формуле I, который окисляют окислителем, таким как кислород воздуха, пероксид водорода, дихлордицианобензохинон, при нагревании в полярном апротонном растворителе, таком как эфир, ацетонитрил, тетрагидрофуран
3. Фунгицидная композиция, содержащая действующее вещество в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве фунгицида используют замещенный 1-(1-трет-бутил-1Н-имидазол-4-ил)-1Н-1,2,3-триазол общей формулы I по п. 1.