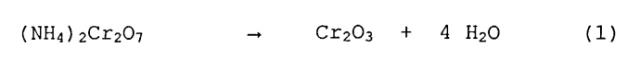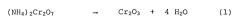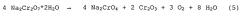Способ получения оксида хрома (iii)
Иллюстрации
Показать всеИзобретение относится к области химии и может быть использовано при получении пигмента для строительных материалов, пластмасс, красок и лаков, стекла и керамики. Осуществляют взаимодействие монохромата натрия с газообразным аммиаком при температуре от 200 до 800°С. Проводят гидролиз реакционного продукта. Понижают рН воды перед гидролизом или рН щелочного маточного щелока во время или после гидролиза до 4-11 путем введения двуокиси углерода. Выделяют выпавший в осадок продукт гидролиза при рН= 4-11. Кальцинируют продукт гидролиза при температуре от 700 до 1400°С. Изобретение позволяет получить оксид хрома (III), содержащий очень малые количества серы, щелочных металлов и побочных продуктов. 11 з.п. ф-лы, 3 пр.
Реферат
Данное изобретение относится к способу получения оксида хрома(III) исходя из монохромата натрия и газообразного аммиака, а также к использованию полученного оксида хрома(III) для различных применений.
Оксид хрома(III) представляет собой многосторонний продукт с широким применением. Так его можно применять в качестве пигмента для использования различным образом, например, в строительных материалах, пластмассах, красках и лаках, стекле и керамике. Для этой области применения предъявляется требование по-возможности низкого содержания водорастворимых примесей.
Кроме того, оксид хрома(III) также применяется в шлифовальных средствах и материалах, устойчивых при высокой температуре. Для применения оксида хрома(III) в материалах, устойчивых при высокой температуре, желательно по-возможности низкое содержание щелочного металла, для того чтобы насколько возможно подавить окисление хрома(III) в хромат щелочного металла при высоких температурах и в присутствии ионов щелочных металлов.
Другой важной промышленной областью применения оксида хрома(III) является применение в качестве исходного материала для получения металлического хрома и/или высокопроизводительных хромсодержащих сплавов. Здесь по всем правилам могут применяться только оксиды хрома(III), которые отличаются низким содержанием серы и низким содержанием углерода. Понятие «оксид хрома(III) с низким содержанием серы» поэтому часто применяется в качестве синонима для «оксида хрома(III) для металлургических целей».
Оксид хрома(III) может быть получен согласно уровню техники различными способами. В большинстве случаев его получают при более высоких температурах из шестивалентных хромовых соединений, причем могут достигаться различные степени чистоты. В качестве исходных соединений шестивалентного хрома применяют хромовую кислоту, хроматы аммония или хроматы щелочных металлов. Реакцию можно проводить с добавлением или без добавления восстановительного средства. В качестве восстановительного средства служат органические или неорганические восстановительные средства, такие как древесные опилки, меласса, целлюлозные отработанные щелоки, ацетилен, метан, сера и ее соединения, фосфор, углерод, водород и тому подобные. Такие способы описаны в многочисленных патентах. В качестве примера здесь будут упомянуты только US 1,893,761 и DE-A-2030510. В US 1,893,761 опубликовано получение оксида хрома(III) путем восстановления хроматов щелочных металлов с помощью органических соединений. В случае применения углерода или органических соединений в качестве восстановительного средства процесс можно проводить так, чтобы в конце концов получить карбонат натрия в качестве побочного продукта, как упоминается в US 1,893,761. Его можно при необходимости возвратить в процесс получения бихромата натрия, если бихромат натрия получают в результате окислительного щелочного разложении хромовой руды. Во всяком случае, полученный таким путем оксид хрома(III) содержит высокую долю углерода, что делает его непригодным для металлургического применения. В DE-A-2030510 описан способ непрерывного получения очень чистого, содержащего мало серы оксида хрома(III) путем восстановления хроматов щелочных металлов водородом при более высоких температурах, а также подходящая для этого установка. Температура реакции составляет от 1000 до 1800°C, более предпочтительно от 1100 до 1400°C, и полученный продукт отделяют с помощью щелочнозаданной дисперсии от отходящих газов. В DE-A-2416203 и в US 4,052,225 описаны способы, при которых также применяют водород для восстановления хроматов щелочных металлов. В обоих этих способах мелко измельченный хромат щелочного металла восстанавливают в обогреваемой содержащей водород реакционной зоне при температуре между 900 и 1600°C, причем восстановление можно проводить в присутствии газа, который при восстановлении хромата щелочного металла связывает ионы щелочного металла с образованием соли и, причем образующийся оксид хрома(III) отделяется в виде щелочнозаданной дисперсии. В качестве солеобразующих газов предпочтительно применяют хлор или хлористый водород, в результате чего образуется хлористый натрий. Однако, в связи с тем что температура плавления хлористого натрия находиться вблизи 800°C, следует ожидать расплавления в реакторе, в результате чего при длительных процессах может происходить комкование и припекание.
Недостаток всех этих способов, которые проводятся с восстановительным средством, состоит в том, что в результате применения восстановительного средства обязательно образуется побочный продукт, который подлежит переработке.
Термическое разложение чистого бихромата аммония, напротив, само не приводит к заметному необходимому образованию побочных продуктов, так как оно в идеальном случае происходит согласно уравнению реакции
и при температуре около 200°C прекращается. Во всяком случае, все практикуемые в настоящее время промышленные способы исходят из получения бихромата аммония из бихроматов щелочных металлов - чаще всего бихроматов натрия. При этом бихромат натрия при взаимодействии с хлоридом аммония или сульфатом аммония превращают в бихромат аммония и хлористый натрий, соответственно, в бихромат аммония и сульфат натрия. Оксид хрома(III) для металлургических целей раньше получали промышленным путем, при котором в печи кальцинировали смесь бихромата аммония и хлористого натрия, которую получали при in-situ реакции бихромата натрия и хлористого аммония в практически стехиометрически эквивалентных количествах. Температура кальцинирования должна была превышать 700°C, для того чтобы гарантировать, что в реакционной смеси оксид хрома(III) составляет высокую долю, при слишком высокой температуре однако возрастает риск образования шлака в печи и в связи с этим температуру, как правило, выдерживают ниже 850°C.
Применение сульфата аммония вместо хлористого аммония часто является предпочтительным в связи с тем что хлористый аммоний в связи с его более низкой температурой сублимации при кальцинировании сублимируется в виде NH3 и HCl и тем самым может попасть в отходящие газы. По этим причинам применение хлористого аммония в настоящее время не имеет промышленного значения. Недостаток применения сульфата аммония состоит, во всяком случае, в том, что таким путем сера вовлекается в процесс производства, хотя желателен оксид хрома(III) с как можно меньшим содержанием серы.
В DE-A-2635086 (US-A-4,235,862) описан способ получения оксида хрома(III) с низким содержанием серы, который отличается отжигом смеси бихромата щелочного металла и сульфата аммония при температуре кальцинирования от 800 до 1100°C и отделением образовавшегося оксида хрома(III) от образовавшейся соли щелочного металла, причем на 1 моль хромата щелочного металла используют от 0,7 до 0,89, предпочтительно от 0,7 до 0,84 моля сульфата аммония. Переработку оксида хрома(III) после отжига проводят общепринятым путем вымывания водорастворимых солей и сушки. Согласно этому способу могут быть достигнуты содержания серы в оксиде хрома(III) от 50 до 100 млн долей. Недостаток при осуществлении этого способа состоит в том, что для достижения низких содержаний серы исходные вещества приходится смешивать не в стехиометрическом отношении и сульфат аммония берется в отчетливо меньшем количестве. Это приводит к низким превращениям в области около 90%, и требует поддержания более высоких температур отжига. Находящийся в избытке бихромат щелочного металла разлагается термически в хромат щелочного металла, оксид хрома(III) и кислород. Таким образом, при реакции, наряду с большим количеством сульфата щелочного металла (например, сульфата натрия), образуется также хромат щелочного металла (например, хромат натрия), который при позднейшем вымывании переходит в маточный раствор или в промывающую жидкость и должен быть отделен, для того чтобы при необходимости возвратить обратно в процесс. Маточный раствор в этом случае также содержит избыточный осадившийся сульфат щелочного металла, очистка которого является затратной в связи с тем что он загрязнен хроматом щелочного металла. Кроме того, на практике оказалось, что предложенные условия получения оксида хрома(III) с низким содержанием серы оказались трудновыполнимыми в связи с тем что содержащийся в реакционной смеси сульфат натрия при требуемой высокой температуре испытывает спекание (температура плавления сульфата натрия около 885°C), а это приводит к нарушению протекания процесса получения.
Что касается получения оксида хрома(III) с низким содержанием серы, то в US 4,296,076 описан способ, при котором среди прочего используют бихромат натрия и хлористый аммоний, соответственно, бихромат натрия и сульфат аммония. В отличие от DE-A-2635086 при этом берется в существенной мере стехиометрическое отношение или предпочтительно избыток аммониевого соединения. На первой стадии реакции исходные соединения переводят в бихромат аммония и хлористый натрий, соответственно, в бихромат аммония и сульфат натрия. В опубликованных примерах эта стадия реакции происходит при температуре от 400 до 800°C, затем следует обработка водой и после этого второй процесс отжига при температуре выше 1100°C. При этом способе добиваются содержания серы в оксиде хрома(III) ниже 40 млн долей. При этом способе образуются большие количества хлористого натрия, соответственно, сульфата натрия, очистка которых является затратной. Кроме того, применение указанных аммониевых соединений, в особенности хлористого аммония, не является беспроблемным в связи с тем что они легко сублимируются и тем самым могут попасть в отходящие газы.
Другой описанный в уровне техники способ получения качественно высокоценного оксида хрома(III) описан в RU 2258039. И здесь используют бихромат аммония, получаемый при взаимодействии бихромата натрия с сульфатом аммония в водной фазе, для получения оксида хрома(III), при этом образующийся при взаимодействии сульфат натрия отделяют от реакционной смеси, так что относительно чистый, то есть бедный серой, бихромат аммония термически разлагается в оксид хрома(III). В качестве побочного продукта образуется сульфат натрия, очистка которого является затратной, так как он загрязнен Cr(VI).
Термическое разложение чистой хромовой кислоты (2) описано среди прочего в литературе в виде реакции (например, в Ullmann′s Encyclopedia of Industrial Chemistry, Vol.A7, p.87, VCH Verlag, 1986)
Также и в случае использования хромовой кислоты в качестве исходного материала для получения оксида хрома(III), как правило, на первой стадии хроматы щелочного металла подвергают взаимодействию с серной кислотой и/или с гидросульфатсодержащими соединениями с образованием бихроматов щелочного металла (3) и затем с помощью дополнительной серной кислоты переводят в хромовую кислоту (4)
И при этих способах получения оксида хрома(III) образуется существенное количество сульфатов щелочных металлов, например, сульфата натрия, в качестве побочного продукта. В упомянутом способе термического разложения чистой хромовой кислоты, исходя из хромата натрия, образуются на один килограмм оксида хрома(III) около 1,9 кг сульфата натрия (комбинация из реакций (3), (4) и (2)). Сульфат натрия, однако, загрязнен хроматом натрия, так что у него худшее качество и его перед продажей надо еще подвергнуть затратной очистке. Кроме того, хромовая кислота является очень сильным окисляющим средством и является сильно корозионно действующим соединением. В связи с этим обращение с этим веществом в технических процессах при более высоких температурах соответственно затруднено.
Описаны и другие способы получения оксида хрома(III) с небольшим содержанием серы, при которых используют исходные вещества, в значительной мере свободные от углерода и серы.
В DE-A-2852198 (US-A-4,230,677) получение монохромата аммония осуществляют превращением бихромата натрия или монохромата натрия и экстракцией из раствора в органическом растворителе. Примыкающее кальцинирование в оксид хрома(III) происходит при температуре 500°C. Недостаток этого способа состоит в том, что работают с очень разбавленными водными растворами. Так концентрация хрома - в пересчете на Cr2O3 - в подлежащем экстрагированию водном растворе лежит в интервале от 1 г/л до 25 г/л, причем в качестве более предпочтительной указана концентрация 8,2 г/л. Но и в органической фазе после двух стадий экстракции может быть достигнута только концентрация Cr2O3, равная 10 г/л. В результате приходится иметь дело с большими количествами жидкости, их переработкой и новым введением в кругооборот. В качестве органических растворителей используют бензол, ксилол или толуол сами по себе или в виде смеси с изопарафиновым углеводородом. В случае всех этих веществ имеются в виду опасные вещества, которые легко воспламеняются, так что осуществление этого способа следует проводить с соблюдением многих мер по защите сотрудников и окружающей среды. Кроме того, экстракция проводится при pH-значении между 1 и 2, для чего используют соляную кислоту. В результате образуется существенное количество хлористого натрия, который загрязняет сточные воды. Используемые органические растворители все обнаруживают заметную растворимость в воде (растворимость при температуре 20°C в воде: бензола 1,77 г/л, толуола 0,47 г/л, ксилола 0,2 г/л), так что сточные воды дополнительно содержат высокую долю органических соединений, и очистка сточных вод является затратной. В связи с многочисленными недостатками этот способ до сих пор не приобрел хозяйственного значения.
Термическая обработка бихромата натрия при более высоких температурах приводит и в отсутствии восстанавливающих средств к оксиду хрома(III). Так Na2Cr2O7*2H2O согласно исследованиям S. Sampath и др. (Thermochimica Acta, 159 (1990), p.327-335), начиная с температуры 500°C медленно разлагается на Na2CrO4 и Cr2O3
Согласно уравнению химической реакции в идеальном случае максимум 50 мол. процентов использованного Cr(VI) превращаются в оксид хрома(III). Во время процесса нагревания вначале при температуре 83°C происходит переход содержащего кристаллизационную воду бихромата натрия в безводное соединение. Не содержащий кристаллизационной воды бихромат натрия плавится при температуре 357°C, так что разложение происходит в расплаве. В результате этого степень превращения при реакции еще раз отчетливо понижается. Скорость реакции при температуре около 500°C еще очень низка, так что приходится применять более высокие температуры для того, чтобы достигнуть приемлемых скоростей реакции. Так, например, при разложении безводного бихромата натрия при температуре 750°C только около 25 мол. процентов Cr(VI) превращаются в Cr2O3. В связи с низким выходом этот способ получения оксида хрома(III) не представляет интереса в промышленных масштабах.
В CN-A-1310132 получение хромата аммония проводят путем превращения хромата натрия в присутствии двуокиси углерода и аммиака. Получаемый согласно этому способу хромат аммония затем используют для получения оксида хрома(III). Однако опубликованный способ получения хромата аммония обнаруживает много недостатков. С одной стороны, используемый раствор хромата натрия перед началом необходимо перекристаллизовать и профильтровать. То есть необходима - только не полностью описанная - стадия очистки, при которой образуется хлористый натрий в качестве побочного продукта. С другой стороны, взаимодействие с двуокисью углерода и аммиаком проходит в две стадии реакции, при которых в каждом случае добавляют двуокись углерода и аммиак. Отделение образовавшегося при первом взаимодействии гидрокарбоната натрия происходит при кристаллизации в результате охлаждения, причем скорость охлаждения составляет от около. 1°C/час до 4°C/час. В связи с этим кристаллизация представляет собой очень медленный и затратный по времени процесс, так как во всех опубликованных примерах перед фильтрованием имеет место двухчасовая стадия старения. Условия, при которых из полученного хромата аммония должен быть получен оксид хрома (III), однако не описаны в CN-A-1310132.
Использование чистого хромата аммония или бихромата аммония для термического разложения с целью получения чистого оксида хрома(III), как правило, не является не критическим, так как разложение в сухом состоянии может происходить взрывообразно. Бихромат аммония в связи с этим является опасным веществом с символом опасности ″Е″ (взрывоопасен). В связи с этим реакция разложения является трудно управляемой. Полученный при этой реакции продукт разложения Cr2O3 отличается экстремально низкой насыпной плотностью, которая может находиться в интервале от 0,1 до 0,2 г/см3. В связи с этим полученный продукт разложения Cr2O2 проявляет очень сильную склонность к распылению. В промышленном процессе отходящие газы должны очищаться от большого количества пыли. Пыль содержит, кроме того, еще не превращенные доли Cr(VI).
В CN-A-1418822 сообщается об одновременном получении бихроматов щелочных металлов и оксида хрома(III), которое отличается тем, что смешивают хромат щелочного металла с хроматом аммония или бихроматом аммония в молярном отношении хромат щелочного металла: хромат аммония или бихромат аммония = (0,3-3):1 и смесь отжигают в температурном интервале от 650°C до 1200°C в течение 0,5-3 часов. Отожженный продукт растворяют в воде. После разделения твердое вещество/жидкость твердый остаток содержит оксид хрома(III) с низким содержанием серы. Из сконцентрированного маточного раствора путем охлаждения выкристаллизовывают бихромат щелочного металла. Твердый бихромат щелочного металла отделяют при разделении твердое вещество/жидкость от еще не прореагировавшего хромата щелочного металла. В опубликованных примерах применяют смеси хромата натрия (Na2CrO4*4H2O) и хромата аммония, хромата натрия (Na2CrO4) и бихромата аммония, хромата калия (K2CrO4) и хромата аммония, а также хромата калия (K2CrO4) и бихромата аммония. Выход оксида хрома(III) в пересчете на содержащийся в исходных смесях Cr(VI) колеблется в примерах 1-3 между 36 и 40%. Кроме того, продукт реакции, который получают, например, в примерах 1 и 2, является очень клейким. Это сильно затрудняет техническую реализацию, например, во вращающейся печи.
Из CN 1418821 известно, что не содержащий серы оксид хрома получают кальцинированием при температуре 650-1200°C двойной соли 1:1 хромата аммония-щелочного металла. Недостаток описанного там способа, однако, состоит в том, что выход оксида хрома составляет только около 23% в пересчете на исходное вещество, содержащее Cr(VI), и способ тем самым не является экономичным способом получения оксида хрома. Другой недостаток состоит в том, что доля Na - в пересчете на металлический Na - в полученном оксиде хрома, составляющая 1900 млн долей, очень высока. Кроме того, реакционная смесь, начиная с температуры около 700°C, при которой происходит кальцинирование, становится сильно клейкой, что, в частности, сильно затрудняет техническую реализацию, например, во вращающейся трубчатой печи.
В GB 748,610 описано в общем виде восстановление водородом хроматов щелочных металлов и последующее превращение в Cr2O3. Выходы при такого рода восстановлении являются, во всяком случае, очень низкими. Так выход Cr2O3, исходя из свободного от щелочи монохромата натрия, составляет менее 67%, что делает этот способ превращения с такими реакционными исходными веществами не представляющим интерес в промышленном масштабе.
В CN 1907865А опубликован способ получения оксида хрома, причем применяют хроматную соль в качестве исходного вещества и восстанавливающий газ, такой как водород, природный газ, каменноугольный газ или их смеси в качестве восстановительного средства при температуре 300-850°C и проводят реакцию в течение 0,5-3 часов. После охлаждения реакционную смесь промывают водой и после просушивания кальцинируют при температуре 400-1100°C в течение 1-3 часов. Способ, описанный в CN 1907865А, в частности пример 1, исходящий из хромата и водорода, соответствует способу, приведенному в GB 748,610, причем повторение этого примера при указанных условиях не приводило ни к экзотермии, ни к измеряемому превращению.
В CN-101475217 получают пигментный оксид хрома путем взаимодействия бихромата натрия с аммиаком при 350°C с последующим гидролизом, выделением промежуточного продукта и последующим кальцинированием в присутствии оксидных добавок при температуре 1100°C.
Поляк и Девятовская описали еще в 1957 году лабораторные опыты по взаимодействию монохромата натрия и бихромата натрия с газообразным аммиаком (Труды Урал. научно-исследовательского хим. инст. 4, 1957, стр.30-32). Согласно их исследованиям монохромат натрия и бихромат натрия могут только при температуре 700°C быть восстановлены газообразным аммиаком в хромит натрия NaCrO2. Гидролиз хромита натрия описывается, как труднопротекающий, а по поводу дальнейшей переработки в оксид хрома авторы не упоминают.
Задача данного изобретения состояла в том, чтобы создать способ получения оксида хрома, который является экономически выгодным и, наряду с этим, получить оксид хрома, который можно применять для металлургических целей, то есть содержащий очень малые количества серы и щелочных металлов, в частности, имеет малое содержание натрия, а также по возможности малое содержание побочных продуктов.
Неожиданно было обнаружено, что газообразный аммиак может быть применен в качестве реагента для монохромата натрия и таким путем создается возможность получения оксида хрома(III) через хромит натрия. Изобретение относится в связи с этим к способу получения оксида хрома(III), включающему стадии:
a) взаимодействия монохромата натрия с газообразным аммиаком, в частности, при температуре от 200 до 800°C,
b) гидролиза продукта реакции, полученного на стадии a), причем pH-значение воды для гидролиза перед гидролизом и/или предпочтительно щелочного маточного раствора во время или после гидролиза понижают с помощью кислоты до значения 4-11, предпочтительно до значения 5-10,
c) выделения продукта гидролиза, выпавшего в осадок на стадии b), предпочтительно при pH-значении от 4 до 11, более предпочтительно при pH-значении от 5 до 10, и при необходимости промывания и при необходимости сушки и
d) кальцинирования продукта гидролиза, полученного на стадии c) при температуре от 700 до 1400°C, более предпочтительно при температуре от 800 до 1300°C.
Стадия a)
В качестве исходного материала для получения оксида хрома (III) применяли монохромат натрия. При этом не существенно, применяется ли монохромат натрия в виде безводных соединений или в виде их гидратов.
Монохромат натрия может применяться или в виде раствора, в частности в виде водного раствора, или в виде суспензии, или в виде твердого вещества. В способе согласно данному изобретению предпочтительно применяют твердые вещества, причем эти вещества предпочтительно имеют остаточную влажность менее 4,0 вес. процентов, предпочтительно менее 2,0 вес. процентов. Также предпочтительно, когда применяемый монохромат натрия имеет содержание гидроксида щелочного металла менее 2 вес. процентов, более предпочтительно менее 1 вес. процента, еще более предпочтительно менее 0,5 вес. процента.
Применяемый на стадии a) монохромат натрия необязательно применять в чистом виде. Может оказаться предпочтительным также применение смеси. Так предпочтителен способ согласно данному изобретению, при котором на стадии a) применяют монохромат натрия в качестве единственного соединения хрома или монохромат натрия в смеси с другими соединениями, содержащими Cr(III) и Cr(VI).
Так, например, особенно предпочтительны смеси монохромата натрия и других соединений, содержащих Cr(III) и Cr(VI). Предпочтительно монохромат натрия применяют в виде смеси с другими соединениями, содержащими Cr(III) и Cr(VI). Такого рода соединениями, содержащими Cr(III) и Cr(VI), применяемыми в смеси с монохроматом натрия, являются предпочтительно оксид хрома(III), хромит натрия, двойная соль хромата натрия-аммония, монохромат аммония, дихромат аммония или хромихромат натрия. Так предпочтителен способ согласно данному изобретению, при котором на стадии a) применяют монохромат натрия в смеси с оксидом хрома(III), хромитом натрия, двойной солью хромата натрия-аммония, монохроматом аммония, бихроматом аммония или хромихроматом натрия.
Такие смеси можно получать синтетически путем смешивания компонентов, однако их можно получать другим путем, например, с помощью твердотельной реакции. Твердотельная реакция между хромитом натрия и бихроматом натрия происходит предпочтительно при температуре выше 300°C. В этом случае из обоих этих компонентов образуется монохромат натрия и оксид хрома(III).
Хромихроматы натрия по смыслу данного изобретения представляют собой соединения, у которых хром находится не только при степени окисления +VI (в виде хромата), но также одновременно и при степени окисления +III. В качестве примера такого рода хромихромата натрия здесь следует упомянуть только NaCr3O8=NaCr(CrO4)2.
К примерам двойных солей хромата натрия-аммония относятся соединения с идеальным составом 3(NH4)2CrO4*Na2CrO4 (=Na0,5(NH4)1,5CrO4) или NaNHCrO4*2H2O, соответственно, в безводной форме NaNHCrO4.
В том случае, когда на стадии a) применяют смеси монохромата натрия с другими соединениями, содержащими Cr(III) и/или Cr (VI), то молярная доля монохромата натрия в смеси составляет, как минимум 30%, более предпочтительно, как минимум 40%, еще более предпочтительно, как минимум 50%, в пересчете на все хромсодержащие соединения смеси. Предпочтительно такая смесь содержит менее 20, более предпочтительно менее 10, еще более предпочтительно менее 5 мол. процентов бихромата натрия, в пересчете на все хромсодержащие соединения смеси.
Реакция монохромата натрия с газообразным аммиаком происходит предпочтительно при температуре от 200 до 800°C, более предпочтительно при температуре от 200 до 650°C, еще более предпочтительно при температуре от 300 до 600°C. Оказалось, что восстановление монохромата натрия аммиаком происходит полностью и в том случае, когда температура реакции отчетливо ниже температуры плавления монохромата натрия, что позволяет избежать опасности расплавления монохромата натрия и прилипания во время восстановления. При этом не обязательно, чтобы реакция проходила при одной и той же температуре. Оказалось предпочтительным, когда температура в ходе реакции повышается. Предпочтительно реакцию начинают при температуре от 200 до 400°C и эту температуру поддерживают до тех пор, пока не будет замечено повышение температуры. Для дальнейшего превращения после этого можно повысить температуру, причем это повышение может происходить непрерывно или ступенчато.
Реакция монохромата натрия с газообразным аммиаком происходит предпочтительно в не непосредственно нагреваемом реакторе, в частности, во вращающейся трубчатой печи или в вихревом слое.
Время реакции составляет, как правило, от 0,5 до 10 часов и зависит среди прочего от температуры реакции, от использованного монохромата натрия и от размеров кристалла использованного монохромата натрия. По этой причине может оказаться предпочтительным, когда монохромат натрия измельчают перед тем, как его подают на стадию a). Предпочтительны частицы менее чем 1000 мкм, более предпочтительно менее чем 500 мкм, еще более предпочтительно менее чем 300 мкм.
Реакция монохромата натрия с газообразным аммиаком приводит среди прочего к образованию хромита натрия в качестве продукта реакции. Образовавшийся хромит натрия NaCrO2 удалось обнаружить с помощью рентгенограммы порошка в одном из описанных ниже примеров.
Для того чтобы гарантировать по возможности полное превращение при реакции, газообразный аммиак предпочтительно применяют не в точно стехиометрическом отношении, а в избытке. Предпочтительно избыток аммиака составляет, как минимум 5%, более предпочтительно, как минимум 10%, еще более предпочтительно от 10 до 30%, в пересчете на стехиометрическое количество монохромата натрия.
Предпочтительно вначале завершают превращение согласно стадии a), а после этого реакционный продукт гидролизуют четырехкратным количеством воды с образованием суспензии с pH-значением, как минимум 11, более предпочтительно, как минимум 12, еще более предпочтительно, как минимум 13. Для установления по возможности полного завершения превращения предпочтительно делают забор проб реакции, подвергают их гидролизу водой, как описано, и определяют pH-значение полученной суспензии.
Продукт реакции, полученный на стадии a), можно перед проведением стадии b) также подвергнуть измельчению, чтобы обеспечить по возможности быстрый и полный гидролиз.
Стадия b)
Продукт реакции, полученный на стадии a), гидролизуют водой, причем образуется осадок и маточный щелок.
Гидролиз можно проводить при комнатной температуре или также при повышенной температуре. При гидролизе в качестве осадка образуется гидроксид хрома(III) и/или оксидгидроксид хрома(III) и натронный щелок, так что образующийся маточный щелок при применении чистой воды показывает очень высокое pH-значение. Гидролиз на примере хромита натрия NaCrO2 можно формально описать двумя следующими уравнениями реакций:
,
.
Впадающий при этом в осадок продукт гидролиза является рентгеноаморфным, так что установление его точной структуры пока не было возможно. Предпочтительно применяют для гидролиза продукта реакции, полученного на стадии a), как минимум, равное по весу количество воды. В связи с тем что вязкость полученной суспензии может оказаться слишком высокой, предпочтительно применяют для гидролиза, как минимум, двойное по весу количество воды, в пересчете на вес продукта реакции, полученного на стадии a). Независимо от точной структуры и состава продукт гидролиза при применении чистой воды суспендируют в сильно щелочном маточном щелоке. Продукт гидролиза, как правило, является мелкочастичным, однако он показывает отчетливо лучшие фильтрационные свойства (отчетливо более короткие времена фильтрования) по сравнению с продуктом гидролиза, который был получен при восстановлении бихромата натрия аммиаком. Предпочтительно понижение pH-значения проводят при температуре от 20 до 140°C, более предпочтительно от 40 до 100°C. Еще более предпочтительно понижение pH-значения проводят во время или после гидролиза. Еще более предпочтительно понижение pH-значения проводят перед происходящим на стадии c) отделением выпавшего в осадок продукта гидролиза. Для понижения pH-значения предпочтительно применяют неорганические кислоты или органические кислоты. К неорганическим кислотам по смыслу данного изобретения относятся и кислореагирующие в воде газы, такие как, например, двуокись углерода. Эти кислореагирующие газы могут вводиться при нормальном или повышенном давлении в маточный щелок. Более предпочтительно применяют органические кислоты, в частности, низкомолекулярные органические кислоты, такие как, например, муравьиная кислота и уксусная кислота. Эти органические кислоты имеют то преимущество, что они - в случае если остатки остаются в продукте гидролиза и эти остатки не удается удалить при промывке на стадии c) - при позднейшем кальцинировании на стадии d) путем окисления разлагаются без остатков и не остаются в виде примесей в кальцинированном продукте.
Наиболее предпочтительно применяют двуокись углерода для задания pH-значения, которую можно вводить при нормальном давлении или при повышенном давлении в маточный щелок. Предпочтительно pH-значение после его задания лежит в области от 4 до 11, более предпочтительно в области от 5 до 10. Задание pH-значения может происходить одноступенчато или многоступенчато.
Преимущество применения CO2 для задания pH-значения состоит в том, что таким путем может быть получен карбонат натрия или гидрокарбонат натрия из щелочного маточного щелока. При этом карбонат натрия или гидрокарбонат натрия может быть отделен различными непрерывными или прерывистыми способами твердо/жидкого разделения. Из непрерывно работающих агрегатов более предпочтительны, например, вакуумные барабанные фильтры или вакуумные ленточные фильтры, или центрифуги. Карбонат натрия можно напрямую опять применять для получения монохромата и бихромата натрия путем оксидативного разложения хромжелезной руды. В случае гидрокарбоната натрия, его можно отжигом перевести в карбонат натрия, а после этого применять для получения монохромата и бихромата натрия путем оксидативного разложения хромжелезного штейна. Двуокись углерода, высвобождающаяся при отжиге гидрокарбоната натрия с образованием карбоната натрия, можно возвратить в процесс с целью понижения pH-значения.
Стадия c)
Полученный на стадии b), выпавший в осадок продукт гидролиза, содержащий хром, отделяют от маточного щелока. Специалистам известно много подходящих агрегатов и способов твердо/жидкого разделения. Является несущественным, происходит ли твердо/жидкое разделение и при необходимости примыкающее промывание непрерывно или прерывисто. Также несущественно, проводятся ли они при повышенном или при пониженном давлении.
В случае непрерывно работающих фильтровальных и промывающих агрегатов более предпочтительны, например, вакуумные барабанные фильтры или вакуумные ленточные фильтры. Из непрерывно работающих фильтровальных и промывочных агрегатов более предпочтительны фильтр-прессы.
Выделенный, предпочтительно отфильтрованный продукт гидролиза можно промыть или - при необходимости после сушки - подать на стадию d). Специалистам известно большое число подходящих агрегатов для стадии сушки. Здесь следует упомянуть только канальные, ленточные, этажные, валковые, барабанные, трубчатые, лопастные, распылительные сушилки (распылительные сушилки с шайбами или форсунками), сушилки с вихревым слоем или прерывисто работающие камерные сушилки Гордена. Предпочтительно влажный фильтровальный осадок, в частности, без промывки напрямую подают на кальцинирование на стадию d).
Выделенный продукт гидролиза можно также промыть одноступенчато или многоступенчато. Промывание можно проводить непосредственно в воде. Для того чтобы улучшить промывные и фильтровальные свойства полученного твердого вещества, может оказаться предпочтительным уменьшение pH-значения воды для промывания. К промывной воде предпочтительно перед промыванием или во время промывания добавляют кислоту для уменьшения pH-значения. Для этого предпочтительно добавляют неорганические кислоты или органические кислоты, или двуокись углерода, как описано выше. Более предпочтительно применяют органические кислоты, в частности, низкомолекулярные органические кислоты, такие как, например, муравьиная кислота или уксусная кислота. Еще более предпочтительно применяют двуокись углерода для задания pH-значения, двуокись углерода подают в промывную воду при нормальном или повышенном давлении. Предпочтительно pH-значение промывной воды после промывки лежит в интервале от 4 до 11, более предпочтительно в интервале от 5 до 10. Задание pH-значения можно проводить одноступенчато или многоступенчато.
Также может оказаться предпочтительным, когда перед фильтрованием или перед промыванием применяют хлопьеобразующие средства или вспомогательные хлопьеобразующие средства. Введение органических хлопьеобразующих средств или вспомогательных хлопьеобразующих средств особенно предпочтительно, так как они при последующем кальцинировании на стадии d) разлагаются при оксидации без образования остатков и не остаются в кальцинированном продукте в качестве примесей. Предпочтительными хлопьеобразующими средствами являются анионные электролиты, например, на основе полиакрилата, полиакриламида, полиэтиленимина и полиэтиленоксида с различной длиной цепи. Наряду с этим, могут применяться