Α,ω-бис(амидо- и гидразидометилсульфинил- и сульфонил)алканы, обладающие противотуберкулезной активностью, и α,ω-бис(метоксикарбонилметилсульфинил- или сульфонил)алканы для их получения
Иллюстрации
Показать всеИзобретение относится к производным серасодержащих дикарбоновых кислот формулы (1)
в которой при:
X=NH2, m=1, n=2, 3, 4, 5, 6, 7, 8, 10;
X=NH2, m=2, n=1, 2, 3, 4, 5, 6, 7, 8, 10;
X=NHNH2, m=1, n=1, 2, 3, 5, 6, 7, 8, 10;
X=NHNH2, m=2, n=1, 2, 3, 4, 5, 6, 7, 8, 10.
Также изобретение относится к производным серасодержащих дикарбоновых кислот формулы (2)
в которой при:
m=1, n=2, 3, 4, 5, 6, 7, 8, 10;
m=2, n=3, 4, 5, 6, 7, 8, 10;
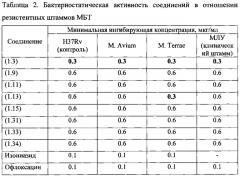
используемым для получения соединений формулы (1). Соединения формулы (1) обладают высокой туберкулостатической активностью, в том числе по отношению к мультирезистентным штаммам микобактерий, низкой токсичностью и простотой синтеза. 3 н.п. ф-лы, 2 табл., 59 пр.
Реферат
Изобретение относится к области органической химии, а именно к производным серасодержащих дикарбоновых кислот формулы (1),
в которой при:
X=NH2, m=1, n=2, 3, 4, 5, 6, 7, 8, 10;
X=NH2, m=2, n=1, 2, 3, 4, 5, 6, 7, 8, 10;
X=NHNH2, m=1, n=1,2, 3, 5, 6, 7, 8, 10;
X=NHNH2, m=2, n=1, 2, 3, 4, 5, 6, 7, 8, 10;
Соединения формулы (1) обладают противотуберкулезной активностью и могут найти применение в медицине и ветеринарии.
Изобретение также относится к новым α,ω-бис(метокси-карбонилметилсульфинил- или сульфонил)алканам формулы (2), которые используют для получения соединений формулы (1).
в которой при:
m=1, n=2, 3, 4, 5, 6, 7, 8, 10;
m=2, n=3, 4, 5, 6, 7, 8, 10.
На сегодняшний день самой распространенной инфекцией-убийцей является туберкулез [http://www.who.int/tb/en (2009); Global Tuberculosis Control: Survelliance, Planning, Financing; WHO Report 2009; World Health Organization: Geneva, 2009]. Статистика показывает, что в 2013 г. в мире им заболело 8 млн. человек и умерло 1.5 млн., из них 360 тыс. ВИЧ-инфицированных. В России в 2013 г. зарегистрировано 142 тыс. случаев заболевания туберкулезом. Эти данные свидетельствуют, насколько велико социально-экономическое значение туберкулеза, соизмеримое по своим негативным последствиям с любым стихийным бедствием или биологической катастрофой. К сожалению, борьба с туберкулезом методами современной химиотерапии должного эффекта не имеет. Основной причиной является то, что микобактерия туберкулеза гипермутабельна - при попадании внутрь клетки начинаются ее многочисленные мутации, ведущие к ее резистентности, повышению скорости роста и других неприятных качеств этого патогена.
В 2013 г. зарегистрировано 480 тыс. случаев заболеваний, вызванных резистентными штаммами микобактерий (MDR), в том числе почти 44 тыс. случая в России. Заболевания, вызванные MDR-штаммами М. tuberculosis, имеют остро прогрессирующий характер и плохо поддаются лечению существующими препаратами. Поэтому существует острая необходимость в разработке новых противотуберкулезных средств, обладающих нетрадиционным механизмом действия на патоген.
В настоящее время геном микобактерий достаточно хорошо изучен, и определен ряд перспективных биологических мишеней, селективное воздействие на которые способно привести к ощутимым эффектам в терапии туберкулеза, и особенно его MDR и XDR-видов [Y. Zhang, L.M. Amzel. // Current Drug Targets. 2002. Vol. 3. P. 131-154; Y.L. Janin. //Bioorg. Med. Chem. 2007. Vol. 15. P. 2479-2513; M. - T. Gutierrez-Lugo, С.A. Bewle. // J. Med. Chem. 2008. Vol. 51. P. 2606-2612].
Одной из таких мишеней является фермент - β-кетоацилсинтаза жирных кислот [L. Kremer, L.G. Dover et al. //Biochem. J. 2002. Vol. 364. P. 423-430; E.K. Schroeder, O.N. de Souza et al. // Curr. Pharm. Biotechnol. 2002. Vol. 3. P. 197-225; L.A. Basso, D.S. Santos. //Med. Chem. Rev. 2005. Vol. 2. P. 393-413]. Данная биомишень является весьма привлекательной целью для разработки лекарственных средств.
Известны соединения, синтезированные как потенциальные ингибиторы β-кетоацилсинтазы, и поэтому обладающие высокой антимикобактериальной активностью и видоспецифичностью по отношению к микобактериям. Это производные изоциануратов [RU 2424235, Опубл. 20.07.2011] и 2,4-диаминотриазинов [RU 2431633, Опубл. 20.10.2011]. Наиболее активными из описанных соединений являются 1-[5-(карбазоилметилсульфинил)-пентил)]-3,5-диметилизоцианурат (МИК 0.05 мкг/мл, LD50 3000 мг/кг, мыши) и 2,4-диамино-6-(карбамоилметил-сульфинилметил]-1,3,5-триазин (МИК 0.1 мкг/мл, LD50 2000 мг/кг, мыши). Однако существенным недостатком данных соединений является плохая растворимость в воде. Кроме того, синтез соединений является сложным, требующим труднодоступных исходных реагентов.
Наиболее близкими по структуре и биологическому действию к заявляемым соединениям формулы (1), являются соединения общей формулы R-SOn-Z-CO-Y, в которой R = алкильный радикал с 6-20 атомами углерода или алкильный радикал, связанный с ароматическим кольцом; n=1 или 2; Z=CH2, (СН2)2 или СН=СН; Y=NH2 или O-СН2-С6Н5 [1) US 2006/0135568 А1, Опубл. 22.06.2006 2) US 2007/0244199 А1, Опубл. 18.10.2007]. Эти соединения были синтезированы как ингибиторы фермента β-кетоацилсинтазы жирных кислот в микобактериях. Однако, как было выяснено позднее при изучении механизма действия н-октанилсульфонилацетамида (OSA), антимикобактериальная активность этого соединения связана не только с ингибированием биосинтеза жирных кислот. Установлено, что OSA воздействует на АТФ-синтазу и, возможно, другие компоненты дыхательной цепи микобактерий, что, в свою очередь, может привести к нарушению энергетического обмена и прекращению биосинтеза больших макромолекул, в том числе и миколовых кислот. [1) Effect of n-octanesulphonylacetamide (OSA) on ATP and protein expression in Mycobacterium bovis BCG / N.M. Parrish, C.G. Ко, M.A. Hughes, C.A. Townsend and J.D. Dick // Journal of Antimicrobial Chemotherapy. - 2004. - 54. - 722-729. 2) Activity of DSA against anaerobically adapted Mycobacterium bovis BCG in vitro / N.M. Parrish, C.G. Ко, J.D. Dick // Tuberculosis. - 89. - 2009, P. 325-327].
Соединения формулы R-SOn-Z-CO-Y проявляют достаточно высокую антимикобактериальную активность in vitro - МИК 0.75-25 мкг/мл, в том числе и по отношению к MDR-штаммам; однако они уступают по активности противотуберкулезным препаратам первого ряда, в частности, изониазиду (МИК 0.1-0.4 мкг/мл).
Задача предлагаемого изобретения - новые соединения, обладающие высокой антимикобактериальной активностью, в том числе по отношению к мультирезистентным штаммам микобактерий, низкой токсичностью, характеризующиеся доступностью и дешевизной исходных реагентов, а также простотой синтеза, расширяющие арсенал известных противотуберкулезных средств.
Технический результат изобретения заключается в заявляемых соединениях - α,ω-бис(амидо- и гидразидометилсульфинил- и сульфонил)алканах, как новых высокоэффективных противотуберкулезных средствах.
В данном изобретении предлагаются α,ω-бис(амидо- и гидразидометилсульфинил- и сульфонил)алканы формулы (1),
в которой
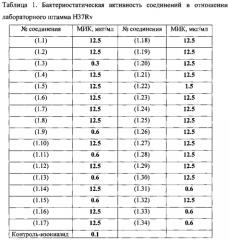
n=2; m=1; X=NH2 (1.1)
n=3; m=1; X=NH2 (1.2)
n=4; m=1; X=NH2 (1.3)
n=5; m=1; X=NH2 (1.4)
n=6; m=1; X=NH2 (1.5)
n=7; m=1; X=NH2 (1.6)
n=8; m=1; X=NH2 (1.7)
n=10; m=1; X=NH2 (1.8)
n=1; m=2; X=NH2 (1.9)
n=2; m=2; X=NH2 (1.10)
n=3; m=2; X=NH2 (1.11)
n=4; m=2; X=NH2 (1.12)
n=5; m=2; X=NH2 (1.13)
n=6; m=2; X=NH2 (1.14)
n=7; m=2; X=NH2 (1.15)
n=8; m=2; X=NH2 (1.16)
n=10; m=2; X=NH2 (1.17)
n=1; m=1; X=NHNH2 (1.18)
n=2; m=1; X=NHNH2 (1.19)
n=3; m=1; X=NHNH2 (1.20)
n=5; m=1; X=NHNH2 (1.21)
n=6; m=1; X=NHNH2 (1.22)
n=7; m=1; X=NHNH2 (1.23)
n=8; m=1; X=NHNH2 (1.24)
n=10; m=1; X=NHNH2 (1.25)
n=1; m=2; X=NHNH2 (1.26)
n=2; m=2; X=NHNH2 (1.27)
n=3; m=2; X=NHNH2 (1.28)
n=4; m=2; X=NHNH2 (1.29)
n=5; m=2; X=NHNH2 (1.30)
n=6; m=2; X=NHNH2 (1.31)
n=7; m=2; X=NHNH2 (1.32)
n=8; m=2; X=NHNH2 (1.33)
n=10; m=2; X=NHNH2 (1.34)
Техническим результатом также являются новые α,ω-бис(метоксикарбонилметилсуль-финил- или сульфонил)алканы формулы (2), используемые для получения соединений формулы (1).
в которой
n=2; m=1 (2.1)
n=3; m=1 (2.2)
n=5; m=1 (2.3)
n=6; m=1 (2.4)
n=7; m=1 (2.5)
n=8; m=1 (2.6)
n=10; m=1 (2.7)
n=3; m=2 (2.8)
n=4; m=2; (2.9)
n=5; m=2 (2.10)
n=6; m=2 (2.11)
n=7; m=2 (2.12)
n=8; m=2 (2.13)
n=10; m=2 (1.14)
Соединения (1.9) и (1.26) описаны в литературе [1) Журнал, органической химии. 1994. Т. 30. Вып. 2, стр. 201-206. 2) Журнал органической химии. 1995. Т. 31. Вып. 4, стр. 565-569], однако их противотуберкулезные свойства не были известны. Остальные приведенные выше соединения являются новыми.
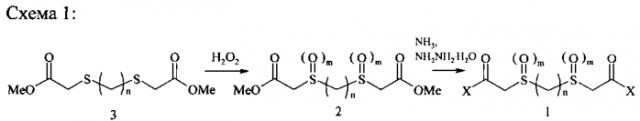
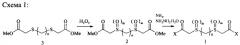
Соединения формулы (1) могут быть получены на основе соединений формулы (3) двумя способами. По способу 1, сульфиды (3) сначала окисляют до сульфонов или сульфоксидов формулы (2), а затем обрабатывают аммиаком или гидразингидратом (схема 1). По способу 2, взаимодействием сульфидов (3) с аммиаком получают амиды (4), которые затем окисляют (схема 2).
Сульфиды формулы (3) являются ключевыми соединениями для синтеза целевых структур общей формулы (1), способы их получения известны. Так α,ω-бис(метокси-карбонилметиотио)алканы (3) с n=1-3 описаны в литературе [1) Ahem, Т.Р.; Fong, Н.О.; Langler, R.F.; Mason, P.M. Canadian Journal of Chemistry (1980), 58(9), 878-83. 2) Ogata, N.; Hosoda, Y; Suzuki, G. Polymer Journal (Tokyo, Japan) (1974), 6(5), 412-18. 3) Oswald, A.A.; Griesbaum, K.; Hall, D.N.; Naegele, W. Preprints - American Chemical Society, Division of Petroleum Chemistry (1964), 9(3), 29-42. 4) Ransley, D.L. US 3361808 А, Опубл. 02.01.1968]. Остальные соединения (3) являются новыми.
Окисление сульфидов (3) до соответствующих сульфоксидов или сульфонов (2) проводили по известным методикам [1) D.A. Alonso, С. Najera and M. Varea. Tetrahedron Lett, 2002, 43, 3459. 2) A.B. Свиридова, В.И. Лаба, E.H. Прилежаева. Журн. орган, химии, 1971, VII, 2480. 3) Л.Ф. Сайфина, М.М. Шулаева, С.Г. Фаттахов и др. Известия АН. Сер. Хим. 2008. №12. Стр. 2528-2534]. В литературе описаны сульфоксид (3, m=1, n=1) [Ahern, T.P.; Fong, H.O.; Langler, R.F.; Mason, P.M. Canadian Journal of Chemistry (1980), 58(9), 878-83] и сульфоны (3, m=2, n=1 и 2) [1) Ahem, T.P.; Fong, И.О.; Langler, R.F.; Mason, P.M. Canadian Journal of Chemistry (1980), 58(9), 878-83. 2) Baliah, V.; Prema, S; Jawaharsingh, С.В.; Chockalingam, K.N.; Jeyaraman, R. Synthesis (1981), (12), 995-6. 3) Базавова И.М., Неплюев B.M., Лозинский M.O. Журнал органической химии. (1987), 23(2), 428-33 4) Неплюев В.М., Базавова ИМ., Лозинский М.О. Журнал органической химии.(1988), 24(6), 1327-31. 5) Bhavani, N.; Perumal, S.; Banureka, R. Canadian Journal of Chemistry (2005), 83(3), 202-208. 6) Baliah, V.; Prema, G. Indian Journal of Chemistry (1971), 9(11), 1310-11]. Остальные соединения формулы (3) являются новыми.
Характеристики новых соединений приведены в примерах конкретного выполнения. Кроме того, в экспериментальной части приведены способы получения исходных и промежуточных соединений, отличающиеся от описанных в литературе.
Структуры полученных соединений подтверждены методами элементного анализа, ИК и 1Н-ЯМР спектроскопии. Спектры ИК сняты на приборе Specord IR-75 в жидких пленках или в таблетках KBr. Спектры 1Н-ЯМР регистрировали на приборе Bruker MSL-400. Чистоту полученных соединений контролировали методом ТСХ на пластинках «Silufol». Температуры плавления определены на столике Boetius.
Примеры конкретного выполнения.
Пример 1
1,4-Бис(метоксикарбонилметилтио)бутан
К раствору метилата натрия, полученного из 13.8 г (0.6 моля) натрия в 200 мл метанола, прибавляют из капельной воронки 63,7 г (0.6 моля) метилового эфира тиогликолевой кислоты в 50 мл метанола, при этом реакционную массу охлаждают водяной баней, чтобы температура не превышала 25°С, перемешивают 15 мин. Затем прибавляют из капельной воронки 64,8 г (0.3 моля) 1,4-дибромбутана в 50 мл метанола, поддерживая температуру не выше 45°С, охлаждение убирают, нагревают до кипения и кипятят 3-5 часов. Реакционную массу упаривают в вакууме, остаток растворяют в 200 мл воды и экстрагируют 300 мл хлористого метилена, сушат Na2SO4. Растворитель упаривают в вакууме. Получают 72 г (90%) прозрачной желтоватой вязкой жидкости. Rf=0.38 (петролейный эфир-диэтиловый эфир 1:1). Найдено, %: С 45.06; Н 6.73; S 23.98. C10H18O4S2. Вычислено, %: С 45.09; Н 6.81; S 24.07. Спектр ЯМР 1Н, δ, м.д.п., CDCl3: 1.69-1.73 м (4Н, СН2), 2.63-2.67 м (4Н, СН2); 3.39 с (4Н, SCH2); 3.73 с (6Н, ОСН3).
Пример 2
1,5-Бис(метоксикарбонилметилтио)пентан получают в условиях примера 1 из 63.7 г метилового эфира меркаптоуксусной кислоты и 71.7 г
1.5-дибромпентана. Выход 77.2 г (92%), вязкая прозрачная желтоватая жидкость. Rf=0.46 (петролейный эфир-диэтиловый эфир 1:1). Найдено, %: С 47.07; Н 7.15; S 22.69. С11Н20О4S2. Вычислено, %: С 44.12; Н 7.15; S 22.69. Спектр ЯМР 1Н, δ, м.д.п., CDCl3: 1.46-1.53 м (2Н, СН2), 1.58-1.65 м (4Н, СН2); 2.63 т (3JHH 7.3, 4Н, СН2); 3.21 с (4Н, SCH2); 3.73 с (6Н, ОСН3).
Пример 3
1.6-Бис(метоксикарбонилметилтио)гексан получают в условиях примера 1 из 17.9 г метилового эфира меркаптоуксусной кислоты и 20.6 г 1.6-дибромгексана. Выход 22.6 г (91%), вязкая прозрачная желтоватая жидкость. Rf=0.51 (петролейный эфир-диэтиловый эфир 1:1). Найдено, %: С 48.78; Н 7.49; S 21.64. C12H22O4S2. Вычислено, %: С 48.95; Н 7.53; S 21.78. Спектр ЯМР 1Н, δ, м.д.п., CDCl3: 1.38-1.41 м (4Н, СН2), 1.58-1.62 м (4Н, СН2), 2.62 т (3JHH 7.3, 4Н, СН2); 3.21 с (4Н, SCH2); 3.73 с (6Н, ОСН3).
Пример 4
1.7-Бис(метоксикарбонилметилтио)гептан получают в условиях примера 1 из 15.7 г метилового эфира меркаптоуксусной кислоты и 19.1 г 1,7-дибромгептана. Выход 19.7 г (86%), вязкая прозрачная желтоватая жидкость. Rf=0.52 (петролейный эфир-диэтиловый эфир 1:1). Найдено, %: С 50.54; Н 7.75; S 20.71. C13H24O4S2. Вычислено, %: С 50.62; Н 7.84; S 20.79. Спектр ЯМР 1Н, δ, м.д.п., CDCl3: 1.29-1.41 м (6Н, СН2), 1.56-1.62 м (4Н, СН2), 2.62 т (3JHH 7.3, 4Н, СН2); 3.21 с (4Н, SCH2); 3.73 с (6Н, ОСН3).
Пример 5
1,8-Бис(метоксикарбонилметилтио)октан получают в условиях примера 1 из 17.8 г метилового эфира меркаптоуксусной кислоты и 22.8 г 1,8-дибромоктана. Выход 24.0 г (89%), вязкая прозрачная желтоватая жидкость. Rf=0.55 (петролейный эфир-диэтиловый эфир 1:1). Найдено, %: С 52.10; Н 8.03; S 19.87. C14H26O4S2. Вычислено, %: С 52.14; Н 8.13; S 19.89. Спектр ЯМР 1Н, δ, м.д.п., CDC13: 1.27-1.37 м (8Н, СН2), 1.54-1.60 м (4Н, СН2), 2.61 т (3JHH 7.4, 4Н, СН2); 3.20 с (4Н, SCH2); 3.72 с (6Н, ОСН3).
Пример 6
1,10-Бис(метоксикарбонилметилтио)декан получают в условиях примера 1 из 12.8 г метилового эфира меркаптоуксусной кислоты и 18.1 г 1,10-дибромдекана. Выход 19.7 г (93%), вязкая прозрачная желтоватая жидкость. Rf=0.58 (петролейный эфир-диэтиловый эфир 1:1). Найдено, %: С 54.77; Н 8.54; S 18.11. C16H30O4S2. Вычислено, %: С 54.82; Н 8.63; S 18.29. Спектр ЯМР 1Н, δ, м.д.п., CDC13: 1.24-1.28 м (8Н, СН2), 1.32-1.37 м (4Н, СН2), 1.54-1.60 м (4Н, СН2), 2.60 т (3JHH 7.4, 4Н, СН2); 3.20 с (4Н, SCH2); 3.72 с (6Н, ОСН3). Окисление до сульфоксидов.
Пример 7
1,2-Бис(метоксикарбонилметилсульфинил)этан (2.1)
К раствору 2.28 г 1,2-бис(метоксикарбонилметилтио)этана в 40 мл ацетонитрила добавляют каталитическое количество MnSO4·5H2O и при охлаждении водяной баней (15-18°С) прибавляют из капельной воронки 1.8 мл 35% Н2O2 (избыток 1.1). Реакционную смесь перемешивают при комнатной температуре (18-22°С) 24-48 часов, контролируя наличие исходного сульфида методом ТСХ, затем фильтруют и упаривают в вакууме. Полученное масло при стоянии кристаллизуется, его промывают смесью диэтиловый эфир-этилацетат 10:1. Получают 2.25 г (87%) белого кристаллического вещества. Т.пл. 104-105°С. Найдено, %: С 35.48; Н 5.18; S 23.54. C8H14O6S2. Вычислено, %: С 35.54; Н 5.22; S 23.72. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.21-3.46 м (4Н, CH2SO); 3.72 с (6Н, ОСН3); 3.89, 3.90, 3.92, 3.93, 4.12, 4.13, 4.15, 4.16 (2 АВ, 2JHH 14.5, 4Н, COCH2SO).
Пример 8
1,3-Бис(метоксикарбонилметилсульфинил)пропан (2.2) получают в условиях примера 7 из 2.44 г 1,3-бис(метоксикарбонилметилтио)пропана. Выход 2.13 г (77%), белое кристаллическое вещество. Т.пл. 94-95°С. Найдено, %: С 37.82; Н 5.44; S 22.38. C9H16O6S2. Вычислено, %: С 38.01; Н 5.67; S 22.55. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 2.05-2.10 м (2Н, СН2), 2.94-3.06 м (4Н, CH2SO); 3.71 с (6Н, ОСН3); 7.82, 3.86, 4.05, 4.08 (АВ, 2JHH 14.2, 4Н, COCH2SO).
Пример 9
1.5-Бис(метоксикарбонилметилсульфинил)пентан (2.3) получают в условиях примера 7 из 3.20 г 1,5-бис(метоксикарбонилметилтио)пентана. Выход 3.03 г (85%), белое кристаллическое вещество. Т.пл. 97-98°С. Найдено, %: С 42.18; Н 6.34; S 20.41. С12Н22О6S2. Вычислено, %: С 42.29; Н 6.45; S 20.53. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.51-1.57 м (2Н, СН2), 1.67-1.73 м (4Н, СН2), 2.85-2.89 м (4Н, CH2SO); 3.70 с (6Н, ОСН3); 7.76, 3.79, 4.00, 4.03 (АВ, 2JHH 14.2, 4Н, COCH2SO).
Пример 10
1.6-Бис(метоксикарбонилметилсульфинил)гексан (2.4) получают в условиях примера 7 из 2.55 г 1,6-бис(метоксикарбонилметилтио)гексана. Выход 2.40 г (85%), белое кристаллическое вещество. Т.пл. 103-104°С. Найдено, %: С 44.06; Н 6.70; S 19.58. C12H22O6S2. Вычислено, %: С 44.15; Н 6.79; S 19.65. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.41-1.48 м (4Н, СН2), 1.64-1.68 м (4Н, СН2), 2.83-2.89 м (4Н, CH2SO); 3.70 с (6Н, ОСН3); 3.76, 3.79, 4.00, 4.03 (АВ, 2JНН 14, 4Н, COCH2SO).
Пример 11
1.7-Бис(метоксикарбонилметилсульфинил)гептан (2.5) получают в условиях примера 7 из 2.58 г 1,7-бис(метоксикарбонилметилтио)гептана. Выход 2.41 г (85%), белое кристаллическое вещество. Т.пл. 105-106°С. Найдено, %: С 45.74; Н 7.08; S 18.59. C13H24O6S2. Вычислено, %: С 45.86; Н 7.11; S 18.59. Спектр ЯМР % 1H, δ, м.д.п., d6-ДМСО: 1.20-1.50 м (6Н, СН2), 1.62-1.69 м (4Н, СН2), 2.83-2.86 м (4Н, CH2SO); 3.70 с (6Н, ОСН3); 7.75, 3.78, 3.99,4.02 (АВ, 2JHH 14, 4Н, COCH2SO).
Пример 12
1.8-Бис(метоксикарбонилметилсульфинил)октан (2.6) получают в условиях примера 7 из 2.72 г 1,8-бис(метоксикарбонилметилтио)октана. Выход 2.63 г (88%), белое кристаллическое вещество. Т.пл. 104-105°С. Найдено, %: С 47.28; Н 7.24; S 18.00. С14Н26О6S2. Вычислено, %: С 47.44; Н 7.39; S 18.09. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.30-1.43 м (8Н, СН2), 1.62-1.68 м (4Н, СН2), 2.82-2.86 м (4Н, CH2SO); 3.70 с (6Н, ОСН3); 7.75, 3.78, 3.99, 4.02 (АВ, 2JHH 14, 4Н, COCH2SO).
Пример 13
1,10-Бис(метоксикарбонилметилсульфинил)декан (2.7) получают в условиях примера 7 из 3.60 г 1,10-бис(метоксикарбонилметилтио)декана. Выход 3.30 г (84%), белое кристаллическое вещество. Т.пл. 105-106°С. Найдено, %: С 50.08; Н 7.82; S 16.68. C16H30O6S2. Вычислено, %: С 50.24; Н 7.82; S 16.68. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.28-1.35 м (8Н, СН2), 1.36-1.43 м (4Н, СН2), 1.61-1.67 м (4Н, СН2), 2.80-2.87 м (4Н, CH2SO); 3.70 с (6Н, ОСН3); 7.75, 3.77, 3.99, 4.02 (АВ, 2JHH 14, 4Н, COCH2SO).
Пример 14
Бис(метоксикарбонилметилсульфинил)метан получают в условиях примера 7 из 2.82 г бис(метоксикарбонилметилтио)метана. Выход 2.68 г (83%), белое кристаллическое вещество. Т.пл. 98-99°С. Найдено, %: С 32.67; Н 4.64; S 24.89. C7H12O6S2. Вычислено, %: С 32.80; Н 4.72; S 25.02. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.72 с, 3.73 с (6Н, ОСН3); 4.11-4.71 (6Н, СН2). [Ahern, Т.Р.; Fong, И.О.; Langler, R.F.; Mason, P.M. Canadian Journal of Chemistry (1980), 58(9), 878-83].
Пример 15
1,4-Бис(амидометилсульфинил)бутан (1.3)
К суспензии 10.0 г 1,4-бис(амидометилтио)бутана в 75 мл уксусного ангидрида прибавляют из капельной воронки 8 мл (избыток 1.1) 35% Н2O2, поддерживая температуру реакционной смеси 18-20°C. Перемешивают при комнатной температуре 48 часов. Фильтруют, осадок промывают метанолом. Для отделения образующегося в качестве побочного продукта сульфона к осадку добавляют 50 мл воды, нагревают до 40°С, фильтруют, фильтрат упаривают, остаток промывают ацетоном. Получают 9.6 г (85%) белого кристаллического вещества, Т.пл. 148-149°C. Найдено, %: С 35.64; Н 5.79; N 10.12; S 23.77. C8H16N2O4S2. Вычислено, %: С 35.81; Н 6.01; N 10.44; S 23.90. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.80-1.84 м (4Н, СН2), 2.77-2.82, 2.85-2.90 м (4Н, CH2SO); 3.51, 3.54, 3.63, 3.67 (АВ, 2JHH 13.3, 4Н, COCH2SO); 7.31, 7.66 уш. с. (4Н, NH2). Окисление до сульфонов.
Пример 16
1,3-Бис(метоксикарбонилметилсульфонил)пропан (2.8)
К раствору 9.69 г 1,3-бис(метоксикарбонилметилтио)пропана в 75 мл ледяной уксусной кислоты прибавляют из капельной воронки 16 мл 35% Н2О2 (избыток 1.1-1.2) таким образом, чтобы температура реакционной смеси не превышала 60°С, перемешивают 15-30 мин., затем осторожно нагревают до 60°С и перемешивают 4 часа. Охлаждают, добавляют 100-150 мл диэтилового эфира, выпавшие пластинчатые кристаллы фильтруют и промывают эфиром. Получают 8.6 г (71%). Т.пл. 119-120°C. Найдено, %: С 34.12; Н 5.03; S 20.18. C9H16O8S2. Вычислено, %: С 34.17; Н 5.10; S 20.27. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 2.17-2.25 м (2Н, СН2), 3.48 т (3JHH 7.7, 4Н, CH2SO2); 3.73 с (6Н, ОСН3); 4.50 с (4Н, COCH2SO2).
Пример 17
1.4-Бис(метоксикарбонилметилсульфонил)бутан (2.9) получают в условиях примера 16 из 3.19 г 1,4-бис(метоксикарбонилметилтио)бутана. Выход 3.20 г (81%), игольчатые кристаллы. Т.пл. 115°C. Найдено, %: С 36.27; Н 5.38; S 19.24. C10H18O8S2. Вычислено, %: С 36.35; Н 5.49; S 19.41. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.86-1.92 м (4Н, СН2), 3.36 т (3JHH 6.7, 4Н, CH2SO2); 3.73 с (6Н, ОСН3); 4.42 с (4Н, COCH2SO2).
Пример 18
1.5-Бис(метоксикарбонилметилсульфонил)пентан (2.10) получают в условиях примера 16 из 15.79 г 1,5-бис(метоксикарбонилметилтио)-пентана. Выход 14.50 г (75%), мелкие игольчатые кристаллы. Т.пл. 86°C. Найдено, %: С 38.29; Н 5.78; S 18.54. C11H20O8S2. Вычислено, %: С 38.36; Н 5.85; S 18.62. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.51-1.56 м (2Н, СН2), 1.73-1.78 м (4Н, СН2), 3.31 т (3JHH 8.0, 4Н, CH2SO2); 3.72 с (6Н, ОСН3); 4.42 с (4Н, COCH2SO2).
Пример 19
1.6-Бис(метоксикарбонилметилсульфонил)гексан (2.11) получают в условиях примера 16 из 16.11 г 1,6-бис(метоксикарбонилметилтио)гексана. Выход 15.0 г (76%), пластинчатые кристаллы. Т.пл. 85°C. Найдено, %: С 40.17; Н 6.14; S 17.78. C12H22O8S2. Вычислено, %: С 40.21; Н 6.19; S 17.89. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.42-1.45 м (4Н, СН2), 1.70-1.75 м (4Н, СН2), 3.28 т (3JHH 7.9, 4Н, CH2SO2); 3.72 с (6Н, ОСН3); 4.40 с (4Н, COCH2SO2).
Пример 20
1.7-Бис(метоксикарбонилметилсульфонил)гептан (2.12) получают в условиях примера 16 из 10.15 г 1,7-бис(метоксикарбонилметилтио)гептана. Выход 9.10 г (74%), игольчатые кристаллы. Т.пл. 86°C. Найдено, %: С 41.90; Н 6.43; S 17.16. C13H24O8S2. Вычислено, %: С 41.92; Н 6.49; S 17.22. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.32-1.45 м (6Н, СН2), 1.69-1.75 м (4Н, СН2), 3.28 т (3JHH 8.0, 4Н, CH2SO2); 3.72 с (6Н, ОСН3); 4.40 с (4Н, COCH2SO2).
Пример 21
1,8-Бис(метоксикарбонилметилсульфонил)октан (2.13) получают в условиях примера 16 из 2.42 г 1,8-бис(метоксикарбонилметилтио)октана. Выход 2.50 г (86%), пластинчатые кристаллы. Т.пл. 103-104°C. Найдено, %: С 43.42; Н 6.71; S 16.54. C14H26O8S2. Вычислено, %: С 43.51; Н 6.78; S 16.59. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.28-1.42 м (8Н, СН2), 1.68-1.75 м (4Н, СН2), 3.28 т (3JHH 8.0, 4Н, CH2SO2); 3.72 с (6Н, ОСН3); 4.40 с (4Н, COCH2SO2).
Пример 22
1,10-Бис(метоксикарбонилметилсульфонил)декан (2.14) получают в условиях примера 16 из 2.64 г 1,10-бис(метоксикарбонилметилтио)декана. Выход 2.50 г (84%), мелкие игольчатые кристаллы вещество. Т.пл. 117-118°C. Найдено, %: С 46.29; Н 7.16; S 15.35. C16H30O8S2. Вычислено, %: С 46.36; Н 7.29; S 15.47. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.24-1.29 м (8Н, СН2), 1.36-1.42 м (4Н, СН2), 1.67-1.75 м (4Н, СН2), 3.27 т (3JHH 8.0, 4Н, CH2SO2); 3.72 с (6Н, ОСН3); 4.39 с (4Н, COCH2SO2).
Пример 23
Бис(метоксикарбонилметилсульфонил)метан получают в условиях примера 16 из 3.63 г бис(метоксикарбонилметилтио)метана. Выход 2.53 г (54%), мелкие игольчатые кристаллы. Т.пл. 106°C. Найдено, %: С 28.95; Н 4.17; S 22.14. C7H12O8S2. Вычислено, %: С 29.16; Н 4.20; S 22.25. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.75 с (6Н, ОСН3); 4.67 с (4Н, COCH2SO2); 5.60 с (4Н, SO2CH2SO2).[1); Ahern, Т.Р.; Fong, H.О.; Langler, R.F.; Mason, P.M. Canadian Journal of Chemistry (1980), 58(9), 878-83. 2) Baliah, V.; Prema, S.; Jawaharsingh, C.B.; Chockalingam, K.N.; Jeyaraman, R. Synthesis (1981), (12), 995-6. 3) Базавова И.M., Неплюев B.M., Лозинский M.O. Журнал органической химии. (1987), 23(2), 428-33 4) Неплюев В.М., Базавова ИМ., Лозинский М.О. Журнал органической химии.(1988), 24(6), 1327-31].
Пример 24
1,2-Бис(метоксикарбонилметилсульфонил)этан получают в условиях примера 16 из 3.41 г 1,2-бис(метоксикарбонилметилтио)этана. Выход 3.58 г (82%), пластинчатые кристаллы. Т.пл. 101°C. Найдено, %: С 31.72; Н 4.58; S 21.13. C8H14O8S2. Вычислено, %: С 31.78; Н 4.67; S 21.21. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.74 с (6Н, ОСН3); 3.81 с (4Н, СН2); 4.66 с (4Н, COCH2SO2). [Bhavani, N.; Perumal, S.; Banureka, R. Canadian Journal of Chemistry (2005), 83(3), 202-208].
Пример 25
1,2-Бис(амидометилсульфонил)этан (1.10) получают в условиях примера 16 из 0.92 г 1,2-бис(амидометилтио)этана. Выход 1.02 г (78%), белое кристаллическое вещество. Т.пл. 245-246°C. Найдено, %: С 26.42; Н 4.38; N 10.21; S 23.44. C6H12N2O6S2. Вычислено, %: С 26.46; Н 4.44; N 10.29; S 23.55. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.78 с (4Н, СН2); 4.18 с (4Н, COCH2SO2); 7.45, 7.78 уш.с. (4Н, NH2).
Взаимодействие с аммиаком
К α,ω-бис(метоксикарбонилметилсульфинил- или сульфонил)алкану (2) по схеме 1 или α,ω-бис(метоксикарбонилметилтио)алкану (3) по схеме 2 добавляют избыток водного аммиака и оставляют при комнатной температуре на 24-48 часов, периодически перемешивая. Осадок фильтруют, промывают холодной водой, метанолом. Перекристаллизовывают из воды.
Пример 26
1,2-Бис(амидометилтио)этан.
К 0,01 молю 1,2-бис(метоксикарбонилметилтио)этана добавляют 40 мл водного аммиака (чда ГОСТ 3760-79) и оставляют при комнатной температуре (18-22°С) на 24-48 часов, периодически перемешивая. Осадок фильтруют, промывают 20 мл холодной воды и перекристаллизовывают из воды. Выход 88%, белое кристаллическое вещество. Т.пл. 177-178°C. Найдено, %: С 34.52; Н 5.76; N 13.38; S 30.71. C6H12N2O2S2. Вычислено, %: С 34.60; Н 5.81; N 13.45; S 30.79. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 2.80 с (4Н, СН2); 3.10 с (4Н, COCH2S); 6.70, 7.42 уш. с (4Н, NH2).
Пример 27
1,4-Бис(амидометилтио)бутан. Выход 87%, белое кристаллическое вещество. Т.пл. 148-149°C. Найдено, %: С 40.62; Н 6.77; N 11.80; S 26.94. C8H16N2O2S2. Вычислено, %: С 40.65; Н 6.82; N 11.85; S 27.13. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.59-1.62 м (4Н, СН2); 2.57 т (3JHH 6.4, 4Н, CH2S); 3.05 с (4Н, COCH2S); 6.96, 7.38 уш. с (4Н, NH2).
Пример 28
1,2-Бис(амидометилсульфинил)этан (1.1). Выход 75%, белое кристаллическое вещество. Т.пл. 235°С с разложением. Найдено, %: С 29.92; Н 5.02; N 11.58; S 26.57. C6H12N2O4S2. Вычислено, %: С 30.00; Н 5.03; N 11.66; S 26.69. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.08-3.20 м, 3.24-3.30 м (4Н, CH2SO); 3.60, 3.63, 3.76, 3.79 (АВ, 2JHH 13.5, 4Н, COCH2SO); 7.34, 7.67 уш. с. (4Н, NH2).
Пример 29
1,3-Бис(амидометилсульфинил)пропан (1.2). Выход 69%, белое кристаллическое вещество. Т.пл. 211-212°С с разложением. Найдено, %: С 32.92; Н 5.48; N 10.87; S 25.18. C7H14N2O4S2. Вычислено, %: С 33.06; Н 5.55; N 11.01; S 25.22. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 2.06-2.12 м (2Н, СН2), 2.86-2.93, 2.96-3.04 м (4Н, CH2SO); 3.55, 3.58, 3.67, 3.70 (АВ, 2JHH 14.9, 4Н, COCH2SO); 7.30, 7.65 уш. с. (4Н, NH2).
Пример 30
1,5-Бис(амидометилсульфинил)пентан (1.4). Выход 71%, белое кристаллическое вещество. Т.пл. 209-210°C. Найдено, %: С 38.19; Н 6.37; N 9.78; S 22.64. C9H18N2O4S2. Вычислено, %: С 38.28; Н 6.42; N 9.92; S 22.71. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.51-1.58 м (2Н, СН2); 1.68-1.74 м (4Н, СН2), 2.73-2.78, 2.83-2.88 м (4Н, CH2SO); 3.51, 3.53, 3.63, 3.66 (АВ, 2JHH 13.4, 4Н, COCH2SO); 7.28, 7.62 уш. с. (4Н, NH2).
Пример 31
1,6-Бис(амидометилсульфинил)гексан (1.5). Выход 83%, белое кристаллическое вещество. Т.пл. 207-208°C. Найдено, %: С 40.41; Н 6.78; N 9.32; S 21.55. C10H20N2O4S2. Вычислено, %: С 40.52; Н 6.80; N 9.45; S 21.64. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.42-1.46 м (4Н, СН2); 1.65-1.70 м (4Н, СН2), 2.71-2.77, 2.81-2.87 м (4Н, CH2SO); 3.50, 3.53, 3.62, 3.65 (АВ, 2JHH 13.3, 4Н, COCH2SO); 7.27, 7.62 уш. с. (4Н, NH2).
Пример 32
1,7-Бис(амидометилсульфинил)гептан (1.6). Выход 88%, белое кристаллическое вещество. Т.пл. 198-199°C. Найдено, %: С 42.34; Н 7.12; N 8.85; S 20.51. C11H22N2O4S2. Вычислено, %: С 42.56; Н 7.14; N 9.02; S 20.66. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.32-1.45 м (6Н, СН2), 1.63-1.69 м (4Н, СН2); 2.71-2.76, 2.80-2.86 м (4Н, CH2SO); 3.50, 3.53, 3.61, 3.64 (АВ, 2JHH 13.2, 4Н, COCH2SO); 7.27, 7.62 уш. с. (4Н, NH2).
Пример 33
1,8-Бис(амидометилсульфинил)октан (1.7). Выход 81%, белое кристаллическое вещество. Т.пл. 193-194°C. Найдено, %: С 44.38; Н 7.32; N 8.57; S 19.65. C12H24N2O4S2. Вычислено, %: С 44.42; Н 7.46; N 8.63; S 19.77. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.30-1.43 м (8Н, СН2), 1.63-1.69 м (4Н, СН2); 2.70-2.76, 2.80-2.86 м (4Н, CH2SO); 3.50, 3.52, 3.61, 3.64 (АВ, 2JHH 13.3, 4Н, COCH2SO); 7.27, 7.61 уш. с. (4Н, NH2).
Пример 34
1,10-Бис(амидометилсульфинил)декан (1.8). Выход 83%, белое кристаллическое вещество. Т.пл. 198-199°C. Найдено, %: С 47.64; Н 9.82; N 7.79; S 18.12. C14H28N2O4S2. Вычислено, %: С 47.70; Н 8.01; N 7.95; S 18.19. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.26-1.43 м (12Н, СН2), 1.61-1.69 м (4Н, СН2); 2.67-2.76, 2.77-2.86 м (4Н, CH2SO); 3.50, 3.52, 3.61, 3.64 (АВ, 2JНН 13.2, 4Н, COCH2SO); 7.27, 7.61 уш. с. (4Н, NH2).
Пример 35
Бис(амидометилсульфонил)метан (1.9). Выход 95%, белое кристаллическое вещество. Т.пл. 251-252°C. Найдено, %: С 23.18; Н 3.67; N 10.69; S 24.78. C5H10N2O6S2. Вычислено, %: С 23.25; H 3.90; N 10.85; S 24.83. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 4.27 с (4Н, COCH2SO2); 5.51 с (4Н, SO2CH2SO2); 7.62, 7.84 уш.с. (4Н, NH2). [1) Журнал органической химии. 1994. Т. 30. Вып. 2, стр. 201-206. 2) Журнал органической химии. 1995. Т. 31. Вып. 4, стр. 565-569]
Пример 36
1,3-Бис(амидометилсульфонил)пропан (1.11). Выход 81%, белое кристаллическое вещество. Т.пл. 240-241°C. Найдено, %: С 29.32; Н 4.88; N 9.73; S 22.35. C7H14N2O6S2. Вычислено, %: С 29.36; Н 4.93; N 9.78; S 22.40. Спектр ЯМР 1Н, δ, м.д.п, d6-ДМСО: 2.16-2.23 м (2Н, СН2); 3.46 т (3JHH 7.8, 4Н, CH2SO2); 4.07 с (4Н, COCH2SO2); 7.46, 7.74 уш.с. (4Н, NH2).
Пример 37
1,4-Бис(амидометилсульфонил)бутан (1.12). Выход 82%, белое кристаллическое вещество. Т.пл. 247-248°C. Найдено, %: С 31.77; Н 5.24; N 9.28; S 21.32. C8H16N2O6S2. Вычислено, %: С 31.99; Н 5.37; N 9.33; S 21.35. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.84-1.88 м (4Н, СН2), 3.31-3.34 м (4Н, CH2SO2); 4.01 с (4Н, COCH2SO2); 7.44, 7.73 уш.с. (4Н, NH2).
Пример 38
1,5-Бис(амидометилсульфонил)пентан (1.13). Выход 75%, белое кристаллическое вещество. Т.пл. 219-220°C. Найдено, %: С 34.31; Н 5.72; N 8.79; S 20.36. C9H18N2O6S2. Вычислено, %: С 34.38; Н 5.77; N 8.91; S 20.40. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.49-1.56 м (2Н, СН2), 1.71-1.79 м (4Н, СН2); 3.28 т (3JHH 7.9, 4Н, CH2SO2); 4.00 с (4Н, COCH2SO2); 7.43, 7.72 уш.с. (4Н, NH2).
Пример 39
1,6-Бис(амидометилсульфонил)гексан (1.14). Выход 83%, белое кристаллическое вещество. Т.пл. 218-219°C. Найдено, %: С 36.52; Н 6.0; N 8.44; S 19.43. C10H20N2O6S2. Вычислено, %: С 36.57; Н 6.14; N 8.53; S 19.53. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.38-1.44 м (4Н, СН2), 1.68-1.75 м (4Н, СН2); 3.27 т (3JHH 7.9, 4Н, CH2SO2); 3.99 с (4Н, COCH2SO2); 7.42, 7.72 уш.с. (4Н, NH2).
Пример 40
1,7-Бис(амидометилсульфонил)гептан (1.15). Выход 87%, белое кристаллическое вещество. Т.пл. 197-198°C. Найдено, %: С 38.49; Н 6.27; N 8.06; S 18.65. C11H22N2O6S2. Вычислено, %: С 38.58; Н 6.48; N 8.18; S 18.73. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.30-1.44 м (6Н, СН2), 1.67-1.75 м (4Н, СН2); 3.26 т (3JHH 7.8, 4Н, CH2SO2); 3.99 с (4Н, COCH2SO2); 7.42, 7.72 уш.с. (4Н, NH2).
Пример 41
1,8-Бис(амидометилсульфонил)октан (1.16). Выход 83%, белое кристаллическое вещество. Т.пл. 215-216°C. Найдено, %: С 40.37; Н 6.54; N 7.82; S 18.87. C12H24N2O6S2. Вычислено, %: С 40.43; Н 6.79; N 7.86; S 17.99. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.28-1.32 м (4Н, СН2); 1.35-1.42 м (4Н, СН2); 1.68-1.74 м (4Н, СН2); 3.26 т (3JHH 8.0, 4Н, CH2SO2); 3.99 с (4Н, COCH2SO2); 7.42, 7.72 уш.с. (4Н, NH2).
Пример 42
1,10-Бис(амидометилсульфонил)декан (1.17). Выход 84%, белое кристаллическое вещество. Т.пл. 204-205°C. Найдено, %: С 43.67; Н 7.27; N 7.16; S 16.59. C14H28N2O6S2. Вычислено, %: С 43.73; Н 7.34; N 7.29; S 16.68. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.27-1.39 м (12Н, СН2); 1.66-1.74 м (4Н, СН2), 3.25 т (3JHH 8.0, 4Н, CH2SO2); 3.98 с (4Н, COCH2SO2); 7.41, 7.72 уш.с. (4Н, NH2).
Взаимодействие с гидразингидратом
К раствору α,ω-бис(метоксикарбонилметилсульфинил- или сульфонил)алкана (2) в абсолютном метаноле добавляют 3-кратный избыток гидразингидрата, нагревают до кипения и кипятят в течение 30 мин. Осадок фильтруют, промывают метанолом, этилацетатом.
Пример 43
Бис(гидразидометилсульфинил)метан (1.18).
К раствору 0,01 моля бис(метоксикарбонилметилсульфинил)метан в абсолютном метаноле добавляют 0.03 моля гидразингидрата. Реакционную смесь нагревают до кипения и кипятят в течение 30 мин. Осадок фильтруют, промывают метанолом. Выход 95%, белое кристаллическое вещество. Т.пл. 187-188°C. Найдено, %: С 23.38; Н 4.67; N 21.82; S 24.93. C5H12N4O4S2. Вычислено, %: С 23.43; Н 4.72; N 21.86; S 25.02. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.73, 3.76, 3.85, 3.87, 3.88, 3.91, 3.93, 3.96, 4.32, 4.35, 4.54, 4.68,4.71 (все с, 6Н, СН2); 4.40 уш. с (4Н, NH2); 9.44 с. (2Н, NH).
Пример 44
1,2-Бис(гидразидометилсульфинил)этан (1.19). Выход 90%, белое кристаллическое вещество. Т.пл. 210-211°С с разложением. Найдено, %: С 26.53; Н 5.18; N 20.68; S 23.54. C6H14N4O4S2. Вычислено, %: С 26.66; Н 5.22; N 20.73; S 23.72. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.57, 3.60, 3.74, 3.77 (АВ, 2JHH 13.2, 4Н, COCH2SO); 4.06-4.10 м (4Н, СН2); 4.39 уш.с (4Н, NH2); 9.38 C. (2Н, NH).
Пример 45
1,3-Бис(гидразидометилсульфинил)пропан (1.20). Выход 98%, белое кристаллическое вещество. Т. пл. 188-189°C. Найдено, %: С 29.53; Н 5.64; N 19.61; S 22.48. C7H16N4O4S2. Вычислено, %: С 29.57; Н 5.67; N 19.70; S 23.55. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 2.04-2.12 м (2Н, СН2), 2.87-2.95, 2.97-3.06 м (4Н, CH2SO); 3.51, 3.55, 3.66, 3.69 (АВ, 2JHH 13.2, 4Н, COCH2SO); 4.38 уш. с (4Н, NH2); 9.35 с. (2Н, NH).
Пример 46
1,5-Бис(гидразидометилсульфинил)пентан (1.21). Выход 98%, белое кристаллическое вещество. Т.пл. 188-189°C. Найдено, %: С 34.53; Н 6.42; N 17.88; S 20.47. C9H20N4O4S2. Вычислено, %: С 34.60; Н 6.45; N 17.93; S 20.53. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.49-1.59 м (2Н, СН2); 1.67-1.74 м (4Н, СН2), 2.73-2.80, 2.84-2.91 м (4Н, CH2SO); 3.47, 3.50, 3.61, 3.65 (АВ, 2JHH 13.0, 4Н, COCH2SO); 4.37 уш. с (4Н, NH2); 9.32 с. (2Н, NH).
Пример 47
1,6-Бис(гидразидометилсульфинил)гексан (1.22). Выход 91%, белое кристаллическое вещество. Т.пл. 190-191°C. Найдено, %: С 36.72; Н 6.71; N 17.08; S 19.59. C10H22N4O4S2. Вычислено, %: С 36.79; Н 6.79; N 17.16; S 19.65. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.42-1.46 м (4Н, СН2); 1.64-1.69 м (4Н, СН2), 2.72-2.79, 2.82-2.89 м (4Н, CH2SO); 3.47, 3.50, 3.61, 3.64 (АВ, 2JHH 13.2, 4Н, COCH2SO); 4.36 уш. с (4Н, NH2); 9.32 с. (2Н, NH).
Пример 48
1,7-Бис(гидразидометилсульфинил)гептан (1.23). Выход 91%, белое кристаллическое вещество. Т.пл. 193-194°C. Найдено, %: С 38.75; Н 6.97; N 16.40; S 18.79. C11H24N4O4S2. Вычислено, %: С 38.81; Н 7.11; N 16.46; S 18.84. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.32-1.47 м (6Н, СН2), 1.62-1.70 м (4Н, СН2); 2.71-2.78, 2.81-2.88 м (4Н, CH2SO); 3.46, 3.49, 3.60, 3.63 (АВ, 2JHH 13.2, 4Н, COCH2SO); 4.36 уш. с (4Н, NH2); 9.32 с. (2Н, NH).
Пример 49
1,8-Бис(гидразидометилсульфинил)октан (1.24). Выход 96%, белое кристаллическое вещество. Т.пл. 192-193°C. Найдено, %: С 40.48; Н 7.33; N 15.74; S 18.01. C12H26N4O4S2. Вычислено, %: С 40.66; Н 7.39; N 15.80; S 18.09. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.30-1.43 м (8Н, СН2), 1.62-1.69 м (4Н, СН2); 2.72-2.78, 2.81-2.88 м (4Н, CH2SO); 3.46, 3.49, 3.60, 3.63 (АВ, 2JНН 13.0, 4Н, COCH2SO); 4.36 уш. с (4Н, NH2); 9.31 с. (2Н, NH).
Пример 50
1,10-Бис(гидразидометилсульфинил)декан (1.25). Выход 98%, белое кристаллическое вещество. Т.пл. 197-198°C. Найдено, %: С 43.87; Н 7.84; N 14.61; S 16.72. С14Н30N4O4S2. Вычислено, %: С 43.96; Н 7.90; N 14.65; S 16.76. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.24-1.43 м (12Н, СН2), 1.61-1.69 м (4Н, СН2); 2.70-2.77, 2.80-2.87 м (4Н, CH2SO); 3.46, 3.49, 3.60, 3.63 (АВ, 2JHH 13.2, 4Н, COCH2SO); 4.36 уш. с (4Н, NH2); 9.31 с. (2Н, NH).
Пример 51
Бис(гидразидометилсульфонил)метан (1.26). Выход 99%, белое кристаллическое вещество. Т.пл. 167-168°C. Найдено, %: С 20.78; Н 4.15; N 19.37; S 22.24. C5H12N4O6S2. Вычислено, %: С 20.83; Н 4.20; N 19.43; S 22.24. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 4.24 с (4Н, COCH2SO2); 4.51 уш. с (4Н, NH2); 5.56 с (4Н, SO2CH2SO2); 9.53 уш. с (2Н, NH). [1) Журнал органической химии. 1994. Т. 30. Вып. 2, стр. 201-206. 2) Журнал органической химии. 1995. Т. 31. Вып. 4, стр. 565-569].
Пример 52
1,2-Бис(гидразидометилсульфонил)этан (1.27). Выход 87%, белое кристаллическое вещество. Т.пл. 200°C. Найдено, %: С 23.77; Н 4.54; N 18.46; S 21.16. C6H14N4O6S2. Вычислено, %: С 23.84; Н 4.67; N 18.53; S 21.21. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 3.81 уш. с (4Н, СН2); 4.18 с (4Н, COCH2S); 4.49 уш. с (4Н, NH2); 9.49 с (2Н, NH).
Пример 53
1,3-Бис(гидразидометилсульфонил)пропан (1.28). Выход 99%, белое кристаллическое вещество. Т.пл. 174-175°C. Найдено, %: С 26.51; Н 4.98; N 17.63; S 20.14. C7H16N4O6S2. Вычислено, %: С 26.58; Н 5.10; N 17.71; S 20.27. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 2.18-2.25 м (2Н, СН2); 3.48 т (3JHH 7.7, 4Н, CH2SO2); 4.05 с (4Н, COCH2SO2); 4.46 уш. с (4Н, NH2); 9.47 с (2Н, NH).
Пример 54
1,4-Бис(гидразидометилсульфонил)бутан (1.29). Выход 84%, белое кристаллическое вещество. Т.пл. 185-186°C. Найдено, %: С 28.87; Н 5.38; N 16.84; S 19.23. C8H18N4O6S2. Вычислено, %: С 29.08; Н 5.49; N 16.96; S 19.41. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.85-1.88 м (4Н, СН2), 3.31-3.34 м (4Н, CH2SO2); 3.00 с (4Н, COCH2SO2); 4.45 уш. с (4Н, NH2); 9.44 с (2Н, NH).
Пример 55
1,5-Бис(гидразидометилсульфонил)пентан (1.30). Выход 96%, белое кристаллическое вещество. Т.пл. 167-168°C. Найдено, %: С 31.18; Н 5.81; N 16.12; S 18.54. C9H18N2O6S2. Вычислено, %: С 34.38; Н 5.77; N 8.91; S 20.40. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.50-1.56 м (2Н, СН2), 1.73-1.79 м (4Н, СН2); 3.30 т (3JHH 8.2, 4Н, CH2SO2); 4.00 с (4Н, COCH2SO2); 4.44 уш. с (4Н, NH2); 9.44 с (2Н, NH).
Пример 56
1,6-Бис(гидразидометилсульфонил)гексан (1.31). Выход 99%, белое кристаллическое вещество. Т.пл. 195-197°C. Найдено, %: С 33.44; Н 6.14; N 15.52; S 17.78. C10H22N4O6S2. Вычислено, %: С 33.51; Н 6.19; N 15.63; S 17.89. Спектр ЯМР 1Н, δ, м.д.п., d6-ДМСО: 1.41-1.45 м (4Н, СН2), 1.71-1.74 м (4Н, СН2); 3.29 т (3JHH 8.3, 4Н, CH2SO2); 3.97 с (4Н, COCH2SO2); 4.43 уш. с (4Н, NH2); 9.43 с (2Н, NH).
Пример 57
1,7-Би