Оптически активное производное диазабициклооктана и способ его получения
Иллюстрации
Показать всеИзобретение относится к оптически активному диазабициклооктановому производному формулы (F), где R1 обозначает CO2R, CO2M или CONH2, причем R обозначает метильную группу, трет-бутильную группу, аллильную группу, бензильную группу или 2,5-диоксопирролидин-1-ильную группу, и М обозначает атом водорода, неорганический катион, выбранный из лития, калия, натрия, или органический катион, причем органическим катионом является соль аммония, образованная из амина, выбранного из циклогексиламина; и R2 обозначает бензильную группу или аллильную группу. Также изобретение относится к способу получения соединения формулы (F) и промежуточных соединений, к промежуточным соединениям, кристаллическим формам соединения формулы (F), а также применению соединения формулы (F) в качестве фармацевтического промежуточного соединения для получения ингибитора β-лактамазы, и к способу его получения. Технический результат: получены новые производные (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты, а также их кристаллические формы, полезные в синтезе ингибитора β-лактамазы. 26 н. и 1 з.п. ф-лы, 16 табл., 25 пр.
Реферат
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение относится к оптически активному производному диазабициклооктана, определенному приведенной ниже формулой (F), которое может быть использовано как фармацевтическое промежуточное соединение для получения ингибитора β-лактамазы, и к способу его получения.
Химическая формула 1
.
В формуле (F), выше, R1 обозначает CO2R, CO2M или CONH2, где R обозначает метильную группу, трет-бутильную группу, аллильную группу, бензильную группу или 2,5-диоксопирролидин-1-ильную группу, и М обозначает атом водорода, неорганический катион или органический катион; и R2 обозначат бензильную группу или аллильную группу.
УРОВЕНЬ ТЕХНИКИ
Пенициллины и цефалоспорины представляют собой β-лактамовые антибиотики, которые наиболее широко и часто используются в клинике. Однако развитие у различных патогенов резистентности к β-лактамовым антибиотикам оказало строго разрушительный эффект на поддержание эффективного лечения бактериальных инфекций. Самым значимым известным механизмом, связанным с развитием резистентности у бактерий, является продукция β-лактамаз класса A, C и D, имеющих сериновый остаток в активном центре. Эти ферменты расщепляют β-лактамовый антибиотик, приводя к потере противомикробных активностей. Класс А β-лактамаз избирательно гидролизуют пенициллины, в то время как класс C β-лактамаз имеет субстратный профиль, благоприятный для цефалоспоринов. Как коммерчески доступные ингибиторы β-лактамаз известны клавулановая кислота, сулбактам и тазобактам, и эти ингибиторы эффективны главным образом против бактерий, продуцирующих класс А β-лактамаз, и используемы в форме смеси с пенициллиновым антибиотиком. Однако до настоящего времени сообщалось о приблизительно 250 типах или более β-лактамаз, и среди них, в дополнение к экспансии класса C β-лактамаз, а также β-лактамаз расширенного спектра (ESBL), принадлежащих классам A и D β-лактамаз, другие резистентные бактерии, которые продуцируют класс А KPC-2 β-лактамаз, расщепляющих даже карбапенем, как последнее прибежище для β-лактамового антибиотика, рассматривают как проблему. Хотя разработка нового ингибитора сильно востребована, поскольку коммерчески доступные ингибиторы неэффективны против этих β-лактамаз и раскрыты потенциальные ингибиторы, в разработке имеются только несколько кандидатов.
В последние годы в US 7112592 (патентный документ 1) и US 7612087 (патентный документ 2) было раскрыто, что рацемическое производное диазабициклооктана является многообещающим соединением для лечения инфекционных заболеваний в качестве не-β-лактамового противомикробного средства или ингибитора β-лактамазы, и был приведен рабочий Пример рацемических диазабициклооктановых производных из рацемического производного цис-5-гидроксипиперидин-2-карбоновой кислоты и их биологической активности.
Относительно оптически активного диазабициклооктанового производного, в рабочем Примере 1 WO2009/091856 A2 (патентный документ 3) и WO2010/126820 A2 (патентный документ 4) описан способ получения производного, имеющего особую боковую амидную цепь. Дополнительно, рабочий Пример 1 патентного документа 3 содержит просто описание химического названия (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты как промежуточного соединения для исследования, и точно также в WO2009/133442 A1 (патентный документ 5) описано химическое название (2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид, и в ЕР 2135959 A1 (патентный документ 6) описано химическое название (2S,5R)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид, 7-оксо-6-(сульфокси)-мононатриевая соль.
С другой стороны, относительно (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты и (2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоновой кислоты, которые рассматриваются как важный исходный материал диазабициклооктанового производного и его производных, об одном соединении, имеющем сложноэфирную боковую цепь, сообщалось в Tetrahedron Asymmetry 2006, 17(17), 2479-2486 (непатентный документ 2) и J. Chem. Soc., Chem. Commun., 1993, 1434 (непатентный документ 3), и о соединении, имеющем боковую амидную цепи сообщалось в рабочем Примере 1C патентного документа 3, Org. Lett., 2009, 11(16), 3566-3569 (непатентный документ 3) и патентном документе 4. Далее, в качестве способа получения производного не через производное (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты, в US 2010/197928 (патентный документ 7) раскрыт способ получения бензил (2S)-5-(бензилоксиимино)пиперидин-2-бензилкарбоксилата или (2S,5R/S)-5-(бензилоксиамино)пиперидин-2-бензилкарбоксилата.
ЛИТЕРАТУРА ИЗ УРОВНЯ ТЕХНИКИ
[Патентный документ 1] патент США 7112592.
[Патентный документ 2] патент США 7612087.
[Патентный документ 3] Международная Публикация 2009/091856 A2.
[Патентный документ 4] Международная Публикация 2010/126820 A2.
[Патентный документ 5] Международная Публикация 2009/133442 A1.
[Патентный документ 6] Публикация европейской заявки на патент 2135959 A1.
[Патентный документ 7] Публикация заявки на патент США 2010/197928 A1.
[Непатентный документ 1] Jung, JC.; Avery, MA. "Diastereoselective synthesis of (2S,5S)- and (2S,5R)-N-benzyloxycarbonyl-5-hydroxypipecolic acids from trans-4-hydroxy-L-proline" Tetrahedron Asymmetry 2006, 17(17), 2479-2486.
[Непатентный документ 2] Baldwin, JE.; Adlington, RM.; Godfrey, CRA.; Gollins, DW.; Vaughan, JG. "A Novel Entry to Carbenoid Species via β-Ketosulfoxonium Ylides" Journal of the Chemical Society Chemical Communications 1993, 1434-1435.
[Непатентный документ 3] Mangion, IK.; Nwamba, IK.; Shevlin, M.; Huffman MA. "Iridium-Catalyzed X-H Insertions of sulfoxonium Ylides" Organic Letters 2009, 11(16), 3566-3569.
[Непатентный документ 4] Dolence, EK.; Lin, CE.; Miller, MJ.; Payne, SM. "Synthesis and siderophore activity of albomycin-like peptides derived from N5-acetyl-N5-hydroxy-L-ornithine" Journal of Medicinal Chemistry 1991, 34(3), 956-968.
[Непатентный документ 5] King, FE.; King, TJ.; Warwick, AJ. "The Chemistry of Extractives from Hardwoods. Part III. Baikiain, an Amino-acid Present in Baikiaea plurijuga" Journal of the Chemical Society 1950, 3590-3597.
[Непатентный документ 6] Witkop, B.; Folts, CM. "The Configuration of 5-Hydroxypipecolic Acid from Dates" Journal of the American Chemical Society 1957, 79(1), 192-197.
[Непатентный документ 7] Freed, ME.; Day AR. "Synthesis of 5-Ketopipecolic Acid from Glutamic Acid" The Journal of Organic Chemistry 1960, 25(12), 2105-2107.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, РЕШАЕМЫЕ В ИЗОБРЕТЕНИИ
Однако уровень техники в отношении ингибитора β-лактамазы, имеющего диазабициклооктановый скелет, особенно в отношении диазабициклооктанового производного, как общего промежуточного соединения, используемого для получения ингибитора β-лактамазы, имеет множество технических проблем, которые решаются, как показано ниже.
В патентных документах 1 и 2 показан рабочий пример рацемического диазабициклооктанового производного, но не раскрыт способ получения оптически активного диазабициклооктанового производного и способ оптического разделения этого производного и данные инструментальных исследований для оптически активного соединения, особенно данные, демонстрирующие получение оптически активного соединения, такие как угол вращения, и там не продемонстрировано, что оптически активное соединение действительно получено в независимой форме.
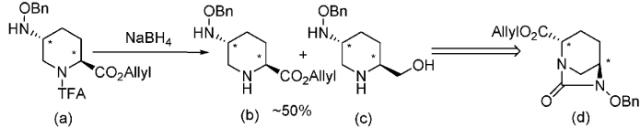
В способах, описанных в патентных документах 1 и 2, выбор защитной группы для сложного эфира карбоксилата в положении 2 является несоответствующим, и поэтому транс-5-(бензилоксиамино)пиперидин-2-аллилкарбоксилат, представленный формулой (b) в реакционной схеме, приведенной ниже, как предшественник для промежуточного соединения, и транс-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-аллилкарбоксилат, представленный формулой (d), приведенной ниже, в качестве желаемого важного промежуточного соединения не могут быть эффективно получены. В области производства лекарственных средств, когда соединение имеет асимметрический атом углерода, желательно, чтобы только единственный энантиомер был селективно получен в зависимости от цели, но непросто применить непосредственно способы согласно патентным документам 1 и 2 к отдельно полученному оптически активному производному (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты или для оптического разделения массового рацемического диазабициклооктанового производного и внедрения полученного оптически активного соединения в областях исследования и производства лекарственных средств.
Химическая формула 2
.
В приведенной выше реакционной схеме TFA обозначает 2,2,2-трифторацетильную группу, NaBH4 обозначает боргидрид натрия, и BnO обозначает бензилоксигруппу.
В патентных документах 3, 5 и 6 описаны химические названия: (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота, (2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид, (1R,2S,5R)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид и 7-оксо-6-(сульфокси)-мононатриевая соль, как оптически активные соединения, но, относительно способа их получения, просто даны ссылки на патентные документы 1 и 2, в которых раскрыт способ получения рацемической модификации.
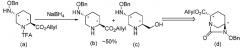
Только патентные документы 3 и 4 демонстрируют способ получения оптически активного диазабициклооктанового производного, но этот способ является специфическим только для соединения, имеющего особую боковую амидную цепь в положении 2, и таким образом, не предлагается применение способа к общему промежуточному соединению. Далее, была сделана попытка реакцию введения бензилоксиаминогруппы через п-трифторметилбензолсульфонилоксигруппу или реакцию образования внутримолекулярного карбамида с использованием трифосгена, раскрытую в патентных документах 3 и 4, применить к соединению, имеющему сложноэфирную боковую цепь в положении 2, но стереоселективность бензилоксиаминогруппы не наблюдалась, и реальная реакция формирования внутримолекулярного карбамида не происходила, что указывает, что вышеупомянутые реакции не могут быть непосредственно применены к соединению, имеющему сложноэфирную боковую цепь в положении 2.
Химическая формула 3
.
В вышеописанной реакционной схеме Вос обозначает трет-бутоксикарбонильную группу, pCF3PhSO2Cl обозначает п-трифторметилбензолсульфонилхлорид, KN(Вос)OBn обозначает N-трет-бутоксикарбонилбензилоксиамид калия, и BnO обозначает бензилоксигруппу; соединения формул (f) и (g), показанные в вышеописанной реакционной схеме, не могут быть непосредственно разделены, и поэтому их структуры были определены ЯМР после удаления защитной группы Вос, формирования внутримолекулярного карбамида с использованием дифосгена и выделения продукта.
Далее, патентный документ 4 также демонстрирует способ получения (2S,5S)-ди-трет-бутил-5-гидроксипиперидин-1,2-дикарбоксилата, но селективное удаление защитной трет-бутоксикарбонильной группы и сложного трет-бутилового эфира на кольце пиперидина затруднительно, и дальнейшая селективная этерификация трет-бутила только карбоксильной группы отдельно от гидроксильной группы после удаления всех защитных групп нелегка. Поэтому трудно в промышленном отношении использовать раскрытое соединение как исходный материал непосредственно для общего промежуточного соединения, к которому относится настоящее изобретение.
В патентном документе 7 не раскрыто количество триметилсульфоксония йодида, используемого в получении важного исходного материала, и неясно, является ли способ пригодным для осуществления на практике процессом без побочной реакции, такой как разложение сложного эфира или возможности рацемизации вследствие избытка реагента. В действительности, описаны данные инструментального анализа, показывающие плоскую конфигурацию сформированного кетосульфоксонийилидного соединения, но относительно соединений, включая продукты, формирующиеся на последующих стадиях, данные инструментального анализа, показывающие оптическую чистоту, особенно такую как угол вращения, не демонстрируется. Далее, стереоселективность бензилоксиаминогруппы в положении 5 является низкой, поскольку цис-транс=1:1, и таким образом процесс не является эффективным. Сформированный изомер цис-транс присутствует в форме смеси, которую трудно разделить, и нет никакого описания, показывающего, что диазабициклооктановое производное может быть действительно получено из готовой смеси.
Как описано выше, способ получения оптически активного диазабициклооктанового производного, в частности, 2-карбоновой кислоты или сложноэфирного производного, которое может быть использовано в качестве общего промежуточного соединения, не был раскрыт до настоящего времени. Поэтому разработка легкоосуществимого способа получения оптически активного диазабициклооктанового производного, имеющего боковую цепь карбоновой кислоты и сложноэфирную боковую цепь, которое может использоваться как общее промежуточное соединение, было желательно для исследования более эффективного нового соединения и фармацевтических разработок.
В этой ситуации, авторы настоящего изобретения провели обширные и интенсивные исследования с целью разработки оптически активного диазабициклооктанового производного, в частности, 2-карбоновой кислоты или сложноэфирного производного, которое может быть использовано как фармацевтическое промежуточное соединение для ингибитора β-лактамазы, и легкоосуществимого способа его получения. В результате было обнаружено, что, при использовании в качестве исходного материала производного (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты, которое является известным соединением, оптически активное диазабициклооктановое производное может быть промышленно получено с превосходной воспроизводимостью с высоким выходом с помощью относительно короткого процесса, без снижения оптической чистоты производного, и далее, что оптически активное диазабициклооктановое производное, полученное таким способом, может использоваться как фармацевтическое промежуточное соединение для ингибитора β-лактамазы, и было осуществлено настоящее изобретение.
СРЕДСТВА РЕШЕНИЯ ЗАДАЧИ
В частности, настоящее изобретение относится к оптически активному производному (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты, определяемому следующей формулой (F):
Химическая формула 4
,
в которой:
R1 обозначает CO2R, CO2M или CONH2,
причем R обозначает метильную группу, трет-бутильную группу, аллильную группу, бензильную группу или 2,5-диоксопирролидин-1-ильную группу, и
М обозначает атом водорода, неорганический катион или органический катион; и
R2 обозначает бензильную группу или аллильную группу.
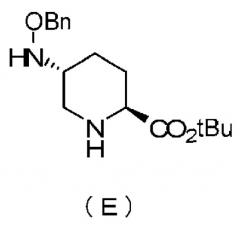
Настоящее изобретение также относится к способу получения соединения, определяемого формулой (F), приведенной выше, причем способ включает подвергание соединения, представленного формулой (E), приведенной ниже, формированию внутримолекулярного карбамида и затем подвергание полученного соединения, представленного ниже формулой (F1), по меньшей мере одной из стадий, описанных ниже:
Химическая формула 5
,
в которой Bn обозначает бензильную группу, и tBu обозначает трет-бутильную группу,
Химическая формула 6
,
в которой Bn обозначает бензильную группу, и tBu обозначает трет-бутильную группу,
стадии а для расщепления сложного эфира,
стадии b для преобразования соединения в форму соли неорганического катионного или органического катиона,
стадии c для обработки соединения кислотой, чтобы преобразовать соединение в свободную кислоту,
стадии d для осуществления карбамоилирования для карбоновой кислоты,
стадии e для преобразования карбоновой кислоты в сложный эфир,
стадии f для удаления бензильной группы бензилоксигруппы в положении 6, и
стадии g для преобразования группы в положении 6 в аллилокси.
Кроме того, настоящее изобретение также относится к способу получения соединения, представленного формулой (E), приведенной выше, причем способ включает подвергание соединения, представленного формулой (B), приведенной ниже, трифторацетилированию и введение полученного соединения, представленного формулой (C), приведенной ниже, в реакцию с бензилоксиамином в присутствии активатора гидроксильной группы и подвергание полученного соединения, представленного формулой (D), приведенной ниже, детрифторацетилированию:
Химическая формула 7
,
в которой tBu обозначает трет-бутильную группу,
Химическая формула 8
,
в которой tBu обозначает трет-бутильную группу, и TFA обозначает трифторацетильную группу,
Химическая формула 9
,
в которой Bn обозначает бензильную группу, tBu обозначает трет-бутильную группу, и TFA обозначает трифторацетильную группу.
Кроме того, настоящее изобретение также относится к промежуточному соединению для применения в получении соединения, представленного формулой (F), приведенной выше, то есть, соединению, представленному следующими формулами (B), (C), (D) и (E):
Химическая формула 10
,
в которой tBu обозначает трет-бутильную группу,
Химическая формула 11
,
в которой tBu обозначает трет-бутильную группу, и TFA обозначает трифторацетильную группу,
Химическая формула 12
,
в которой Bn обозначает бензильную группу, tBu обозначает трет-бутильную группу, и TFA обозначает трифторацетильную группу,
Химическая формула 13
,
в которой Bn обозначает бензильную группу, и tBu обозначает трет-бутильную группу.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
С помощью способа получения оптически активного диазабициклооктанового производного согласно настоящему изобретению, оптически активное производное (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты может быть промышленно получено с превосходной воспроизводимостью с высоким выходом с помощью относительно короткого процесса, без снижения оптической чистоты производного. Кроме того, таким образом полученное оптически активное производное (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты согласно настоящему изобретению легко кристаллизуется, и следовательно, легко в обращении и может использоваться в массовом производстве оптически активного соединения для ингибитора β-лактамазы, имеющего диазабициклооктановый скелет, или может использоваться как важное промежуточное соединение в исследовании и массовом производстве более эффективного нового ингибитора β-лактамазы, и поэтому особенно превосходно как промежуточное соединение для промышленной продукции.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Как упомянуто выше, настоящее изобретение относится к оптически активному производному (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты, определяемому следующей формулой (F):
Химическая формула 14
,
в которой: R1 обозначает CO2R, CO2M или CONH2,
причем R обозначает метильную группу, трет-бутильную группу, аллильную группу, бензильную группу или 2,5-диоксопирролидин-1-ильную группу, и М обозначает атом водорода, неорганический катион или органический катион; и R2 обозначает бензильную группу или аллильную группу.
Неорганический катион представляет собой, например, натрий, калий, литий или кальций и предпочтительно натрий, калий или кальций. Органический катион представляет собой соль аммония, образованную из амина, такого как триметиламин, триэтиламин, циклогексиламин или дициклогексиламин; или соль четвертичного аммониевого основания, такого как тетраметиламмоний, тетраэтиламмоний, тетрабутиламмоний или триэтилбензиламмоний, и предпочтительно соль циклогексиламмония.
Предпочтительные примеры соединений, определяемых формулой (F), включают следующие соединения:
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-трет-бутилкарбоксилат,
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота соль циклогексиламина,
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота,
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-метилкарбоксилат,
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-аллилкарбоксилат,
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-бензилкарбоксилат,
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-2,5-диоксопирролидин-1-ил-карбоксилат,
(2S,5R)-6-(аллилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-трет-бутилкарбоксилат,
(2S,5R)-6-(аллилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота соль циклогексиламина,
(2S,5R)-6-(аллилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота и
(2S,5R)-6-(аллилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-бензилкарбоксилат.
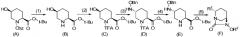
Оптически активное производное (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты, определяемое общей формулой (F), получаемое в соответствии с настоящим изобретением, может быть получено из соединения формулы (E), и соединение формулы (E) может быть получено из соединения формулы (A), которое является известным соединением, в качестве исходного материала в основном в соответствии с процессом, показанным в соответствии со схемой химической реакции, приведенной ниже.
Химическая формула 15
.
В приведенной выше схеме химической реакции, Cbz обозначает бензилоксикарбонильную группу, t-Bu обозначает трет-бутильную группу, TFA обозначает 2,2,2-трифторацетильную группу, OBn обозначает бензилоксигруппу, R2 обозначает бензильную группу или аллильную группу, предпочтительно бензильную группу, и числа в круглых скобках указывают число соответствующих стадий.
В частности, соединение, определяемое формулой (F) согласно настоящему изобретению, может быть получено через первую стадию удаления бензилоксикарбонильной группы соединения, представленного формулой (A), с получением соединения, представленного формулой (B), вторую стадию трифторацетилирования атома азота пиперидина с получением соединения, представленного формулой (C), третью стадию замещения гидроксильной группы в положении 5 бензилоксиамином в присутствии активатора гидроксильной группы с получением соединения, представленного формулой (D), четвертую стадию удаления трифторацетильной группы с получением соединения, представленного формулой (E), и пятую стадию осуществления формирования внутримолекулярного карбамида и затем преобразования боковых цепей R1, R2 с получением оптически активного производного (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты, определяемого формулой (F).
Выбор сложного трет-бутилового эфира соединения, представленного формулой (A), который может использоваться как исходный материал в настоящем изобретении, имеет очень важную роль в селективном удалении трифторацетильной группы соединения, представленного формулой (D). Кроме того, бензилоксикарбонильная группа, которая является защитной группой для NH на кольце пиперидина, может быть легко разблокирована отдельно от сложного трет-бутилового эфира, и следовательно, соединение формулы (A) представляет собой оптимальный исходный материал как предшественник для соединения, представленного формулой (B). Далее, способ согласно настоящему изобретению представляет собой чрезвычайно полезный процесс, такой, что транс-оксиамино соединение может быть селективно получено без образования ненужного цис-бензилоксиамино соединения. Таким образом, вышеупомянутый способ с использованием соединения, представленного формулой (A), в качестве исходного материала чрезвычайно полезен так же, как способ эффективного получения оптически активного (2S,5R)-5-(бензилоксиамино)пиперидин-2-трет-бутилкарбоксилата, представленного формулой (E).
Соединение, представленное формулой (A), которое используется как исходный материал в способе согласно настоящему изобретению, может быть получено способом, описанным в непатентном документе 1, но может также быть получено более эффективным способом, показанным на реакционной схеме, приведенной ниже, из известного соединения, представленного формулой (k), приведенной ниже, описанного в непатентном документе 4.
Химическая формула 16
.
В приведенной выше схеме химической реакции, Cbz обозначает бензилоксикарбонильную группу, и t-Bu обозначает трет-бутильную группу.
Оптически активное производное (2S,5R)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты, определяемое формулой (F), получаемое в соответствии с настоящим изобретением, может быть получено, например, способом, который включает подвергание соединения, представленного формулой (E), формированию внутримолекулярного карбамида и затем подвергание полученного соединения, представленного формулой (F1), по меньшей мере одной из стадий: стадии (стадия a) расщепления сложного эфира, стадии (стадия b) преобразования соединения в форму соли неорганического катиона или органического катиона, стадии (стадия c) обработки соединения кислотой с преобразованием соединения в свободную кислоту, стадии (стадия d) осуществления карбамоилирования карбоновой кислоты, стадии (стадия e) преобразования карбоновой кислоты в сложный эфир, стадии (стадия f) удаления бензильной группы бензилоксигруппы в положении 6 и стадии (стадия g) преобразования группы в положении 6 в аллилокси.
Химическая формула 17
.
Символы, показанные в формулах, имеют значения, определенные выше.
В некоторых вариантах осуществления вышеописанного способа получения соединения, определяемого формулой (F), из соединения, определяемого формулой (E), как показано ниже, соединение, представленное формулой (F), в каждом варианте осуществления может быть получено через стадию (5-1) для формирования внутримолекулярного карбамида и затем по меньшей мере одну из стадий с (5-2) по (5-8). В частности, эти стадии могут быть проведены в соответствии со способом, показанным в соответствии со схемой химической реакции, приведенной ниже.
Химическая формула 18
.
В приведенной выше реакционной схеме OBn обозначает бензилоксигруппу, t-Bu обозначает трет-бутильную группу, M1 обозначает циклогексил аммоний, R3 обозначает метильную группу, аллильную группу, бензильную группу или 2,5-диоксопирролидин-1-ильную группу, OAllyl обозначает аллилоксигруппу, и числа в круглых скобках указывают число соответствующих стадий.
В частности, процесс согласно показанному выше варианту осуществления настоящего изобретения включает стадию 5-1 подвергания соединения, представленного формулой (E), формированию внутримолекулярного карбамида с получением соединения, представленного формулой (F1), стадию 5-2 расщепления сложного трет-бутилового эфира с получением соли циклогексил аммония, представленной формулой (F1-1), стадию 5-3 обработки соли циклогексиламмония кислотой с получением свободной кислоты, представленной формулой (F1-2), стадии 5-4 или 5-5 с получением формулы (F1-4) или формулы (F1-3) из карбоновой кислоты, или стадию 5-8 удаления бензильной группы из формулы (F1) и преобразования ее в аллильную группу с получением формулы (F2), стадии 5-9 и 5-10 расщепления сложного трет-бутилового эфира с получением формул (F2-1) и (F2-2), и стадию 5-5 с получением формулы (F2-3) из карбоновой кислоты.
Среди соединения, определяемого формулой (F) согласно настоящему изобретению, полученного вышеупомянутым способом согласно настоящему изобретению, (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-трет-бутилкарбоксилат, (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-метилкарбоксилат, (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-аллилкарбоксилат, (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота соль циклогексиламмония, (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3,2,1]октан-2-карбоновая кислота и (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид, которые, соответственно, представлены ниже формулами (F1), (F1-3a), (F1-3b), (F1-1a), (F1-2) и (F1-4), могут быть индивидуально получены в форме кристалла оптически активного диазабициклооктанового производного и поэтому имеют то преимущество, что они являются легкими в выделении, очистке, хранении и транспортировке. Это указывает, что настоящее изобретение является полезным в промышленном отношении изобретением.
Химическая формула 19
.
В приведенных выше формулах t-Bu обозначает трет-бутильную группу, OBn обозначает бензилоксигруппу, и Ме обозначает метильную группу.
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-трет-бутилкарбоксилат, представленный формулой (F1), присутствует в форме кристалла, имеющего характеристические пики, появляющиеся в интервалах решетки (d) 11,56, 10,96, 6,55, 6,00, 5,79, 5,56, 5,47, 5,25, 4,90, 4,35, 4,23 и 3,86 Å, и особенно предпочтительно, чтобы соединение было получено как кристалл с высокой чистотой, который является легким в работе, выделении или очистке, особенно в промышленном масштабе.
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-метилкарбоксилат, представленный формулой (F1-3a), присутствует в форме кристалла, который показывает порошковую структуру дифракции рентгеновских лучей, имеющую характеристические пики, появляющиеся в интервалах решетки (d) 10,39, 5,86, 5,69, 5,34, 4,81, 4,44, 3,98, 3,78, 3,11, 3,03, 2,93 и 2,77 Å, и особенно предпочтительно, чтобы соединение было получено как кристалл с высокой чистотой, который является легким в работе, выделении или очистке, особенно в промышленном масштабе.
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-аллилкарбоксилат, представленный формулой (F1-3b), присутствует в форме кристалла, который показывает порошковую структуру дифракции рентгеновских лучей, имеющую характеристические пики, появляющиеся в интервалах решетки 14,72, 4,91, 4,46, 4,24 и 3,67 Å, и особенно предпочтительно, чтобы соединение было получено как кристалл с высокой чистотой, который является легким в работе, выделении или очистке, особенно в промышленном масштабе.
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота соль циклогексиламмония, представленная формулой (F1-1a), присутствует в форме кристалла, который показывает порошковую структуру дифракции рентгеновских лучей, имеющую характеристические пики, появляющиеся в интервалах решетки (d) 9,95, 8,45, 6,26, 5,87, 5,52, 5,22, 5,10, 4,96, 4,73, 4,54, 4,16, 3,93 и 3,55 Å, и особенно предпочтительно, чтобы соединение было получено как кристалл с высокой чистотой, который является легким в работе, выделении или очистке, особенно в промышленном масштабе.
(2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота, представленная формулой (F1-2), присутствует в форме кристалла, который показывает порошковую структуру дифракции рентгеновских лучей, имеющую характеристические пики, появляющиеся в интервалах решетки (d) 8,19, 7,14, 6,64, 6,29, 5,60, 5,21, 4,91, 4,60, 4,21, 3,69, 3,45 и 3,13 Å, и особенно предпочтительно, чтобы соединение было получено как кристалл с высокой чистотой, который является легким в работе, выделении или очистке, особенно в промышленном масштабе.
Далее, (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид, представленный формулой (F1-4), присутствует в форме кристалла, который показывает порошковую структуру дифракции рентгеновских лучей, имеющую характеристические пики, появляющиеся в интервалах решетки (d) 13,06, 6,52, 5,14, 4,74, 4,63, 4,34, 3,85 и 3,72 Å, и особенно предпочтительно, чтобы соединение было получено как кристалл с высокой чистотой, который является легким в работе, выделении или очистке, особенно в промышленном масштабе.
Ниже будет описан более подробно способ в соответствии с настоящим изобретением, который включает ряд стадий для получения оптически активного диазабициклооктанового производного, определяемого формулой (F), из соединения, определяемого формулой (A), в качестве исходного материала.
Синтез соединения формулы (B) из соединения формулы (A)
Бензилоксикарбонильную группу (2S,5S)-1-бензил-2-трет-бутил-5-гидроксипиперидин-1,2-дикарбоксилата, который используется как исходный материал в настоящем изобретении и который представлен формулой (A):
Химическая формула 20
,
причем в формуле (A), приведенной выше, Cbz обозначает бензилоксикарбонильную группу, и t-Bu обозначает трет-бутильную группу,
удаляют реакцией каталитического гидрирования в атмосфере газообразного водорода в присутствии катализатора, получая (2S,5S)-5-гидроксипиперидин-2-трет-бутилкарбоксилат, представленный формулой (B):
Химическая формула 21
,
причем в формуле (B), приведенной выше, t-Bu обозначает трет-бутильную группу.
Относительно катализатора, используемого в реакции, может использоваться произвольный гидрирующий катализатор, но предпочтительно может использоваться, например, оксид платины, оксид палладия, палладиевая чернь или палладий на углероде. Катализатор может использоваться в диапазоне от 0,05 до 1 вес./вес. в терминах весового отношения катализатора к соединению формулы (A). Давление водорода может быть от атмосферного давления до 0,5 МПа.
Растворитель, используемый в реакции, может быть выбран из воды, метанола, этанола, пропанола, изопропанола, бутанола, простого эфира, простого диизопропилового эфира, этилацетата, бутилацетата, толуола, тетрагидрофурана и 1,4-диоксана, и эти растворители могут использоваться индивидуально или в комбинации.
Предпочтительно, катализатор, выбранный из оксида платины, оксида палладия, палладиевой черни и палладия на углероде, может использоваться в весовом отношении 0,05 к 0,5 вес./вес. в метаноле или этаноле.
Более предпочтительно, палладий на углероде в весовом отношении 0,05 к 0,25 вес./вес. может использоваться как катализатор в этаноле.
Соединение, представленное формулой (B), полученное на первой стадии, может быть выделено, например, в форме свободного основания с использованием, после завершения реакции, обычных средств процедуры обработки, обычно используемых в органической химии, таких как фильтрация для катализатора, концентрация растворителя, обмен растворителя, формирование соли и кристаллизация, и использовано на следующей стадии, или оно может использоваться на следующей стадии без очистки после обработки.
Синтез соединения формулы (C) из соединения формулы (B)
Полученное выше соединение формулы (B) обрабатывают трифторацетилирующим средством в присутствии основания, получая (2S,5S)-5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-трет-бутилкарбоксилат, представленный формулой (C):
Химическая формула 22
,
причем в формуле (C), приведенной выше, TFA обозначает 2,2,2-трифторацетильную группу, и t-Bu обозначает трет-бутильную группу.
В частности, трифторацетилирование соединения, представленного формулой (B), осуществляют, растворяя соединение формулы (B) в подходящем растворителе и вводя его в реакцию с избытком трифторацетилирующего средства в присутствии избытка основания, чтобы сформировать 1,5-дитрифторацетильное соединение, и затем отщепляя только трифторацетильную группу в положении 5.
Основание, используемое в реакции, может быть выбрано из неорганических оснований, таких как гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, гидроксид натрия и гидроксид калия, и органических оснований, таких как триэтиламин, диизопропилэтиламин, трибутиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен, пиридин, 2-пиколин и 2,6-диметилпиридин, и используется в количестве в диапазоне от 2 до 6 молярных эквивалентов относительно соединения формулы (B).
Трифторацетилирующее средство может быть выбрано из трифторуксусной кислоты, трифторэтилацетата, ангидрида трифторуксусной кислоты, хлорангидрида трифторуксусной кислоты, сложного эфира трифторацетилсукцинимида, сложного эфира трифторацетилбензотриазола, сложного эфира трифторацетилпентафторфенила, 2-тр