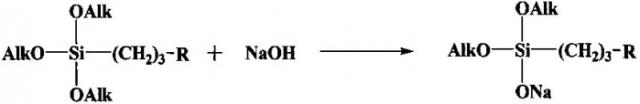Натрийокси(аминопропил)диалкоксисиланы и способ их получения
Иллюстрации
Показать всеИзобретение относится к области химии кремнийорганических соединений. Предложены натрийокси(аминопропил)диалкоксисиланы общей формулы (I), где Alk означает углеводородный радикал из ряда -CH3, -C2H5, -CH2CH2CH3, -CH2CH2CH2CH3; R означает заместитель из ряда -NH2, -NHCH2CH2NH2, -NHCH2CH2NHCH2CH2NH2. Предложен также способ их получения взаимодействием в среде безводного органического растворителя гидроксида натрия с алкоксисиланом формулы (AlkO)3Si[(CH2)3R], где R и Alk имеют вышеуказанные значения. Технический результат - созданы новые функциональные мономеры, используемые в различных поликонденсационных процессах, а также разработан технологичный способ их получения. 2 н. и 4 з.п. ф-лы, 5 ил., 6 пр.
(I)
Реферат
Настоящее изобретение относится к области химии кремнийорганических соединений.
Конкретнее, изобретение относится к созданию и способу получения индивидуальных мононатриевых солей аминопропилалкоксисиланов - новых функциональных кремнийорганических мономеров.
Аминосодержащие алкоксисиланоляты натрия, представленные настоящим изобретением, могут использоваться в качестве мономерных реагентов и инициаторов в различных поликонденсационных процессах, в том числе и в контролируемом синтезе функциональных полисилоксанов регулярного строения, а также для создания различных связующих, сшивающих агентов, отвердителей, адсорбентов и функциональных матриц различного назначения.
Приведенные примеры использования изобретения являются частной иллюстрацией и не ограничивают возможные области его применения.
К основным способам получения органоалкоксисиланолятов относится их синтез непосредственно из органоалкоксисиланолов, при их непосредственном взаимодействии с щелочными металлами [Wojnowski, W.; Bochenska, W.; Peters, K.; Eva, M.; Von Schnering. Ζ Anorg Allg Chem 1986, 533, 165-174)]. Многостадийность такого способа, обусловленная необходимостью предварительного получения соответствующего органоалкоксисиланола, а также использование химически неустойчивых щелочных металлов делают данный метод практически малопригодным и неэффективным. Более того, данный метод не может быть применен к синтезу аминосодержащих силанолятов ввиду высокой реакционной способности аминов по отношению к силанолам. В то же время, органоалкоксисиланоляты могут быть получены значительно более технологичным способом в ходе реакции органоалкоксисиланов с гидроксидами щелочных металлов [Anrianov, K.A.; Chananashvili, L.M.; Minakov, V.T.; Gashnikova, N.P. Izv Akad Nauk SSSR Ser Khim 1970, 10, 2276-2280; Yoshimoto, A.; Ichiro K. Bull Chem Soc Japan 1969, 42(4), 1118-1123; Matukhina, E.V.; Shchegolikhina, O.I.; Molodtsova, Yu.A.; Pozdnyakova, Yu.A.; Lyssenko, Κ.A.; VasiFev, V.G.; Buzin, M.I. Liq Cryst 2004, 31(3), 401-420]. Однако использование в вышеприведенных работах в качестве реакционной среды водно-спиртовых растворов делает такой процесс плохо контролируемым и зачастую приводит к образованию, наряду с целевыми мономерными продуктами, ряда побочных силоксановых гомологов.
Литературные данные по получению конкретно аминопропилалкоксисиланолятов натрия отсутствуют.
Известно получение широкого набора моно- и олигомерных аминопропилалкоксисиланолятов калия взаимодействием аминопропилтриалкоксисиланов с гидроксидом калия в водно-спиртовом растворе [Foley Kevin M, McCombs Frank; US 3932686].
Известен способ получения триэтоксисиланолята калия реакцией эквимолярного количества тетраэтоксисилана и гидроксида калия в среде ТГФ [Kolditz, L.; Preiss, H. Ζ Anorg Allg Chem 1963, 325, 245-251].
Наиболее близкими и по химическому строению, и по способу получения заявляемых соединений являются результаты работы [Rebrov E.A., Muzafarov A.M., Zhdanov A.A., Dokl Akademii Nauk SSSR 1988 302(2) 346-348], где описаны мононатриевые соли алкоксисиланов, а также метод их получения взаимодействием избытка алкоксисиланов с гидроксидом натрия или при взаимодействием алкоксисиланов с гидроксидом натрия в эквимолярном соотношении в среде органических растворителей.
Задачей заявляемого изобретения является создание новых функциональных мономеров - индивидуальных мононатриевых солей аминопропилалкоксисиланов.
Задачей заявляемого изобретения является также разработка технологичного способа получения индивидуальных мононатриевых солей аминопропилалкоксисиланов.
Задача решается тем, что получены натрийокси(аминопропил)диалкоксисиланы общей формулы:
где Alk означает углеводородный радикал из ряда: -CH3, -C2H5, -CH2CH2CH3, -CH2CH2CH2CH3; R означает заместитель из ряда: -NH2, -NHCH2CH2NH2, -NHCH2CH2NHCH2CH2NH2.
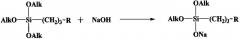
Задача решается также тем, что разработан способ получения новых натрийокси(аминопропил)диалкоксисиланов, заключающийся в том, что проводят взаимодействие в среде безводного органического растворителя гидроксида натрия с алкоксисиланом формулы (AlkO)3Si[(CH2)3R], где R имеет вышеуказанные значения, а Alk означает углеводородный радикал C1-C4.
В частности, исходные реагенты - гидроксид натрия и алкосисилан используют в соотношении 1:1.
В частности, в качестве органического растворителя используют растворитель из ряда: тетрагидрофуран (ТГФ), этилацетат, метилтретбутиловый эфир, толуол, гексан.
Взаимодействие реагентов осуществляют при соотношении параметров температура/продолжительность, необходимом для полного растворения гидроксида натрия, в частности при температуре кипения органического растворителя.
Общая схема реакции имеет следующий вид:
Строение синтезированных соединений анализировались с использованием 1H и 29Si ЯМР-спектроскопии. Результаты анализов полностью подтверждали строение соединений.
Индивидуальность полученных соединений доказывалась анализом блокированных триметилхлорсиланом образцов синтезированных солей методами ГЖХ, 1H ЯМР и 29Si ЯМР спектроскопии.
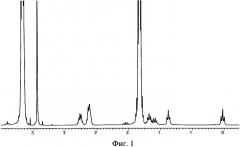
В качестве примера на Фиг. 1 приведен 1H ЯМР (THF) спектр натрийокси-3-(2-аминоэтил)-аминопропилдиметоксисилана, полученного по примеру 1.
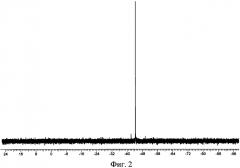
На Фиг. 2 приведен 29Si ЯМР (THF) спектр натрийокси-3-(2-аминоэтил)-аминопропилдиметоксисилана, полученного по примеру 1.
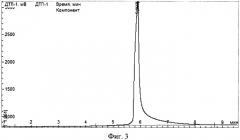
На Фиг. 3 приведен ГЖХ спектр 1-[3-(2-аминоэтил)-аминопропил]-1,1-диметокси-2,2,2-триметилдисилоксана, полученного по примеру 1.
На Фиг. 4 приведен 1H ЯМР (CDCl3) спектр 1-[3-(2-аминоэтил)-аминопропил]-1,1-диметокси-2,2,2-триметилдисилоксана, полученного по примеру 1.
На Фиг. 5 приведен 29Si ЯМР (CDCl3) спектр 1-[3-(2-аминоэтил)-аминопропил]-1,1-диметокси-2,2,2-триметилдисилоксана, полученного по примеру 1.
Достоинством данного метода является высокий выход целевого продукта, достигающий 95-97%, а также отсутствие необходимости использования избытка одного из реагентов, что делает процесс получения продукта более технологичным. Так же большим преимуществом данного процесса является скорость протекания реакции, которая завершается уже после 15-20 минут кипения реакционного раствора.
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1.
Синтез натрийокси-3-(2-аминоэтил)аминопропилдиметоксисилана
Смесь, состоящую из 11.03 г (0.05 моль) 3-(2 аминоэтил)аминопропил-триметоксисилана в 40 мл любого из вышеуказанных безводных растворителей и 2.00 г (0.05) гидроксида натрия, кипятили до полного растворения гидроксида натрия. Летучие компоненты удаляли в вакууме. Выход 97%.
Пример 2.
Синтез натрийокси-3-(2-аминоэтил)аминопропилдибутоксисилана
Смесь, состоящую из 17.43 г (0.05 моль) 3-(2 аминоэтил)аминопропил-трибутоксисилана в 60 мл любого из вышеуказанных безводного растворителя и 2.00 г (0.05) гидроксида натрия, кипятили до полного растворения гидроксида натрия. Летучие компоненты удаляли в вакууме. Выход 95%.
Пример 3.
Синтез натрийокси-3-аминопропилдиметоксисилана
Смесь, состоящую из 8.95 г (0.05 моль) 3-аминопропил-триметоксисилана в 40 мл любого из вышеуказанных безводного растворителя ТГФ и 2.00 г (0.05) гидроксида натрия, кипятили до полного растворения гидроксида натрия. Летучие компоненты удаляли в вакууме. Выход 98%.
Пример 4.
Синтез натрийокси-3-аминопропилдибутоксисилана
Смесь, состоящую из 15.25 г (0.05 моль) 3-аминопропил-трибутоксисилана в 60 мл любого из вышеуказанных безводного растворителя ТГФ и 2.00 г (0.05) гидроксида натрия, кипятили до полного растворения гидроксида натрия. Летучие компоненты удаляли в вакууме. Выход 95%.
Пример 5.
Синтез натрийокси-3-[2-(2-аминоэтиламино)этиламино]пропилдиметоксисилана
Смесь, состоящую из 13.25 г (0.05 моль) 3-[2-(2-аминоэтиламино)этиламино]пропилтриметоксисилана в 40 мл любого из вышеуказанных безводного растворителя и 2.00 г (0.05) гидроксида натрия, кипятили до полного растворения гидроксида натрия. Летучие компоненты удаляли в вакууме. Выход 98%.
Пример 6.
Синтез натрийокси-3-[2-(2-аминоэтиламино)этиламино]пропилдибутоксисилана
Смесь, состоящую из 19.60 г (0.05 моль) 3-[2-(2-аминоэтиламино)этиламино]пропилтрибутоксисилана в 80 мл любого из вышеуказанных безводного растворителя и 2.00 г (0.05) гидроксида натрия, кипятили до полного растворения гидроксида натрия. Летучие компоненты удаляли в вакууме. Выход 95%.
1. Натрийокси(аминопропил)диалкоксисиланы общей формулы: где Alk означает углеводородный радикал из ряда -CH3, -С2Н5, -СН2СН2СН3, -СН2СН2СН2СН3; R означает заместитель из ряда -NH2, -NHCH2CH2NH2, - NHCH2CH2NHCH2CH2NH2.
2. Способ получения натрийокси(аминопропил)диалкоксисиланов по п.1, заключающийся в том, что проводят взаимодействие в среде безводного органического растворителя гидроксида натрия с алкоксисиланом формулы (AlkO)3Si[(СН2)3R], где R имеет вышеуказанные значения, а Alk означает углеводородный радикал C1-C4.
3. Способ по п.2, отличающийся тем, что исходные реагенты гидроксид натрия и алкосисилан используют в соотношении 1:1.
4. Способ по п.2, отличающийся тем, что в качестве органического растворителя используют растворитель из ряда: тетрагидрофуран, этилацетат, метилтретбутиловый эфир, толуол, гексан.
5. Способ по п.2, отличающийся тем, что взаимодействие реагентов осуществляют при соотношении параметров температура/продолжительность, необходимом для полного растворения гидроксида натрия.
6. Способ по п.5, отличающийся тем, что взаимодействие реагентов осуществляют при температуре кипения органического растворителя.