Средство на основе дегидроэпиандростерона, способ его применения
Иллюстрации
Показать всеИзобретение относится к медицине и фармацевтике и касается средства на основе дегидроэпиандростерона (ДГЭА) для нормализации баланса эстрогенов и андрогенов в организме, характеризующегося тем, что оно содержит микронизированный порошок дегидроэпиандростерона (ДГЭА) с размерами частиц от 1 до 5 мкм, либо его микроэмульсию с размером частиц от 2 до 5 мкм и хитозановый натуральный биосовместимый наноструктурированный гель с содержанием ДГЭА от 5 до 10 мг в 1 мл. Средство применяется для менопаузальных женщин, а также для чрескожного введения лицам пожилого возраста. Изобретение обеспечивает улучшение клинических показателей у пациентов обоего пола. 2 з.п. ф-лы, 6 ил., 6 пр.
Реферат
Изобретение относится к средствам заместительной терапии и направлено на создание биологически активных, профилактических и лечебных средств в области эндокринологии, андрологии, гинекологии, диабетологии в форме средства наружного применения на основе дегидроэпиандростерона (ДГЭА), являющегося промежуточным продуктом гормонального метаболизма и способствующего нормализации баланса эстрогенов и андрогенов в организме. В частности, изобретение относится к композициям средств, включающим хитозан в форме геля, и позволяет эффективно и удобно осуществлять введение ДГЭА чрескожно или внутривагинально по сравнению с ранее применяющимися мазями, пластырями, гелями.
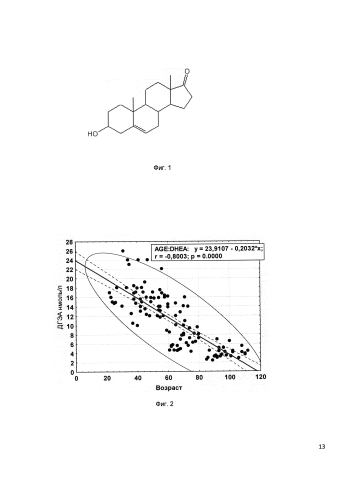
Дегидроэпиандростерон (ДГЭА) - стероид фенантренового ряда, который вырабатывается организмом приматов и растением дикий ямс, структурная формула которого представлена на фиг. 1. Приматами он синтезируется и секретируется преимущественно корой надпочечников в сульфатной форме. Суточная выработка его у человека достигает примерно от 40 до 45 мг. До начала полового созревания он синтезируется в сравнительно небольших количествах, увеличиваясь с началом пубертата и достигая максимального уровня к 30 годам. Затем уровень его синтеза и поступление в кровь начинает неуклонно снижаться со скоростью 60 нг/мл в год. В возрасте от 70 до 80 лет концентрация ДГЭА в крови уменьшается на 80%. Динамика возрастных изменений показателей ДГЭА в периферической крови у мужчин в диапазоне 22-112 лет показана на фиг. 2. ДГЭА циркулирует в кровеносных сосудах главным образом в виде ДГЭА-сульфата (ДГЭА-С). Взаимопревращение ДГЭА/ДГЭА-С происходит с высокой скоростью под действием сульфатазы и сульфотрансферазы. ДГЭА осуществляет свое биологическое действие через множественные сигнальные пути, включая специфические мембранные рецепторы и в результате его внутриклеточной трансформации, в более биологически активные производные андрогенов и эстрогенов, в частности тестостерон и эстрадиол (Dehydroepiandrosterone (DHEA) - a precursor steroid or an active hormone in human physiology - Traish AM, Kang HP, Saad F, Quay AT - J Sex Med 2011 8(11) 2960-2982 guiz 2983 dol:10.1111/5.1749-6109.2011.02.523.X). Именно изменение баланса андрогенной и эстрогенной активностей определяет благоприятное влияние ДГЭА на ожирение, сердечно-сосудистые заболевания, рак молочной железы, чувствительность к инсулину, клеточный иммунитет, улучшения сексуальной функции и физической силы, когнитивной функции, памяти и болезни Альцгеймера.
В экспериментах на старых обезьянах М. Resus, достигших предела биологического возраста, проведенные исследования с подкожным введением ДГЭА в физиологической дозе 1 мг/ кг веса тела через каждые 2 дня в течение 1 месяца показали резкое изменение поведения обезьян от пассивного до бурной двигательной активности и с повышением пищевой мотивации. По данным методики двигательно-пищевых условных рефлексов компенсация уровня ДГЭА в организме привела к достоверному повышению долгосрочной и оперативной памяти, которая сохраняется в течение 2-х лет после прекращения введения ДГЭА. У обезьян восстанавливается шерстный покров, утерянный с возрастом (Гончаров Н.П., Кация Г.В. и др. Влияние нейростероида дегидроэпиандростерона на состояние высшей нервной деятельности старых обезьян. Физиология человека, 2014, том 40, №2, с. 1-8).
В настоящее время доказан широкий спектр биологической активности ДГЭА. Препараты на основе ДГЭА применяют для лечения вагинальной атрофии, гипогонадизме, недостаточном либидо (патент США №5855548), ожирении (патент США №5527788, 5795880, 5846962), остеопорозе (патент США №5776923, 5846960), раке матки, раке груди, недержании мочи, раке прямой кишки, диабете (патент США №4518595), кожных и аутоиммунных заболеваниях, для повышения иммунного ответа на вакцины (патент США №5837269), для общего повышения иммунитета (патент США №5919465), синдроме хронической усталости, при пониженной мышечной массе (патент США №5756469), при заболеваниях соединительной ткани, при депрессии, для лечения вредных привычек (патент W09737663A1), а также для повышения продолжительности жизни и улучшения психологического состояния (патент США №5798347, №5807849). ДГЭА широко используется в качестве препарата для повышения его уровня при дефиците у лиц пожилого возраста. ДГЭА синтезируется в мозге de novo и рассматривается как нейростероид для профилактики и лечения болезни Альцгеймера. ДГЭА повышает функцию центральной нервной системы (Гончаров Н.П., Кация Г.В. Нейростероид ДГЭА и функция мозга. Журнал «Физиология человека»,2013, том 39, №6, с. 120-128).
В настоящее время известны различные способы доставки ДГЭА в организм: пероральный способ в форме таблеток, в том числе сублингвальных, капсул, в том числе желатиновых, сублингвальные растворы, жевательные резинки, способ применения в виде крема или геля, имеющих в составе многочисленные химические компоненты, а также трансдермальный способ в виде пластыря [патент США №4978532, №5869090].
Однако во всех перечисленных формах применения ДГЭА одной из основных и существенных проблем является то, что для достижения необходимого биологического и терапевтического эффекта требуется применять достаточно высокие дозы (от 40 до 100 мг/сутки) вследствие быстрого метаболизма в печени свободного ДГЭА в ДГЭА-сульфат еще до того, как он попадет в кровоток, что является следствием низкого терапевтического биоаккумулирования и снижения эффективности производимых и применяемых в настоящее время препаратов.
Применение высокой первоначальной дозы обусловлено весьма низкой растворимостью ДГЭА как в воде, так и в масле. В гидрофильном окружении кристаллический ДГЭА имеет тенденцию к оседанию, слипанию частиц и агрегации, что является определенным препятствием для эффективного рассасывания их в ротовой полости или трансферту в организм в случае чрескожной аппликации. Применение масляных или жировых форм различных кремов или имеющих многокомпонентный химический состав искусственных гелей позволяет избежать первоначального попадания ДГЭА в печень с последующим метаболизмом, но не позволяет снизить наносимые при аппликациях высокие дозы ДГЭА для достижения требуемой концентрации его в крови также из-за несовершенного состава средств на основе ДГЭА и его низкой степени абсорбции (около 10% от наносимой дозы).
Подобное по своему физиологическому действию, разработанное и выпускаемое средство «Андрогель» (производитель Laboratoires BESINS INTERNATIONAL, Франция) содержит кроме стероида тестостерона гель на основе химически синтезируемых компонентов и до 70% этилового спирта. Достаточно большой объем наносимой аппликации (5 мл геля и 25 мг тестостерона) в этом случае, помимо побочных эффектов при длительном применении, может оказывать повреждающее действие на ткань печени, почки и другие органы и ткани.
Те же недостатки относятся к препарату для чрескожного введения ДГЭА - крем с ДГЭА (производитель «NOW Foods, Ltd.», США), и выбранному авторами в качестве аналога, в котором это многокомпонентное средство наряду с ДГЭА содержит 18 химических и растительных ингредиентов. Для достижения достаточного терапевтического эффекта при использовании данного препарата необходимо применять аппликацию в количестве не менее 15 мг ДГЭА.
Таким образом, представленные и другие выпускаемые на основе стероидов средства не решают проблему его низкой абсорбции и всех сопутствующих этому побочных нежелательных эффектов вследствие необходимости применения высокой первоначальной дозы и присутствия многочисленных химических компонентов в мазях и гелях.
Заявленное изобретение устраняет все вышеуказанные проблемы путем создания оригинального состава (композиции) чрескожного средства, содержащего либо микронизированный порошок ДГЭА с размерами частиц от 1 до 5 мкм либо микроэмульсию ДГЭА с размером частиц от 2 до 5 мкм с наноструктурированным хитозановым гелем.
Разработанная авторами композиция имеет ряд существенных преимуществ по сравнению с имеющимися средствами в форме мазей или гелей:
1. Состав разработанной композиции не включает никаких дополнительных химических компонентов, кроме ДГЭА и биологически подобного наноструктурированного хитозана с содержанием влаги от 95 до 99,5%, что обеспечивает отсутствие нежелательных побочных эффектов (токсичности, аллергии, раздражения и др.).
2. Состав разработанной композиции и способ его применения позволяют исключить возможность избыточного образования из ДГЭА нефизиологически завышенного эстрадиола и тестостерона, которые могут оказывать нежелательные побочные эффекты.
3. Состав разработанной композиции и способ его применения позволяет решить проблему биоаккумулирования ДГЭА, его биодоступности и существенно снизить первоначальную дозу по сравнению с выпускаемыми на рынке средствами (мазями, гелями и капсулами, таблетками), содержащими ДГЭА в диапазоне от 2 до 10 раз больше, чем в разработанной авторами композиции.
4. Состав разработанной композиции и способ его применения путем чрескожной аппликации позволяют снизить количество применяемого для аппликации ДГЭА до минимальной физиологической (до 5-10 мг в день) для компенсации его дефицита при длительных курсах приема, тем самым исключив его метаболическую нагрузку на печень.
Примененный в составе композиции хитозан хорошо известен как нетоксичный биологически совместимый полимер, производный хитина и являющийся широко применяемым и коммерчески производимым продуктом различными производителями как в России, так и за рубежом. Он представляет собой линейный полисахарид, состоящий из случайно связанных D-глюкозаминовых и N-ацетил-D-глюкозаминовых звеньев. Это полимер глюкозы, в котором гидроксильная группа С-2 замещена на N-ацетил-аминогруппу (NHCOCH3). В хитозане ацетильная группа отсутствует. Таким образом, хитозан является деацетилированным хитином, содержит около 7% азота и структурно подобен целлюлозе. Хитин может быть получен из панцирей крабов и других ракообразных в виде аморфного порошка после обработки карбоната кальция панцирей и удаления белков. Наиболее перспективную форму хитозана в виде наноструктурированного гидрофильного геля получают путем дальнейшей его обработки (Ohya et al., 1994; Yokohama et al., 1998; Kataoka et al., 2000; Preparation and application of chitosan nanoparticles and nanofibers. Li-Ming Zhao et al. Braz. J. Chem. Eng. vol. 28 no. 3 Sao Paulo July/Sept. 2011; патент РФ №2428432).
В обзоре T. Klean и M. Thanou «Биодеградация, биораспределение и токсичность хитозана», опубликованном в журнале (Advanced Drug Delivery Reviews, 2010, v. 62, р.3-11), показано отсутствие какого-либо токсичного действия хитозана. Благодаря наличию в его структуре NH2-групп и хорошей биосовместимости хитозан рассматривается как перспективная транспортная форма для доставки в организм лекарственных препаратов. Вследствие положительного заряда хитозан обладает наиболее интересным свойством для использования его в качестве агента проникновения через кожу или слизистую оболочку.
Хитозан одобрен и широко используется в фармацевтическом и пищевом производстве Японии, Италии, Финляндии, США и ФРГ. Благодаря положительному заряду молекулы он нашел применение в препарате для остановки профузного кровотечения за счет механизма электростатического действия на отрицательно заряженные оболочки эритроцитов (B.C. Schmid, G.A. Rezniczek et al. Amer J Obstetrics and Gynecology, 2013, (3) 225.el).
Всесторонне исследованная заявленная композиция ДГЭА с хитозановым наноструктурированным гелем, несмотря на его гидрофильную природу, проявила замечательные качества по доставке через оболочку кожи и слизистую оболочку гидрофобного вещества ДГЭА и тем самым позволила резко уменьшить его терапевтическую дозу, увеличить биодоступность, степень абсорбции и обеспечить необходимую концентрацию в крови. Заявленная композиция для чрескожной аппликации с низкими физиологическими дозами (от 5 до 10 мг/день) в отличие от применяемых в других средствах высоких доз ДГЭА (от 15 до 50 мг/ день и более) позволяет исключить метаболическую нагрузку на печень и, что особенно важно, исключить возможность образования из ДГЭА нефизиологически завышенного эстрадиола и тестостерона, которые могут оказывать нежелательные побочные эффекты, обеспечив, тем самым, наиболее оптимальную компенсацию менопаузы как эстрогенами, так и андрогенами, которые образуются в тканях-мишенях из основного источника ДГЭА. Проведенные фундаментальные исследования профессора Ф. Лабри по изучению процесса метаболизма ДГЭА и внутриклеточной его ферментативной трансформации в тканях-мишенях в более биологически активные эстрогены и тестостерон показали особую важность наличия и контроля соответствующих ферментных систем, которые осуществляют локально биологический эффект за счет нежелательного метаболизма (F. Labrie, A. Belanger, Van Luu-the, et al. DHEA, The precursor of Androgens and Estrogens in Peripheral Tissues in the Human: Intracrinology. Dehydroepiandrosterone (DHEA) edited by M. Kalimi and W. Regelson 2000, p 299-342; F. Labrie et al. Serum steroid levels during 12-week intravaginal dehydroepiandrosterone administration. The journal of The North American Menopause Society. 2009, 5, 897-906; Trivedi D.P., Khaw K.T. Dehydroepiandrosterone sulfate and mortality in elderly men and women. J Clin Endocrin Metab, 2001, 80, 9: 4171-4177). Особенно это важно для женщин в период менопаузы и постменопаузы, когда яичники утрачивают гормональную функцию и основным источником эстрадиола и тестостерона является ДГЭА, который продуцируется надпочечниками. Его концентрация в периферической крови у менопаузальных женщин снижена, однако уровень его секреции достаточен для внутриклеточного образования эстрадиола и тестостерона в периферических тканях, прежде всего в жировой ткани, а оттуда они поступают в системный кровоток.
Применение заявленной композиции ДГЭА/хитозановый наногель для чрескожной аппликации позволяет регулировать и устанавливать необходимый терапевтический уровень ДГЭА в крови, который, как показано ранее (Trivedi D.P., Khaw K.T. - Dehydroepiandrosterone sulfate and mortality in elderly men and women. - J Clin Endocrinol Metab, 2001, 80, 9: 4171-4177; Morales A.J., Nolan J.J. et al. Effect of replacement dose of dehydroepiandrosterone in men and women of advancing age. J Clin Endocrinol Metab, 1999, 78(6), 1360-1367; Гончаров Н.П., Кация Г.В. Гормон здоровья и долголетия, стр. 134-141. Издательство АдамантЪ, Москва, 2012) способен обеспечить коррекцию всего кластера симптомов, характерных для менопаузы, включая остеопению и остеопороз, потерю мышечной массы, снижение и устранение приливов, изменение объема жировой ткани, возрастные изменения кожи, ухудшение когнитивной функции и памяти, коррекции тяжести диабета 2 при его наличии и болезни Альцгеймера.
Приведенные примеры подтверждают оригинальность и новизну заявленной композиции ДГЭА в хитозановом наногеле и способ ее применения, но не ограничивают область ее применения.
Чрескожная аппликация ДГЭА в хитозановом геле
Для оценки эффективности применения композиции ДГЭА/хитозановый наногель по сравнению с пероральным способом в качестве заместительной терапии использовали чрескожную аппликацию. Первоначальная терапевтическая доза ДГЭА в разработанной авторами композиции была в 5 раз меньше, чем при пероральном применении. Оценивалась фармакокинетика свободного ДГЭА как у мужчин, так и женщин в возрасте от 68 до 78 лет. Определение свободного ДГЭА и тестостерона проводилось по содержанию его в слюне, так как это является более удобным, быстрым и неинвазивным способом определения стероидных гормонов по сравнению с методикой таких анализов путем взятия крови вследствие того, что концентрация свободного ДГЭА в слюне высоко коррелирует с концентрацией общего ДГЭА в крови. На фиг. 3 показана динамика возрастных изменений показателей ДГЭА в периферической крови у мужчин в диапазоне 22-112 лет Hbc (Science for Health. Immuno Biological Laboratories IBL. Saliva Diagnostics www.salivadiagnostics.de).
Способ чрескожной аппликации ДГЭА в хитозановом геле: ДГЭА в дозе от 5 до 10 мг в 1 мл геля наносится на внутреннюю поверхность предплечья или бедра площадью 10 см2 и втирается в кожу легким растиранием в течение около 5 мин. Это обеспечивает быстрое чрескожное поступление ДГЭА в капиллярный и общий кровоток с достижением максимума концентрации через от 30 до 60 мин.
Пример 1
Мужчина 78 лет. Исходное состояние: симптомы возрастного дефицита, включая общую и мышечную слабость, повышенную утомляемость к концу дня, сонливость, депрессию.
Применяли композицию ДГЭА/хитозановый наногель с размером частиц хитозана не более 50 нм. В результате ежедневной аппликации композиции ДГЭА/хитозановый гель в дозе 10 мг в 1 мл на поверхность кожи симптомы возрастного дефицита существенно улучшились уже через 14 дней, а через 30 дней практически нормализовались. Уровень циркулирующего ДГЭА повысился до уровня характерного для мужчин возраста от 30 до 40 лет. Параллельно с повышением уровня ДГЭА происходило незначительное повышение концентрации свободного тестостерона в слюне.
Сравнительная оценка фармакокинетики свободного ДГЭА после однократной чрескожной аппликации композиции ДГЭА/хитозановый гель 10 мг и после однократного перорального приема капсулы ДГЭА в дозе 25 мг и на контрольном фоне аппликации хитозанового геля без ДГЭА показали, что чрескожная аппликация 10 мг ДГЭА в 1 мл геля обеспечивает более высокое (от 75 до 228%%) повышение концентрации свободной формы ДГЭА в сравнении с пероральным приемов 25 мг ДГЭА. Динамика свободного ДГЭА в слюне после однократной аппликации ДГЭА в хитозановом геле (10 мг ДГЭА в мл геля); после однократного перорального приема капсулы ДГЭА (25 мг) и динамика свободного ДГЭА после аппликации хитозанового геля без ДГЭА показана на фиг. 4.
Пример 2
Пациентка в возрасте 68 лет.
Исходное состояние: выраженный дефицит ДГЭА и тестостерона, жалобы на повышенную утомляемость, депрессивное состояние и ухудшение памяти. Уже через 2 недели введения ДГЭА снизилась утомляемость и депрессивные симптомы, а через два месяца наблюдалось улучшение по всем показателям возрастных симптомов, включая когнитивную функцию.
Исследовалась фармакокинетика ДГЭА и образующегося из него тестостерона в случае аппликации разработанной авторами композиции ДГЭА/хитозановый гель.
В результате применения однократной аппликации композиции ДГЭА/хитозановый гель уже через 1 час содержание свободного ДГЭА увеличивается в 15 раз по сравнению с исходным. Одновременно регистрируется выраженный подъем свободного тестостерона, определяемого в слюне. Но его максимальные значения регистрируются с задержкой около 2 часов по сравнению с ДГЭА. Спустя 24 часа уровень тестостерона в слюне превышал исходные показатели на 95%, т.е. происходит компенсация его дефицита, которая характерна для женщин в период менопаузы. Динамика свободного ДГЭА в слюне в зависимости от дозы ДГЭА при чрескожной аппликации ДГЭА у женщины в постменопаузальном периоде показана на фиг. 5. Динамика повышения уровня свободного тестостерона в слюне на фоне чрескожной аппликации ДГЭА у женщины в постменопаузе с андрогенным дефицитом показана на фиг. 6.
Полученные фармакокинетические данные позволяют утверждать, что заявленная композиция, состоящая из ДГЭА и биологически подобного хитозана в виде геля по сравнению с известными составами и формами средств в виде таблеток, капсул, кремов и гелей другого состава, решает проблему первоначальной высокой терапевтической дозы, биоаккумуляции и биодоступности с применением меньшей первоначальной дозы от 2 до 10 раз и может быть основой для создания профилактических средств, биологически активных добавок и лекарственных средств заместительной терапии.
Внутривлагалищное введение ДГЭА в хитозановом геле
В случаях атрофии влагалища у женщин была изучена эффективность влияния композиции ДГЭА/хитозановый гель при уменьшении начальной терапевтической дозы ДГЭА в 2-2,3 раза по сравнению с дозой в случае применения. Средний возраст женщин составлял от 51 до 56,6 лет, с хирургической менопаузой продолжительностью от 1 до 14 лет, которая является наиболее тяжелой по своим клиническим проявлениям. Хирургическая менопауза быстро развивается при оперативном двустороннем удалении яичников, которое проводится по строгим медицинским показаниям.
Пример 3
Диагноз: Хирургическая менопауза (1 год).
Климактерический синдром. Атрофический вагинит.
До применения терапии наблюдались вегето-эмоциональные приливы более 10 раз в сутки, высокие астенодепрессивные проявления (шкала Green 30 баллов), низкий индекс вагинального здоровья (ИВЗ) составлял от 1 до 2 баллов, рН среды более 6,1. Эластичность отсутствует, выраженная сухость, кровоточивость слизистой при осмотре. Неблагоприятный уровень микрофлоры отделяемого влагалища: Lactobacillus - не обнаружены, Enteroccocus faecalis 1·107, Escherichia coli - обильный рост.
Было назначено ежедневное внутривлагалищное введение композиции ДГЭА в дозе 5 мг в 1 мл хитозанового геля на протяжении трех месяцев. В результате применения существенно улучшились вегето-эмоциональные проявления. Шкала Green снизилась с 30 до 22 баллов, индекс вагинального здоровья увеличился от 1-2 до 4 баллов; бактериологический анализ показал существенное улучшение микрофлоры отделяемого влагалища: Lactobacillus sp.- 1·105, Enteroccocus faecalis 1·105, Escherichia coli 1·104. Выявлен дополнительный положительный эффект по нормализации мочеиспускания.
Пример 4
Диагноз: Хирургическая менопауза (14 лет). Климактерический синдром, эмоционально-вегетативная форма. Атрофический вагинит. Метаболический синдром.
Исходно у женщины доминировала эмоционально-вегетативная форма климактерического синдрома (приливы более 10 в день), астенодепрессивные симптомы. По шкале Green высокая выраженность проявлений климактерического синдрома соответствовала 36 баллам. Урогенитальные проявления (недержание мочи, частое мочеиспускание), ИВЗ соответствовал значениям от 2 до 3 баллов, рН составлял 5,8. При осмотре отмечены слабая эластичность, выраженная сухость, воспаленная поверхность и кровоточивость. Бактериологический анализа отделяемого влагалища показал неблагоприятный уровень микрофлоры: Lactobacillus - не обнаружены, Enteroccocus faecalis 1·107, Staphyloccocus spp - 1·104, Escherichia coli - 1·105.
Было назначено ежедневное внутривлагалищное введение композиции ДГЭА в дозе 5 мг в 1 мл хитозанового геля на протяжении трех месяцев, что позволило получить существенное улучшение состояния здоровья. Число приливов снижается в 2 раза (от 5 до 6 в день), зарегистрирована нормализация мочеиспускания. Шкала Green снизилась в 1,8 раза до 20 баллов, а ИВЗ повысился до 4 баллов, рН был равен 4,8. Отмечено значительное улучшение эластичности, отсутствие кровоточивости и нормализация влажности слизистой влагалища. Бактериологический анализ показал нормализацию микрофлоры: Lactobacillus - 1·104, Enteroccocus faecalis 1·103, Staphyloccocus spp 1·104.
Пример 5
Диагноз: Хирургическая менопауза (3 года).
Климактерический синдром, эмоционально-вегетативная форма. Атрофический вагинит. Шкала Green - 28 баллов (доминируют астенодепрессивные симптомы и урогенитальные проявления), показатель ИВЗ составлял от 2 до 3 баллов: рН равен 5,6, эластичность слабая, выраженная сухость, поверхность не воспалена. По данным бактериологического анализа отделяемого влагалища: Lactobacillus - 1·102, Enteroccocus faecalis - 1·104, Staphyloccocus spp - 1·103.
Было назначено ежедневное внутривлагалищное введение композиции ДГЭА в дозе 5 мг в 1 мл хитозанового геля на протяжении трех месяцев, что позволило получить существенное улучшение. Уже к второму месяцу отмечено снижение показателя по шкале Green с 28 до 11 баллов, показатель ИВЗ увеличился до 4 баллов при нормализации показателя (рН равен 4,9), эластичности и влажности. Отмечена нормализация состояния слизистой влагалища по микробиологическим показаниям (Lactobacillus sp. - 1·105, Staphyloccocus spp - 1·103).
Пример 6
Диагноз: Хирургическая менопауза (3 года).
Климактерический синдром, эмоционально-вегетативная форма. Атрофический вагинит. Исходный показатель по шкале Green составлял 27 баллов (доминируют вегето-эмоциональные проявления). Показатель ИВЗ был от 2 до 3 баллов: рН равен 5,2, эластичность слабая, выраженная сухость, поверхность не воспалена. По данным бактериологического анализа отделяемого влагалища: Lactobacillus - 1·102, Enteroccocus faecalis - 1·106, Corynebacterium amycolatum - 1·103.
Было назначено ежедневное внутривлагалищное введение композиции ДГЭА в дозе 5 мг в 1 мл хитозанового геля на протяжении 3-х месяцев, что позволило получить существенное улучшение. К 2-му месяцу отмечено существенное снижение баллов по шкале Green до с 27 до 14 баллов. Показатель ИВЗ увеличился до 4 баллов. При этом рН установился на уровне 4,4, нормализовалась эластичность и влажность. Бактериологический анализ отделяемого влагалища показал нормализацию состояния микрофлоры (Lactobacillus sp. - 1·105, Enteroccocus faecalis - 1·102).
Представленные результаты по применению заявленного средства на основе ДГЭА/хитозановый гель по устранению симптомов вульвовагинальной атрофии у менопаузальных женщин подтверждают существенное улучшение всех клинических показателей. Установлено снижение показателя по шкале Green и улучшение индекса вагинального здоровья, что позволяет получить значимый положительный результат: восстанавливается структура влагалища, улучшается состояние микрофлоры влагалища и улучшаются все субъективные симптомы, связанные с менопаузой.
1. Средство на основе дегидроэпиандростерона для нормализации баланса эстрогенов и андрогенов в организме, характеризующееся тем, что средство содержит микронизированный порошок дегидроэпиандростерона с размерами частиц от 1 до 5 мкм либо его микроэмульсию с размером частиц от 2 до 5 мкм и хитозановый натуральный биосовместимый наноструктурированный гель с содержанием ДГЭА от 5 до 10 мг в 1 мл.
2. Средство по п. 1 составляет не более 1 мл с содержанием ДГЭФ не более 5-10 мг для ежедневного влагалищного введения менопаузальным женщинам.
3. Средство по п. 1 составляет не более 1 мл с содержанием ДГЭФ не более 5-10 мг для ежедневного чрескожного введения лицам пожилого возраста.