Фосфодиэстераза 9а в качестве маркера злокачественной опухоли предстательной железы
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. В частности, изобретение связано с фосфодиэстеразой-9А (PDE9A) для применения ее в качестве маркера злокачественной опухоли предстательной железы, а также для применения PDE9A в качестве маркера для диагностики, детекции, мониторинга или прогнозирования злокачественной опухоли предстательной железы или прогрессии злокачественной опухоли предстательной железы, и иммуноанализом. Способы и иммуноанализ включают следующие стадии: определение уровня PDE9A в образце; определение уровня экспрессии референсного гена в образце; нормализацию измеренного уровня экспрессии PDE9A относительно экспрессии референсного гена и сравнение нормализованного уровня экспрессии с предопределенным граничным значением, выбранным таким образом, чтобы исключить гормон-чувствительную злокачественную опухоль предстательной железы. Причем нормализованный уровень экспрессии, который оказывается ниже граничного значения, является показателем гормон-резистентной злокачественной опухоли предстательной железы. 5 н. и 3 з.п. ф-лы, 15 ил., 3 табл., 3 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с фосфодиэстеразой-9А (PDE9A) для применения ее в качестве маркера злокачественной опухоли предстательной железы (или рака простаты, или рака предстательной железы), а также для применения PDE9A в качестве маркера для диагностики, детекции, мониторинга или прогнозирования злокачественной опухоли предстательной железы или прогрессии злокачественной опухоли предстательной железы. Настоящее изобретение связано также с композицией для диагностики, детекции, мониторинга или прогнозирования злокачественной опухоли предстательной железы или прогрессии злокачественной опухоли предстательной железы, с соответствующим способом и иммуноанализом, со способом диагностики, мониторинга или прогнозирования гормон-резистентной злокачественной опухоли предстательной железы, в отличие от гормон-чувствительной злокачественной опухоли предстательной железы, с соответствующим способом и иммуноанализом, со способом сбора данных, иммуноанализом для диагностики, детекции, мониторинга или прогнозирования злокачественной опухоли предстательной железы или прогрессии злокачественной опухоли предстательной железы, способом идентификации индивида в соответствии с критериями правомочности проведения лечения в связи со злокачественной опухолью предстательной железы, иммуноанализом для стратификации индивида или когорты индивидов в группу лечения злокачественной опухоли предстательной железы. В настоящем изобретении дополнительно предусмотрены фармацевтические композиции и их применение для лечения злокачественной опухоли предстательной железы, в частности, гормон-резистентной предстательной железы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Злокачественная опухоль, или рак, относится к классу заболеваний, при которых проявляются неконтролируемый рост, инвазия и иногда метастазирование группы клеток. Три указанных свойства злокачественности разных типов рака отличают его от доброкачественных опухолей, которые являются самокупирующимися, не инвазирующими и не метастазирующими. Среди мужчин в развитых странах тремя наиболее часто диагностируемыми видами злокачественных опухолей являются рак предстательной железы, легкого и рак ободочной и прямой кишки. В частности, рак простаты является наиболее распространенной злокачественной опухолью у мужчин-европейцев. В 2002 году в Европе у 225000 мужчин был впервые диагностирован рак предстательной железы, и приблизительно 83000 скончалось от указанного заболевания.
Определенные фосфодиэстеразы ассоциированы с развитием злокачественных опухолей. Например, было показано, что фосфодиэстераза PDE7 ассоциирована с хроническим лимфолейкозом (Zhang L et al., PNAS, 2008, 105(49): 19532-7). Однако для многих типов злокачественных опухолей или форм прогрессирующего рака адекватный молекулярный маркер не выявлен.
Злокачественная опухоль предстательной железы, например, традиционно диагностируется по уровню специфического антигена простаты в сыворотке (PSA, prostate-specific antigen). Однако PSA не является специфичным для рака предстательной железы и может быть повышен также и при других обстоятельствах, что приводит к ложно-положительным результатам (злокачественная опухоль не обнаруживается приблизительно у 70% подвергшихся биопсии мужчин с повышенными уровнями PSA). Более того, можно ожидать неподдающееся оценке количество ложно-отрицательных результатов у мужчин, у которых в дальнейшем разовьется рак предстательной железы при наличии "нормальных" результатов теста на PSA.
Следовательно, необходимо создание новой и эффективной альтернативной диагностики для детекции, мониторинга и прогнозирования рака предстательной железы.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на удовлетворение указанной потребности, и здесь предложены средства и способы, которые позволяют осуществлять диагностику и детекцию рака предстательной железы.
Указанную выше задачу удается решить с помощью фосфодиэстеразы-9A (PDE9A), используемой в качестве маркера злокачественной опухоли предстательной железы.
Как показали авторы настоящего изобретения, уровень фосфодиэстеразы-9A в линиях клеток злокачественной опухоли предстательной железы и в ткани простаты, полученной из организма пациентов, понижен. Таким образом, PDE9A рассматривается в качестве прогностического биомаркера и определяющего инструмента для стратификации определенных схем лечения, а также прогноза и мониторинга прогрессии рака предстательной железы. В частности, авторами настоящего изобретения было показано, что уровень PDE9A понижается в гормон-резистентных клеточных линиях, полученных из организма человека, также как и в соответствующих образцах ткани человека. Диагностические методы и способы применения PDE9A в качестве маркера рака предстательной железы могут, таким образом, успешно использоваться для (i) детекции и диагностики опасных для жизни форм злокачественной опухоли предстательной железы, (ii) прогнозирования опасных для жизни форм злокачественной опухоли предстательной железы, (iii) мониторинга прогрессии злокачественной опухоли в направлении представляющих угрозу для жизни форм рака простаты и (iv) проведения различий между медленно растущими и представляющими угрозу для жизни формами злокачественной опухоли.
В другом аспекте настоящее изобретение связано с композицией для диагностики, детекции, мониторинга или прогнозирования рака предстательной железы или прогрессии злокачественной опухоли предстательной железы, содержащей аффинный лиганд на основе нуклеиновой кислоты и/или аффинный пептидный лиганд, обладающий сродством к продукту экспрессии PDE9A или к белку PDE9A.
В предпочтительном воплощении настоящего изобретения указанная композиция содержит аффинный лиганд на основе нуклеиновой кислоты или аффинный пептидный лиганд, который модифицирован таким образом, чтобы функционировать в качестве контрастного средства.
В другом предпочтительном воплощении настоящего изобретения указанная композиция содержит набор олигонуклеотидов, специфичных в отношении продукта экспрессии PDE9A, зонд, специфичный в отношении продукта экспрессии PDE9A, аптамер, специфичный в отношении продукта экспрессии PDE9A или белка PDE9A, антитело, специфичное в отношении белка PDE9A, и/или вариант антитела, специфичного в отношении белка PDE9A.
Еще в одном аспекте настоящее изобретение связано с применением PDE9A в качестве маркера для диагностики, детекции, мониторинга или прогнозирования рака предстательной железы или прогрессии злокачественной опухоли предстательной железы.
В другом аспекте настоящее изобретение связано со способом детекции, диагностики, мониторинга или прогнозирования рака предстательной железы или прогрессии злокачественной опухоли предстательной железы, предусматривающим стадию определения уровня PDE9A. В другом аспекте настоящее изобретение связано со способом диагностики, мониторинга или прогнозирования гормон-резистентного рака предстательной железы или прогрессии в направлении развития гормон-резистентного рака предстательной железы, причем указанный способ позволяет отличить гормон-чувствительную злокачественную опухоль предстательной железы от гормон-резистентной злокачественной опухоли предстательной железы, предусматривающим следующие стадии:
(a) определение уровня PDE9A в образце;
(b) определение уровня экспрессии референсного гена в образце;
(c) деление (или нормирование, или нормализацию) измеренного уровня экспрессии PDE9A на уровень экспрессии референсного гена; и
(d) сравнение нормализованного уровня экспрессии с предопределенным граничным значением, выбранным таким образом, чтобы исключить гормон-чувствительную злокачественную опухоль предстательной железы, при этом нормализованный уровень экспрессии, который оказывается ниже граничного значения, является показателем гормон-резистентной злокачественной опухоли предстательной железы, причем указанное граничное значение приблизительно составляет от 2 до 15, предпочтительно около 5.
В другом аспекте настоящее изобретение связано со способом сбора данных, предусматривающим по меньшей следующие стадии:
(a) тестирование у индивида уровня экспрессии PDE9A; и
(b) сравнение уровня экспрессии, определяемого на стадии (a), с контрольным уровнем.
В другом предпочтительном воплощении настоящего изобретения диагностику, детекцию, мониторинг, прогнозирование или сбор данных осуществляют на основе образца, полученного из индивидуального организма.
В другом аспекте настоящее изобретение связано с иммуноанализом для детекции, диагностики, мониторинга или прогнозирования рака простаты или прогрессирования злокачественной опухоли предстательной железы, включающим в себя по меньшей мере следующие стадии:
(a) тестирование образца на предмет определения экспрессии PDE9A,
(b) тестирование контрольного образца на предмет определения экспрессии PDE9A,
(c) определение разницы в уровнях экспрессии PDE9A, определяемых на стадиях (a) и (b); и
(d) вынесение заключения относительно наличия или стадии рака простаты или же прогрессирования злокачественной опухоли предстательной железы на основе результатов, полученных на стадии (c), при этом указанные стадии тестирования основаны на использовании антитела, специфически связывающегося с PDE9A.
В другом аспекте настоящее изобретение связано с иммуноанализом, позволяющим отличить гормон-чувствительный рак предстательной железы от гормон-резистентного рака простаты, предусматривающим осуществление следующих стадий:
(a) определения уровня PDE9A в образце;
(b) определения уровня экспрессии референсного гена в образце;
(c) деления (или нормирования) измеренного уровня экспрессии PDE9A на уровень экспрессии референсного гена; и
(d) сравнение нормализованного уровня экспрессии с предопределенным граничным значением, чтобы исключить гормон-чувствительную злокачественную опухоль предстательной железы, при этом нормализованный уровень экспрессии, который оказывается ниже граничного значения, является показателем гормон-резистентного рака простаты, причем указанное граничное значение приблизительно составляет от 2 до 15, предпочтительно около 5.
В другом аспекте настоящее изобретение связано со способом идентификации индивида как удовлетворяющего критериям [правомочности] назначения лечения от злокачественной опухоли предстательной железы, включающим в себя следующие стадии:
(a) тестирование образца, полученного из организма индивида, на предмет определения экспрессии PDE9A;
(b) тестирование в указанном образце экспрессии референсного гена и/или тестирование в контрольном образце экспрессии PDE9A;
(c) классификацию уровней экспрессии, определяемых на стадии (a), относительно их уровней в контрольных образцах PDE9A, определяемых на стадии (b); и
(d) идентификацию индивида как удовлетворяющего критериям [правомочности] назначения лечения от злокачественной опухоли предстательной железы, при этом полученный из организма индивида образец классифицируется как таковой, имеющий измененный уровень экспрессии PDE9A.
Еще в одном аспекте настоящее изобретение связано с иммуноанализом с целью стратификации индивида или когорты индивидов со злокачественным опухолевым заболеванием предстательной железы, включающим в себя
(a) тестирование образца, полученного из организма индивида, на предмет определения экспрессии PDE9A;
(b) тестирование в указанном образце экспрессии референсного гена и/или тестирование в контрольном образце экспрессии PDE9A;
(с) определение разницы в экспрессии PDE9A на стадии (a) и экспрессии PDE9A и/или референсного гена на стадии (b); и
(d) стратификации индивида или когорты индивидов в группу лечения рака предстательной железы на основании результатов, полученных на стадии (с), при этом полученный из организма индивида образец имеет измененный уровень экспрессии PDE9A.
В другом предпочтительном воплощении настоящего изобретения указанное тестирование или определение экспрессии осуществляется или же дополнительно осуществляется путем измерения уровней нуклеиновой кислоты или белка, или путем определения биологической активности PDE9A или референсного гена.
В другом предпочтительном воплощении настоящего изобретения указанный способ или иммуноанализ включает в себя дополнительную стадию сравнения измеренных уровней нуклеиновой кислоты или белка или же измеряемой биологической активности с контрольным уровнем.
В другом предпочтительном воплощении настоящего изобретения указанный референсный ген является геном домашнего хозяйства, особенно предпочтительно GAPDH или PBGD, или другой фосфодиэстеразой, особенно предпочтительно PDE4D5.
В другом предпочтительном воплощении настоящего изобретения указанный способ или иммуноанализ включает в себя дополнительную стадию определения уровня специфического антигена простаты (PSA).
В другом предпочтительном воплощении настоящего изобретения, в указанном способе или иммуноанализе, как определено выше, индивид, тестированный или классифицированный как индивид, имеющий повышенный уровень экспрессии PDE9A и повышенный уровень PSA, составляющий более чем приблизительно >2,5 нг/мл и приблизительно вплоть до 10 нг/мл, идентифицируется как страдающий злокачественной гормон-чувствительной опухолью предстательной железы; а индивид, классифицированный или тестированный как индивид, имеющий пониженный уровень экспрессии PDE9A и повышенный уровень PSA, составляющий более чем приблизительно >10 нг/мл, идентифицируется как страдающий злокачественной гормон-резистентной опухолью предстательной железы.
В другом предпочтительном воплощении настоящего изобретения указанным выше образцом является образец ткани, образец мочи, образец осадка мочи, образец крови, образец слюны, образец семенной жидкости, образец, содержащий циркулирующие опухолевые клетки, или образец, содержащий секретируемые предстательной железой экзосомы.
Еще в одном аспекте настоящее изобретение связано со стимулирующей фармацевтической композицией, содержащей по меньшей мере один элемент, выбранный из следующей группы:
(a) соединения, непосредственно стимулирующего или модулирующего активность PDE9A, предпочтительно, аллостерического агониста ферментативной активности PDE9A;
(b) соединения, опосредованно стимулирующего или модулирующего активность PDE9A;
(c) белка PDE9A или его биологически активного эквивалента;
(d) нуклеиновой кислоты, кодирующей и экспрессирующей PDE9A;
(e) ингибитора микро-РНК (miRNA), специфичного в отношении различных микро-РНК фосфодиэстеразы-9A;
(f) деметилирующего агента; и
(g) фактора вытеснения фосфодиэстеразы.
Поскольку в линиях клеток, ассоциированных с заболеваниями, фосфодиэстераза-9A подавлена, PDE9A как таковая и агенты, модифицирующие или стимулирующие PDE9A, модифицирующие или стимулирующие экспрессию PDE9A, или же модифицирующие или стимулирующие взаимодействия PDE9A, могут с успехом быть использованы в качестве лекарственных средств. Таким образом, противодействуя наблюдаемому процессу подавления, PDE9A и/или агенты, модифицирующие PDE9A, могут быть использованы в качестве лекарственного средства, например, в качестве лекарственного средства, препятствующего всем или некоторым из эффектов, ассоциированных с низким уровнем экспрессии PDE9A или с ее подавлением.
Еще в одном аспекте настоящее изобретение связано со стимулирующей фармацевтической композицией, предназначенной для лечения или профилактики злокачественной опухоли предстательной железы, содержащей по меньшей мере один элемент, выбранный из следующей группы:
(a) соединения, непосредственно стимулирующего или модулирующего активность PDE9A, предпочтительно, аллостерического агониста ферментативной активности PDE9A;
(b) соединения, опосредованно стимулирующего или модулирующего активность PDE9A;
(c) белка PDE9A или его биологически активного эквивалента;
(d) нуклеиновой кислоты, кодирующей и экспрессирующей PDE9A;
(e) ингибитора микро-РНК, специфичного в отношении различных микро-РНК фосфодиэстеразы-9A;
(f) деметилирующего агента; и
(g) фактора вытеснения фосфодиэстеразы.
Поскольку в линиях клеток, ассоциированных со злокачественной опухолью предстательной железы, фосфодиэстераза-9A подавлена, PDE9A как таковая и агенты, модифицирующие или стимулирующие PDE9A, модифицирующие или стимулирующие экспрессию PDE9A, или же модифицирующие или стимулирующие взаимодействия PDE9A, могут с успехом быть использованы в качестве лекарственных средств для лечения злокачественной опухоли, в частности, для лечения злокачественной опухоли предстательной железы. Таким образом, противодействуя наблюдаемому процессу подавления, PDE9A и/или агенты, модифицирующие PDE9A, могут быть использованы в качестве лекарственного средства, препятствующего низкому уровню экспрессии PDE9A и/или подавлению PDE9A в злокачественных клетках, в частности, в клетках злокачественной опухоли предстательной железы.
Еще в одном аспекте настоящее изобретение связано с ингибирующей фармацевтической композицией, содержащей по меньшей мере один элемент, выбранный из следующей группы:
(a) соединения, непосредственно ингибирующего активность PDE9A, предпочтительно, антагониста ферментативной активности PDE9A;
(b) соединения, опосредованно ингибирующего активность PDE9A;
(c) доминантной негативной формы белка PDE9A или его биологически активного эквивалента;
(d) нуклеиновой кислоты, кодирующей и экспрессирующей доминантную негативную форму PDE9A;
(e) микро-РНК (miRNA), специфичной в отношении PDE9A;
(f) антисмысловой молекулы PDE9A;
(g) ки-РНК (siRNA), специфичной в отношении PDE9A;
(h) аптамера, специфичного в отношении продукта экспрессии PDE9A или белка PDE9A;
(i) малой молекулы или пептидомиметика, способного специфически связываться с белком PDE9A; и
(j) антитела, специфичного в отношении белка PDE9A, и/или варианта антитела, специфичного в отношении белка PDE9A.
В предпочтительном воплощении настоящего изобретения либо указанная ингибирующая, либо указанная стимулирующая фармацевтическая композиция предназначена для лечения злокачественной опухоли предстательной железы в зависимости от уровня экспрессии PDE9A, при этом указанный уровень экспрессии определяется и/или подвергается мониторингу в соответствии со следующими стадиями:
(a) определением уровня PDE9A в образце;
(b) определением уровня экспрессии референсного гена в образце; и
(c) нормализацией, или нормированием, измеренной экспрессии уровня PDE9A относительно экспрессии референсного гена.
Еще в одном, особенно предпочтительном, воплощении настоящего изобретения, в случае повышенных и/или повышающихся уровней PDE9A следует вводить ингибирующую фармацевтическую композицию, а в случае пониженных и/или понижающихся уровней PDE9A следует вводить стимулирующую фармацевтическую композицию.
В другом аспекте настоящее изобретение связано со способом лечения или профилактики злокачественной опухоли, в частности, злокачественной опухоли предстательной железы, предусматривающим введение индивиду
(a) соединения, непосредственно стимулирующего или модулирующего активность PDE9A, предпочтительно, аллостерического агониста ферментативной активности PDE9A;
(b) соединения, опосредованно стимулирующего или модулирующего активность PDE9A;
(c) белка PDE9A или его биологически активного эквивалента;
(d) нуклеиновой кислоты, кодирующей и экспрессирующей PDE9A;
(e) ингибитора микро-РНК, специфичного в отношении различных микро-РНК фосфодиэстеразы-9A;
(f) деметилирующего агента; и/или
(g) фактора вытеснения фосфодиэстеразы.
В предпочтительном воплощении настоящего изобретения указанным выше фактором вытеснения фосфодиэстеразы является пептид, пептидомиметик, малая молекула, антитело или аптамер.
В другом предпочтительном воплощении настоящего изобретения указанная злокачественная опухоль предстательной железы является гормон-резистентной злокачественной опухолью предстательной железы.
Эти и другие характеристики, признаки и задачи настоящего изобретения станут более наглядными после следующего ниже подробного описания, в совокупности с сопроводительными фигурами и примерами, которые лишь в иллюстративных целях демонстрируют принципы данного изобретения.
Настоящее описание приведено лишь для примера и не предназначено для ограничения объема, охватываемого настоящим изобретением.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
Фиг. 1 дает общее представление об образцах, тестируемых в отношении уровня экспрессии. AD означает "андроген-зависимый", AS означает "андроген-чувствительный", и AI означает "андроген-независимый". Образцы, начиная с "LNCaP" и кончая образцом "DuCaP", являются клеточными линиями, а образцы, начиная с "PC-EW" и кончая образцом "PC374", являются ксенотрансплантатами.
На фиг. 2 приведена относительная экспрессия мРНК PDE9A в клеточных линиях и ксенотрансплантатах злокачественной опухоли предстательной железы по сравнению с LNCaP.
На фиг. 3 приведена относительная экспрессия мРНК PDE9A в линиях ксенотрансплантата, нормализованная относительно GAPDH, по сравнению с LNCaP.
На фиг. 4 приведена относительная экспрессия мРНК PDE9A в клеточных линиях злокачественной опухоли предстательной железы, нормализованная относительно GAPDH, по сравнению с LNCaP.
На фиг. 5 показана относительная экспрессия мРНК PDE9A в ксенотрансплантатах и клеточных линиях злокачественной опухоли предстательной железы.
На фиг. 6 показано содержание мРНК PDE9A в ксенотрансплантатах злокачественной опухоли предстательной железы, нормализованная относительно GAPDH.
На фиг. 7 показано содержание PDE9A в клеточных линиях злокачественной опухоли предстательной железы, нормализованная относительно GAPDH.
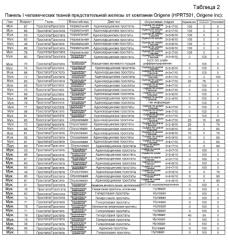
На фиг. 8 показана относительная экспрессия гена человеческой PDE9A в образцах ткани предстательной железы человека, полученных из организма пациентов. Информация получена в общей сложности из 16 различных образцов, как показано в таблице 1. Группа образцов, обозначенная как "нет", определена как гормон-чувствительные первичные опухоли предстательной железы, а группа образцов, обозначенная как "да", определена как гормон-резистентные опухоли предстательной железы. Показаны индивидуальные значения относительной экспрессии человеческой PDE9A в образцах тканей предстательной железы человека. Результаты нормализованы относительно экспрессии GAPDH и PBGD. Для каждой группы пациентов приведено срединное значение относительно данных, полученных при измерениях.
На фиг. 9 показана относительная экспрессия гена человеческой PDE9A в образцах ткани предстательной железы человека, полученных из организма пациентов. Информация получена в общей сложности из 16 различных образцов, как показано в таблице 1 (включая и удаленные ткани лимфатических узлов). Группа образцов, обозначенная как "нет", определена как гормон-чувствительные первичные опухоли предстательной железы, а группа образцов, обозначенная как "да", определена как гормон-резистентные опухоли предстательной железы. Результаты нормализованы относительно экспрессии GAPDH и PBGD. На данной фигуре изображена ящичковая диаграмма индивидуальных данных измерения относительной экспрессии человеческой PDE9A, где «ящичек»-блок включает в себя 75% всех измерений. Срединное значение относительной экспрессии показано в виде границы между двумя окрашенными «ящичками»-блоками.
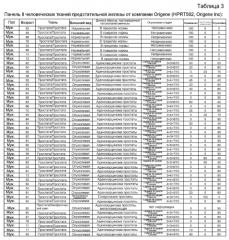
На фиг. 10 показана относительная экспрессия гена PDE9A в 96 различных образцах, полученных из панелей Origene HPRT I и II. Показаны индивидуальные значения относительной экспрессии человеческой PDE9A в образцах тканей предстательной железы человека и срединное значение относительно данных, полученных при измерениях, для каждой группы пациентов.
На фиг. 11 показана относительная экспрессия гена PDE9A в 96 различных образцах, полученных из панелей Origene HPRT I и II. На данной фигуре изображена ящичковая диаграмма индивидуальных данных измерения относительной экспрессии человеческой PDE9A, где «ящичек»-блок включает в себя 75% всех измерений. Срединное значение относительной экспрессии показано в виде границы между двумя окрашенными в серый цвет «ящичками»-блоками.
На фиг. 12 приведено представление на кривой ROC экспрессии гена PDE9A на образцах ткани предстательной железы человека, с указанием AUC (площадь под кривой) для попарных сравнений нормы (N) и опухоли.
На фиг. 13 приведен PDE-индекс предстательной железы (PPI, Prostate PDE-Index), то есть относительная экспрессия гена дельта (CT [PDE4D5 человека]-CT [PDE9A человека]). Значения CT человеческой PDE9a вычитывали из значений CT человеческой PDE4D5 индивидуально для каждого образца тестируемой ткани. Информация получена в общей сложности из 96 различных образцов, измеренных на панелях Origene HPRT I и II (см. Примеры). На данной фигуре приведены индивидуальные значения относительной экспрессии человеческого гена дельта (CT [PDE4D5 человека]-CT [PDE9A человека]) на тканях предстательной железы человека. Для каждой группы пациентов указано срединное значение относительно данных, полученных при измерениях.
На фиг. 14 приведен PDE-индекс предстательной железы (PPI), то есть относительная экспрессия гена дельта (CT [PDE4D5 человека]-CT [PDE9A человека]). Значения CT человеческой PDE9a вычитали из значений CT человеческой PDE4D5 индивидуально для каждого образца тестируемой ткани. Информация получена в общей сложности из 96 различных образцов, измеряемых на панелях Origene HPRT I и II (см. Примеры). На данной фигуре изображена ящичковая диаграмма индивидуальных данных измерения относительной экспрессии человеческой PDE9A, где «ящичек»-блок включает в себя 75% всех измерений. Срединное значение относительной экспрессии показано в виде границы между двумя окрашенными в серый цвет «ящичками»-блоками.
На фиг. 15 изображена рабочая референсная кривая (ROC, Receiver Operating Characteristic) экспрессии гена дельта (CT [PDE4D5 человека]-CT [PDE9A человека]) для оценки правомочности диагностического критерия. Приведено представление на кривой ROC экспрессии гена PDE9A на образцах ткани предстательной железы человека, с указанием AUC (площадь под кривой) для попарных сравнений нормы (N) и опухоли.
ПОДРОБНОЕ ОПИСАНИЕ АСПЕКТОВ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения было обнаружено, что PDE9A сильно подавлена в определенных типах клеток, ассоциированных со злокачественной опухолью предстательной железы, и в человеческих тканях пациентов, и, следовательно, она может быть использована в качестве биомаркера рака предстательной железы. PDE9A, также как и средства, модифицирующие PDE9A или модифицирующие экспрессию PDE9A, могут быть дополнительно использованы в качестве лекарственных средств, в частности, для лечения злокачественной опухоли предстательной железы.
Несмотря на то что настоящее изобретение будет описано со ссылкой на конкретные воплощения, настоящее описание не должно рассматриваться как ограничивающее объем, охватываемый данным изобретением.
Прежде чем перейти к подробному описанию конкретных воплощений настоящего изобретения, следует привести определения, имеющие важное значение для понимания данного изобретения.
Используемые в описании и в прилагаемой формуле изобретения формы единственного числа включают в себя, если в контексте специально не указано иное, также и форму множественного числа.
В контексте настоящего изобретения термины "приблизительно" и "примерно" означают интервал точности, в котором специалист в данной области будет рассматривать технический эффект обсуждаемого признака. Данный термин обычно указывает на отклонение от указанного числового значения на ±20%, предпочтительно, на ±15%, более предпочтительно, на ±10%, и даже еще более предпочтительно, на ±5%.
Следует иметь в виду, что термин «включающий в себя» не является ограничивающим. Для целей настоящего изобретения термин «состоящий из» считается предпочтительным воплощением термина «составляющий», или «в составе». Если в дальнейшем в данном документе какая-либо группа определяется как включающая в себя по меньшей мере определенное число воплощений, это означает, что в нее входит также и группа, которая предпочтительно состоит только из указанных воплощений.
Кроме того, термины "первый", "второй", "третий", или "(a)", "(b)", "(c)", "(d)" и т.д., встречающиеся в данном описании и в прилагаемой формуле изобретения, используются здесь скорее для обособления сходных элементов, а не для указания их последовательности или хронологического порядка. Следует иметь в виду, что используемые таким образом термины при определенных обстоятельствах являются взаимозаменяемыми, и что в описанных здесь воплощениях данного изобретения можно оперировать другими последовательностями, нежели те, которые здесь описаны или проиллюстрированы.
В случае, когда термины "первый", "второй", "третий", или "(a)", "(b)", "(c)", "(d)" и т.д., связаны со стадиями способа или применения, если, как уже было сказано, специально не указано иное, они не образуют определенную временную последовательность или когерентность временных интервалов между стадиями, то есть стадии могут выполняться одновременно, или же такие стадии могут быть разделены интервалами в секунды, минуты, часы, дни, недели, месяцы или даже годы.
Следует иметь в виду, что настоящее изобретение не ограничено какими-либо из описанных здесь методологий, протоколов, белков, бактерий, векторов, реагентов и т.п., поскольку они могут варьировать. Следует также понимать, что используемая здесь терминология приведена только с целью описания конкретных воплощений и не предназначена для ограничения объема, охватываемого настоящим изобретением, который будет определяться только прилагаемой формулой изобретения. Если специально не указано иное, все используемые здесь технические и научные термины имеют такой же смысл, какой обычно подразумевается специалистами в данной области.
Как уже было указано выше, настоящее изобретение в одном из аспектов относится к фосфодиэстеразе-9A (PDE9A) с целью ее применения в качестве маркера рака предстательной железы. Термин "фосфодиэстераза-9A", или "PDE9A", относится ко всем вариантам сплайсинга человеческой фосфодиэстеразы PDE9A, то есть гена человеческой фосфодиэстеразы PDE9A, предпочтительно, к последовательностям, определяемым в базе данных Genbank под номером доступа No: NM_002606 (версия NM_002606.2, GI:48762716 от 9 марта 2009), представляющим собой вариант 1 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001567 (версия NM_001001567.1, GI:48762717 от 9 марта 2009), представляющим собой вариант 2 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001568 (версия NM_ 001001568.1, GI:48762719 от 9 марта 2009), представляющим собой вариант 3 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001569 (версия NM_001001569.1, GI:48762721 от 9 марта 2009), представляющим собой вариант 4 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001570 (версия NM_001001570.1, GI:48762723 от 9 марта 2009), представляющим собой вариант 5 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001571 (версия NM_001001571.1, GI:48762725 от 9 марта 2009), представляющим собой вариант 6 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001572 (версия NM_001001572.1, GI:48762727 от 9 марта 2009), представляющим собой вариант 7 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001573 (версия NM_001001573.1, GI:48762729 от 9 марта 2009), представляющим собой вариант 8 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001574 (версия NM_001001574.1, GI:48762731 от 9 марта 2009), представляющим собой вариант 9 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001575 (версия NM_001001575.1, GI:48762733 от 9 марта 2009), представляющим собой вариант 10 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001576 (версия NM_001001576.1, GI:48762735 от 9 марта 2009), представляющим собой вариант 11 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001577 (версия NM_001001577.1, GI:48762737 от 9 марта 2009), представляющим собой вариант 12 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001578 (версия NM_001001578.1, GI:48762739 от 9 марта 2009), представляющим собой вариант 13 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001579 (версия NM_001001579.1, GI:48762741 от 9 марта 2009), представляющим собой вариант 14 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001580 (версия NM_001001580.1, GI:48762743 от 9 марта 2009), представляющим собой вариант 15 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001581 (версия NM_001001581.1, GI:48762745 от 9 марта 2009), представляющим собой вариант 16 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001582 (версия NM_001001582.1, GI:48762747 от 9 марта 2009), представляющим собой вариант 17 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001583 (версия NM_001001583.1, GI:48762749 от 9 марта 2009), представляющим собой вариант 18 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001584 (версия NM_001001584.2, GI:209954812 от 26 марта 2009), представляющим собой вариант 19 транскрипта PDE9A, в базе данных Genbank под номером доступа No: NM_001001585 (версия NM_001001585.1, GI:48762753 от 9 марта 2009), представляющим собой вариант 20 транскрипта PDE9A.
Более предпочтительно, когда указанный термин связан с нуклеотидными последовательностями, приведенными в SEQ ID NO: 1-20, которые соответствуют последовательностям указанных выше номеров доступа в базе данных Genbank вариантов 1-20 транскриптов PDE9A, и соответствующими им аминокислотными последовательностями, приведенными в SEQ ID NO: 21-40, которые соответствуют последовательностям указанных выше номеров доступа в базе данных Genbank полипептидов PDE9A, кодируемых вариантами транскриптов 1-20. Указанный термин включает в себя также нуклеотидные последовательности, обладающие высокой степенью гомологии с PDE9A, например, последовательности нуклеиновых кислот, которые по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны любой из последовательностей, приведенных в SEQ ID NO: 1-20, или аминокислотные последовательности, которые по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны любой из последовательностей, приведенных в SEQ ID NO: 21-40, или последовательности нуклеиновых кислот, кодирующие аминокислотные последовательности, которые по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны любой из последовательностей, приведенных в SEQ ID NO: 21-40, или аминокислотные последовательности, кодируемые последовательностями нуклеиновых кислот, которые по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны любой из последовательностей, приведенных в SEQ ID NO: 1-20.
Используемый здесь термин "ген PDE9A фосфодиэстеразы человека", "ген PDE9A" или "маркерный ген PDE9A" относится к гену, кодирующему фосфодиэстеразу-9A. Предпочтительно, когда указанный термин относится к гену, экспрессирующему фосфодиэстеразу-9A в виде вариантов сплайсинга 1-20, например, специфической комбинации экзонов, которая обозначена в базе данных Genbank под номером доступа No: NM_002606 (версия NM_002606.2, GI:48762716 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 1, комбинации, которая обозначена в базе данных Genbank под номером доступа NM_001001567 (версия NM_001001567.1, GI:48762717 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 2, комбинации, которая обозначена в базе данных Genbank под номером доступа NM_001001568 (версия NM_001001568.1, GI:48762719 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 3, комбинации, которая обозначена в базе данных Genbank под номером доступа NM_001001569 (версия NM_001001569.1, GI:48762721 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 4, комбинации, которая обозначена в базе данных Genbank под номером доступа NM_001001570 (версия NM_001001570.1, GI:48762723 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 5, комбинации, которая обозначена в базе данных Genbank под номером доступа No: NM_001001571 (версия NM_001001571.1, GI:48762725 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 6, комбинации, которая обозначена в базе данных Genbank под номером доступа NM_001001572 (версия NM_001001572.1, GI:48762727 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 7, комбинации, которая обозначена в базе данных Genbank под номером доступа No: NM_001001573 (версия NM_001001573.1, GI:48762729 от 9 марта 2009), или которая представлена в виде SEQ ID NO: 8, комбинации, которая обозначена в базе данных Genbank под номером доступа NM_