Радиоактивно меченые пептиды, связывающиеся с her2
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к применению полипептида, меченного радиоактивной меткой 99mTс, для визуализации экспрессии рецептора человеческого эпидермального фактора роста 2 типа (HER2), и может быть использовано в диагностике опухолевых заболеваний. Изобретение позволяет получить специфически связывающийся с HER2 полипептид, конъюгированный с радионуклидом и хелатообразующим агентом, причем введение радиоактивной группировки осуществляется на конечной стадии синтеза конъюгата, что обеспечивает более высокие выходы целевого продукта. 3 н. и 2 з.п. ф-лы, 22 ил., 10 табл., 1 пр.
Реферат
Настоящая заявка на изобретение содержит перечень последовательностей, который размещен в формате ASCII при помощи EFS-Web и включен здесь посредством ссылки во всей его полноте. Указанная копия ASCII, созданная 13 декабря 2010 года, названа 2355971. txt и имеет размер 4957 байт.
Область изобретения
Изобретение в общем относится к визуализирующим агентам, которые связываются с рецептором человеческого эпидермального фактора роста 2 типа (HER2), и способам получения и применения таких агентов.
Предшествующий уровень техники
Рецептор человеческого эпидермального фактора роста 2 типа (HER2) представляет собой трансмембранный белок и члена семейства erbB белков-рецепторов тирозинкиназы. HER2 представляет собой общепризнанный опухолевый биомаркер, который сверхэкспрессируется при обширном разнообразии видов рака, включающих рак молочной железы, яичников, легкого, желудка и полости рта. Таким образом, HER2 обладает большой ценностью в качестве молекулярной мишени и в качестве диагностического или прогностического показателя выживания пациента, или в качестве прогностического показателя ответа на противоопухолевую хирургию.
В течение прошедшего десятилетия широко исследовали неинвазивную молекулярную визуализацию экспрессии HER2 с использованием различных способов визуализации. Эти способы включают радионуклидную визуализацию посредством позитронно-эмиссионной томографии (PET) и однофотонной эмиссионной компьютерной томографии (SPECT). Визуализация HER2 при помощи PET и SPECT (HER2-PET и HER2-SPECT соответственно) обеспечивают высокую чувствительность, высокое пространственное разрешение. Визуализация HER2 посредством PET также обеспечивает высокую способность к количественному определению. HER2-PET и HER2-SPECT особенно полезны в анализах общей экспрессии HER2 в опухоли у пациентов в режиме реального времени, идентификации экспрессии HER2 в опухолях с течением времени, отбора пациентов для лечения, направленного на HER (например, терапия, основанная на трастузумабе), для предсказания ответа на терапию, оценки эффективности лекарства и множества других применений. Тем не менее, не разработано никаких лигандов HER2, меченные для PET или SPECT, которые обладали бы химизмом и демонстрировали бы поведение in vivo, которое подходило бы для клинических приложений.
Встречающийся в природе стафилококковый белок А содержит домены, которые формируют трехспиральную структуру (каркас), которая связывается с фрагментом, кристаллизуемой областью (Fc) иммуноглобулина изотипа G (IgG). Некоторые полипептиды, происходящие из Z-домена белка А, содержат каркас, состоящий из трех α-спиралей, связанных петлями. Некоторые аминокислотные остатки, расположенные на двух из этих спиралей, составляют сайт связывания для области Fc в IgG. Альтернативные связывающие молекулы получают путем замены находящихся на поверхности аминокислотных остатков (13 остатков), расположенных на спиралях 1 и 2, для изменения связывающей способности этих молекул. Один из таких примеров представляет собой молекулы, связывающиеся с HER2, или связующие элементы HER2. Эти связующие элементы HER2 были помечены при помощи радионуклидов, активных для PET или SPECT. Такие связующие элементы, меченные для PET и SPECT, обеспечивают способность измерения картин экспрессии HER2 in vivo у пациентов, и, таким образом, помогают клиницистам и исследователям диагностировать, прогнозировать и лечить ассоциированные с HER2 болезненные состояния.
Связывающиеся с HER2 молекулы аффител, радиоактивно меченные радионуклидом, активным для PET, 18F, оценивали в качестве визуализирующих агентов для злокачественных опухолей, которые сверхэкспрессируют HER2. Связывающиеся с HER2 молекулы аффител, конъюгированные с 99mTc через хелатообразующие агенты, такие как maGGG (меркаптоацетилтриглицил), CGG (цистеин-диглицил), CGGG (SEQ ID No: 6) (цистеин-триглицил) или АА3, также используются для диагностической визуализации. Связывание этих молекул с опухолями-мишенями, экспрессирующими HER2, продемонстрировано у мышей.
В большинстве случаев генерирующую сигнал группу 18F связывают с аффителом посредством тиольной реакционноспособной малеимидной группы. Тиольную реакционноспособную малеимидную группу получают с использованием многостадийного синтеза после включения 18F. Однако эта химия обеспечивает лишь низкий радиохимический выход. Аналогично, конъюгация 99mTc с аффителом представляет собой многостадийный процесс с низким выходом. Кроме того, восстановление Tc и образование комплекса с хелатами требует условий с высоким рН (например, рН 11) и продолжительного времени реакций.
Хотя эффективность 18F меченных молекул аффител in vivo является умеренно хорошей, существуют значительные возможности для ее улучшения. Например, в некоторых исследованиях обнаружено, что поглощение в опухоли составляет только 6,36±1,26% ИД/г (инъецированная доза/г ткани) через 2 часа после инъекции визуализирующего агента. С другой стороны, меченные 99mTc молекулы аффител обладают преобладающим гепатобилиарным клиренсом, который приводит к обильному накоплению радиоактивности в кишечнике, что ограничивает их использование для обнаружения опухолей HER2 и метастазов в брюшной полости.
Таким образом, существует потребность в химии и способах синтеза радиоактивно меченных полипептидов, в которых радиоактивная группировка, такая как 18F, может быть введена на конечной стадии, что, в свою очередь, обеспечит высокие радиохимические выходы. Кроме того, существует потребность в новом, основанном на HER2 визуализирующем агенте для визуализации посредством PET или SPECT, обладающем улучшенными свойствами, в частности связанными с почечным клиренсом и эффектами токсичности.
Краткое описание сущности изобретения
Композиции по изобретению представляют собой новый класс визуализирующих агентов, которые способны специфически связываться с HER2 или его вариантами.
В одном или более чем одном воплощении композиция визуализирующего агента содержит выделенный полипептид, содержащий SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант, конъюгированный с 99mTc через диаминдиоксимовый хелатообразующий агент. Диаминдиоксимовый хелатообразующий агент может содержать Pn216, cPn216, Pn44 или их производные. Выделенный полипептид специфически связывается с HER2 или его вариантами.
В одном или более чем одном воплощении композиция визуализирующего агента содержит выделенный полипептид, содержащий SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант, конъюгированный c 67Ga или 68Ga через хелатообразующий агент NOTA (1,4,7-триазациклононан-N,N'N''-триуксусная кислота). Выделенный полипептид специфически связывается с HER2 или его вариантами.
В одном или более чем одном воплощении композиция визуализирующего агента содержит выделенный полипептид, содержащий SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант, конъюгированный с 18F через линкер. Линкер содержит группу, происходящую из аминокси-группы, азидо-группы или алкиновой группы. Выделенный полипептид специфически связывается с HER2 или его вариантами.
Пример способов по изобретению для приготовления композиции визуализирующего агента включает (1) получение выделенного полипептида, содержащего SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант; и (2) взаимодействие диаминдиоксимового хелатообразующего агента с полипептидом с образованием полипептида, конъюгированного с хелатообразующим агентом. В другом примере способ включает (1) получение выделенного полипептида, содержащего SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант; (2) взаимодействие полипептида с линкером; и (3) взаимодействие линкера с группировкой 18F с образованием конъюгированного с 18F полипептида. Линкер может содержать аминокси-группу, азидо-группу или алкиновую группу.
Графические материалы
Эти и другие особенности, аспекты и преимущества настоящего изобретения станут более понятны при прочтении следующего подробного описания со ссылкой на графические материалы, где:
Фиг.1А и 1Б представляют собой графики поверхностного плазменного резонанса (SPR) связывающей аффинности к человеческому HER2 для двух полипептидов против HER2, Z477 (SEQ ID No: 3) и (Z477)2 (SEQ ID No: 5) соответственно в восьми различных концентрациях.
Фиг.2А и Фиг.2Б представляют собой графики качественной проточной цитометрии С6 (крысиная глиома, контроль) и человеческого антитела против HER2 к SKOV3 (рак яичника человека) соответственно. Фиг.2В демонстрирует столбчатую диаграмму для рецепторов Her2 на клетку для клеточных линий SKOV3 и С6.
Фиг.3 представляет собой столбчатую диаграмму анализов ELISA (твердофазный иммуноферментный анализ) для Her2 в отношении списка опухолей типов SKOV3 2-1, SKOV3 3-1, SKOV3 3-4, в отношении клеток SKOV3, и контроля («холостой» пробы, blank).
Фиг.4 представляет собой гамма-хроматограмму обращенно-фазовой ВЭЖХ (высокоэффективной жидкостной хроматографии) Z00477, меченного 99mTc (SEQ ID No: 3).
Фиг.5А представляет собой гамма-хроматограмму эксклюзионной ВЭЖХ агрегированного 99mTc(CO)3(His6)Z00477 (SEQ ID No: 4) («His6» раскрыт как SEQ ID No: 7) при рН 9. Фиг.5Б представляет собой гамма-хроматограмму эксклюзионной ВЭЖХ не агрегированного меченного 99mTc(CO)3(His6)Z00477 («His6» раскрыт как SEQ ID NO:7) стандарта аффитела.
Фиг.6 представляет собой график профиля биораспределения Z00477 (SEQ ID No: 3) в образцах крови, опухоли, печени, почки и селезенки мышей, несущих опухоль SKOV3, включающий отношение опухоль:кровь, с течением времени.
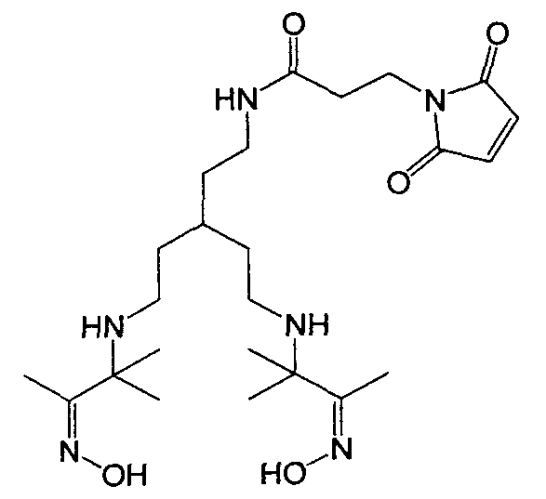
Фиг.7 представляет собой схему химической структуры линкера Mal-cPN216.
Фиг.8А представляет собой график масс-спектра, полученного посредством времяпролетной масс-спектрометрии с электрораспылительной ионизацией (ESI-TOF-MS) и Фиг.8Б представляет собой график результата деконволюции массы для очищенного Z00477 (SEQ ID No: 3)-cPN216.
Фиг.9 представляет собой хроматограмму гамма-следа для обращенно-фазовой ВЭЖХ для Z02891-cPN216 (SEQ ID No: 2), меченного 99mTc.
Фиг.10 представляет собой график профиля биораспределения Z02891 (SEQ ID No: 2) меченного 99mTc через cPN216 (% ИД, % инъецированной дозы) в образцах крови, печени, почек, селезенки и хвоста мышей, несущих опухоль SKOV3.
Фиг.11 представляет собой график профиля биораспределения Z02891 (SEQ ID No: 2), меченного 99mTc через cPN216 (% ИД, % инъецированной дозы) в образцах опухоли, крови, печени, почек, мочевого пузыря/мочи, хвоста, кишечника и селезенки мышей, несущих опухоль SKOV3.
Фиг.12 представляет собой график профиля биораспределения Z02891 (SEQ ID No: 2) у мышей, несущих опухоль SKOV3, демонстрирующий отношение опухоль:кровь (отношение О:К).
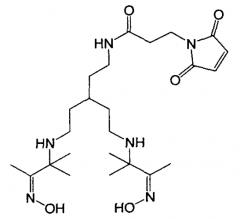
Фиг.13А и 13Б представляют собой схемы химической структуры малеимид-аминокси Вос-защищенных линкеров (Mal-AO-Boc) и малеимид-аминокси (Mal-AO) линкеров. 13А представляет собой химическую структуру трет-бутил 2-(2-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)этиламино)-2-оксоэтоксикарбамата (Mal-AO-Boc) и 13Б представляет собой химическую структуру 2-(аминоокси)-N-(2-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)этил)ацетамида гидрохлорида (Mal-AO.HCl).
Фиг.14А представляет собой хроматограмму обращенно-фазовой ВЭЖХ исходного материала Z00342 (SEQ ID No: 1) и 14Б представляет собой хроматограмму обращенно-фазовой ВЭЖХ очищенной композиции Z00342 (SEQ ID No: 1)-AO визуализирующего агента, оба проанализированы при 280 нм.
Фиг.15 представляет собой гамма-хроматограмму обращенно-фазовой ВЭЖХ неочищенных реакционных смесей и очищенных конечных продуктов 18F-фторбензил-Z00342 (SEQ ID No: 1) и 18F-фторбензил-Z02891' (SEQ ID No: 2).
Фиг.16 представляет собой график профиля биораспределения (% ИД, % инъецированной дозы) полипептида Z02891 (SEQ ID No: 2), меченного 18F, у животных, несущих опухоль SKOV3.
Фиг.17 представляет собой график профиля биораспределения полипептида Z02891 (SEQ ID No: 2), меченного 18F (% ИД, % инъецированной дозы), и отношения опухоль:кровь у животных, несущих опухоль SKOV3.
Фиг.18 представляет собой столбчатую диаграмму профиля биораспределения (% ИД, % инъецированной дозы) Z00342 (SEQ ID No: 1), меченного 18F, и Z02891 (SEQ ID No: 2), меченного 18F, в образцах крови, опухоли, печени, почек, селезенки и кости.
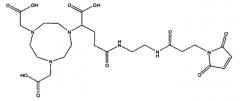
Фиг.19 представляет собой схему химической структуры линкера Mal-NOTA.
Фиг.20А представляет собой график масс-спектра, полученного посредством времяпролетной масс-спектрометрии с электрораспылительной ионизацией (ESI-TOF-MS), и 20Б представляет собой график результата деконволюции массы ESI-TOF-MS для Z00477 (SEQ ID No: 3)-NOTA.
Фиг.21 представляет собой график гамма-следа обращенно-фазовой ВЭЖХ для неочищенной реакционной смеси Z00477, меченного 67Ga (SEQ ID No: 3)-NOTA после 1 часа реакции.
Фиг.22 представляет собой график гамма-следа обращенно-фазовой ВЭЖХ очищенного NOTA Z00477, меченного 67Ga (SEQ ID No: 3)-NOTA полипептида.
Подробное описание изобретения
Визуализирующие агенты по изобретению, как правило, содержат выделенный полипептид в соответствии SEQ ID No: 1, SEQ ID No: 2 или их консервативным вариантом, конъюгированный с 18F, 99mTc, 67Ga или 68Ga; и способы приготовления и применения композиций. Выделенный полипептид специфически связывается с HER2 или его вариантом. В одном или более чем одном воплощении последовательность выделенного полипептида имеет по меньшей мере 90% сходства последовательности с любой из SEQ ID No: 1, SEQ ID No: 2 или их консервативным вариантом.
Выделенный полипептид может содержать природные аминокислоты, синтетические аминокислоты или аминокислотные миметики, которые действуют по аналогии со встречающимися в природе аминокислотами. Встречающиеся в природе аминокислоты представляют собой аминокислоты, кодируемые генетическим кодом, а также аминокислоты, которые позже были модифицированы, например, гидроксипролин, γ-карбоксиглутамат, О-фосфосерин, фосфотреонин и фосфотирозин.
Выделенные полипептиды могут быть получены стандартными методами твердофазного синтеза. Альтернативно, полипептиды могут быть получены рекомбинантными методами. Если полипептиды получают рекомбинантными методами, то ДНК, кодирующая полипептиды или их консервативные варианты может быть выделена. ДНК, кодирующая полипептиды или их консервативные варианты, может быть встроена в клонирующий вектор, введена в клетку-хозяина (например, эукариотическую клетку, клетку растения или прокариотическую клетку), и экспрессирована посредством любой системы экспрессии, известной в области техники.
Полипептид может по существу состоять из единичной хиральной формы аминокислотных остатков. Таким образом, полипептиды по изобретению могут по существу состоять из L-аминокислот или D-аминокислот; хотя также можно использовать комбинацию L-аминокислот и D-аминокислот.
Поскольку предложенные здесь полипептиды происходят из Z-домена белка А, остатки на связывающей поверхности могут быть не консервативно замещены или консервативно замещены с сохранением связывающей активности. В некоторых воплощениях замещаемые остатки могут происходить из любой из 20 встречающихся в природе аминокислот или любого их аналога.
Полипептиды могут иметь длину от приблизительно 49 остатков до приблизительно 130 остатков. Специфические полипептидные последовательности перечислены в таблице 1.
| Таблица 1 | ||
| Название | Последовательность | Длина |
| Z00342 (SEQ ID No: 1) | VENKFNKEMRNAYWEIALLPNLNNQQKRAFIRSLYDDPSQSANLLAEAKKLNDAQAPK | 58 |
| Z02891 (SEQ ID No: 2) | AEAKYAKEMRNAYWEIALLPNLTNQQKRAFIRKLYDDPSQSSELLSEAKKLNDSQAPKVDC | 61 |
| Z00477 (SEQ ID No: 3) | VDNKFNKEMRNAYWEIALLPNLNVAQKRAFIRSLYDDPSQSANLLAEAKKLNDAQAPKVDC | 61 |
| Z00477-His6 (SEQ ID No: 4) («His6» раскрыт как SEQ ID NO: 7) | GSSHHHHHHLQVDNKFNKEMRNAYWEIALLPNLNVAQKRAFIRSLYDDPSQSANLLAEAKKLNDAQAPKVDC | 72 |
| (Z00477)2 (SEQ ID No: 5) | GSSHHHHHHLQVDNKFNKEMRNAYWEIALLPNLNVAQKRAFIRSLYDDPSQSANLLAEAKKLNDAQAPKVDNKFNKEMRNAYWEIALLPNLNVAQK | 130 |
| RAFIRSLYDDPSQSANLLAEAKKLNDAQAPKVDC |
Дополнительные последовательности могут быть добавлены к концам для того чтобы придать выбранную функциональность. Таким образом, дополнительные последовательности могут быть присоединены к одному или обоим концам для облегчения очистки или выделения полипептида, самого по себе или сопряженного с мишенью для связывания (например, посредством добавления His-метки к полипептиду).
Полипептиды, перечисленные в таблице 1, могут быть конъюгированы с 18F через линкер; с 99mTc через диаминдиоксимовый хелатообразующий агент, или с 67Ga или 68Ga через NOTA хелатообразующий агент. В таблице 2 приведена изоэлектрическая точка (pI) этих полипептидов.
| Таблица 2 | ||
| pI | MM (молекулярная масса) (кДа) | |
| His6-Z00477 (SEQ ID No: 4) («His6» раскрыт как SEQ ID No: 7) | 8,31 | 8143,11 |
| Z02891(SEQ ID No: 2) | 8,10 | 7029,96 |
| His6-Z00342 («His6» раскрыт как SEQ ID No: 7) | 8,14 | 8318,27 |
В одном или более чем одном воплощении выделенный полипептид, содержащий SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант, может быть конъюгирован с 18F. 18F может быть соединен с С-концом, с N-концом или с внутренней частью выделенного полипептида.
В одном или более чем одном воплощении 18F может быть конъюгирован с выделенным полипептидом через линкер. Линкер может содержать аминокси-группу, азидо-группу или алкиновую группу. Аминокси-группа линкера может быть присоединена к альдегиду, такому как фторзамещенный альдегид. Азидная группа линкера может быть присоединена к фторзамещенному алкину. Аналогично, алкиновая группа линкера может быть присоединена к фторзамещенному азиду. Линкер может также содержать тиольную реакционноспособную группу. Линкер может содержать группу малеимидо-аминокси, малеимидо-алкин или малеимидо-азид. 18F конъюгированный полипептид может быть получен путем: (1) получения выделенного полипептида, содержащего SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант; (2) взаимодействия полипептида с линкером, который содержит аминокси-группу, азидо-группу или алкиновую группу с образованием полипептида, конъюгированного с линкером; и взаимодействие линкера с группировкой 18F.
В другом воплощении способ может включать: (1) получение выделенного полипептида, содержащего SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант; (2) получение линкера; (3) взаимодействие линкера с группировкой 18F с образованием 18F меченного линкера; и (4) взаимодействие 18F меченного линкера с выделенным полипептидом в соответствии с SEQ ID No: 1, SEQ ID No: 2 или их консервативным вариантом с образованием полипептида, конъюгированного с линкером.
Используя вышеописанные примеры, атом(ы) фтора или радиоактивного фтора, такие как 18F, могут быть введены в полипептиды. Фторзамещенный полипептид образуется, когда фтор-замещенный альдегид взаимодействует с группой аминокси полипептида, конъюгированного с линкером. Аналогично, фторзамещенный полипептид образуется, когда фторзамещенная азидная или алкиновая группа взаимодействует с соответствующий алкиновой или азидной группой полипептида, конъюгированного с линкером. Композиция меченного радиоактивным фтором полипептида или визуализирующего агента образуется, когда замещенный радиоактивным фтором альдегид, азид или алкин взаимодействует с соответствующей аминокси, алкиновой или азидной группой полипептида, конъюгированного с линкером. Дополнительно, каждый из альдегидов, азидов или алкинов может иметь в качестве заместителя радиоактивный фтор (18F) для получения композиций визуализирующего агента, меченного радиоактивным фтором. Способы введения фтора в полипептид также могут быть использованы для приготовления композиции фторированного визуализирующего агента любой длины. Таким образом, в некоторых воплощениях полипептид из композиции визуализирующего агента может содержать, например, от 40 до 130 аминокислотных остатков.
Химия для синтеза полипептида, конъюгированного с линкером, в качестве визуализирующего агента является простой, и одностадийная реакция способов более эффективна по сравнению с ранее известными способами и приводит в результате к более высоким выходам. Эти способы легче осуществить, они являются более быстрыми и реализуются в более мягких, более благоприятных для пользователя условиях. Например, способ мечения полипептида 18F, конъюгированного с линкером (например, 18F-фторбензальдегид) проще, чем способы, известные в области техники. 18F конъюгированный-линкер получают в одну стадию путем прямого нуклеофильного включения 18F в триметиланилиниевый предшественник. 18F-линкер (т.е. 18F-FBA) затем конъюгируют с полипептидом, таким как аффитело. Получение линкера также легче по сравнению с ранее известными в области техники способами. Кроме того, радиоактивно меченные основанные на аминокси полипептиды, конъюгированные с линкером, и семейство полипептидов cPn, конъюгированных с хелатообразующим агентом (например, аффителом), демонстрируют значительно лучшее биораспределение и лучшее поглощение опухолью, а также улучшенный клиренс с меньшим поглощением печенью.
Меченные фтором композиции представляют собой весьма желаемые в диагностических приложениях материалы. Композиции визуализирующего агента, меченного 18F, могут быть визуализированы с использованием признанных методов визуализации, таких как PET.
В еще одном воплощении полипептид может быть конъюгирован с 99mTc через диаминдиоксимовый хелатообразующий агент формулы (1).
где R/, R//, R///, R//// независимо представляют собой Н или С1-10 алкил, С3-10 алкиларил, С2-10 алкоксиалкил, C1-10 гидроксиалкил, С1-10 алкиламин, С1-10 фторалкил, или 2 или более чем 2 группы R вместе с атомами, к которым они присоединены образуют карбоциклическое, гетероциклическое, насыщенное или ненасыщенное кольцо, где R может представлять собой Н, С1-10 алкил, С3-10 алкиларил, С2-10 алкоксиалкил, C1-10 гидроксиалкил, C1-10 алкиламин или С1-10 фторалкил. В одном из воплощений n может варьировать от 0 до 5. Примеры способов получения диаминдиоксимовых хелатообразующих агентов описаны в заявке РСТ, Международной публикации № WO 2004080492 (A1), озаглавленной «Methods of radio fluorination of biologically active vector», и заявке РСТ, Международной публикации № WO 2006067376 (A2), озаглавленной «Radio labelled conjugates of RGD-containing peptides and methods for their preparation via click-chemistry», которые включены здесь посредством ссылки.
99mTc может быть конъюгирован с выделенным полипептидом через диаминдиоксим на N-конце выделенного полипептида. Хелатообразующий агент может представлять собой бифункциональное соединение. В одном воплощении бифункциональное соединение может представлять собой Mal-cPN216. Mal-cPN216 содержит тиол-реакционноспособную малеимидную группу для конъюгации с концевым цистеином полипептида в соответствии с SEQ ID No: 1 или SEQ ID No: 2, и бис-аминоксимовую группу (диаминдиоксимовый хелатообразующий агент) для хелатирования с 99mTc. Mal-cPN216 может иметь формулу (2).
Пептид, конъюгированный с диаминдиоксимовым хелатообразующим агентом, может быть приготовлен путем (1) получения выделенного полипептида, содержащего SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант, (2) взаимодействия диаминдиоксимового хелатообразующего агента с полипептидом с образованием диаминдиоксимового конъюгированного полипептида. Диаминдиоксимовый хелатообразующий агент может быть дополнительно конъюгирован с 99mTc.
В одном или более чем одном воплощении полипептид может быть конъюгирован с 67Ga, или 68Ga через хелатообразующий агент NOTA (1,4,7-триазациклононан-N,N',N''-триуксусную кислоту). Полипептид, конъюгированный с NOTA, может быть приготовлен посредством (1) получения выделенного полипептида, содержащего SEQ ID No: 1, SEQ ID No: 2 или их консервативный вариант, (2) взаимодействия хелатообразующего агента NOTA с полипептидом с образованием конъюгированного с NOTA полипептида. Хелатообразующий агент NOTA может быть дополнительно конъюгирован с 67Ga или 68Ga.
В одном из воплощений, Ga, в частности 67Ga, может быть конъюгирован с выделенным полипептидом через хелатообразующий агент NOTA. Хелатообразующий агент NOTA может быть замещен малеимидной группой, как описано в формуле (3).
Изобретение также включает способы визуализации по меньшей мере части субъекта. В одном воплощении способ включает введение композиции визуализирующего агента субъекту и визуализации субъекта. Субъект может быть визуализирован, например, при помощи диагностического устройства.
Способ дополнительно может включать стадии мониторинга доставки композиции субъекту и постановки диагноза у субъекта, страдающего HER2-ассоциированным болезненным состоянием (например, рака молочной железы). В одном воплощении субъект может представлять собой млекопитающее, например, человека. В другом воплощении субъект может включать клетки или ткани. Ткани могут быть использованы в биопсии. В диагностическом устройстве может использоваться способ визуализации, выбранный из магниторезонансной визуализации, оптической визуализации, оптической когерентной томографии, рентгена, компьютерной томографии, позитронно-эмиссионной томографии или их комбинаций.
Композиции визуализирующего агента могут быть введены людям и другим животным парентерально. Фармацевтические композиции по изобретению для парентеральной инъекции содержат фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные инъецируемые растворы или дисперсии непосредственно перед применением. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла (такие как оливковое масло) и инъецируемые органические сложные эфиры, такие как этилолеат. Надлежащая текучесть может поддерживаться, например, использованием покрывающих материалов, таких как лецитин, корректированием размера частиц в дисперсии и использованием поверхностно-активных веществ.
Эти композиции визуализирующего агента также могут содержать адъюванты, такие как консерванты, увлажнители, эмульгаторы и диспергирующие агенты. Предупреждение действия микроорганизмов может обеспечиваться включением различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т.п. Также может быть желательно включение изотонических агентов, таких как сахара, хлорид натрия и т.п. Продолжительная абсорбция инъецируемой фармацевтической формы может быть осуществлена включением агентов, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
Композиции визуализирующего агента могут быть диспергированы в физиологически приемлемом носителе для минимизации потенциальной токсичности. Таким образом, визуализирующие агенты могут быть диспергированы в биосовместимом растворе с рН от приблизительно 6 до приблизительно 8. В некоторых воплощениях агент диспергирован в биосовместимом растворе с рН от приблизительно 7 до приблизительно 7,4. В других воплощениях агент диспергирован в биосовместимом растворе с рН приблизительно 7,4.
Композиции визуализирующего агента могут быть комбинированы с другими добавками, которые используют в фармацевтической промышленности для суспендирования или растворения соединений в водной среде, и затем суспензия или раствор могут быть стерилизованы методами, известными в области техники. Композиция визуализирующего агента может быть введена в различных формах и адаптирована для выбранного пути введения. Например, агенты могут быть введены местно (т.е. через ткань или слизистые оболочки), внутривенно, внутримышечно, внутрикожно или подкожно. Формы, подходящие для инъекции, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов, дисперсий, липосомальных или эмульсионных композиций. Формы, подходящие для ингаляции, включают агенты, такие как агенты, диспергированные в аэрозоле. Формы, подходящие для местного введения, включают кремы, лосьоны, мази и т.п.
Композиции визуализирующего агента могут быть концентрированы для удобства доставки предпочтительного количества агентов субъекту и упакованы в контейнер в желаемой форме. Агент может быть дозирован в контейнер, в котором он диспергирован в физиологически приемлемом растворе, который для удобства облегчает введение агента в концентрации от 0,1 мг до 50 мг агента на кг массы тела субъекта.
В одном или более чем одном воплощении ткань-мишень может быть визуализирована приблизительно через четыре часа после введения агентов. В альтернативных воплощениях ткань-мишень может быть визуализирована приблизительно через 24 часа после введения агентов субъекту.
Примеры
Следующие примеры приведены только для иллюстрации и их не следует истолковывать как ограничивающие изобретение.
Список онкогенных клеточных линий с приемлемой вероятностью экспрессии HER2 выбирали на основе имеющейся литературы (Bruskin, et. al. Nucl. Med. Biol. 2004: 31: 205; Tran, et. al. Imaging agent composition Chem. 2007: 18: 1956), как описано в таблице 3.
| Таблица 3 | |||
| Клеточная линия | Виды | Тип | Назначение |
| SKOV3 | Человек | Рак яичников | Кандидат |
| SKBR3 | Человек | Рак молочной железы | Кандидат |
| С6 | Крыса | Глиома | Контроль |
Все клеточные линии получены из Американской коллекции типовых культур (АТСС) и выращивались в соответствии с рекомендациями. Клетки выращивали до >90% конфлюэнтности перед использованием. Проточную цитометрию (Beckman Coulter Cytomics FC500 MPL) осуществляли на клеточных линиях, перечисленных в таблице 3, с использованием первичных антител против Her2 (R&D Systems, PN MAB1129), и Dako QIFIKIT (PN K0078) для количественного анализа непрямого иммунофлуоресцентного окрашивания. Калибровочные гранулы с 5 различными группами, несущими различные количества молекул Mab, использовали в сочетании с клеточными линиями для определения количества поверхностных рецепторов на клетку. Во всех случаях подходящие по изотипу контроли получали у соответствующих поставщиков.
Прикрепившиеся клетки высвобождали из колб, применяя буфер для клеточной диссоциации (PBS (фосфатно-солевой буферный раствор) + 10 мМ EDTA (этилендиаминтетрауксусная кислота)), вместо трипсина, для того чтобы избежать протеолиза рецепторов клеточной поверхности. Клетки дважды промывали в PBS и ресуспендировали в охлажденном на льду буфере FC (PBS+0,5% BSA (бычий сывороточный альбумин) масс./об.) до концентрации 5-10×106 клеток/мл. 100 мкл аликвоты клеток смешивали с 5 мкг первичного антитела и инкубировали на льду в течение 45 минут. Затем клетки промывали 1 мл охлажденного на льду буфера для проточной цитометрии (FC) (PBS с 2% бычьим сывороточным альбумином), центрифугировали при 300 g в течение 5 мин и ресуспендировали в 0,5 мкл буфера FC. Добавляли 100 мкл фрагмента вторичного антитела (F(ab)2 козьего иммуноглобулина против антител мыши, конъюгированного с FITC (фенилизотиоцианат)) в разведении 1:50 в PBS, и инкубировали на льду и в темноте в течение 45 минут. Затем клетки дважды промывали 1 мл охлажденного на льду буфера FC, центрифугировали при 300 g в течение 5 мин и ресуспендировали в 500 мкл буфера FC. Все окрашенные клетки пропускали через 100-микронный фильтр перед проточной цитометрией для предупреждения засорения проточной кюветы.
Проточную цитометрию осуществляли на Beckman Coulter Cytomics FC500 MPL. Минимум 5×104 событий регистрировали в каждой пробирке. Все анализы были одного цвета с обнаружением FITC в FL1. Данные малоуглового рассеяния (FS) и бокового рассеяния (SS) демонстрировали, что все клеточные популяции были плотно сгруппированы.
Проточную цитометрию использовали для оценки клеток в отношении экспрессии HER2 in vitro (Фиг.2А, 2Б и 2В), причем клетки SKOV3 демонстрировали самый высокий уровень экспрессии HER2 (Фиг.3). Результаты на Фиг.3 были воспроизводимы (n=3).
Линия клеток с самой высокой экспрессией представляла собой SKOV3. Эти клетки инъецировали мышам с нарушением иммунитета в возрасте 6-12 недель и оставляли для роста опухоли. Кривые роста опухоли и доля успешных результатов зависели от количества инокулированных клеток. Оптимальный рост опухоли достигали при инокуляции от трех до четырех миллионов клеток/мышь.
Исследования in vivo осуществляли с самками голых мышей CD-1 (Charles River Labs, Hopkinton, MA) в возрасте от 6 до 15 недель. Мышей содержали в вентилируемой клетке с достаточным количеством корма и воды и стандартным 12-часовым циклом день-ночь. Для получения ксенотрансплантатов животным инъецировали 100 мкл клеток в PBS. Клетки имплантировали подкожно в правую заднюю конечность. Имплантацию осуществляли под изофлурановой анестезией. Для SKOV3 от 3×106 до 4×106 клеток имплантировали каждой мыши. В этих условиях пригодные для использования опухоли (от 100 до 300 мкг) получали в течение от 3 до 4 недель у более чем 80% инъецированных животных.
Опухоли собирали у мышей путем иссечения, и целые опухоли хранили при -20°С до обработки. Опухоли измельчали на льду в 1 мл буфера RIPA (буфер для радиоиммунопреципитационного анализа), дополненного смесью протеазного ингибитора (Santa Cruz Biotech, Santa Cruz, CA #24948) в гомогенизаторе Dounce. Затем гомогенаты инкубировали на льду в течение 30 минут, затем центрифугировали при 10000 g в течение 10 минут в охлажденной центрифуге. Супернатанты собирали и хранили на льду или при 4°С до дальнейшей обработки. Концентрации белка в лизатах определяли с использованием набора для анализа белка ВСА (бицинхониновая кислота) (Pierce Biotechnology 23225). Лизаты разбавляли до стандартной концентрации с получением 20 мкг белка/лунку в микротитрационном планшете. ELISA осуществляли с использованием имеющихся в продаже наборов для анализа человеческого HER2 (R&D Systems, DYC1129) в соответствии с указаниями производителя. Каждый образец анализировали в трех повторностях, и данные представлены в пг HER2/мкг общего белка, ошибки приведены в виде стандартных отклонений.
Целевую экспрессию in vivo измеряли посредством ELISA. Вырезанные опухоли гомогенизировали и анализировали в отношении HER2 с использованием имеющегося в продаже набора для анализа комплементарных пар (R&D systems, DYC1129, Minneapolis, MN). Результаты на Фиг.3 демонстрируют, что клеточная линия SKOV3 позволяет выращивать высокоэкспрессирующуюся опухоль. Контролями для ELISA выступали лизаты клеточных культур отрицательных контрольных линий, используемых для проточной цитометрии. Эти результаты указывают на то, что опухолевые ксенотрансплантаты SKOV3 подходят для in vivo исследования молекул, нацеленных на человеческий HER2.
Все полипептиды получены от Affibody АВ в Швеции. Полипептиды названы в соответствии с их числовыми внутренними кодами, присваиваемыми при разработке, которые начинаются с «Z». В таблице 1 приведена подробная информация об описанных здесь полипептидах. Полипептиды включают полипептид Z00342 (SEQ ID No: 1); полипептид Z02891 (SEQ ID No: 2); полипептид Z00477 (SEQ ID No: 3 и 4) и димер Z00477, т.е. (Z00477)2 (SEQ ID No: 5).
Связывающие взаимодействия между полипептидами и антигеном HER2/neu измеряли in vitro методом поверхностного плазменного резонанса (SPR) на приборе Biacore™ 3000 (GE Healthcare, Piscataway, NJ). Внеклеточный домен антигена Her2/neu получали в виде конъюгата с областью Fc человеческого IgG (Fc-Her2) от R&D Systems (Minneapolis, MN) и ковалентно присоединяли к СМ-5 декстран-замещенному сенсорному чипу (GE Healthcare, Piscataway, NJ), предварительно уравновешенному буфером HBS-EP (0,01М HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) рН 7,4, 0,15 М NaCl, 3 мМ EDTA, 0,005% об./об. поверхностно-активного вещества Р20) при скорости потока 10 мкл/мин и затем активировали с использованием EDC (1,2-дихлорэтана) и NHS. Fc-HER2 (5 мкг/мл) в 10 мМ ацетате натрия (рН 5,5) вводили на активированный сенсорный чип до достижения желаемого уровня иммобилизации (прибл. 3000 резонансных единиц) (2 мин). Остаточные активированные группы на сенсорном чипе блокировали путем введения этаноламина (1М, рН 8,5). Любой нековалентно связанный конъюгат удаляли при помощи повторяющихся (5×) промываний 2,5 М NaCl, 50 мМ NaOH. Второй поток клеток на том же самом сенсорном чипе обрабатывали аналогично за исключением того, что отсутствовала иммобилизация Fc-HER2, для того чтобы выступать в качестве контрольной поверхности