Способ получения полимеров с различной структурой путем инициации аминами
Иллюстрации
Показать всеИзобретение относится к способу получения линейных полимеров с амидной концевой группой или звездообразной структуры с амидным ядром формулы (I) путем раскрытия цикла. Способ заключается в том, что подвергают взаимодействию избыток лактидного мономера или лактидного и гликолидного мономеров с инициатором в растворителе. Затем добавляют катализатор и проводят нейтрализацию реакционной смеси. В качестве инициатора используют амин или аминоспирт, который содержит по меньшей мере одну функциональную группу первичного или вторичного амина. В качестве катализатора используют ненуклеофильное основание, содержащее по меньшей мере один нейтральный атом азота с sp2-гибридизацией. Изобретение позволяет контролировать процесс получения полимеров, а также регулировать текучесть и кристалличность полимеров. 2 н. и 13 з.п. ф-лы, 2 ил., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Объектом настоящей заявки является способ получения полимеров с различной структурой (линейной и звездообразной), на основе лактида и/или гликолида, а также новых полимеров, которые необязательно могут быть получены данным способом. Такие полимеры обладают полезными физико-химическими свойствами. Данный способ является легко контролируемым и обеспечивает лучшее регулирование полимеров и, следовательно, свойств, чем способы по предшествующему уровню техники.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
В настоящее время внимание все больше обращается на синтетические полимеры для изготовления искусственных органов и формулирования лекарственных средств [Chem. Eng. News 2001, 79 (6), 30]. Рассматриваемые полимеры должны удовлетворять определенному ряду условий и, в частности, должны быть биологически совместимыми. Биоразлагаемость составляет дополнительное преимущество, если полимер должен быть удален после соответствующего периода вживления в организм. В этом отношении, сополимеры на основе молочной и гликолевой кислоты (PLGA) имеют значительное преимущество, поскольку являются чувствительными к гидролизу и разлагаются in vivo с высвобождением нетоксичных побочных продуктов. Сфера применения PLGAов очень широка (Adv. Mater. 1996, 8, 305 и Chemosphere 2001, 43, 49). В области хирургии, указанные сополимеры используют для синтеза многожильных проволок, лигатуры, имплантов, протезов и прочее. В фармакологии, такие сополимеры делают возможным инкапсулирование, перенос и контролируемое высвобождение активных ингредиентов. Для всех указанных применений, одним из ключевых факторов является скорость разложения PLGAов, которая, несомненно, зависит от структуры таких сополимеров (длины цепи, дисперсности, соотношения, стереохимии и строения цепи мономеров и т.д.).
Для получения новых свойств может оказаться полезной модификация структуры PLGA. Однако, возможные модификации весьма ограничены и некоторые уже были описаны: молекулярная масса, тактичность и прочее. Одним из параметров, который не очень изучен, является модификация концов цепи. Однако, описано, что физические свойства и скорости разложения PLGA со сложноэфирной концевой группой отличаются от соответствующих параметров для PLGA с кислотной концевой группой (WO200804963). Получается, что новая функциональность может обеспечить полезные свойства.
В заявке указано, что PLGAи с амидной концевой группой могут быть особенно полезны. В настоящее время большинство современных методов не учитывает, что инициаторы гидрокси-функциональности (спирт/вода) дают возможность получать PLGAи со сложноэфирной/кислотной концевой группой. Пример получения полилактидной структуры (PLA) нуклеофильным катализом полимеризации лактида, исходя из инициатора типа первичного амина (RNH2), описан в O. Coulembier, М. K. Kiesewetter, A. Mason, P. Dubois, J. L. Hedrick, R. M. Waymouth, Angew. Chem. Int. Ed. 2007, 46, 4719. Исходя из поли(этиленгликол)я, функционализированного первичными аминами, полимеризация с раскрытием цикла (ROP) лактида, катализируемая карбенами, обеспечивает доступ к PLAaм со сложными структурами. На каждый первичный амин вырастают две ветви PLA. Поэтому невозможно таким способом привить одну боковую ветвь на первичный амин. J. Liu, L. Liu, Macromolecules 2004, 37, 2674 описывает получение отдельного линейного сложного полиэфира с амидной концевой группой. Такое получение описано только для поликапролактонов (PCL) (полимеризации в массе в течение 24-48 часов при 160°C).
Разветвленные полимеры, которые включают звездообразные полимеры, дендримеры и гиперразветвленные полимеры, являются предметом многочисленных исследований вследствие полезных реологических и механических свойств.
В частности, звездообразные полимеры, или полимеры со звездообразной структурой могут применяться для введения активных ингредиентов и обладают пригодными профилями высвобождения. Такой тип полимера обычно получают из полиоловых инициаторов, включающих n спиртовых функциональностей, для получения звезд с n лучами.
Кроме того, для звездообразных полимеров температуры стеклования, а также вязкость в стеклообразном состоянии чуть ниже, чем для линейных эквивалентов. То же самое применимо в отношении кристалличности и, следовательно, температуры плавления, которые также ниже, чем для линейных эквивалентов. Однако кристаллическая фаза сохраняет аналогичный характер в обеих структурах.
Биоразлагаемый звездообразный полимер (например, PLGA) будет иметь значительно большую начальную скорость разложения, чем соответствующий линейный эквивалент с той же массой. Действительно, скорость высвобождения и разложения коррелируются со структурой полимерной матрицы. Показано, что при химическом или ферментативном гидролизе первичные расщепления сложноэфирных связей происходят в ядре звезды, близко к инициатору, тем самым приводя к образованию линейных полимеров с более низкими молекулярными массами. С другой стороны, примером служит звездообразный полимер с ядром из PEG и связью амид-PLA, где первичные расщепления осуществляются по сложноэфирным связям и амидные связи гидролизуются позднее (Biomacromolecules 2010, 11, 224).
Такие различия в свойствах таким образом открывают доступ к полезным инновационным матрицам. Например, инкапсулирование активных ингредиентов в звездообразные полимеры, в случае PLGAов, описано в A. Breitenbach, Y. X. Li, T. Kissel, Journal of Controlled Release 2000, 64, 167.
Полимеризация с раскрытием цикла, инициируемая комплексами металлов, для синтеза полимеров со звездообразной структурой описана с 1990-х. Звездообразные полимеры в основном получают полимеризацией в растворе или в массе с металлическими катализаторами, такими как октаноат олова, хотя и сообщается о других системах на основе Fe, Zn, Al и прочих. (H.R. Kricheldorf, Polymer for Advanced Technologies 2002, 13, 969; A. Finne, A.-C. Albertsson, Biomacromolecules 2002, 3, 684; H. R. Kricheldorf, H. Hachmann-Thiessen, G. Schwarz, Biomacromolecules 2004, 5, 492; I. Arvanitoyannis, A. Nakayama, E. Psomiadou, N. Kawasaki, N. Yamamoto, Polymer 1996, 37, 651).
Заявителем предложен новый способ на основе неметаллов, который легко контролируем и обладает большей гибкостью, чем известные из уровня техники способы.
Заявителем также разработаны новые линейные полимеры с амидной концевой группой или звездообразной структуры с амидным ядром.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, предметом изобретения является способ получения линейных полимеров с амидной концевой группой или звездообразной структуры с амидным ядром путем раскрытия цикла исходя из лактидного и гликолидного мономеров или лактидного мономера, включающий стадии:
(i) взаимодействие мономера или мономеров в избытке с инициатором в растворителе, где указанный инициатор выбирают из амина и аминоспирта, при условии, что инициатор содержит, по меньшей мере, одну функциональную группу первичного или вторичного амина,
(ii) добавление катализатора, где указанный катализатор представляет собой ненуклеофильное основание и содержит, по меньшей мере, один атом азота типа sp2,
(iii) нейтрализация реакционной смеси,
и, предпочтительно, стадии, включающие:
(iv) взаимодействие мономера или мономеров в избытке с инициатором в растворителе, где указанный инициатор выбирают из амина и аминоспирта, при условии, что инициатор содержит, по меньшей мере, одну функциональную группу первичного или вторичного амина,
(v) добавление катализатора, где указанный катализатор представляет собой ненуклеофильное основание и содержит, по меньшей мере, один нейтральный атом азота типа sp2,
(vi) нейтрализация реакционной смеси.
Предпочтительно, мономер представляет собой лактид.
Предпочтительно, полимеры получают на основе лактидного мономера и гликолидного мономера.
Предпочтительно, стадию (ii) осуществляют после полного включения инициатора.
Предпочтительно, основной катализатор выбирают из группы, включающей:
- 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU),
- 1,5-диазабицикло[4.3.0]нон-5-ен (DBN),
- 4-аминопиридиновое соединение формулы:
в которой R4 и R5 независимо выбирают из атома водорода или C1-C12-алкильного радикала; или R4 и R5 образуют вместе с атомом азота, с которым связаны указанные заместители, насыщенный гетероцикл;
циклический гуанидин формулы:
в которой p равно 1 или 2 и R6 означает атом водорода или C1-C4-алкильный радикал;
- фосфазен формулы:
в которой R7, R10, R11 и R12 независимо означают C1-C6-алкильный радикал,
R8 и R9 независимо означают атом водорода или С1-C6-алкильный радикал, или R8 и R9 образуют вместе с атомами азота, с которыми связаны указанные заместители, насыщенный гетероцикл,
R13 означает C1-C6-алкильный радикал.
Предпочтительно, взаимодействие происходит в органическом растворителе, преимущественно, в галогенированном или ароматическом растворителе.
Предпочтительно, растворитель представляет собой галогенированный растворитель, преимущественно, растворителем является дихлорметан.
Предпочтительно, инициатор представляет собой амин.
Преимущественно, инициатором является аминоспирт.
Предпочтительно, реакционная температура составляет 0-150°C, преимущественно от 20 до 45°C.
Данный способ имеет преимущество, состоящее в том, что предусматривается полное включение инициатора в полимерные цепи в виде амидной концевой группы и потому приводит к очень высокой эффективности инициирования.
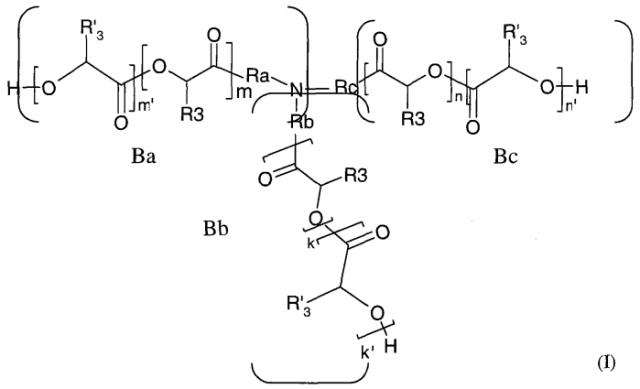
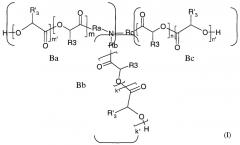
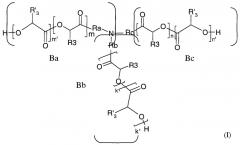
Предмет настоящего изобретения составляют также новые полимеры формулы I:
в которой n, n', m, m', k и k' независимо означают целое число от 0 до 12,
Ra означает ковалентную связь, линейный или разветвленный C5-С14-алкильный радикал, алкиламино-радикал, алкилокси-радикал, арильный или аралкильный радикал, причем предполагается, что если Ra означает арильный или аралкильный радикал, то m и m' равны нулю,
Rb означает ковалентную связь, линейный или разветвленный C5-С14-алкильный радикал, алкиламино-радикал или алкилокси-радикал,
Rc означает ковалентную связь, линейный или разветвленный C5-С14-алкильный радикал, алкиламино-радикал или алкилокси-радикал,
R3 означает атом водорода и R'3 означает алкильный радикал, причем предполагается, что, по меньшей мере, один из n', m' и k' отличен от нуля;
или R'3 означает атом водорода, и R3 означает алкильный радикал, причем предполагается, что, по меньшей мере, один из n, m и k отличен от нуля;
и предполагается, что
- по меньшей мере, одна из боковых ветвей Ba, Bb и Bc означает атом водорода,
- если одна из боковых ветвей Ba, Bb и Bc означает атом водорода, то, по меньшей мере, одна из двух других ветвей связана с атомом азота алкиламино-радикалом.
Предпочтительно, R3 означает алкильный радикал, и n', m' и k' равны нулю.
Предпочтительно, одна из боковых ветвей Ba, Bb и Bc означает атом водорода.
Предпочтительно, по меньшей мере, один из Ra, Rb и Rc означает алкиламино-радикал.
Предпочтительно, по меньшей мере, один из Ra, Rb и Rc означает алкилокси-радикал.
Предмет изобретения составляет также фармацевтическая композиция, содержащая, по меньшей мере, один полимер по изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой сделанную с помощью электронного микроскопа фотографию полимера с CO-NCH3-C12-алкильной концевой группой (пример 8).
Фигура 2 представляет собой сделанную с помощью электронного микроскопа фотографию полимера с CO-NH-C12 алкильной концевой группой (пример 1).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Таким образом, предмет изобретения составляет способ получения линейных полимеров с амидной концевой группой или звездообразной структуры с амидным ядром.
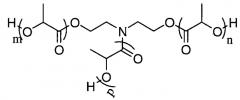
Под звездообразным полимером понимают полимер, имеющий единственную точку разветвления, из которой исходит несколько линейных цепей (боковых ветвей). Под “амидным ядром” подразумевают, что точкой разветвления является атом азота и что, по меньшей мере, одна из линейных цепей содержит, по меньшей мере, еще один атом азота (около “ядра” полимера), связанный с -C(=O)-радикалом в целях образования амидной функциональности. На линейной цепи или цепях, содержащих амидную функциональность, существует не более 10 последовательных атомов, которые отделяют атом азота точки разветвления от атома азота амидной функциональности, предпочтительно, не более 5 атомов, более предпочтительно, не более 3 атомов, еще предпочтительней, не более 2 атомов.
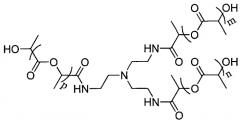
Например, полимер
представляет собой полимер с амидным ядром: точкой разветвления, из которой исходят три линейные цепи, является атом азота; два атома отделяют атом азота амидной функциональности от точки разветвления с атомом азота.
Под линейными полимерами с амидной концевой группой понимают линейный полимер с одной из двух концевых групп незамещенного, N-монозамещенного или N,N-дизамещенного амидного типа. Например, подразумевается линейный полимер с -C(=O)-NH-C12H25-концевой группой.
Реакция полимеризации относится к типу раскрытия цикла. Полимеризация с раскрытием цикла является аддитивной полимеризацией. Данная реакция схематически может быть представлена следующим образом:
где n означает число мономеров.
Взаимодействие осуществляют исходя из лактидного мономера и гликолидного мономера или из одного лактидного мономера. Согласно варианту мономер представляет собой лактид. Согласно другому варианту реакция является сополимеризацией и взаимодействие осуществляют, исходя из лактида и гликолида.
Способ включает первую стадию (i), состоящую во взаимодействии мономера или мономеров с инициатором в растворителе. Мономер или мономеры должны быть в избытке по отношению к инициатору, предпочтительно, от 1/1 до 100/1, более предпочтительно, от 1/1 до 30/1, еще предпочтительней, от 1/1 до 6/1.
Инициатор выбирают из амина и аминоспирта.
Под амином, понимают любое соединение, содержащее, по меньшей мере, одну функциональную группу первичного, вторичного или третичного амина. Например, подразумеваются алкиламины, диаминоалкилы или триаминоалкилы. Например, имеется ввиду трис-(2-аминоэтил)амин.
Под аминоспиртом, понимают любое соединение, содержащее, по меньшей мере, одну функциональную группу первичного, вторичного или третичного амина и, по меньшей мере, одну -OH функциональность. Например, имеется ввиду диэтаноламин.
Предполагается, что инициатор содержит, по меньшей мере, одну функциональную группу первичного или вторичного амина.
Способ включает вторую стадию (ii), состоящую в добавлении катализатора.
Предпочтительно, стадию (ii) осуществляют после того, как весь инициатор на стадии (i) является включенным, т.е. инициатора в реакционной смеси больше не остается.
Инициатора в реакционной смеси больше не остается, когда взаимодействие между добавленным инициатором и стехиометрическим количеством лактида завершено. Мониторинг взаимодействия можно осуществлять методом протонного ЯМР, и в таком случае, катализатор добавляют, когда сигналы инициатора больше не видны.
Например, стадию (ii) осуществляют через временной интервал от 5 до 30 минут после начала стадии (i), предпочтительно, от 10 до 20 минут.
Такая временная выдержка позволяет получить исключительную эффективность инициирования.
Катализатор представляет собой ненуклеофильное основание, предпочтительно, ненуклеофильное сильное основание. Катализатор содержит, по меньшей мере, один атом азота типа sp2, т.е. азота типа =N-, т.е. связанного одной стороной (с первым смежным атомом) двойной связью и другой стороной (со вторым смежным атомом) простой связью. Предпочтительно, катализатор содержит, по меньшей мере, один нейтральный атом азота типа sp2. Катализатор, ненуклеофильное основание, преимущественно реагирует как основание Брэнстеда, а не как нуклеофил.
Катализатор представляет собой ненуклеофильное основание, которое может быть выбрано из диазациклоалкеновых производных; аминопиридиновых производных, таких как 4-аминопиридиновые производные; циклических производных гуанидина или фосфазеновых производных.
Катализатор представляет собой ненуклеофильное основание, которое предпочтительно может быть выбрано из группы, включающей:
- диазациклоалкеновые производные, такие как диазабициклоундецены и диазабициклононены;
- 4-аминопиридиновые производные, такие как 4-аминопиридиновые производные формулы
в которой R4 и R5 независимо выбирают из атома водорода или C1-C12-алкильного радикала; или R4 и R5 образуют вместе с атомом азота, с которым связаны указанные заместители, насыщенный гетероцикл;
- циклические производные гуанидина формулы
в которой p равно 1 или 2 и R6 означает атом водорода или C1-C4-алкильный радикал;
- или фосфазеновые производные формулы
в которой R7, R10, R11 и R12 независимо означают C1-C6-алкильный радикал,
R8 и R9 независимо означают атом водорода или C1-C6-алкильный радикал, или R8 и R9 образуют вместе с атомами азота, с которыми связаны указанные заместители, насыщенный гетероцикл,
R13 означает C1-C6-алкильный радикал.
Катализатор представляет собой ненуклеофильное основание, которое предпочтительно может быть выбрано из группы, включающей 1,8-диазабицикло[5.4.0]ундец-7-ен (или DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN); N',N'-диметиламино-4-пиридин (или DMAP), 1,5,7-триазабицикло-[4.4.0]дец-5-ен (TBD), 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорин (или BEMP).
Например, катализатор представляет собой DBU (1,8-диазабицикло[5.4.0]ундец-7-ен).
Предпочтительно, катализатор представляет собой 4-аминопиридиновое соединение формулы
в которой R4 и R5 независимо выбирают из атома водорода или C1-C12-алкильного радикала; или R4 и R5 образуют вместе с атомом азота, с которым связаны указанные заместители, насыщенный гетероцикл. Под 4-аминопиридиновым соединением формулы
подразумевают, например, N',N'-диметиламино-4-пиридин (или DMAP).
Предпочтительно, катализатор представляет собой циклический гуанидин формулы
в которой p равно 1 или 2 и R6 означает атом водорода или C1-C4-алкильный радикал. Под циклическим гуанидином подразумевают, например, 1,5,7-триазабицикло-[4.4.0]дец-5-ен (TBD).
Предпочтительно, катализатор представляет собой фосфазен, и преимущественно монофосфазен.
Предпочтительно, катализатор представляет собой монофосфазен формулы
в которой R7, R10, R11 и R12 независимо означают,
R8 и R9 независимо означают атом водорода или C1-C6-алкильный радикал, или R8 и R9 образуют вместе с атомами азота, с которыми связаны указанные заместители, насыщенный гетероцикл,
R13 означает C1-C6-алкильный радикал.
Под вышеуказанным монофосфазеновым соединением подразумевают, например, 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорин (BEMP).
Предпочтительно, соотношение исходной концентрации NH2 функциональности инициатора и концентрации катализатора составляет 1-1000, более предпочтительно 2-500, еще предпочтительней 10-100.
Способ включает третью стадию (iii), состоящую в нейтрализации реакционной смеси. Нейтрализация может быть выполнена любым способом, известным специалисту из уровня техники. Например, нейтрализацию осуществляют добавлением кислоты или кислой смолы, такой как Amberlyst™ A15.
Взаимодействие происходит в растворителе. Термин "растворитель" здесь означает отдельный растворитель или смесь растворителей. Предпочтительно, растворитель выбирают так, чтобы образовавшийся полимер был растворим в данном растворителе. Преимущественно, растворитель выбирают из галогенированных растворителей, циклических простых эфиров и ароматических растворителей. Например, растворитель выбирают из группы, включающей дихлорметан, дихлорэтан, тетрагидрофуран (ТГФ) и толуол. Предпочтительно, растворителем является дихлорметан.
Предпочтительно, взаимодействие осуществляют при температуре в диапазоне от температуры окружающей среды, т.е. около 25°C, и до температуры кипения выбранного растворителя. Реакционную температуру выбирают так, чтобы данная температура была ниже температуры разложения образующегося полимера. Например, температура составляет от 0 до 150°C. Предпочтительно, температура составляет от 10 до 90°C. Преимущественно также, температура составляет от 20 до 45°C, предпочтительно, от 20 до 30°C. Например, взаимодействие осуществляют при температуре окружающей среды.
Альтернативно, стадию (i) нагреванием, преимущественно до температуры в диапазоне от 50 до 80°C, предпочтительно нагреванием до температуры кипения с обратным холодильником. Такая температура предпочтительна, когда инициатором является вторичный амин.
При такой альтернативе, стадию (ii) предпочтительно осуществляют при температуре от 15 до 35°C, преимущественно, при температуре окружающей среды.
Предпочтительно, реакцию останавливают стадией (iii) сразу после получения заданной степени полимеризации. Например, реакцию останавливают, когда расход начального мономера составляет от 90 до 100%. Предпочтительно, реакцию останавливают, когда расход начального мономера составляет свыше 96%.
Способ по изобретению имеет многочисленные преимущества. В частности, способ обеспечивает высокую селективность. Данный способ имеет преимущество, состоящее в том, что предусматривается полное включение инициатора в полимерные цепи в виде амидной концевой группы и потому приводит к очень высокой эффективности инициирования. Благодаря приведенному способу можно получать очень различные полимеры с легко регулируемыми свойствами. Можно получить полимер с 1, 2 или 3 боковыми ветвями с амидной концевой группой.
Преимущественно, полученный полимер представляет собой полимер с одной боковой ветвью с амидной концевой группой. Предпочтительно, полученный полимер представляет собой полимер с двумя боковыми ветвями с амидной концевой группой. Предпочтительно, полученный полимер представляет собой полимер с тремя боковыми ветвями с амидной концевой группой.
Фигуры 1 и 2 показывают такие различия в свойствах.
Фигура 1 представляет полученную в поляризованном свете с помощью электронного микроскопа фотографию полимера с CO-NCH3-C12-алкильной концевой группой (пример 8). Фотография, которая является черной, свидетельствует о том, что полимер является аморфным.
Фигура 2 представляет полученную в поляризованном свете с помощью электронного микроскопа фотографию полимера с CO-NH-C12 алкильной концевой группой (пример 1). Полимер является кристаллическим.
Изобретение также касается нового полимера формулы I
в которой n, n', m, m', k и k' независимо означают целое число от 0 до 12,
Ra означает ковалентную связь, линейный или разветвленный C5-С14-алкильный радикал, алкиламино-радикал, алкилокси-радикал, арильный или аралкильный радикал, причем предполагается, что если Ra означает арильный или аралкильный радикал, то m и m' равны нулю,
Rb означает ковалентную связь, линейный или разветвленный C5-С14-алкильный радикал, алкиламино-радикал или алкилокси-радикал,
Rc означает ковалентную связь, линейный или разветвленный C5-С14-алкильный радикал, алкиламино-радикал или алкилокси-радикал,
R3 означает атом водорода и R'3 означает алкильный радикал, причем предполагается, что, по меньшей мере, один из n', m' и k' отличен от нуля;
или R'3 означает атом водорода и R3 означает алкильный радикал, причем предполагается, что, по меньшей мере, один из n, m и k отличен от нуля;
и предполагается, что
- по меньшей мере, одна из боковых ветвей Ba, Bb и Bc означает атом водорода,
- если одна из боковых ветвей Ba, Bb и Bc означает атом водорода, то, по меньшей мере, одна из двух других ветвей связана с атомом азота алкиламино-радикалом.
Если не указано иное, термин алкил применительно к данному изобретению означает линейный или разветвленный алкильный радикал, содержащий 1-12 атомов углерода, такой как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор-бутильный и трет-бутильный, пентильный или амильный, изопентильный, неопентильный, гексильный или изогексильный, гептильный, октильный, нонильный, децильный, ундецильный или додецильный радикалы. Предполагается, что алкильный радикал по настоящей заявке может быть типа CnH2n и имеет две точки связывания, в начале и конце цепи (также носит название алкандиил). Предпочтительно, алкильный радикал представляет собой (C1-C6)-алкильный радикал, т.е. означает алкильный радикал с 1-6 атомами углерода, как указано выше, или (C1-C4)-алкильный радикал, означающий алкильный радикал с 1-4 атомами углерода, такой как, например, метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор-бутильный и трет-бутильный радикалы.
Термин алкил в выражениях алкилокси (или алкокси), алкиламино, диалкиламино, аралкил означает вышеуказанный алкильный радикал.
Конкретнее, под алкиламино понимают алкильный радикал, по меньшей мере, один из атомов водорода которого замещен амино-функциональностью, предпочтительно, имеется ввиду, алкильный радикал, по меньшей мере, один из концевых атомов водорода которого, т.е. на концевой группе алкильной цепи, замещен амино-функциональностью, такой как, например, и преимущественно, -(CH2)2-NH радикал, или -(CH2)3-NH радикал.
Конкретнее, под алкокси понимают алкильный радикал, по меньшей мере, один из концевых атомов водорода которого, т.е. на одной из концевых групп алкильной цепи, замещен атомом кислорода, такой как, например, и преимущественно, -(CH2)2-O-радикал, или -(CH2)3-O-радикал.
Применительно к данному изобретению, арильные радикалы могут быть ароматического моно- или полициклического типа. Моноциклические арильные радикалы могут быть выбраны из группы, включающей фенил, толил, ксилил, мезитил, куменил, и, предпочтительно, из фенильных радикалов. Полициклические арильные радикалы могут быть выбраны из группы, включающей нафтильные, антрильные, фенантрильные, флуоренильные радикалы. Указанные радикалы необязательно замещены одним или несколькими одинаковыми или различными радикалами, такими как алкил, галогеналкил, алкокси, алкоксикарбонил, алкилкарбонилокси, галоген, циано, нитро, арил, арилокси, арилоксикарбонил или арилкарбонилокси.
Термин арил в выражении аралкил означает вышеуказанный арильный радикал. Например, под аралкилом подразумевают бензильный радикал.
Под насыщенным гетероциклом, если не указано иное, понимают насыщенный углеродсодержащий циклический радикал, включающий, по меньшей мере, один гетероатом, выбираемый из N, О и S, такой как оксиран, азиридин, азетидин, пиперидин. Предпочтительно, насыщенный гетероцикл содержит от 3 до 7 членов, преимущественно, от 3 до 6 членов, предпочтительно, от 4 до 6 членов, более предпочтительно, от 5 до 6 членов.
Под диазациклоалкеновым соединением понимают конденсированное бициклическое соединение, содержащее 2 атома азота и, по меньшей мере, одну двойную связь.
Предмет изобретения составляет также фармацевтическая композиция, содержащая, по меньшей мере, один полимер по изобретению.
Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют то же самое значение, что и значение, обычно подразумеваемое средним специалистом в области, к которой относится изобретение.
Следующие примеры приведены для иллюстрации изобретения и никоим образом не могут считаться ограничивающими рамки объема изобретения.
ПРИМЕРЫ
Примеры 1 и 2:
Общая методика осуществления
Лактид (LA) и аминированный инициатор (1 эквивалент) растворяют в свежеперегнанном дихлорметане ([LA]0=1 моль.л-1). Реакционную среду перемешивают в течение 20 минут при T=26°C (до полного включения амина, мониторинг 1H-ЯМР спектроскопией), затем добавляют DBU (0,01 эквивалент) и реакционную среду перемешивают при T=26°C, от 3 до 10 минут, пока лактид полностью не израсходуется (также мониторинг 1H-ЯМР спектроскопией).
10 эквивалентов (по отношению к DBU) смолы Amberlyst A15 (~5 мэкв/л), заранее промытой и высушенной, добавляют для удаления катализатора. Реакционную среду перемешивают в течение 10 минут, затем фильтруют. Добавляют еще 5 эквивалентов смолы Amberlyst A15 добавляют к реакционной среде, которую перемешивают в течение 10 минут, затем фильтруют. После чего реакционный растворитель выпаривают в вакууме, затем полученный полимер сушат в вакууме в течение 48 часов при 50°C в случае линейных сложных полиэфиров и при 60°C в случае звездообразных сложных полиэфиров.
Пример 1: полимер, инициируемый додециламином и с DP=3,5
1H ЯМР (δ, CDCl3, 300,1 МГц): 6,15 (1H, уш.с, NH), 5,20-5,13 (6,2H, м, CHC), 4,35 (1H, кв, J=6,7 Гц, CHa), 3,20 (2H, м, CH2e), 1,60-1,54 (16H, м, CH3d), 1,48 (8H, м, CH3d, CH3b и CH2f), 1,25 (18H, м, CH2f), 0,88 (3H, т, J=6,7 Гц, CH3g) м.д.
13C ЯМР (δ, CDCl3, 75,5 МГц): 169,6 (CO), 71,8 (CH) 69,8-68,5 (CH), 66,7 (CH-OH), 39,4 (CH2N), 31,9 (CH2), 29,7-29,6 (CH2), 29,4-29,3 (CH2), 26,9-26,8 (CH2), 22,7 (CH2), 21,4 (CH3), 20,5 (CH3), 17,8 (CH3), 16,8-16,7 (CH3), 14,1 (CH3) м.д.
DPЯМР=3,6
% включенного амина >99%
SEC (ТГФ): Mn=1056, Mw/Mn=1,14.
Пример 2: полимер, инициируемый диэтаноламином в присутствии 6 эквивалентов D,L-лактида
1H ЯМР (δ, CDCl3 300,1 МГц): 5,21-5,14 (8,3Н, м, СН), 4,35-4,23 (7Н, м, CH-OH и СН2-О), 2,87 (2Н, м, CH2-N), 1,60-1,50 (23, м, CH3), 1,46-1,48 (9,1H, м, CH3-OH) м.д.
13C ЯМР (δ, CDCl3, 75,5 МГц): 169,6 (CO), 69,4-69,0 (CH), 66,6 (CH), 64,6 (CH2), 47,4 (CH2), 20,4 (CH3), 16,6 (CH3) м.д.
DPЯМР=5,7
% включенного амина >99%
SEC (ТГФ): Mn=1134, Mw/Mn=1,25.
Пример 3: синтез D,L-PLA с DP=30, инициируемый додециламином
D,L-лактид (30 эквивалентов) и додециламин (1 эквивалент) растворяют в свежеперегнанном дихлорметане ([LA]0=1 моль.л-1). Реакционную среду перемешивают в течение 20 минут при температуре окружающей среды, затем добавляют DBU (0,05 эквивалента). Смесь энергично перемешивают при температуре окружающей среды, пока лактид полностью не израсходуется, осуществляют мониторинг 1H-ЯМР спектроскопией. Спустя 5 минут реакционную среду нейтрализуют добавлением бензойной кислоты. Органическая фаза может быть промыта водой, затем насыщенным раствором NaHCO3 и, наконец, насыщенным раствором NaCl для удаления катализатора. После чего органическую фазу сушат над Na2SO4, фильтруют и упаривают, получая полимер.
1H ЯМР (δ, CDCl3 300,1 МГц): 6,19 (1H, уш.с, NH), 5,17-5,14 (57H, м, CH), 4,35 (1H, кв, CH), 3,27-3,05 (2H, м, CH2), 1,58-1,53 (178H, м, CH), 1,24 (18H, уш.с, CH2), 0,87 (3H, т, CH3) м.д.
DPЯМР=29
% включенного амина >99%
SEC (ТГФ): Mw=6608, Mw/Mn=1,18.
Пример 4: синтез сополимера PLGA 80/20 с DP=3,5, инициируемый додециламином
Лактид (2,8 эквивалента), гликолид (0,7 эквивалента) и додециламин (1 эквивалент) растворяют в свежеперегнанном дихлорметане ([LA]0=1 моль.л-1). Реакционную среду перемешивают в течение 25 минут при температуре окружающей среды, затем добавляют DBU (0,05 эквивалента), и реакционную смесь энергично перемешивают. Спустя 3 минуты реакционную среду нейтрализуют добавлением бензойной кислоты и общий расход мономера проверяют методом 1H-ЯМР спектроскопии.
1H ЯМР (δ, CDCl3 300,1 МГц): 6,28 (1H, уш.с, NH), 5,25-5,15 (4,5H, м, CHpol), 4,90-4,67 (3,0H, м, CH2pol), 4,35 (1H, м, CH), 3,32-3,21 (2H, м, CH2), 1,60-1,48 (18,4H, м, CH2 и CH3), 1,24 (18h, уш.с, CH2), 0,87 (3H, т, CH3) м.д.
DPЯМР=3,5
% включенного амина >99%
Соотношение лактид/гликолид = 79/21 (по 1H-ЯМР)
SEC (ТГФ): Mw=1008, Mw/Mn=1,19
Пример 5: синтез L-PLA с DP=30, инициируемый бензиламином
L-лактид (30 эквивалентов) и бензиламин (1 эквивалент) растворяют в свежеперегнанном дихлорметане ([LA]0=1 моль.л-1). Реакционную среду перемешивают в течение 30 минут при температуре окружающей среды, затем добавляют DBU (0,06 эквивалента). Смесь энергично перемешивают. Спустя 5 минут реакционную среду нейтрализуют добавлением бензойной кислоты и общий расход мономера проверяют методом 1H-ЯМР спектроскопии.
1H ЯМР (δ, CDCl3 300,1 МГц): 7,42-7,27 (5H, м, CH), 6,62 (1H, уш.с, NH), 5,25-5,15 (52H, кв, J=7,1 Гц, CHpol), 4,48 (2H, м, CH2), 4,39 (1H, кв, J=6,9 Гц, CH), 1,61-1,47 (160H, м, CH3) м.д.
13C ЯМР (δ, CDCl3, 75,5 МГц): 169,6 (CO), 129,2 (C), 128,6 (CH), 127,7 (CH), 127,5 (CH), 71,8 (CH), 69,8 (CH), 69,0 (CH), 66,7 (CHOH), 43,2 (CH2), 20,5 (CH3), 17,8 (CH3), 16,6 (CH3pol) м.д. CO-амид не наблюдается.
DPЯМР=26
% включенного амина >99%
SEC (ТГФ): Mw=8114, Mw/Mn=1,12
Пример 6: синтез L-PLA с DP=30, инициируемый 1,3-пропандиамином
L-лактид (30 эквивалентов) и 1,3-пропандиамин (1 эквивалент) растворяют в свежеперегнанном дихлорметане ([LA]0=1 моль.л-1). Реакционную среду перемешивают в течение 20 минут при температуре окружающей среды, затем добавляют DBU (0,02 эквивалента) и смесь энергично перемешивают. Спустя 3 минуты реакционную среду нейтрализуют добавлением бензойной кислоты и общий расход мономера проверяют методом 1H-ЯМР спектроскопии.
1H ЯМР (δ, CDCl3 300,1 МГц): 6,81 (2Н, уш.с, NH), 5,16 (63H, кв, J=7,1 Гц, CHpol), 4,37 (2H, кв, J=6,9 Гц, CH), 3,48 (2H, м, CH2), 3,25 (4H, м, CH2), 1,58 (195H, д, J=7,1 Гц, CH3) м.д.
13C ЯМР (δ, CDCl3, 75,5 МГц): 169,6 (CO), 71,7 (CH), 69,1 (CH), 66,7 (CHOH), 35,5 (CH2), 20,5 (CH3), 17,8 (CH3), 16,7 (CH3pol,) м.д. CO-амид и центральный CH2 не наблюдаются.
DPЯМР=32,5
% включенного амина >99%
SEC (ТГФ): Mw=8709, Mw/Mn=1,12
Пример 7: синтез D,L-PLA с DP=30, инициируемый трис-(2-аминоэтил)амином
D,L-лактид (30 эквивалентов) и трис-(2-аминоэтил)амин (1 эквивалент) растворяют в свежеперегнанном дихлорметане ([LA]0=1 моль.л-1). Реакционную среду перемешивают в течение 30 минут при температуре окружающей среды, затем добавляют DBU (0,1 эквивалента) и смесь энергично перемешивают. Спустя 10 минут реакционную среду нейтрализуют добавлением бензойной кислоты и общий расход мономера проверяют методом 1H-ЯМР спектроскопии.
1H ЯМР (δ, CDCl3 300,1 МГц): 6,91-6,71 (3Н, уш.с, NH), 5,20-5,14 (72Н, м, CHpol), 4,35 (3Н, кв, J=6,9 Гц, CH), 3,44-3,04 (6H, м, CH2), 2,64-2,48 (6H, м, CH2), 1,61-1,48 (225H,м,CH3) м.д.
13C ЯМР (δ, CDCl3, 75,5 МГц): 175,1 (CO), 169,6 (CO), 69,1 (CH), 69,0 (CH), 66,7 (CHOH), 54,4 (CH2), 38,0 (CH2), 20,5 (CH3), 17,6 (CH3), 16,6 (CH3) м.д.
DPЯМР=37,5
% включенного амина >99%
SEC (ТГФ): Mw=8514, Mw/Mn=1,09
Пример 8: синтез D,L-PLA с DP=3,5, инициируемый N-метилдодециламином, в ТГФ при 70°C
D,L-лактид (3,2 эквивалента) и N-метилдодециламин (1 эквивалент) растворяют в свежеперегнанном ТГФ ([LA]0=1 моль.л-1). Реакционную среду перемешивают в течение 3 часов при T=70°C, затем добавляют DBU (0,05 эквивалента) и смесь энергично перемешивают при температуре окружающей среды. Спустя 4 минуты реакционную среду нейтрализуют добавлением бензойной кислоты (1,5 экв., 21 мг). ТГФ выпаривают и реакционную среду поглощают 70 мл дихлорметана. Органическую фазу дважды промывают насыщенным раствором NaHCO3, один раз водой, один раз насыщенным раствором соли, затем сушат над Na2SO4, фильтруют и упаривают. Полученный полимер с