Способ получения сложного оксида иттербия и железа ybfe2o4±δ
Иллюстрации
Показать всеИзобретение относится к технологии получения сложных оксидов, обладающих магнитоэлектрическими эффектами. Способ получения сложного оксида иттербия и железа YbFe2O4±δ, включающий приготовление смеси из предварительно просушенных оксидов железа (III) и оксида иттербия (III), и обжиг полученной смеси при температуре 1000°С в газовой смеси, состоящей из инертного газа и кислорода, при поддержании заданного значения давления кислорода в смеси в диапазоне lgPo2=-14-19 атм. При этом в качестве инертного газа используют по меньшей мере один из газов, выбранных из группы, содержащей аргон, азот, а сушку оксидов осуществляют при температуре 600°С. Технический результат - повышение качества сложного оксида YbFe2O4±δ. 2 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к технологии получения сложных оксидов, обладающих магнитоэлектрическими эффектами. Соединение YbFe2O4±δ относится к семейству LnFe2O4 (Ln=Ho, Er, Tm, Yb, Lu) со смешанной валентностью катионов железа - Fe+2 и Fe+3. Наличие металлических катионов одного и того же элемента различной валентности может придавать оксидным материалам необычные свойства, что дает возможность использования их при изготовлении материалов для микроэлектроники.
Известен способ получения сложного оксида иттрия, бария и меди, в котором для получения YBa2Cu3O7-δ из водного раствора, содержащего нитраты иттрия, бария и меди, проводят совместную сорбцию иттрия, бария, меди в заданном мольном соотношении Y:Ba:Cu=1:2:3 из указанного раствора на карбоксильном катионите КБ-4п-2, дальнейшую сушку полученного материала и последовательное нагревание при температуре 110°С - 2 ч, при 250°С - 2 ч, при 450°С - 5 ч, при 600°С - 3 ч, при 850°С - 6 ч и затем 1 час в атмосфере кислорода. При термическом разложении происходит выгорание органической части ионита и взаимодействие ионов с образованием сложного оксида YBa2Cu3O7-δ в виде микросфер (патент РФ №2503621, МПК С01F 17/00, опубл. 10.01.2014).
Недостатком способа является сложность и длительность его осуществления, обусловленная многочисленными операциями обжига при получении сложных оксидов. Применяемая атмосфера обжига является окислительной, что исключает существование катионов Fe2+, являющееся необходимым условием получения сложных оксидов железа и лантаноидов, например иттербия (YbFe2O4±δ). Кроме того, указанные температуры обжига не позволят получить подобные оксиды.
Известен способ получения сложных оксидных материалов, в частности получение сложных оксидов алюминия и магния, активированных ионами редкоземельных металлов. Исходную смесь получают путем предварительного перемешивания в течение 30 минут порошка оксида церия (III), оксида тербия (III), металлического алюминия, оксида алюминия (III), оксида магния (II), взятых в стехиометрических соотношениях, к полученной реакционной смеси добавляют сверхстехиометрическое количество перхлората натрия с последующим перемешиванием в течение 30 минут и процесс взаимодействия компонентов в полученной реакционной смеси осуществляют в режиме самораспространяющегося высокотемпературного синтеза (патент РФ №2492963, МПК В22F 3/23, опубл. 20.09.2013).
Недостатком способа является невозможность получения сложных оксидов железа и лантаноидов, например иттербия, т.к. самораспространяющийся высокотемпературный синтез осуществляется на воздухе в неконтролируемой атмосфере по содержанию кислорода.
Наиболее близким по совокупности существенных признаков является способ получения сложного оксида железа и церия (редкоземельный элемент подгруппы лантоноидов), принятый за прототип, включающий приготовление смеси порошков из оксида железа (III) и оксида церия (IV), предварительно просушенных при 1000°С, обжиг полученной смеси при температуре 1000-1200°С в газовой смеси, содержащей СO2 и СО или СO2 и O2 при поддержании давления кислорода в смеси lgPo2=-7,25-15,68 атм с получением сложного оксида CeFeO3 (Kitayama K., Nojiri K., Sugihara Т., Katsura Т. Phase equilibria in the Ce-O and Ce-Fe-O systems //J. Of Solid State Chemistry. 1985. V.56. P.l-11).
Недостатком способа при получении по его условиям сложного оксида железа и иттербия является недостаточно высокое качество получаемого сложного оксида с заданным содержанием кислорода, т.к.:
- исходные компоненты могут вступать во взаимодействие с СO2 и СО газовой смеси с образованием карбидов и оксикарбонатов (посторонние фазы и примеси);
- при высоком содержании кислорода в газовой смеси в получаемом сложном оксиде дополнительно присутствуют окисленные фазы (Fe3O4 и YbFeO3).
Техническим результатом предлагаемого способа является повышение качества получаемого сложного оксида YbFe2O4±δ с заданным значением кислородного индекса.
Указанный технический результат достигается тем, что в способе получения сложного оксида иттербия и железа YbFe2O4±δ, включающем приготовление смеси из предварительно просушенных оксидов железа (III) и лантаноида, обжиг полученной смеси при температуре 1000°С в газовой смеси, содержащей кислород, согласно изобретению в качестве оксида лантоноида используют оксид иттербия (III) и обжиг приготовленной смеси ведут в газовой смеси, состоящей из инертного газа (аргона или азота) и кислорода, при поддержании заданного значения давления кислорода в смеси в диапазоне lgPo2=-14-19 атм. При этом в качестве инертного газа используют по меньшей мере один из газов, выбранных из группы, содержащей аргон, азот, а сушку оксидов осуществляют при температуре 600°С.
Поскольку соединение YbFe2O4±δ относится к гомологическому ряду LnFeO3 * n FeO и содержит железо в двух степенях окисления Fe3+ и Fe2+, то оно не может быть получено в атмосфере воздуха. Проведение обжига в газовой смеси, состоящей из инертного газа и кислорода, при поддержании заданного значения кислорода позволяет создать требуемое соотношение Fe2+и Fe3+ в сложном оксиде, при этом не происходит взаимодействия компонентов газовой смеси с образцом, кроме кислородного обмена. Оксид YbFe2O4±δ получают в интервале давлений кислорода lgPo2=-14-19 атм, обеспечивающем содержание кислорода от низкокислородной до высококислородной границы области гомогенности, следовательно, происходит изменение соотношения Fe2+и Fe3+, которое обеспечивает переменность свойств полученного материала.
При проведении обжига при давлении кислорода lgPo2<-14 атм наряду с основной фазой происходит образование окисленных фаз - Fe3O4 и YbFeO3, что ухудшает качество получаемого оксида и приводит к изменению его свойств.
При проведении обжига при давлении кислорода lgPo2>-19 атм в сложном оксиде наряду с основной фазой образуются восстановленные фазы - Fe и Yb2O3, что также приводит к изменению состава и свойства оксида.
Проведение сушки оксидов железа (III) и иттербия (III) при 600°С перед их смешиванием дополнительно обеспечивает гарантированное удаление влаги из смеси оксидов, что приводит к сокращению времени, предназначенного для удаления излишков кислорода из смеси и приведение ее в равновесие с газовой фазой.
Предлагаемый способ осуществляют следующим образом:
Просушенные исходные оксиды иттербия (III) и железа (III), взятые в эквимолярной по катионам пропорции, согласно уравнению
Fe2O3+l/2Yb2O3=YbFe2O4+1/4O2
смешивали и подвергали обжигу при температуре 1000°С в газовой смеси, состоящей из инертного газа (аргона или азота) и кислорода, при поддержании заданного значения давления кислорода в смеси в диапазоне lgPo2=-14-19 атм с получением сложного оксида YbFe2O4±δ с заданным значением кислородного индекса.
Заявленный способ испытан в лабораторных условиях.
Исходные оксиды иттербия (III) и железа (III), просушенные при температуре 600°С до постоянной массы и взятые в эквимолярной по катионам пропорции, смешивали и перетирали в течение часа в агатовой ступке. Из полученной смеси прессовали таблетки диаметром 10 мм на гидравлическом прессе при давлении 150 кПа/см2, которые подвергали обжигу в газовой смеси, состоящей из аргона и кислорода, с контролируемым парциальным давлением кислорода при 1000°С в течение 48 часов. При варьировании Ро2 в зоне реактора получены образцы сложного оксида YbFe2O4±δ различных фазовых составов.
Фазовый состав полученных образцов исследовался при помощи рентгенографического метода на дифрактометре Shimadzu XRD 7000С.
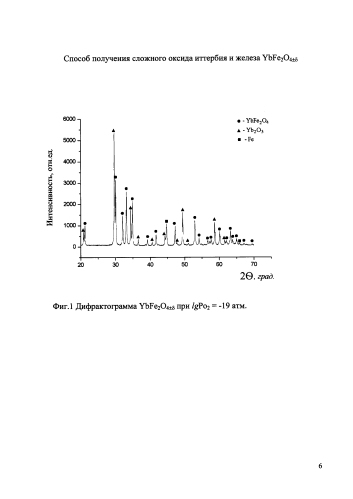
На фиг.1 приведена дифрактограмма образца номинального состава YbFe2O4±δ, полученного в газовой смеси Ar+O2 (logPo2=-19 атм) при температуре 1000°С, в которой наряду с рефлексами основной фазы видны рефлексы восстановленных фаз (Fe и Yb2O3), т.е. равновесие фиксируется на низкокислородной границе области гомогенности соединения YbFe2O4±δ, при этом δ=-0,071.
На фиг.2 приведена дифрактограмма образца номинального состава YbFe2O4±δ, полученного в газовой смеси Ar+O2 (lgPo2=-14 атм) при температуре 1000°С, в которой наряду с рефлексами основной фазы YbFe2O4±δ видны рефлексы окисленных фаз (Fe3O4 и YbFeO3), т.е. определено равновесие на высококислородной границе области гомогенности YbFe2O4±δ, при этом δ=+0,052.
Из этих данных следует, что соединение YbFe2O4±δ при температуре 1000°С существует в интервале давлений кислорода от lgPo2=-14 до lgPo2=-19 (атм.).
На фиг.3 приведена дифрактограмма образца номинального состава YbFe2O4±δ, полученного в газовой смеси Ar+O2 (lgPo2=-16 атм) при температуре 1000°С, на которой отсутствуют рефлексы посторонних фаз, т.е. данное давление кислорода в газовой фазе позволяет получать оксид YbFe2O4±δ в гомогенном состоянии, при этом δ=0,002.
1. Способ получения сложного оксида иттербия и железа YbFe2O4±δ, включающий приготовление смеси из предварительно просушенных оксидов железа (III) и лантаноида, обжиг полученной смеси при температуре 1000°C в газовой смеси, содержащей кислород, отличающийся тем, что в качестве оксида лантоноида используют оксид иттербия (III) и обжиг приготовленной смеси ведут в газовой смеси, состоящей из инертного газа и кислорода, при поддержании заданного значения давления кислорода в смеси в диапазоне lgPo2=-14-19 атм.
2. Способ по п. 1, отличающийся тем, что в качестве инертного газа используют по меньшей мере один из газов, выбранных из группы, содержащей аргон, азот.
3. Способ по п. 1, отличающийся тем, что сушку оксидов осуществляют при температуре 600°C.