Синбиотическая композиция для коррекции дисбиотических нарушений микробиоценоза желудочно-кишечного тракта
Иллюстрации
Показать всеИзобретение относится к области медицины и касается средств для коррекции дисбиотических нарушений микробиоценоза желудочно-кишечного тракта. Предлагаемая синбиотическая композиция выполнена в твердой дозированной форме в виде капсул и включает, мас. %: пробиотическую составляющую, представляющую рациональную комбинацию лиофилизатов пробиотических штаммов бактерий Lactobacillus delbraeckii TS1-06 (2,5) и Lactobacillus fermentum TS3-06 (2,5), по 107 клеток/капс. каждого штамма, а также стерилизованных высушенных культуральных жидкостей с метаболитами пробиотического штамма бактерий Bacillus subtilis ВКПМ № В-2335 (1,9) и метаболитами пробиотического штамма бактерий Enterococcus faecium L-3 (8,4), пребиотическую составляющую в виде овсяных хлопьев (20,1), цеолит в качестве адсорбента-носителя (64,3) и стеарат кальция или аэросил в качестве технологической добавки (0,3). Состав композиции обеспечивает достаточный уровень специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов, благоприятное воздействие на индигенную составляющую микрофлоры кишечника, способствует эффективному повышению неспецифической резистентности организма. 3 ил., 22 табл., 8 пр.
Реферат
Изобретение относится к области медицины и касается средства коррекции дисбиотических нарушений микробиоценоза желудочно-кишечного тракта.
На протяжении многих десятилетий внимание клиницистов разных стран приковано к проблеме изучения состава нормальной микрофлоры и ее возможных нарушений, что неслучайно, так как нарушения микрофлоры встречаются все чаще, сопровождаются самой разнообразной симптоматикой, носят массовый характер и выявляются практически среди всех слоев населения. Многие исследователи наблюдаемое увеличение частоты и тяжести острых инфекционных заболеваний, торпидное течение и хронизацию воспалительных процессов объясняют развивающимися или уже имевшими место нарушениями микробиоты, сопровождающими основную болезнь. В связи с этим, в настоящее время большое внимание уделяется нарушениям микроэкологии человека, и в первую очередь, нарушению нормофлоры одного из наиболее сложных микробиоценозов - микробиоты кишечника, так как возникшие нарушения микробного пейзажа кишечника играют немаловажную, а порой и решающую роль в развитии и течении широкого спектра заболеваний местного и общего характера.
Столь пристальное внимание в современной медицинской науке к микрофлоре кишечника и ее значению в жизнедеятельности человека связано с тем, что она составляет основу микроэкологии макроорганизма и оказывает непосредственное влияние на его состояние, выполняя ряд жизненно важных функций. Это обменная и синтетическая функции, функция деток-сикации, участие в процессах пищеварения и формирования естественного иммунитета человека, обеспечение колонизационной резистентности и другие. Изменение качественного и/или количественного состава кишечного микробиоценоза приводит к нарушению процессов усвоения нутриентов и минорных компонентов пищи и уменьшению поступления в организм человека целого ряда биологически активных веществ (БАВ) и витаминов, что проявляется, в первую очередь, в виде кишечных расстройств, изменений статуса питания и психоэмоциональных дисфункций.
При коррекции дисбиотических нарушений микрофлоры кишечника проводят комплекс мероприятий с учетом клинических проявлений основного заболевания и степени выраженности дисбиотических нарушений кишечного микробиоценоза, а также данных лабораторных исследований микрофлоры указанного биотопа и состояния реактивности организма. При этом нормальная микрофлора кишечника рассматривается как качественное и количественное соотношение популяций микробов, а ее нарушения - клинико-лабораторный синдром, характеризующийся изменением качественного и/или количественного состава нормофлоры биотопа, а также метаболическими и иммунными нарушениями, сопровождающимися у части пациентов клиническими симптомами [1].
Причины возникновения кишечного дисбактериоза самые разнообразные и носят экзогенный и эндогенный характер. Достаточно распространенными в настоящее время являются нарушение режима питания, переедание или перекусы на бегу, плохая экология, курение, стресс и переутомление, хронические заболевания и многое другое. Ввиду того, что микробиоценоз является эволюционно сложившейся и четко интегрированной системой, которая обеспечивает слаженную работу всех органов и систем и базируется до известной степени на принципе саморегуляции, то возникающие изменения симбиотической микрофлоры в ряде случаев восстанавливаются самопроизвольно. В более отягощенных ситуациях, ассоциированных с возникновением дисбактериоза 1 степени выраженности возникших нарушений, для нормализации микрофлоры кишечника предусматривается курс заместительной терапии. Значимую роль при этом играет дифференцированное применение различных иммунобиологических препаратов.
Спектр иммунобиологических препаратов для коррекции дисбиотических нарушений кишечника достаточно широк. Большой интерес в клинической практике представляют биологические препараты из группы пробиотиков, включающие определенные виды непатогенных для человека микроорганизмов и вещества микробного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию и стабилизацию его микроэкологического статуса [2]. К их числу относятся, прежде всего, бифидо- и лакто-содержащие средства для регулирования равновесия кишечной микрофлоры, так как бифидо- и лактобактерии играют важнейшую роль в обеспечении нормального функционирования кишечника. В случае возникновения дисбиотических нарушений указанные анаэробные бактерии претерпевают изменения в первую очередь. Поэтому чрезвычайно важно использование препаратов на их основе.
Препаратами выбора в ряде клинических ситуаций являются пробиотические комплексы Линекс и Бифиформ [3, 4], действующим началом которых являются живые бактерии. Так, в состав Линекса, производимого фармацевтической фирмой «Лек» (Словения), включен сбалансированный комплекс молочнокислых бактерий: лактобактерии Lactobacillus acidophilus, бифидобактерии Bifidobacterium infantis и энтерококки Enterococcus faecium. В отличие от Линекса в состав Бифиформа, производимого датской фармацевтической компанией «Ферросан Интернейшнл А/С», помимо бифидобактерий Bifidobacterium longum (штамм АТСС 15707) и энтерококков Enterococcus faecium (штамм SF68) от микробиологической лаборатории «Кристиан Хансен» (Дания) включена особая питательная среда для их питания, роста и размножения. Кроме того, Бифиформ не содержит лактозу, вследствие чего показан пациентам с ее непереносимостью.
Входящие в состав препаратов бактерии предназначены для регулирования физиологического равновесия кишечной микрофлоры путем продукции молочной кислоты, в меньшей степени уксусной и пропионовой кислот. Создаваемая в результате кислая среда является неблагоприятной для развития патогенных и условно-патогенных микроорганизмов. Полезные бактерии лиофильно высушены и расфасованы в специальные защитные капсулы, что обеспечивает их надежную защиту от разрушения под воздействием желудочного сока и позволяет донести в неизмененном виде непосредственно до кишечника и там высвободить.
Однако, помимо благоприятных эффектов препаратам Линекс и Бифиформ характерен ряд существенных недостатков, ограничивающих возможности их широкого применения в клинической практике. Прежде всего, нельзя утверждать, что входящие в их состав бактерии близки представителям собственной индигенной микрофлоры различных отделов кишечника и способны в нем размножаться. Одной из основных причин этого является их недостаточная биосовместимость с резидентными бактериями кишечника. Индивидуальная биосовместимость микроорганизмов, вносимых в составе указанных препаратов, и их приживаемость не гарантированы. Искусственно введенные в составе Линекса и Бифиформа микроорганизмы, как правило, стойко не приживаются в организме и после прекращения их приема быстро элиминируются из кишечника и замещаются случайной микрофлорой. Соответственно, низка вероятность выполнения указанными бактериями, внесенными в макроорганизм извне, своей основной функции (заместительной) и тем более за короткий промежуток времени.
Кроме того, механизм действия входящих в состав указанных препаратов микроорганизмов носит транзиторный характер, они не колонизируют в кишечнике, в связи с чем их благоприятный эффект продолжается практически только в период курсового приема. Поэтому, как правило, назначают их достаточно длительно (не менее 3-4 недель) и рекомендуют прием по 1-2 капсулы не реже 3 раз в день. А так как стоимость указанных препаратов достаточно велика (300-400 рублей за 30 капсул), то данное обстоятельство, связанное с необходимостью их длительного приема, также существенно ограничивает доступность Линекса и Бифиформа для широких слоев населения.
Линекс и Бифиформ рекомендуют для лечения и профилактики дисбиотических нарушений различной этиологии. При этом используют их в схемах коррекции подобных нарушений кишечника лишь на втором этапе с целью заместительной терапии. В составы указанных препаратов включены штаммы бактерий с достаточно высоким уровнем антибиотикорезистентности и зачастую рекомендуют их применение одновременно с антибиотиками. Однако, опыт использования указанных средств в клинической практике с широким спектром антибактериальных препаратов при рекомендуемых схемах их назначения показал, что большая часть бактерий при таком сочетанном назначении гибнет, а активность попавших в кишечник в жизнеспособном состоянии чрезвычайно низка.
Известно также, что одним из перспективных направлений профилактики нарушений состава микробиоты кишечника является использование препаратов, которые в своем составе содержат не живые микроорганизмы (например, Бифидобактерин, Лактобактерии, Споробактерин, Ламинолакт, Линекс, Бифиформ и др.), а метаболиты пробиотических штаммов микроорганизмов [5,6].
В клинической практике для восстановления и поддержания оптимальных микроэкологических параметров в кишечнике из числа подобных средств достаточно широкое применение находит пробиотический комплекс Бактистатин [7], в состав которого включены (мас. %): стерилизованная культуральная жидкость (СКЖ), полученная при культивировании бактерий вида Bacillus subtilis и содержащая их метаболиты (1,0), гидролизат соевой муки (20,0), природный минерал цеолит (78,0) и стеарат кальция (СК) или аэросил (1,0). Указанный пробиотический комплекс по составу, механизму воздействия на организм и достигаемому благоприятному эффекту наиболее близок к заявляемой синбиотической композиции и принят в качестве средства-прототипа.
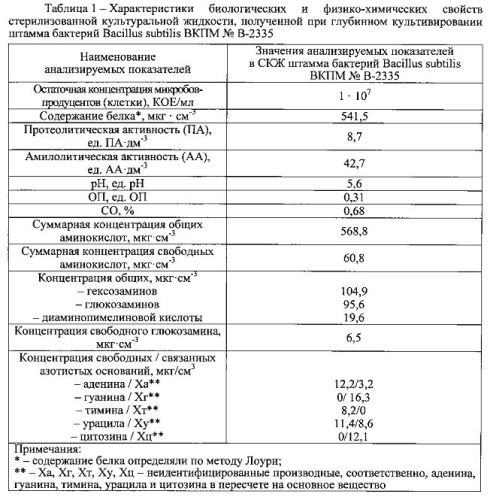
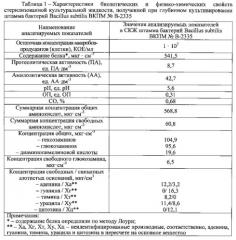
Основу средства-прототипа составляют иммобилизованные на цеолите БАВ, синтезируемые бактериями Bacillus subtilis при глубинном выращивании, которые и обусловливают благоприятный эффект данного пробиотического комплекса. Перечень их достаточно обширен и включает разнородные по химическому составу и биологическим свойствам вещества: протеолитические и амилолитические ферменты, аминокислоты, полисахариды (гексозамин, глюкозамин), витамины группы В (пиридоксина гидрохлорид, рибофлавин), азотистые основания и их производные (аденин, гуанин, тимин, урацил, цитозин) [8-10]. Перечисленные БАВ, синтезируемые бактериями Bacillus subtilis, оказывают положительное влияние на макроорганизм в целом. Среди них особую значимость имеют природные антибактериальные субстанции (бактериоцины, лизоцим и др.), которые селективно подавляют рост и размножение патогенных и условно-патогенных микроорганизмов в кишечнике, не влияя при этом на симбионтную микрофлору.
Цеолит, входящий в состав средства-прототипа, выполняет функции адсорбента метаболитов бацилл Bacillus subtilis и их носителя. Основное его предназначение заключается в иммобилизации метаболитов, синтезируемых бациллами при культивировании и сконцентрированных в культуральной жидкости, и доставке их в качестве носителя в кишечник.
Важная составная часть средства-прототипа - ГСМ - является, с одной стороны, частью защитной среды метаболитов, во многом отвечающей за прочность их сорбции на поверхности цеолита, а с другой стороны, - источником аминокислот, обеспечивающим питательные потребности нормальной микрофлоры кишечника и клеток макроорганизма. Основной компонент ГСМ - соевый олигосахарид (SOE) - обладает бифидогенными свойствами [11].
СК или аэросил включены в состав средства-прототипа в качестве технологической добавки.
Основным предназначением средства-прототипа является восстановление и поддержание оптимальных микроэкологических параметров в кишечнике путем введения в организм веществ, сдерживающих развитие патогенов и стимулирующих развитие полезных микроорганизмов. Так, практически доказана возможность применения средства-прототипа при коррекции нарушений состояния микробиоты и лечения ряда заболеваний ЖКТ путем нормализации микроэкологических условий в кишечнике. Кроме улучшения соматических симптомов у больных на фоне проведения терапии снижался уровень депрессии и невротизации [12].
Вместе с тем, наряду с указанными благоприятными эффектами для средства-прототипа характерен ряд недостатков:
- ограниченная биологическая активность, выражающаяся в недостаточных уровнях специфической антагонистической активности в отношении ряда патогенов и иммунобиологической реактивности организма, что связано с использованием в его составе только одного вида микроорганизмов (Bacillus subtilis);
- невозможность концентрирования культуральной жидкости, полученной на соевой среде с использованием ГСМ, ввиду ее высокой вязкости;
- использование в технологическом процессе получения средства-прототипа в качестве питательной среды нативной соевой муки не позволяет в полной мере использовать питательные свойства исходного сырья. Требуется дополнительное проведение химического или ферментативного гидролиза соевой муки, что существенно усложняет технологию получения средства-прототипа;
- использование для обеспечения питательных потребностей нормальной микрофлоры кишечника и клеток макроорганизма труднодоступного и неполноценного по аминокислотному составу дорогостоящего пищевого продукта - ГСМ, содержащего в своем составе только две незаменимые аминокислоты (лизин и метионин), причем в весьма незначительных количествах (0,2% и 0,096%, соответственно).
Отмеченные недостатки существенно ограничивают возможности широкого использования средства-прототипа при коррекции дисбиотических нарушений микробиоценоза кишечника.
Целью изобретения явилось повышение эффективности коррекции дисбиотических нарушений микробиоценоза кишечника за счет использования поликомпонентной синбиотической композиции на основе сбалансированного комплекса биологически активных веществ, обеспечивающих благоприятное влияние на индигенную составляющую микрофлоры кишечника, достаточные уровни специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов и неспецифической резистентности организма, не содержащей опасные для здоровья вещества, нетоксичной, не обладающей сенсибилизирующим действием, способностью к кумуляции, токсическим влиянием на репродуктивную функцию, мутагенным эффектом и отдаленными негативными последствиями, стабильной при хранении и доступной для широких слоев населения.
Достижение поставленной цели возможно за счет создания поликомпонентной синбиотической композиции, качественный и количественный состав которой позволит нормализовать микробиоценоз кишечника как за счет обеспечения специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов и поддержания его естественной индигенной составляющей, так и путем повышения неспецифической резистентности организма
При формировании качественного и количественного состава заявляемой синбиотической композиции, предназначенной для коррекции дисбиотических нарушений микробиоценоза кишечника, исходили из того, что основные ее компоненты должны:
- оказывать эффективное благоприятное влияние на индигенную составляющую микрофлоры кишечника;
- обеспечивать достаточный уровень специфической антагонистической активности в отношении широкого спектра условно-патогенных микроорганизмов, с которыми, как правило, ассоциированы д исбиотические нарушения биотопа;
- оказывать влияние на факторы неспецифической резистентности организма и стимулировать функциональную активность иммунокомпетентных клеток.
Для этого в состав заявляемой синбиотической композиции включены: пробиотическая составляющая, представляющая собой рациональную комбинацию живых пробиотических микроорганизмов и метаболитов пробиотических микроорганизмов, пребиотическая составляющая с иммуномодулирующей активностью, адсорбент-носитель и вспомогательная технологическая добавка.
Важной отличительной особенностью заявляемой синбиотической композиции является то, что входящие в ее состав компоненты подобраны с учетом их индивидуальных свойств и комплексного воздействия. Так, в ее составе пробиотическая составляющая представлена рациональной комбинацией штаммов пробиотических бактерий, имеющих большое значение для организма, прежде всего, за счет синтезируемых ими БАВ. В отличие от средства-прототипа в обеспечении комплексного благоприятного воздействия на состояние кишечного микробиоценоза, специфического антагонистического эффекта по отношению к широкому спектру патогенов и стимулирования функциональной активности иммунокомпетентных клеток участвуют БАВ не одного вида микроорганизмов (Bacillus subtilis), а дополнительно еще трех, а именно, Enterococcus faecium, Lactobacillus delbrueckii и Lactobacillus fermentum.
Используемые пробиотические штаммы бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 представлены в составе заявляемой синбиотической композиции своими метаболитами, синтезированными в процессе их культивирования. При этом штамм бактерий Bacillus subtilis ВКПМ № В-2335 введен в виде стерилизованной высушенной культуральной жидкости, так как именно в ней сконцентрирован уникальный набор БАВ, синтезируемых бациллами в процессе их выращивания. Из числа БАВ ценность представляют природные субстанции, которые вносят весомый вклад в способность заявляемой синбиотической композиции оказывать влияние на факторы неспецифической резистентности организма и стимулировать функциональную активность иммунокомпетентных клеток.
Способность бацилл Bacillus subtilis повышать фагоцитарную активность макрофагов и тем самым проявлять иммуномодулирующий эффект связана также с синтезом при их глубинном выращивании азотистых оснований и их производных (аденин, гуанин, тимин, урацил, цитозин), которые представляют отдельную группу иммуномодулирующих веществ и содержатся в СКЖ в значительных количествах (таблица 1). Для заявляемой синбиотической композиции это имеет большое значение, так как указанные БАВ способствуют восстановлению функциональной активности единой макрофагальной системы организма, угнетенной вследствие воздействия патогенов, и существенному повышению эффективности неспецифической защиты.
Введение в состав заявляемой синбиотической композиции стерилизованной высушенной культуральной жидкости, содержащей метаболиты пробиотического штамма энтерококков Enterococcus faecium L-3 (энтероцины А и В) [13] также способствует повышению эффективности коррекции нарушений микробиоценоза ЖКТ. Указанные бактериоцины обеспечивают способность заявляемой синбиотической композиции селективно подавлять рост и размножение условно-патогенных микроорганизмов, не оказывая ингибирующего действия на лактобациллы. Кроме того, в составе заявляемой синбиотической композиции метаболиты Enterococcus faecium L-3 представляют бифидогенный фактор и способны оказывать благоприятное воздействие на бифидобактерии собственной индигенной микрофлоры кишечника, стимулируя их рост и размножение.
Лиофилизированные пробиотические штаммы бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 (Россия) активно синтезируют метаболиты с протеиновым компонентом - бактериоцины, а именно, лактоцин В [14,15]. Данное и обусловливает их существенный вклад в обеспечение специфической антагонистической активности заявляемой синбиотической композиции к широкому спектру условно-патогенных микроорганизмов.
Пробиотические штаммы бактерий подобраны таким образом, что биосовместимы и не проявляют взаимного антагонистического воздействия. Комбинированное же введение живых пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06 вместе с метаболитами пробиотических штаммов бактерий Bacillus subtilis ВКПМ № В-2335 и Enterococcus faecium L-3 приводит к появлению дополнительных комплексных эффектов, что обусловливает специфическую антагонистическую активность заявляемой синбиотической композиции к широкому спектру условно-патогенных микроорганизмов. При этом также значимо, что метаболиты Bacillus subtilis ВКПМ № В-2335 как лактогенный фактор стимулируют рост, размножение и активность лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, входящих в состав заявляемой синбиотической композиции. Данное способствует тому, что значительное количество попавших в кишечник жизнеспособных и активных лактобацилл оказывает там благоприятное воздействие. Кроме того, метаболиты Bacillus subtilis ВКПМ № В-2335 стимулируют рост и размножение лактобацилл Lactobacillus plantarum 8R-A3, близких естественной составляющей индигенной микрофлоры кишечника.
Адсорбент в составе заявляемой синбиотической композиции предназначен, прежде всего, для иммобилизации метаболитов, продуцируемых бациллами Bacillus subtilis в процессе их культивирования и сконцентрированных в СКЖ. Целесообразность использования цеолита в качестве компонента заявляемой синбиотической композиции определена уникальным химическим строением его молекул, что оптимально способствует выполнению функций адсорбента и носителя метаболитов Bacillus subtilis. Цеолит, не всасываясь в ЖКТ и проходя транзитом, выполняет транспортировку иммобилизованных на нем метаболитов по всему протяжению кишечника. Постепенное высвобождение метаболитов позволяет достаточно длительный промежуток времени (до 1 суток) поддерживать необходимый уровень активности заявляемой синбиотической композиции. Частицы цеолита имеют размеры не более 500 мкм и овальную форму кристалла, что исключает образование микротравм в кишечнике и полностью безопасно [16-18].
Существенное отличие заявляемой синбиотической композиции от средства-прототипа состоит и в том, что в качестве пребиотической составляющей она содержит овсяные хлопья, которые не только выполняют свое основное предназначение, заключающееся в обеспечении питательных потребностей кишечной нормофлоры (в том числе бифидо- и лактобактерий), а также клеток макроорганизма, но и проявляют иммуномодулирующую активность. Овсяные хлопья оптимально обеспечивают восстановление микрофлоры кишечника, так как доля пищевой клетчатки в них составляет 11%, которая на 35% представлена очень ценными для человеческого организма β-глюканами. При коррекции дисбиотических состояний кишечника несомненна роль средств, отличающихся высоким содержанием пищевых волокон и позволяющих оптимизировать условия вегетирования симбионтов. Пищевые волокна (совокупность различных водорастворимых полисахаридов) не перевариваются (не расщепляются на моносахариды) эндогенными секретами ЖКТ человека и в неизмененном виде достигают толстой кишки, где метаболизируются анаэробной симбионтной микрофлорой до короткоцепочечных жирных кислот. Коротко-цепочечные жирные кислоты (ацетат, пропионат, бутират, валерат), в свою очередь, являются основным энергетическим субстратом для эпителиоцитов слизистой оболочки толстой кишки [19], стимулирующим пролиферацию, дифференциацию клеток и образование муциновой слизи. Помимо этого, пищевые волокна, фиксируя на своей обширной поверхности симбионтные микроорганизмы и вносимые в составе заявляемой синбиотической композиции штаммы лактобацилл Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06, способствуют значительному увеличению их содержания в единице внутрикишечного объема и возрастанию суммарной метаболической активности индигенной микрофлоры кишечника.
Иммуномодулирующее воздействие β-глюкана, поступающего в организм в составе используемого пребиотика, обусловлено тем, что он транспортируется через эпителиальный барьер клеток кишечного тракта в лимфу, в которой взаимодействует с ключевыми клетками иммунной системы (макрофагами) путем прикрепления к специфическим рецепторам, находящимся на их клеточных мембранах. Воздействуя на макрофаги, β-глюкан усиливает их фагоцитарную активность (подвижность), а также способность находить и устранять чужеродные, в том числе условно-патогенные микроорганизмы. Кроме того, β-глюкан стимулирует и такие клетки как нейтрофилы NK (натуральные клетки-киллеры) и LAK (лимфокиноактивированные клетки-киллеры), за счет чего дополнительно повышает антагонистическую активность заявляемой синбиотической композиции.
Для улучшения технологичности процесса получения заявляемой синбиотической композиции в качестве вспомогательной технологической добавки используют СК или аэросил.
Действие заявляемой синбиотической композиции, выполненной в капсулированной форме, начинается уже в желудке, где происходит растворение защитной капсулы под воздействием желудочного сока. Благодаря тому, что живые пробиотические культуры, входящие в состав заявляемой синбиотической композиции, устойчивы к действию факторов, которые могут вызвать их деградацию в ходе транзита по ЖКТ (в том числе кислая и сменяющая ее щелочная среда, присутствие желчи и т.п.) [14,15], значительное их количество попадает в кишечник, где и проявляет свое благоприятное воздействие.
Как видно, ингредиенты подобраны таким образом, что заявляемая синбиотическая композиция представляет собой сбалансированный комплекс, а количество их в одной капсуле составляет, масс. %:
| лиофилизат пробиотического штамма бактерий | |
| Lactobacillus delbrueckii TS1-06 | 2,5 (107 клеток/капс.) |
| лиофилизат пробиотического штамма бактерий | |
| Lactobacillus fermentum TS3-06 | 2,5 (107 клеток/капс.) |
| стерилизованная высушенная культуральная жидкость, | |
| содержащая метаболиты пробиотического штамма | |
| бактерий Bacillus subtilis ВКПМ № В-2335 | 1,9 |
| стерилизованная высушенная культуральная жидкость, | |
| содержащая метаболиты пробиотического штамма | |
| бактерий Enterococcus faecium L-3 | 8,4 |
| цеолит | 64,3 |
| овсяные хлопья | 20,1 |
| стеарат кальция или аэросил | 0,3 |
Возможность достижения цели изобретения подтверждается результатами проведенных исследований, представленными в следующих примерах.
Пример 1. Получение заявляемой синбиотической композиции в виде капсулированной твердой дозированной формы для перорального введения.
Заявляемая синбиотическая композиция выполнена в виде капсулированной твердой дозированной формы для перорального введения, что не только существенно упрощает ее использование, но и обеспечивает надежную защиту входящих в ее состав компонентов от воздействия факторов, которые могут вызвать их деградацию.
Получают заявляемую синбиотическую композицию вначале в виде порошка, для чего выполняют следующий алгоритм действий. Выращивают микроорганизмы Bacillus subtilis ВКПМ № В-2335 методом глубинного культивирования в биологическом реакторе (ферментере). После окончания процесса культивирования СКЖ с микроорганизмами подвергают центрифугированию для отделения и последующего удаления живых клеток микроорганизмов, а затем стерилизуют. Перед стерилизацией СКЖ смешивают с адсорбентом - цеолитом, предварительно измельченным до частиц размером не более 500 мкм. Полученную смесь подвергают лиофилизации, при которой происходит иммобилизация биологически активных метаболитов продуцента на частицах цеолита. Далее в массу добавляют смесь лиофилизатов пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus delbrueckii TS 1-06, стерилизованной высушенной культуральной жидкости с метаболитами пробиотического штамма бактерий Enterococcus faecium L-3, овсяных хлопьев, а также СК или аэросила и помещают в резервуар установки для гранулирования с целью смешивания и досушивания. Затем массу просеивают на вибросите и передают на стадию капсулирования. Наполнение твердых желатиновых капсул осуществляют на автомате для наполнения капсул.
Лиофилизаты пробиотических штаммов бактерий Lactobacillus delbrueckii TS1-06 и Lactobacillus delbrueckii TS1-06 вводят в виде сухого продукта «Авена-Л» (ООО «Авена», Санкт-Петербург) [20].
Стерилизованную высушенную культуральную жидкость с метаболитами пробиотического штамма бактерий Enterococcus faecium L-3 вводят в виде сухого продукта «Авена» (ООО «Авена», Санкт-Петербург) [21].
В состав заявляемой синбиотической композиции входят овсяные хлопья, включающие пищевые волокна (11%), которые на 35% представлены β-глюканами [22].
В качестве адсорбента используют цеолит природный - натуральный микропористый силикатный минерал Холинского месторождения (Бурятия) (ООО «КРАФТ», Санкт-Петербург) [23,24].
В качестве вспомогательной добавки используют СК [25] или аэросил [26].
Как видно, процесс получения заявляемой синбиотической композиции в капсулированной твердой дозированной форме для перорального введения отличается простотой, а используемые при этом ингредиенты выпускаются в промышленных условиях, доступны и недороги.
Пример 2. Оценка безопасности заявляемой синбиотической композиции.
Безопасность заявляемой синбиотической композиции оценивали по результатам санитарно-химического анализа, микробиологических исследований, а также путем определения ряда токсикологических и других характеристик: острой токсичности, хронической токсичности и способности к кумуляции, возможного местно-раздражающего действия на слизистую пищевода, раздражающего действия на кожу и глаза, ингаляционного воздействия пылью, сенсибилизирующего действия, возможных отдаленных последствий.
Санитарно-химический анализ.
Подготовку проб проводили по ГОСТ 26929-94 «Сырье и продукты пищевые. Подготовка проб. Минерализация для определения токсичных элементов. Межгосударственный стандарт». Свинец и кадмий определяли по ГОСТ 30178-96 «Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов. Межгосударственный стандарт». Мышьяк определяли согласно ГОСТ 26930-86 «Сырье и продукты пищевые. Метод определения мышьяка». Ртуть определяли согласно «Методическим указаниям по обнаружению и определению содержания общей ртути в пищевых продуктах методом беспламенной атомной абсорбции» (№5178-90).
Содержание хлорорганических пестицидов (токсикантов) определяли согласно «Методическим указаниям по определению остаточных количеств хлорорганических пестицидов» (№1766-77) и официальным методам анализа АО AC («Official methods of analysis of the AOAC», 1984, 14th ed., Chapter 29, P. 537-538).
Исследования проводили с использованием весов лабораторных ВЛР-500, газожидкостного хроматографа «Карло Эрба» (модель HRGC 5700), обменных клеток итальянской фирмы «Texnoplast».
Результаты проведенных измерений представлены в таблицах 2 и 3 и свидетельствуют, что в заявляемой синбиотической композиции содержание токсикантов (хлорорганические пестициды ГХЦТ и ДДТ) и опасных для здоровья веществ (свинец, кадмий, ртуть, мышьяк) не превышает допустимые уровни, установленные Техническим регламентом Таможенного союза TP ТС 021/2011 «О безопасности пищевой продукции» (приложение 3, раздел 10) [27]. Такие же пестициды как алдрин и гептахлор в заявляемой синбиотической композиции не обнаружены.
Микробиологические исследования.
Микробиологические исследования проводили в соответствии с требованиями методических указаний МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов», МУК 2.3.2.721-98 «Определение безопасности и эффективности биологически активных добавок к пище», ГОСТ Р 52814-2007 «Продукты пищевые. Метод выявления бактерий рода Salmonella», ГОСТ Р 52816-2007 «Продукты пищевые. Метод выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)», ГОСТ 10444.12-88 «Продукты пищевые. Метод определения дрожжей и плесневых грибов», ГОСТ 30726-2001 «Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli».
Результаты оценки микробиологических показателей безопасности представлены в таблице 4 и свидетельствуют, что по микробиологическим показателям безопасности заявляемая синбиотическая композиция соответствует требованиям, установленным Техническим регламентом Таможенного союза TP ТС 021/2011 «О безопасности пищевой продукции» (приложения 1 и 2, раздел 1.9).
Исследование острой токсичности.
Заявляемую синбиотическую композицию вводили здоровым беспородным белым крысам обоих полов массой тела 130-150 г и 180-200 г внутрижелудочно в виде водных суспензий через металлический атравматичный зонд, медленно погружая его до желудка. Исследования проводили с использованием пробит-анализа по Литчфилду-Уилкоксону в модификации З. Рота [28]. В ходе эксперимента были сформированы две группы по 10 животных в каждой: опытная (вводили заявляемую синбиотическую композицию два раза в день в максимально переносимой дозе, составляющей 15 г/кг) и контрольная (вводили эквивалентные объемы дистиллированной воды). Животные распределялись по группам случайным образом методом рандомизации. В качестве критериев приемлемости рандомизации считали отсутствие внешних признаков заболеваний и гомогенность групп по массе тела (±10%).
Наблюдение за подопытными животными осуществляли в течение 14 сут с регистрацией показателей: летальность, время гибели животных, симптоматика отравления, результаты ежедневного наблюдения общего состояния, поведения и взвешивания, результаты контроля потребления корма и воды, результаты вскрытия и макроскопического описания погибших и выживших животных в конце исследования (эвтаназия осуществлялась передозировкой эфира), результаты определения массовых коэффициентов (МК) внутренних органов.
Введение заявляемой синбиотической композиции в максимально переносимых дозах не вызывало гибели подопытных животных. Не отмечали и какие-либо другие признаки негативного действия заявляемой синбиотической композиции. В частности, не отмечали какие-либо диспепсические явления. Во все дни наблюдения по общему состоянию и поведению животные опытной и контрольной групп не отличались.
Результаты изучения динамики изменения массы тела подопытных животных, получавших заявляемую синбиотическую композицию, в течение 14 сут наблюдения за ними позволили установить, что динамика массы тела животных опытной и контрольной групп практически не различалась (таблица 5).
Анализ величин МК органов белых крыс позволил установить, что острое введение им заявляемой синбиотической композиции в максимально переносимой дозе не вызывало какие-либо достоверные отличия по сравнению с контрольной группой животных, получавших дистиллированную воду (таблица 6).
Таким образом, результаты токсикометрии, данные наблюдений за подопытными животными на протяжении 14 сут после острого введения позволяют отнести заявляемую синбиотическую композицию к нетоксичным (относительно безвредным по С.Д. Заугольникову) и малоопасным (IV класс опасности по ГОСТ 12.1.007) веществам.
Исследование хронической токсичности и способности к кумуляции.
Исследования хронической токсичности проводили на белых нелинейных крысах-самцах массой 180-200 г при введении заявляемой синбиотической композиции внутрижелудочно через атравматичный металлический зонд в течение 30 дней при суточной дозе 1,5 г/кг. Животные контрольной группы получали дистиллированную воду в аналогичном объеме.
Измерение основных физиологических показателей осуществляли через 30 дней хронического ежедневного введения заявляемой синбиотической композиции.
В течение всего периода наблюдения летальных эффектов не наблюдали. Общее состояние и поведение подопытных животных оставалось нормальным и не отличалось от контрольной группы в течение всего эксперимента.
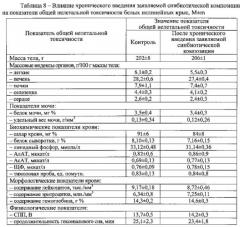
Результаты изучения интегральных показателей общей токсичности, представленные в таблицах 7 и 8, свидетельствуют, что ни по одному из анализируемых показателей не было выявлено статистически значимых различий с контрольной группой животных, получавших дистиллированную воду (р>0,05 при 95% уровне вероятности) или патологических отклонений за пределы варьирования физиологической нормы.
Вскрытие крыс, умерщвленных на следующий день после последнего введения заявляемой синбиотической композиции, показало, что размеры, форма и окраска их внутренних органов не имели макроскопических изменений по сравнению с контрольной группой. Слизистая оболочка желудка и тонкого кишечника были блестящими, бледно-розовыми, бе