Пантенола докозагексаеноат и его применение для лечения и предупреждения сердечно-сосудистых заболеваний
Иллюстрации
Показать всеИзобретение относится к эфиру докозагексаеновой кислоты с пантенолом, представленному формулой 1, или его энантиомеру, представленному формулой А. Эфир докозагексаеновой кислоты с пантенолом предназначен для применения в качестве лекарственного средства или в качестве фармацевтической композиции для профилактики и/или лечения сердечно-сосудистых заболеваний. Эфир докозагексаеновой кислоты с пантенолом получают за счет осуществления a) избирательной защиты двух функциональных ОН-групп пантенола или D-пантенола с помощью О-защитных групп, b) этерификации незащищенных функциональных ОН-групп DHA в присутствии 1-[(1Н-имидазол-1-ил)карбонил]-1Н-имидазола и N,N-диметилпиридин-4-амина и c) депротекции двух защищенных функциональных ОН-групп, причем О-защитная группа представляет собой триметилхлорсилан. Технический результат - моноэфир докозагексаеновой кислоты с пантенолом для лечения и предупреждения сердечно-сосудистых заболеваний. 3 н. и 5 з.п. ф-лы, 1 ил., 2 пр.
Реферат
Настоящее изобретение относится к моноэфиру докозагексаеновой кислоты (DHA) с пантенолом, обладающему особыми свойствами, позволяющими использовать его в качестве лекарства для лечения и предупреждения сердечно-сосудистых заболеваний.
Полиненасыщенные жирные кислоты из группы Omega-3, в частности докозагексаеновая кислота, известны благодаря их потенциальному применению в лечении определенных сердечно-сосудистых заболеваний и в модуляции соответствующих факторов риска. В частности, они известны в качестве лекарственного средства для лечения гиперлипидемии, гиперхолестеринемии и гипертензии. Клинические испытания, проводимые при использовании композиций, содержащих высокие концентрации этилового эфира DHA, у пациентов, перенесших инфаркт миокарда, показали эффективность этих препаратов за счет сокращения смертности, в частности случаев внезапной смерти. Эти результаты отчасти можно объяснить стабилизирующим влиянием на клеточные мембраны кардиомиоцитов желудочков, что предотвращает появление злокачественной аритмии в присутствии ишемических миоцитов у пациентов, перенесших инфаркт, или в экспериментальных моделях, которые воспроизводят подобные состояния.
Более того, из патентной заявки WO 2004/047835 известно, что этиловый эфир DHA может быть использован для предупреждения развития фибрилляции предсердий.
Кроме того, WO 2007/147899 описывает получение и использование определенных эфиров DHA, в частности фармацевтическое действие одного из эфиров DHA - пиридин-3-илметилдокозагексаеноата (эфир DHA с никотиновым спиртом).
Однако авторы настоящего изобретения неожиданно обнаружили, что моноэфир DHA с пантенолом обладает особенно благоприятными свойствами в отношении лечения сердечно-сосудистых заболеваний.
Пантенол является спиртовым аналогом пантотеновой кислоты, более известной в качестве витамина B5. В организме пантенол превращается в пантотеновую кислоту, которая впоследствии становится основной составляющей соединения "коэнзим А," которое представляет большой интерес в связи с клеточным метаболизмом. Действительно, это соединение принимает участие в метаболизме липидов, углеводов и белков. Пантенол также участвует в образовании ацетилхолина и стероидов надпочечниками. Также он вносит вклад в детоксикацию чужеродных веществ и в устойчивость к инфекциям.
Авторы настоящего изобретения неожиданно обнаружили, что введение свиньям пантенола докозагексаеноата, имеющего следующую формулу:
приводит к значительному увеличению продолжительности рефракторного периода предсердий (см. Пример 2 настоящего описания) по сравнению с другими эфирами DHA и, в частности, по сравнению с диэфирами DHA с пантенолом.
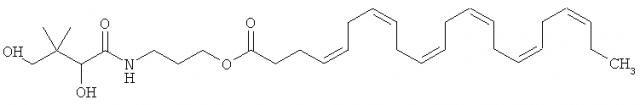
Таким образом, настоящее изобретение относится к эфиру докозагексаеновой кислоты с пантенолом или пантенола докозагексаеноату следующей формулы:
или фармацевтически приемлемой соли указанного соединения, его энантиомеру или диастереомеру или их смеси, включая рацемическую смесь.
Другими словами, настоящее изобретение отноится к (2,4-дигидрокси-3,3-диметилбутанамидо)пропилдокоза-4,7,10,13,16,19-гексаеноату или фармацевтически приемлемой соли, энантиомеру или диастереомеру этого соединения или их смеси, включая рацемическую смесь.
В контексте настоящего изобретения термин "энантиомеры" относится к оптическим изомерам, которые имеют одинаковые молекулярные формулы, но различаются пространственной конфигурацией; они являются зеркальным отображением друг друга и не могут быть совмещены в пространстве. Термин "диастереомеры" относится к оптическим изомерам, которые не являются зеркальным отображением друг друга. В контексте настоящего изобретения "рацемическая смесь" является эквимолярной смесью левовращающего и правовращающего энантиомеров хиральной молекулы.
В контексте настоящего изобретения термин "фармацевтически приемлемый" относится к понятию, обозначающему пригодность для получения фармацевтической композиции, которая, как правило, является безопасной, нетоксичной и благоприятной в биологическом или другом отношении, а также является приемлемой для применения в ветеринарии и в лекарственных препаратах для человека.
Термин "фармацевтически приемлемые соли" (соединения) относится к солям, которые являются фармацевтически приемлемыми согласно определению, данному выше, и обладают необходимой фармакологической активностью исходного соединения. Такие соли включают:
(1) Кислотно-аддитивные соли, образованные с минеральными кислотами, такими как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образованные с органическими кислотами, такими как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфокислота, молочная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, метансульфокислота, муконовая кислота, 2-нафталинсульфокислота, пропионовая кислота, салициловая кислота, янтарная кислота, дибензоил-L-винная кислота, винная кислота, п-толуолсульфокислота, триметилуксусная кислота, трифторуксусная кислота и т.п.; или
(2) Соли, которые образуются в результате замещения протона кислоты исходного соединения на ион металла, например на ион щелочного металла, ион щелочно-земельного металла или ион алюминия; или в результате координационного присоединения органического или неорганического основания. Приемлемые органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и т.п. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия. Предпочтительными фармацевтически приемлемыми солями являются соли, образованные из соляной кислоты, трифторуксусной кислоты, дибензоил-L-винной кислоты и фосфорной кислоты.
Необходимо понимать, что все упоминания фармацевтически приемлемых солей включают формы с добавлением растворителя (сольваты) или кристаллические формы (полиморфы), как определено в настоящем изобретении, а также кислотно-аддитивные соли.
В одном из вариантов осуществления эфир настоящего изобретения представляет собой докозагексаеноат пантенола или "DHA эфир D-пантенола" следующей формулы А:
он или фармацевтически приемлемая соль указанного соединения, его энантиомер или диастереомер или их смесь, включая рацемическую смесь.
Способ синтеза данного соединения предложен в примере 1 настоящего изобретения.
Настоящее изобретение также относится к способу получения эфира пантенола настоящего изобретения посредством этерификации докозагексаеновой кислоты с пантенолом, например с D-пантенолом, включающему следующие стадии:
a) Избирательная защита двух функциональных OH-групп пантенола, в частности D-пантенола, с помощью O-защитных групп, предпочтительно триметилхлорсилана,
b) Этерификация незащищенной функциональной OH-группы посредством реакции с DHA в присутствии 1-[(1H-имидазол-1-ил)карбонил]-1H-имидазола и N,N-диметилпиридин-4-амина,
c) Депротекция двух защищенных функциональных OH-групп.
Стадия депротекции с) широко известна специалистам данной области техники и может быть проведена, например, в метаноле и п-толуолсульфокислоте в случае, когда в качестве O-защитной группы используется триметилхлорсилан.
В контексте настоящего изобретения термин "O-защитная группа" относится к любому заместителю, который защищает гидроксильную группу от нежелательных реакций во время получения моноэфира, такому как O-защитные группы, описанные в Greene, "Защитные группы в органическом синтезе" (John Wiley & Sons, New York (1981)) и Harrison et al. "Compendium of Synthetic Organic Methods", Vols. 1 to 8 (J. Wiley & Sons, 1971 to 1996).
Настоящее изобретение также относится к фармацевтической композиции, содержащей DHA эфир пантенола настоящего изобретения, например DHA эфир D-пантенола формулы А настоящего изобретения, и по крайней мере один фармацевтически приемлемый эксципиент.
Фармацевтические композиции настоящего изобретения могут быть приготовлены для введения млекопитающим, включая человека. Дозировки варьируют в зависимости от схемы лечения и конкретного заболевания. Эти композиции готовят таким образом, чтобы они вводились пероральным, подъязычным, подкожным, внутримышечным, внутривенным, трансдермальным или ректальным путем. В этих случаях активный ингредиент может быть введен животным и человеку в виде единичных дозированных форм, в смеси с традиционными фармацевтическими эксципиентами. Подходящие единичные дозированные формы для введения включают пероральные лекарственные, такие как таблетки, желатиновые капсулы, порошки, гранулы и растворы или суспензии для перорального приема, формы для подъязычного и буккального введения, лекарственные формы для подкожного, местного, внутримышечного, внутривенного, интраназального или внутриглазного введения, а также лекарственные формы для ректального введения.
В случае когда твердую композицию получают в форме таблеток, основной активный ингредиент смешивают с фармацевтическим носителем, таким как желатин, крахмал, лактоза, стеарат магния, тальк, гуммиарабик, кремнезем или их аналоги. Таблетки могут быть покрыты сахарозой или другими подходящими материалами или они могут быть обработаны таким образом, чтобы получить таблетки с замедленным или пролонгированным действием, а также таблетки с непрерывным высвобождением заданного количества активного ингредиента.
Препараты в форме желатиновых капсул получают при смешивании активного ингредиента с растворителем, после чего полученную смесь выливают в мягкие или твердые желатиновые капсулы.
Препарат в форме сиропа или эликсира может содержать смесь активного ингредиента с подсластителем, антисептиком, а также ароматизатором и подходящим красителем.
Порошки или гранулы, которые могут быть диспергированы в воде, могут содержать смесь активного ингредиента с диспергирующими веществами, увлажнителями или суспендирующими веществами, а также регуляторами вкуса или подсластителями.
Суппозитории, приготовленные с помощью связующего вещества, например такого, как какао-масло или полиэтиленгликоль, которое плавится при ректальной температуре, используются для ректального введения.
Водные суспензии, изотонические солевые растворы или стерильные растворы для инъекций, содержащие фармакологически совместимые диспергирующие вещества и/или увлажнители, могут быть использованы для парентерального (внутривенного, внутримышечного и т.д.), интраназального или внутриглазного введения.
Активный ингредиент может быть также приготовлен в форме микрокапсул, возможно, с одним или более дополнительными веществами.
Предпочтительно, фармацевтическая композиция настоящего изобретения предназначена для перорального или внутривенного введения, предпочтительно для внутривенного введения в случае постинфарктного лечения.
В этом случае фармацевтическая композиция предпочтительно содержит полиоксиэтиленовую жирную кислоту, такую как Solutol HS 15, и по крайней мере одно производное фосфолипида, такое как приведено в заявке FR0955612.
Фармацевтическая композиция настоящего изобретения может включать другие активные ингредиенты, которые позволяют получить дополнительный, а возможно, и синергитический эффект.
Настоящее изобретение также относится к эфирам докозагексаеновой кислоты настоящего изобретения, т.е. пантенола докозагексаеноату и, в частности, пантенола докозагексаеноату формулы А, или фармацевтической композиции настоящего изобретения для ее применения в качестве лекарственного средства.
Настоящее изобретение также относится к эфирам докозагексаеновой кислоты настоящего изобретения, т.е. пантенола докозагексаеноату и, в частности, пантенола докозагексаеноату формулы А, или фармацевтической композиции настоящего изобретения для ее применения в качестве лекарственного средства, предназначенного для предупреждения и/или лечения сердечно-сосудистых заболеваний, предпочтительно выбранных из аритмии предсердий и/или желудочков, тахикардии и/или фибрилляции; для предупреждения и/или лечения заболеваний, вызванных дефектами в электрической проводимости клеток миокарда; для предупреждения и/или лечения множественных факторов риска сердечно-сосудистых заболеваний, предпочтительно выбранных из гиперглицеридемии, гиперхолестеринемии, гипертензии, а именно артериальной гипертензии, в частности артериальной рефракторной гипертензии, гиперлипидемии, дислипидемии, предпочтительно смешанной дислипидемии, и/или гиперактивности фактора VII системы свертывания крови; для лечения и/или первичного или вторичного предупреждения сердечно-сосудистых заболеваний в результате аритмии предсердий и/или желудочков, тахикардии, и/или фибрилляции, и/или дефектов электрической проводимости, вызванных инфарктом миокарда, предпочтительно внезапной смертью; и/или для постинфарктного лечения.
Другими словами, настоящее изобретение относится к эфиру докозагексаеновой кислоты настоящего изобретения, т.е. пантенола докозагексаеноату и, в частности, пантенола докозагексаеноату формулы А, или фармацевтической композиции настоящего изобретения для применения при профилактике и/или лечении заболеваний, упомянутых выше.
Предпочтительно, настоящее изобретение относится к эфиру докозагексаеновой кислоты настоящего изобретения, т.е. пантенола докозагексаеноату, в частности пантенола докозагексаеноату формулы А, или фармацевтической композиции настоящего изобретения для применения в качестве лекарственного средства, предназначенного для профилактики и/или лечения фибрилляции предсердий.
Суть настоящего изобретения раскрывается лучше с помощью фигуры и примеров, которые приведены ниже.
На Фиг.1 представлены вариации рефракторных периодов in vivo после введения носителя, или этилового эфира DHA, в сравнении с пантенола докозагексаеноатом настоящего изобретения, диэфира пантенола и DHA, а также диэфира изосорбида и DHA согласно протоколу, описанному ниже в примере 2.
Следующие далее примеры иллюстрируют данное изобретение, не ограничивая его объем.
Пример 1: Синтез пантенола докозагексаеноата формулы А
1. Синтез промежуточного соединения I, полученного из пантенола (защита спиртовых функциональных групп на левой стороне молекулы пантенола)
Синтез данного соединения проводили в трехгорлой колбе объемом 2000 мл, которую очищали и выдерживали в атмосфере азота.
К раствору (2R)-2,4-дигидрокси-N-(3-гидроксипропил)-3,3-диметилбутанамида (D-пантенол, 100 г, 0.488 моль, 1.00 экв.) в ацетоне (1 л) добавляли 120 мл триметилхлорсилана (TMCS) по каплям при перемешивании при температуре 10-15°C.
Полученный раствор перемешивали в течение 3 часов при комнатной температуре, а рН раствора доводили до 7 с помощью триэтиламина. Далее полученный раствор концентрировали под вакуумом и остаток наносили на колонку с силикагелем и смесью петролейного эфира и ацетона (5.5:1).
В результате было получено 65 г (54%) (4R)-N-(3-гидроксипропил)-2,2,5,5-тетраметил-1,3-диоксан-4-карбоксамида (соединение I) в виде белого твердого вещества.
LC-MS соединения I: (ES, m/z): 268 [M+Na+], 513 [2M+Na+]
2. Синтез промежуточного соединения II = DHA эфира соединения I
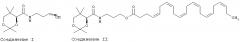
Синтез данного соединения проводили в трехгорлой колбе объемом 1 л, которую очищали и выдерживали в инертной атмосфере аргона, а затем в нее помещали раствор (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеновой кислоты (CAS 6217-54-5) (70 г, 0.213 моль, 1.00 экв.), 1',1-[(1H-имидазол-1-ул)карбонил]-1H-имидазола (51.9 г, 0.320 моль, 1.50 экв.), N,N-диметилпиридин-4-амина (31.2 г, 0.256 моль, 1.2 экв.) и (4R)-N-3-гидроксипропил-2,2,5,5-тетраметил-1,3-диоксан-4-карбоксамида (соединение I) (62.7 г, 0.256 моль, 1.20 экв.) в дихлорметане (600 мл).
Полученный раствор перемешивали в течение ночи при комнатной температуре, а затем разбавляли 200 мл дихлометана. Далее полученный раствор промывали 2×100 мл воды. Органическую фазу сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем и элюировали с помощью смеси петролейного эфира и ацетона (40:1-20:1). В результате был получен 71.0 г (60%) 3-{[(4R)-2,2,5,5-тетраметил-1,3-диоксан-4-ил]формамидо}пропил(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноата (соединение II) в виде бесцветного твердого вещества.
3. Синтез пантенола докозагексаеноата настоящего изобретения (депротекция спиртовой функциональной группы)
Синтез соединения настоящего изобретения проводили в трехгорлой колбе объемом 1 л, которую очищали и выдерживали в инертной атмосфере аргона, в которую помещали раствор 3-{[(4R)-2,2,5,5-тетраметил-1,3-диоксан-4-ил]формамидо}пропил(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноата (соединение II) (71 г, 0.128 моль, 1.00 экв.) в метаноле (710 мл) и п-толуолсульфокислоте (0.972 г, 5.12 ммоль, 0.04 экв.).
Далее полученный раствор перемешивали в течение ночи при комнатной температуре. Полученную смесь концентрировали под вакуумом. Остаток наносили на колонку с силикагелем и смесью гексан : ацетон (8:1-3:1).
Было получено 51.9 г (79%) 3-[(2R)-2,4-дигидрокси-3,3-диметилбутанамидо]propyl(4z,7z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноата (соединение формулы А) в виде желтого масла.
LC-MS соединения формулы A: (ES, m/z): 516 [M+H]+, 538 [M+Na]+
UPLC соединения формулы А:
- Колонка: Waters X-bridge C18, 3.5 мкм, 2.1*50 мм
- Подвижная фаза В: метанол
- Подвижная фаза А: вода/0.05% ТФУ
- Градиент: от 15% до 100% фазы В в течение 2.3 минут, 100% фазы В в течение 1.2 минуты, от 100% до 15% фазы В в течение 0.1 минуты, затем остановка.
- Скорость потока: 1.0 мл/мин
Хиральная ВЭЖХ соединения формулы А: ee%=98.1%
- Колонка: Chiralpak IA, 0.46*25 см, 5 мкм
- Подвижная фаза: гексан : этанол (96:4)
- Скорость потока: 1.5 мл/мин
HNMR соединения формулы А: (300 MHz, CDCl3, ppm): δ 0.92-0.99 (m, 9H), 1.83-1.90 (m, 2H), 2.07-2.09 (m, 2H), 2.39-2.4 (m, 4H), 2.82-2.85 (m, 10H), 3.31-3.41 (m, 2H), 3.49-3.56 (m, 2H), 4.04 (s, 1H), 4.14-4.17 (t, J=6.0 Hz, 2H), 5.29-5.42 (m, 12H), 7.02 (s, 1H).
Пример 2: Влияние пантенола докозагексаеноата формулы А настоящего изобретения на рефракторный период у свиньи
Благоприятный эффект пантенола докозагексаеноата формулы А при лечении сердечно-сосудистых заболеваний был продемонстрирован с помощью измерения рефракторного периода предсердий. Известно, что увеличение продолжительности этого параметра приводит к ослаблению приступа аритмии и сокращению ее продолжительности, в частности, это было показано для фибрилляции предсердий (Attuel et al., 1982; Wijffels et al., 1995).
В эксперименте использовали самцов свиней Landrace (20-25 кг). Анестезию проводили с помощью изофлюрана (0.5-3% дыхательного объема легких). Частоту дыхания и дыхательный объем легких регулировали таким образом, чтобы уровень газов в крови не превышал физиологических норм.
В левой части грудной клетки, в четвертой межреберной области, проводили торакотомию с последующим вскрытием перикарда. Катетеры из полиэтилена вводили в ближайшую грудную артерию для измерения артериального давления во время эксперимента и в левую подкожную вену бедра для введения активных продуктов и контрольного носителя.
Электрокардиограмму предсердий (ECG) непрерывно записывали, при этом три электрода поместили в эпикард и укрепили их наложением швов, а четвертый использовали в качестве массы, поместив его в грудные мышцы. Таким образом, использование ECG позволило получить информацию об активности предсердий. Два биполярных электрода также поместили в левое предсердие с интервалом в 0.3 см и закрепили их рыболовными крючками. Электрическую стимуляцию выполняли с помощью стимулятора (DS 8000, WPI).
После операции животные восстанавливались в течение определенного времени (гемодинамические параметры и уровень газов в крови стабилизировались и нормализовались), после чего начали проводить определение рефракторного периода у животных, которые получали активный агент или контрольный носитель.
Ряд непрерывных стимулов (S1) инициировали при относительно низком напряжении (0.1 V), которое недостаточно для стимуляции сердца, а затем напряжение постепенно повышали с шагом 0.1 V для того, чтобы найти пороговое значение стимуляции, которое позволило следить за фиксированной частотой. Поиск этого порогового значения осуществляли для каждой частоты стимуляции.
Использовали две основные продолжительности цикла (BCL) - 400 мс и 500 мс. После достижения порогового значения стимуляция S1 (последовательность из 10 стимулов) была в два раза больше, а дополнительный стимул S2 был в четыре раза больше, чем пороговое значение напряжения. Каждые 10 стимулов S1 инициировали дополнительный стимул S2 во время рефракторного периода (т.е. 80 мс после последнего S1, рефракторный период теоретически длится по крайней мере 100 мс) и затем каждые 10 стимулов S1 инициировали дополнительный стимул после последнего стимула S1 (приращение на 5 единиц через каждые 5 мс), пока не было возбуждено сердцебиение.
Наиболее длительный интервал без специфического ответа на S2 представляет собой рефракторный период предсердий (Wirth et al., 2003).
Пантенола докозагексаеноат формулы А растворяли в диметилацетамиде (DMA) и Cremophor® ELP (30/70), разбавленном на 1/4 в 5%-ном растворе глюкозы. 5%-ный раствор глюкозы можно добавлять после обработки ультразвуком.
Пантенола докозагексаеноат формулы А (количество: 10+10 мг/кг, n=4) вводили в виде болюса в течение 1 минуты, а затем позволяли ему диффундировать в течение 40 минут.
Носитель состоит из диметилацетамида (DMA) и Cremophor® ELP (30/70), разбавленного на 1/4 в 5%-ном растворе глюкозы.
Носитель вводили тем же способом, что и активный агент.
Пантенола диэфир, изосорбида диэфир и этиловый эфир готовили и вводили тем же способом, что и пантенола докозагексаеноат формулы А.
Этиловый эфир представляет собой этиловый эфир DHA следующей формулы:
Пантенола диэфир имеет следующую формулу:
Изосорбида диэфир имеет следующую формулу:
Результаты представлены на Фиг.1. На этой фигуре приведены вариации рефракторных периодов in vivo после введения носителя по сравнению с пантенола докозагексаеноатом формулы А согласно способу, описанному выше.
Результаты, представленные на фиг.1, показывают, что пантенола докозагексаеноат формулы А значительно увеличивает рефракторные периоды предсердий (ARPs) у экспериментальных животных. Внутривенное введение 10 мг/кг+10 мг/кг пантенола докозагексаеноата формулы А действительно увеличивает ARPs на 19±2 мс (n=4, p<0.001), в то время как плацебо вообще не оказывает никакого эффекта (-4±3 мс, n=10, NS).
Кроме того, неожиданно обнаружили, что пантенола докозагексаеноат формулы А значительно более активный, чем пантенола диэфир (несмотря на наличие двух молекул DHA в одной молекуле диэфира), что усиливает значимость соединения настоящего изобретения.
Таким образом, введение пантенола докозагексаеноата формулы А увеличивает рефракторный период предсердий у экспериментальных животных и поэтому может быть использован для уменьшения аритмии, например продолжительности и/или частоты фибрилляции предсердий (Attuel et al., 1982; Wijffels et al., 1995).
Источники информации
Attuel et al., Failure in the rate adaptation of the atrial refractory period: its relationship to vulnerability, Int J Cardiol. 1982; 2(2): 179-97.
Harrison et al. "Compendium of Synthetic Organic Methods", Vols. 1 to 8 (J. Wiley & Sons, 1971 to 1996).
Wijffels et al., Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation. 1995 Oct. 1; 92(7): 1954-68.
Wirth KJ et al.; Atrial effects of the novel K(+)-channel-blocker AVE0118 in anesthetized pigs. Cardiovasc Res. 2003 Nov. 1; 60(2): 298-306.
1. Эфир докозагексаеновой кислоты с пантенолом формулы: или его энантиомер.
2. Эфир по п.1 формулы А:
3. Эфир по п.1 или п.2 для применения в качестве лекарственного средства для профилактики и/или лечения сердечно-сосудистых заболеваний.
4. Фармацевтическая композиция для профилактики и/или лечения сердечно-сосудистых заболеваний, содержащая в качестве активного ингредиента эфир по п.1 или 2 и фармацевтически приемлемый эксципиент.
5. Эфир по п.1 или 2 или композиция по п. 4, для применения при профилактике и/или лечении сердечно-сосудистых заболеваний, выбранных из: аритмии предсердий и/или желудочков, такихардии и/или фибрилляции; при профилактике и/или лечении заболеваний, вызванных дефектами электрической проводимости клеток миокарда; при профилактике и/или лечении множественных факторов риска сердечно-сосудистых заболеваний, выбранных из: гипертриглицеридемии, гиперхолестеринемии, гипертензии, в частности артериальной рефрактерной гипертензии, гиперлипидемии, дислипидемии, предпочтительно смешанной дислипидемии; или при первичной или вторичной профилактике и/или лечении сердечно-сосудистых заболеваний, возникших в результате аритмии предсердий и/или желудочков, тахикардии, фибрилляции и/или дефектов электрической проводимости, вызванных инфарктом миокарда, предпочтительно внезапной смертью; и/или при постинфарктном лечении.
6. Эфир по п.5 для применения при профилактике и/или лечении фибрилляции предсердий.
7. Способ получения эфира по п.1 или 2, содержащий следующие стадии:a) избирательная защита двух функциональных ОН-групп пантенола или D-пантенола с помощью О-защитных групп,b) этерификация незащищенных функциональных ОН-групп DHA в присутствии 1-[(1Н-имидазол-1-ил)карбонил]-1Н-имидазола и N,N-диметилпиридин-4-амина,c) депротекция двух защищенных функциональных ОН-групп.
8. Способ по п.7, где О-защитная группа представляет собой триметилхлорсилан.