Способ оценки внутримышечной инъекции нанодисперсного железа на продуктивность и метаболизм цыплят-бройлеров
Иллюстрации
Показать всеИзобретение относится к области сельского хозяйства и предназначено для повышения продуктивности цыплят-бройлеров. Цыплятам-бройлерам в 14-дневном возрасте одноразово вводят инъекцию препарата наножелеза, который готовят путем смешивания наночастиц железа размером частиц 80,5±5,5 нм с физраствором в дозе: физраствора 200 мкл/гол, железа в дозировке 2 мг/кг живой массы. Способ эффективно повышает продуктивность и метаболизм цыплят-бройлеров. 4 табл., 1 пр., 2 ил.
Реферат
Изобретение относится к сельскому хозяйству, в частности к животноводству, и может быть использовано при внедрении нанотехнологий в отрасли птицеводства.
Нанодисперстные формы эссенциальных металлов и их соединений нашли широкое применение в животноводстве в качестве препаратов микроэлементов. Это определилось меньшей их токсичностью [1, 2, 3], более высокой биодоступностью из наноформ в сравнении с традиционными препаратами [4].
В этой связи определенный интерес представляют исследования, направленные на создание новых препаратов железа. Железодефицитная анемия сохраняется в качестве основного расстройства обмена веществ человека, затрагивая более 1 млрд жителей нашей планеты [5]. Сельскохозяйственные животные так же широко подвержены этому заболеванию.
Современная терапия железодефицитной анемии включает пероральные препараты железа, в том числе простые соли Fe+2, растворимые хелатные формы Fe+2 или Fe+3. Эти препараты имеют ряд недостатков: расстройства желудочно-кишечного тракта [6, 7], изменения состава микрофлоры в толстом кишечнике [8, 9]. Терапия железодефицитной анемии включает и внутримышечные инъекции препаратов. Недостатком этого метода являются негативные последствия для организма по причине образования активных форм кислорода в реакциях Фентона, Хабера-Вайса, Осипова.
Наночастицы железа и его соединения могут рассматриваться, как выгодная альтернатива существующим препаратам. Известны работы, демонстрирующие ростостимулирующие и ранозаживляющие эффекты наножелеза [10, 11], продемонстрирована перспектива наночастиц Fe+3 и в качестве пищевой добавки [12, 13].
Одним из направлений совершенствования нанопрепаратов является уточнение размера наночастиц вещества. Установлены различия в биологических свойствах наножелеза с разноразмерными частицами [14], уменьшение их размера повышает абсорбцию элемента [14]. В то же время известна связь токсичности наночастиц с их размерами [15, 16].
Однако комплексная оценка ростостимулирующего влияния частиц Fe на продуктивность, в частности на примере птиц, с учетом размерности нано- и микрочастиц, их дозировки, влияния на увеличение аргинина, как основного носителя азота, участвующего при перераспределении энергии между протеином и жиром в организме в сторону повышения продуктивности цыплят-бройлеров, с таких позиций в современных литературных источниках не представлена.
Материалы и методы
Наночастицы железа при проведении эксперимента были синтезированы методом высокотемпературной конденсации на установке Миген-3 в Институте энергетических проблем химической физики РАН г. Москвы [17].
Биологическая доступность и активность выбранных образцов была достоверно подтверждена в тесте ингибирования бактериальной биолюминесценции по существующему алгоритму [18].
Для синтеза использовано металлическое железо чистотой 99,99%. По итогам аттестации частиц установлено, что наночастицы железа размером 80±5 нм, содержат кристаллического металла в ядре частиц 96,0±4,5%, микрочастицы железа размером 9,8±0,4 мкм - чистота металла составляет 99,5%, агломераты наночастиц имели размер 923,7±29,6 нм.
В связи с поставленной целью исследования были проведены на цыплятах-бройлерах «Смена-7» в условиях вивария Оренбургского государственного университета, в соответствии с рекомендациями [19].
Для проведения исследований было приобретено 150 суточных курочек. По итогам десятидневных наблюдений за ростом и развитием было сформированы 4 группы цыплят по 30 голов. Вся птица находилась в одинаковых условиях кормления и содержания. В 14-дневном возрасте однократно внутримышечно (в бедро) цыплятам вводили: I группе - препарат наночастиц железа (80±5 нм); II - препарат агломератов наночастиц железа (923,7±29,6 нм); III - препарат микрочастиц железа (9,8±0,4 мкм); IV(контроль) - стерильный физраствор 200 мкл/гол. Препараты железа для инъекций готовили путем смешивания частиц с физраствором объемом 200 мкл. Полученный препарат стерилизовали ультрафиолетом, затем обрабатывали ультразвуком (частота 35 кГц; мощность - 300 (450) Вт, амплитуда колебаний - 10 мкм). Продолжительность ультразвуковой обработки для I и III групп - 30 минут, II группы - 20 сек. Дозировка железа составила 2 мг/кг живой массы птицы и обосновывалась ранее проведенными исследованиями [20].
В течение эксперимента цыплят ежедневно взвешивали.
Убой цыплят производился в 15-, 21- и 35-суточном возрасте (n=5). Это соответствовало 1, 7 и 21 суткам после инъекции.
На основании полученных данных рассчитывали отложение в теле цыплят протеина и жира по периодам.
Статистическую обработку полученных данных проводили с использованием программного пакета «Statistica 6.0». Полученные результаты достоверны при р≤0,05.
В исследованиях установлено ростостимулирующее действие препаратов железа.
Динамика разницы (%) по живой массе между контрольной и опытной группами цыплят-бройлеров представлена на фиг. 1.
Живая масса цыплят в I группе, спустя сутки после введения, была выше контрольных значений на 6,7%, через 10 суток на 8,06%, через 21 день после введения на 6,9%, максимальная разница в живой массе - 9,8% отмечалась на 4 сутки после инъекции.
Введение агломератов наночастиц железа во II группе сопровождалось достоверным увеличением живой массы на 10 и 17 сутки после введения (4,69%; 4,97%).
Ростостимулирующие эффекты были характерны и для препарата микрочастиц железа, однако изменения были отмечены только на 3 неделе после введения микрочастиц (+7,8%).
Механизм ростостимулирующего эффекта препаратов наночастиц железа может быть объяснен изменениями метаболизма в теле цыплят.
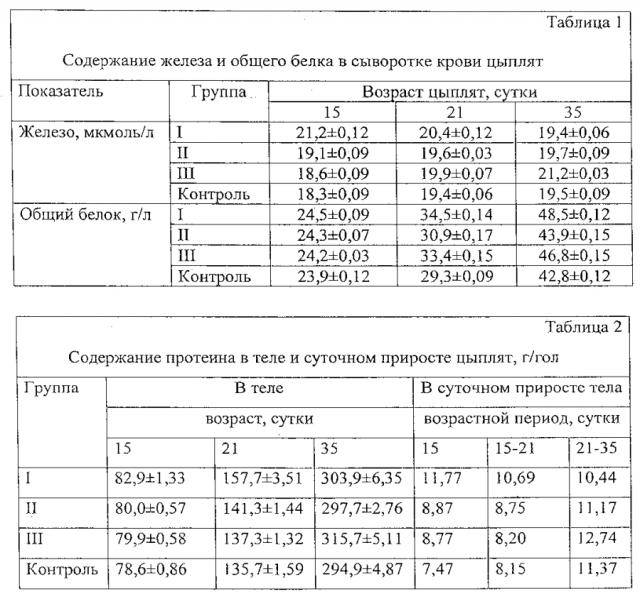
В I группе отмечено повышение концентрации железа в сыворотке крови через сутки на 15,8%, через 7 суток на 5,15%. На 21 сутки содержание железа в сыворотке было увеличено только в третьей группе на 8,71% (табл. 1).
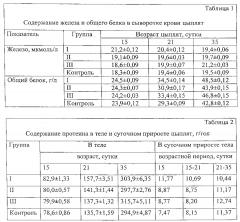
Ростостимулирующее действие препаратов железа определялось изменениями в метаболизме. Это отмечалось по динамике концентрации общего белка в сыворотке крови (табл. 1). Аналогичным образом изменялось общее содержание протеина в теле цыплят (табл. 2).
Содержание протеина в теле цыплят I группы в 15 суток превышало уровень контроля на 5,5%, в 21 сутки на 16,2%, в 35 на 3,1%. Эта разница и определила больший прирост массы I опытной группы. Отложение в организме одного грамма белка привело к повышению массы тела на величину 4,96-5,16 грамм [26].
С целью проверки связи обмена аргинина с действием наночастиц металлов изучен аминокислотный состав печени. Массовая доля аргинина в печени была определена методом капиллярного электрофореза на приборе «Капель».
Влияние наночастиц железа в I группе сопровождалось достоверным увеличением процента аргинина в печени по сравнению с контрольной группой спустя сутки на 2,25%, через 7 суток после введения на 3,78%.
Разница содержания аргинина (%) в печени цыплят в возрасте 15, 21 и 35 суток представлена на фиг 2.
Во II группе повышение содержания аргинина отмечалось через 7 суток после введения на 2,08%, в III - только через 21 сутки после инъекций на 3,86%.
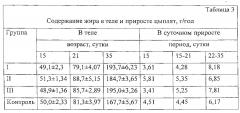
Известно, что аргинин является наиболее распространенным носителем азота и основным фактором, регулирующим максимальный рост молодых животных [21, 22]. Увеличение содержания аргинина в печени сопровождалось перераспределением энергии между протеином и жиром в организме цыплят. Ранее [23] на модели цыплят-бройлеров показано снижение массы брюшной жировой ткани и циркулирующих липидов под влиянием добавок диетического аргинина. В наших исследованиях мы отмечали тенденцию к снижению отложения жира в приросте массы тела цыплят I группы с 15 по 21 сутки (табл. 3).
Повышение концентрации аргинина в печени могло стать следствием активизации синтеза макрофагов в ответ на введение частиц железа. Известно, что путем синтеза полиаминов и белка аргинин определяет пролиферацию моноцитов и лимфоцитов [24]. В наших исследованиях количество моноцитов достоверно увеличивалось спустя сутки после инъекций на 16,3 и 12% в первой и третьей группах соответственно, в 2,17 раза во второй группе относительно контроля. Содержание моноцитов через 7 суток после введения высокодисперсных частиц железа было выше, чем в контроле, на 5,56 и 8,89% в первой и третьей группах, в 1,53 раза во второй группе. Уровень моноцитов в 35-дневном возрасте опытной птицы был увеличен только в третьей группе на 2,19%.
Подводя итог результатам наших исследований, следует отметить влияние размера частиц железа на рост и развитие цыплят. В эксперименте отмечено ростостимулирующее действие препаратов железа на различных сроках после внутримышечной инъекции, в зависимости от размеров частиц. При этом отмечались изменения в организме цыплят. Повышение интенсивности роста сопровождалось увеличением массы протеина в приросте цыплят, нарастанием концентраций аргинина в печени, закономерным увеличением концентрации моноцитов в крови.
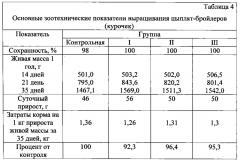
Таким образом, при оценке безопасности внутримышечной инъекции цыплятам-бройлерам в 14-дневном возрасте продуктивность к 21-дневному возрасту возрастает на 6,1% за счет достоверного увеличения аргинина в печени птицы на 3,78%, участвующего как основной носитель азота при перераспределении энергии между протеином и жиром в сторону увеличения среднесуточного прироста на 21,7% при снижении затрат корма на единицу прироста живой массы за 35 дней на 7,4% по сравнению с контролем (табл. 4).
Увеличение аргинина действием инъекции наночастиц железа в дозе 2 мг/кг живой массы сохраняется в течение 21 суток, до срока производственной реализации (рис. 2).
Список литературы
1. Zhang J, Wang H, Yan X, Zhang L. 2005.Comparison of short-term toxicity between Nano-Se and selenite in mice.LifeSci. Jan 21; 76(10):1099-109.
2. Hao L, Wang Z, Xing B. 2009.Effect of sub-acute exposure to ТiO2 nanoparticles on oxidative stress and histopathological changes in Juvenile Carp (Cyprinuscarpio).J EnvironSci (China).; 21(10): 1459-66.
3. Wang H, Sun X, Liu Z, Lei Z. 2014.Creation of nanopores on graphene planes with MgO template for preparing high-performance supercapacitor electrodes.Nanoscale. May 7.
4. Rohner F, Ernst FO, Arnold M, Hilbe M, Biebinger R, Ehrensperger F, Pratsinis SE, Langhans W, Hurrell RF, Zimmermann MB. 2007. Synthesis, characterization, and bioavailability in rats of ferric phosphate nanoparticles. J Nutr.Mar; 137(3):614-9.
5. World Health Organization 2008. Global Database on Anaemia, World Health Organization, Geneva, Switzerland.
6. Cancelo-Hidalgo M. J., Castelo-Branco С, Palacios S., Haya-Palazuelos J., Ciria-Recasens M., Manasanch J., Pérez-Edo L. 2013. Tolerability of different oral iron supplements: a systematic review. Curr. Med. Res. Opin.29, 291-303.
7. Peña-Rosas Juan P., De-Regil Luz M., Dowswell T., Viteri Fernando E. 2012. Daily oral iron supplementation during pregnancy. In Cochrane Database of Systematic Reviews, John Wiley & Sons, Ltd., Chichester, UK.Zimmermann M.В.
8. Zimmermann M.B., Chassard C., Rohner F., N'Goran E., Nindjin C., Dostal Α., Utzinger J., Ghattas H., Lacroix С, Hurrell R.F. 2010. The effects og iron fortification on the gut microbiota in African children: a randomized controlled trial in Cote d'Ivoire. Am. J. Clin. Nutr. 92., 1406-1415.
9. Dostal Α., Chassard C., Hilty F.M., Zimmermann M.В., Jaeggi T., Rossi S., Lacroix С. 2012. Iron depletion and repletion with ferrous sulfate or electrolytic iron modifies the composition and metabolic activity of the gut microbiota in rats. J. Nutr. 142, 271-277.
10. Глущенко H.H., Богословская Ο.Α., Ольховская И.П., Лобаева T.А. 2002. Влияние наночастиц цинка на процессы ранозаживления. Материалы VI международной конференции "Биоантиоксидант". - Москва, - С. 114-11.
11. Sizova E., Miroshnikov S., Polyakova V., Glushchenko Ν., Skalny Α. 2013. Biological effects connected with metal nanoparticles entry into organism / //Ann BiolClin, vol. 71, № 5, septembre-octobre, 568-569.
12. Mohamad F. Aslam, David M. Frazer, NunoFaria, Sylvaine F. A. Bruggraber, Sarah J. Wilkins, Cornel Mirciov, Jonathan J. Powell, Greg J. Anderson, and Dora I. A. Pereira 2014. Ferroportin mediates the intestinal absorption of iron from a nanoparticulate ferritin core mimetic in mice FASEB J. Aug; 28(8): 3671-3678.
13. Hilty FM, Arnold M, Hilbe M, Teleki A, Knijnenburg JT, Ehrensperger F, Hurrell RF, Pratsinis SE, Langhans W, Zimmermann MB.. 2010. Iron from nanocompounds containing iron and zinc is highly bioavailable in rats without tissue accumulation.NatNanotechnol. May; 5(5):374-80. doi: 10.1038/nnano.2010.79. Epub 2010 Apr 25.
14. Yang L, Kuang H, Zhang W, Aguilar ZP, Xiong Y, Lai W, Xu H, Wei H. 2014. Size dependent biodistribution and toxicokinetics of iron oxide magnetic nanoparticles in mice. Nanoscale. Dec 11; 7(2):625-36. doi: 10.1039/c4nr0506ld.
15. Cho WS, Kim S, Han BS, Son WC, Jeong J. 2009.Comparison of gene expression profiles in mice liver following intravenous injection of 4 and 100 nm-sized PEG-coated gold nanoparticles. Toxicol Lett.; 191:96-102.
16. Prietl B, Meindl C, Roblegg E, Pieber TR, Lanzer G, Fröhlich E. 2014. Nano-sized and micro-sized polystyrene particles affect phagocyte function. Cell BiolToxicol. Feb; 30(1):1-16. doi: 10.1007/sl0565-013-9265-y. Epub 2013 Nov 29.
17. Жигач A.H., Лейпунский И.О., Кусков М.Л., Стоенко Н.И., Сторожев В.Б. 2000. Установка для получения и исследования физико-химических свойств наночастиц металлов. Приборы и техника эксперимента. №6. С.12.
18. Дерябин Д.Г., Алешина Е.С., Дерябина Т.Д., Ефремова Л.В. 2011. Биологическая активность ионов, нано- и микрочастиц Cu и Fe в тесте ингибирования бактериальной биолюминесценции // Вопросы биологической, медицинской и фармацевтической химий. №6. С. 31-36.
19. Фисинин В.И., Имангулов Ш.А., Егоров И.А., Околелова Т.М. и др. Рекомендации по кормлению сельскохозяйственной птицы. Сергиев Посад, 2000-67 с.
20. Сипайлова О.Ю., Лебедев C.B., Сизова Е.А. 2011. Влияние высокодисперсного порошка железа на морфофункциональное состояние селезенки (экспериментальное исследование). Вопросы биологической, медицинской и фармацевтической химии Т.9. №8. С. 43-46.).
21. Flynn N.E, Meininger C.J, Haynes T.E, Wu G. 2002.The metabolic basis of arginine nutrition and pharmacotherapy. BiomedPharmacother.; 56:427-438. doi: 10.1016/S0753-3322(02)00273-1.
22. Wu G, Ott Τ L, Knabe DA, Bazer FW. 2004.Amino acid composition of the fetal pig. J Nutr. 1999; 129:1031-1038.] [Wu G, Knabe DA, Kim SW. Arginine nutrition in neonatal pigs. J Nutr.; 134:2783S-2790S.
23. Fouad AM, El-Senousey HK, YangXJ, Yao JH. 2013. Dietary L-arginine supplementation reduces abdominal fat content by modulating lipid metabolism in broiler chickens. Animal. Aug; 7(8): 1239-45. doi: 10.1017/S1751731113000347. Epub 2013 Mar 11.
24. Suchner U, Heyland DK, Peter K. 2002. Immune-modulatory actions of arginine in the critically ill. Br J Nutr.; 87:S121-S132. doi: 10.1079/BJN2001465.
Способ повышения продуктивности цыплят-бройлеров, отличающийся тем, что цыплятам-бройлерам в 14-дневном возрасте одноразово вводят инъекцию препарата наножелеза, который готовят путем смешивания наночастиц железа размером частиц 80,5±5,5 нм с физраствором в дозе: физраствора 200 мкл/гол, железа в дозировке 2 мг/кг живой массы.