Основанная на наночастицах, нацеленная на опухоли доставка лекарственных средств
Иллюстрации
Показать всеГруппа изобретений относится к водным нацеливающим на опухоли композициям липосомных наночастиц, содержащих нацеливающий на легумаин липид, содержащий липидный компонент, ковалентно связанный со связывающей легумаин группой, где связывающая легумаин группа включает ингибитор легумаина типа аза-Asn пептида с реакционноспособной частью, представленной формулой (I):
а также их применению для лечения экспрессирующих легумаин опухолевых заболеваний. Группа изобретений снимает опасения, связанные с нацеливанием с помощью лигандов, в то же время предоставляя эффективные средства для специфической для опухолей доставки лекарственных средств. 5 н. и 11 з.п. ф-лы, 11 ил., 1 табл., 6 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США серийный № 61/402686, поданной 2 сентября 2010 г., полное содержание которой приведено в настоящем документе в качестве ссылки.
ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА
Это изобретение осуществлено при государственной поддержке от правительства Соединенных Штатов Америки, National Institutes of Health, грант no. 5 R01 CA134364-01 A, и National Heart, Lung, and Blood Institute, грант на обучение no. T32HL007195.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Нацеливание с помощью лигандов стало основным усовершенствованием опосредованной наночастицами (NP) доставки лекарственных средств, достигающим высокой местной концентрации и низкого системного воздействия, снижающим токсичность лекарственного средства при поддержании в то же время доставки оптимальной дозы к клеткам-мишеням. Проверку обоснованности концепции для этого способа осуществляли с помощью антител и связанных с хомингом пептидов, которые связывают рецепторы адгезии, обладающие сверхэкспрессией в сосудистой сети опухоли, включая интегрины, и HER-2, и рецепторы поверхности клеток для фолатов на клетках опухолей. Опасения, связанные с нацеливанием с помощью лигандов, включают в себя насыщение рецепторов, низкую аффинность рецептор-лиганд, ограниченную проницаемость тканей и генетическую гетерогенность солидных опухолей. Легумаин представляет собой аспарагинил-эндопептидазу, сверхэкспрессированную во множестве клеток опухолей. Следовательно, легумаин обеспечивает удобную мишень для направления лекарственных средств к клеткам опухолей. Композиции и способы по настоящему изобретению снимают опасения, связанные с нацеливанием с помощью лигандов, в то же время предоставляя эффективные средства для специфической для опухолей доставки лекарственных средств.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к водной нацеливающей на опухоли композиции липосомных наночастиц, содержащей водную дисперсию липосомных наночастиц, необязательно инкапсулирующих противораковое химиотерапевтическое средство. Водная нацеливающая на опухоли композиция липосомных наночастиц по изобретению содержит нацеливающий на легумаин липид, смешанный с одним или несколькими формирующими мицеллу или везикулу липидными материалами в форме дисперсии липосомных наночастиц, необязательно инкапсулирующих противораковое химиотерапевтическое средство внутри липосомных наночастиц. Нацеливающий на легумаин липидный компонент содержит гидрофобную липидную часть, ковалентно присоединенную к связывающей легумаин группе. Противораковое химиотерапевтическое средство можно инкапсулировать внутри липосомных наночастиц во время получения наночастиц, или наночастицы можно формировать предварительно, и затем нагружать химиотерапевтическим средством. Предпочтительная водная нацеливающая на опухоли композиция липосомных наночастиц содержит (a) нацеливающий на легумаин липидный компонент, (b) цвиттер-ионный липидный компонент; (c) аминозамещенный липидный компонент; (d) нейтральный липидный компонент; и (e) конъюгированный с полиэтиленгликолем липидный компонент, диспергированный в форме липосомных наночастиц в водном носителе (например, физиологически переносимом буфере, который может включать различные физиологически приемлемые наполнители и адъюванты, общеупотребительные в составах лекарственных средств). Нацеливающий на легумаин липидный компонент содержит гидрофобную липидную часть, ковалентно присоединенную к связывающей легумаин группе. Связывающая легумаин группа может представлять собой любой материал, который избирательно образует стабильный комплекс или ковалентную связь с легумаином.
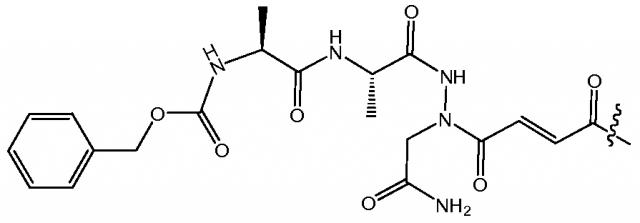
Предпочтительная нацеливающая на легумаин группа представляет собой ингибитор легумаина типа аза-Asn акцептора Михаэля. Предпочтительный нацеливающий на легумаин липидный компонент содержит ингибитор легумаина типа аза-Asn акцептора Михаэля, связанный с фосфолипидом. Например, ингибитор, известный как RR-11a, можно связывать с подходящим липидом, как показано на Фиг.1, панель (a).
В некоторых предпочтительных вариантах осуществления нацеливающий на легумаин липидный компонент содержит связывающую легумаин группу, ковалентно присоединенную к группе 1,2-диацилглицерофосфоалканоламина, такой как 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE).
Предпочтительный цвиттер-ионный липидный компонент (b) содержит соединение 1,2-диацилглицерофосфохолина, такое как 1,2-ди-(9Z-октадеценоил)-sn-глицеро-3-фосфохолин (DOPC).
Предпочтительный аминозамещенный липидный компонент (c) содержит соединение 1,2-диацилглицерофосфоалканоламина, такое как DOPE.
Предпочтительный нейтральный липидный компонент (d) содержит холестерин.
Предпочтительный конъюгированный с полиэтиленгликолем липидный компонент (e) содержит конъюгированное с полиэтиленгликолем соединение 1,2-диацилглицерофосфоалканоламина, такое как 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)], где полиэтиленгликольная часть соединения обладает средней молекулярной массой приблизительно 2000 атомных единиц массы (а.е.м.).
В одном предпочтительном варианте осуществления компоненты (a), (b), (c), (d) и (e) присутствуют в липосомных наночастицах в молярном соотношении (a):(b):(c):(d):(e) приблизительно 1,1:6,7:6,7:2,2:1.
Предпочтительно, композиция липосомных наночастиц инкапсулирует противораковое химиотерапевтическое средство, например, доксорубицин, 1-[2-циано-3-,12-диоксоолеана-1,9(11)-диен-28-оил]имидазол (известный также как CDDO-Im) или любое другое известное противораковое химиотерапевтическое средство.
Композиции по настоящему изобретению особенно подходят для использования в лечении экспрессирующих легумаин опухолей. Методический аспект настоящего изобретения включает в себя введение пациенту, нуждающемуся в лечении злокачественной опухоли, эффективного количества противоракового химиотерапевтического средства, инкапсулированного внутри липосомных наночастиц из композиции по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ.1 иллюстрирует получение и характеризацию нацеленных на легумаин наночастиц (NP). Панель (a) иллюстрирует конъюгацию RR-11a с 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламином (DOPE). Панель (b) представляет изображения после флуоресцентной микроскопии, демонстрирующие гипоксию опухоли (масштабные линейки, 100 мкм). Панель (c) представляет график специфического связывания в зависимости от концентрации антитела, демонстрирующий аффинность моноклонального антитела (mAb) мыши против экспрессированного на мембране клеток легумаина, как определено анализом Скэтчарда. Панель (d) представляет график положительных по родамину клеток в зависимости от времени для клеток карциномы молочной железы 4T1 и 4TO7 и карциномы ободочной кишки CT26 мыши, культивированных в течение приблизительно 24 часов (час) с CoCl2, после чего не нацеленные наночастицы (не нацеленные) или нацеленные с помощью RR-11a наночастицы (нацеленные) NP добавляли к клеткам (n=3 лунок на группу; данные представляют собой среднее±s.e.m). Панель (e) представляет изображения после флуоресцентной микроскопии, визуализирующие распределение NP для клеток опухоли, печени, селезенки и почки от мышей, обработанных нацеленными (верхний ряд) и не нацеленными (нижний ряд) NP по настоящему изобретению, как показано по флуоресценции родамина B (n=2 мыши на группу; масштабные линейки, 100 мкм).
ФИГ.2 демонстрирует, что нацеливание на легумаин усиливает поглощение инкапсулированного в PEG-липосому доксорубицина и улучшает опосредованную NP доставку лекарственного средства к первичным опухолям молочной железы. Панель (a) представляет график средней интенсивности флуоресценции (MFI) в зависимости от времени для клеток 4T1 и 4TO7, культивированных с CoCl2 в течение приблизительно 24 часов и затем инкубированных с композицией нацеленных наночастиц, нагруженных доксорубицином (обозначенных RDZ-218 в настоящем документе), нагруженных доксорубицином не нацеленных NP (NP-Dox) или свободным доксорубицином (свободный Dox) в течение указанных периодов времени, с последующим анализом проточной цитометрией для определения средней интенсивности флуоресценции (MFI) доксорубицина (n=3 лунки на группу для каждой временной точки; данные представляют собой среднее±s.e.m). Панель (b) представляет столбчатые диаграммы, показывающие процент поглощенной концентрации лекарственного средства, как определено сравнением MFI для клеток, обработанных RDZ-218, NP-Dox и свободным Dox, с MFI для серийно разведенного доксорубицина. Панель (c) представляет столбчатую диаграмму, сравнивающую относительный процент мертвых клеток 4T1 и 4TO7 после контрольной обработки (без обработки), обработки свободным Dox, NP-Dox, свободным RR-11a, NP-RR-11a (без доксорубицина) и RDZ-218, приблизительно через 24 часа после обработки, как определено анализом графика прямого и бокового рассеяния при проточной цитометрии (данные показаны относительно необработанных клеток (контроль); n=3 лунки на группу; данные представляют собой среднее±s.e.m. *p<0,05, **p<0,005). Панель (d) представляет изображения при флуоресцентной микроскопии клеток опухоли (верхний ряд), печени (средний ряд) и сердца (нижний ряд) самок мышей BALB/c, которым клетки 4TO7 инъецировали в жировое тело паховой молочной железы; опухолям позволяли приживаться в течение приблизительно 5 суток (сут.), до размера приблизительно 500 мм3, после чего мышам вводили две i.v. инъекции RDZ-218, NP-Dox или свободного Dox; мышей умерщвляли приблизительно через 24 часа после последней инъекции, и ткани выделяли и немедленно анализировали флуоресцентной микроскопией для детекции распределения доксорубицина; срезы также окрашивали DAPI для визуализации ядер клеток (n=2 мыши на группу; масштабные линейки, 100 мкм).
ФИГ.3 демонстрирует, что терапевтическая обработка мышей, несущих опухоль 4TO7, с помощью RDZ-218 приводит к полной супрессии роста первичной опухоли молочной железы без токсичности для мышей, обработанных 5 i.v. инъекциями RDZ-218, NP-Dox, свободного доксорубицина (свободный Dox), пустых конгъюгированных с RR-11a NP (NP-RR-11a), или фосфатно-солевого буфера (PBS) с 3-суточными интервалами; точки данных представляют сутки лечения; n=5 мышей на группу. Панель (a) представляет график размера опухоли в зависимости от времени (данные представляют собой среднее±s.e.m.). Панель (b) представляет изображения первичных опухолей, снятые до иссечения; изображения являются репрезентативными для каждой группы. Панель (c) представляет столбчатую диаграмму, сравнивающую массу опухоли во влажном состоянии для первичных опухолей от мышей из каждой группы обработки (данные представляют собой среднее±s.e.m; *p<0,05). Панель (d) представляет столбчатую диаграмму, сравнивающую положительные по TUNEL (апоптотические) клетки опухолей от мышей из каждой группы обработки (n=5 полей на срез; данные представляют собой среднее±s.e.m; ***p<0,0005). Панель (e) представляет столбчатую диаграмму, сравнивающую изменение массы тела для мышей из каждой группы обработки (массу первичной опухоли вычитали из общей массы тела на время умерщвления и сравнивали с массой тела до заражения клетками опухоли для определения изменения массы тела; данные представляют собой среднее±s.e.m; контрольные группы сравнивали с обработанной RDZ-218 группой, **p=0,0029, ***p < 0,001).
ФИГ.4 схематически иллюстрирует добавление по Михаэлю остатка цистеина легумаина к аза-Asn акцептору Михаэля на панели (a); реакцию остатка Cys легумаина с аза-Asn-эпоксидом на панели (b) и реакцию остатка Cys легумаина с аза-Asn-галометилкетоном на панели (c).
ФИГ.5. Физико-химическая характеризация NP с присоединенным RR-11a. Нацеленные на легумаин NP, нагруженные CDDO-Im (A), без CDDO-Im (B), или не нацеленные NP, нагруженные CDDO-Im (C) или без CDDO-Im (D), анализировали динамическим световым рассеянием и TEM (врезка) для определения распределения размеров частиц (диаметр, нм) и дзета-потенциала (мВ). Масштабная линейка=100 нм.
ФИГ.6. Инкапсулированный CDDO-Im ингибирует фосфорилирование STAT-3 в клетках и первичных опухолях рака молочной железы мыши по анализу Вестерн-блоттингом. (A) Клетки рака молочной железы мыши 4T1 обрабатывали IL-6 (10 нг/мл) и CDDO-Im в различных концентрациях. (B) клетки рака молочной железы мыши 4TO7 обрабатывали IL-6 (10 нг/мл) в комбинации со свободным CDDO-Im (свободным CDDO), пустыми нацеленными NP (Leg-NP), не нацеленными NP с инкапсулированным CDDO-Im (NP-CDDO) или нацеленными NP с инкапсулированным CDDO-Im (Leg-NP-CDDO). (C) экстракты первичных опухолей MMTV-Neu получали от мышей после обработки 8 i.v. инъекциями PBS (дорожка 1), Leg-NP (дорожка 2) или Leg-NP-CDDO (дорожка 3).
ФИГ.7. Терапевтическая обработка Leg-NP-CDDO ингибирует рост опухолей 4TO7. (A) Схема обработки мышей, зараженных 5×103 клеток опухоли 4TO7 и обработанных Leg-NP-CDDO, или контрольных (PBS, свободный CDDO, NP-CDDO или Leg-NP) (n=8 мышей/группу). (B) Опухоли пальпировали каждые 2 суток, и рассчитывали размер опухолей. Данные представляют собой среднее±s.e.m. (C) Массы опухолей измеряли на сутки 19 и сравнивали с массами тела для определения процента опухолевой нагрузки. Данные представляют собой среднее±s.e.m. *p<0,05.
ФИГ.8. Терапевтическая обработка первичных опухолей MMTV-Neu Leg-NP-CDDO задерживает рост опухолей. (A) Схема обработки мышей, зараженных 1×104 клеток первичной опухоли MMTV-Neu и обработанных Leg-NP-CDDO, или контрольных (PBS или Leg-NP) (n=8 мышей/группу). (B) Опухоли пальпировали каждые 3 суток, и рассчитывали размер опухолей. Данные представляют собой среднее±s.e.m. (C) Массы опухолей измеряли на сутки 46 и использовали для расчета процента опухолевой нагрузки. Данные представляют собой средние±s.e.m, *p<0,05.
ФИГ.9. Leg-NP-CDDO модулирует профили экспрессии цитокинов и факторов роста опухолей in vivo. Экстракты цельной ткани получали из первичных опухолей MMTV-Neu, выделенных из мышей, обработанных, как описано на ФИГ.8A. Проводили анализ Вестерн-блоттингом (левые панели) и оценивали количественно относительно актина (правые графики) для определения экспрессии белка для ассоциированных с Th1 (A) и Th2 (B) факторов роста и цитокинов. Кроме того, определяли также экспрессию антиапоптотических белков (C). Данные представляют собой среднее±s.e.m. из 3 независимых экспериментов. *p<0,05 и **p<0,005.
ФИГ.10. Терапевтическая обработка Leg-NP-CDDO модулирует инфильтрацию иммуноцитов в первичные опухоли. Мышей обрабатывали, как изображено на фигуре 8A. (A-C) Через 46 суток после заражения клетками опухоли, суспензии отдельных клеток живых первичных опухолей анализировали проточной цитометрией для детекции активированных CD8+ T-клеток (A), макрофагов (B) или дендритных клеток (C). Данные представляют собой среднее±s.e.m. (D) Макрофаги M1 идентифицировали в замороженных срезах опухолей посредством иммуногистохимии с использованием антител против F4/80 (красное окрашивание) и NOS2 (светлое окрашивание). Ядра клеток окрашивали DAPI (темное окрашивание). Масштабная линейка = 100 мкм.
ФИГ.11. Комбинированная терапия Leg-NP-CDDO и pNeuTm усиливает противоопухолевый иммунологический надзор и предотвращает рецидив рака молочной железы. (A) Схема расписания обработки для исследования рецидивов опухолей. Мышей заражали ортотопически клетками первичной опухоли MMTV-Neu (сутки 0, черная пунктирная стрелка), обрабатывали Leg-NP-CDDO или контрольными NP (серые сплошные стрелки) и вакцинировали pNeuTm или pVector (серые пунктирные стрелки). Первичные опухоли хирургически удаляли после достижения размера ~500 мм3 (черная сплошная стрелка). Через четыре недели мышей повторно заражали в жировое тело контралатеральной молочной железы клетками первичной опухоли MMTV-Neu (сутки 53, черная пунктирная стрелка). Определяли измерения опухолей и использовали для расчета размера опухоли (n=5 мышей/группу). Данные представляют собой среднее±s.e.m. (B) Мышей умерщвляли, когда вторичные опухоли достигали объема 500 мм3. Мышей без опухолей умерщвляли через 128 суток после исходного заражения клетками опухоли. Спленоциты от вакцинированных pNeuTm мышей, обработанных PBS, Leg-NP или Leg-NP-CDDO, культивировали с облученными клетками первичных опухолей MMTV-Neu и анализировали проточной цитометрией. Данные представляют собой среднее±s.e.m. *p<0,05. (C) Спленоциты от обработанных Leg-NP-CDDO/pNeuTM мышей культивировали с облученными клетками первичных опухолей HEVc или MMTV-Neu и анализировали проточной цитометрией. Экспрессию белка HER-2 подтверждали Вестерн-блоттингом. Данные представляют собой среднее±s.e.m. ***p<0,0005.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к новому способу нацеливания NP с использованием нацеливающей группы, которая связывается с легумаином, аспарагинил-эндопептидазой. Настоящее изобретение относится к водной нацеливающей на опухоли композиции липосомных наночастиц, содержащей водную дисперсию липосомных наночастиц. Наночастицы предпочтительно инкапсулируют противораковое химиотерапевтическое средство, которое можно добавлять к предварительно сформированной липосомной композиции или можно включать в липосомы во время формирования липосом. Липосомные наночастицы содержат нацеливающий на легумаин липид, смешанный с одним или несколькими другими формирующими мицеллы или везикулы липидными материалами в форме дисперсии липосомных наночастиц, предпочтительно включающих конъюгированный с полиэтиленгликолем липид. Предпочтительная композиция липосомных наночастиц содержит (a) нацеливающий на легумаин липидный компонент, (b) цвиттер-ионный липидный компонент; (c) аминозамещенный липидный компонент; (d) нейтральный липидный компонент; и (e) конъюгированный с полиэтиленгликолем липидный компонент, например, композицию PEG-липосом. Нацеливающий на легумаин липидный компонент содержит гидрофобную липидную часть, ковалентно присоединенную к связывающей легумаин группе.
Связывающая легумаин группа может представлять собой любой материал, который избирательно образует стабильный комплекс или ковалентную связь с легумаином, например, необратимые ингибиторы легумаина, которые, как правило, содержат пептидный каркас с аффинностью к легумаину, такой как Ala-Ala-Asn (или Ala-Ala-X, где X представляет собой модифицированный остаток Asn, такой как аза-Asn), присоединенный к реакционноспособной функциональной группе, например, аза-Asn-галометилкетоны, аза-Asn-эпоксиды и аза-Asn акцепторы Михаэля, содержащие α,β-ненасыщенную карбонильную группу в качестве акцептора Михаэля. Такие аза-Asn группы вступают в реакцию с остатком цистеина в активном участке легумаина с образованием ковалентной сульфидной связи между ингибитором и легумаином, например, как показано на ФИГ.4.
Упомянутая нацеливающая группа представлена формулой (I):
,
которая представляет собой синтетический аза-пептидный ингибитор легумаина типа акцептора Михаэля, содержащий два остатка аланина, присоединенные к модифицированной группе аза-Asn, которая включает электронодефицитную двойную связь, действующую как акцептор Михаэля для остатка цистеина в активном участке легумаина. Формула (I) представляет реакционноспособную часть ингибитора легумаина типа аза-Asn акцептора Михаэля, известного как RR-11a:
,
в которой сукцинимидилокси-группа RR-11a заменена на фосфолипид. Для удобства, структуру формулы (I) обозначают в настоящем документе как RR-11a в ссылках на нацеливающие на легумаин липидные материалы.
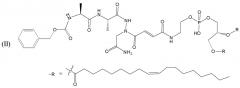
Предпочтительный нацеливающий на легумаин липид содержит соединение формулы (II):
Экспрессией легумаина на поверхности клеток управляет гипоксический стресс, отличительный признак солидных опухолей, и для покрытых полиэтиленгликолем (PEG) липосом с присоединенной нацеливающей на легумаин группой, такой как RR-11a, показаны высокая аффинность лиганд-рецептор, поглощение и превосходное проникновение в опухоли. Противораковое химиотерапевтическое средство, такое как доксорубицин, доставляемый посредством композиции конъюгированных с RR-11a PEG-липосом по изобретению, приводит к значительно улучшенной избирательности для опухолей, уменьшенной чувствительности к лекарственному средству и исключенной системной токсичности лекарственного средства.
Часть носителя наночастиц (NP) из нацеленных липосомных композиций по настоящему изобретению предпочтительно содержит мембранный липид, такой как везикула или другая мембранная структура, например, липосома или мицелла, способная инкапсулировать противораковое химиотерапевтическое средство, такое как доксорубицин. Предпочтительные NP содержат материал, обладающий гидрофобной липидной частью и гидрофильной частью, расположенными так, что липосомы или мицеллы образуются, когда материал диспергируют в водной системе. ФИГ.1, панель (a) иллюстрирует один из предпочтительных мембранных липидных материалов (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин, DOPE). Термин «липид» относится к любому производному жирной кислоты, способному формировать бислой или мицеллу, так что гидрофобная часть липидного материала ориентирована к бислою, в то время как гидрофильная часть ориентирована к водной фазе. Гидрофильные характеристики происходят от присутствия фосфата, фосфоната, карбоксилата, сульфата, сульфоната, сульфгидрила, амино, нитро, гидроксила или других подобных групп, которые хорошо известны в данной области. Гидрофобность можно придавать включением групп, которые включают в себя, но без ограничения, насыщенные и ненасыщенные алифатические углеводородные группы с длинной цепью из вплоть до 20 атомов углерода, и такие группы, замещенные одной или несколькими арильными, гетероарильными, циклоалкильными и/или гетероциклическими группой(-ами). Предпочтительными липидами являются фосфоглицериды и сфинголипиды. Репрезентативные примеры фосфоглицеридов включают в себя фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидную кислоту, пальмитоилолеоил, фосфатидилхолин, лизофосфатидилхолин, лизофосфатидилэтаноламин, дипальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, дистеароилфосфатидилхолин и дилинолеоилфосфатидилхолин. Соединения, в которых отсутствуют содержащие фосфор группы, такие как семейства сфинголипидов и гликосфинголипидов, также входят в группу, обозначенную как липид. Кроме того, амфипатические липиды, описанные выше, можно смешивать с другими липидами, включая триглицериды и стеролы.
Ингибитор легумаина/нацеливающее на опухоли средство можно присоединять к липосомным наночастицам в любом подходящем положении, например, на конце линейной цепи или в любом ее промежуточном положении, пока присоединение не мешает связыванию нацеливающего на опухоли средства к опухоли, экспрессирующей легумаин. Нацеливающее на опухоли средство может также включать необязательную двухвалентную мостиковую группу, или его можно снабжать необязательной двухвалентной мостиковой группой для облегчения присоединения к наночастицам, если желательно.
Композиции по настоящему изобретению могут преимущественно инкапсулировать любое противораковое химиотерапевтическое средство (например, противоопухолевое средство) для нацеленной доставки к экспрессирующим легумаин опухолям. Такие химиотерапевтические средства описаны, например, в Imai and Takaoka, Nat. Rev. Cancer 6, 714-726 (2006), полное содержание которого приведено в настоящем документе в качестве ссылки. Такие химиотерапевтические средства включают в себя в качестве неограничивающих примеров: алкилирующие средства (например, цисплатин; карбоплатин; оксалиплатин; мехлорэтамин; циклофосфамид; хлорамбуцил; ифосфамид); производные и аналоги пурина и пиримидина (например, 5-фторурацил; флоксуридин; арабинозид цитозина; меркаптопурин; тиогуанин; азатиоприн; флударабин; пентостатин; кладрибин); ингибиторы топоизомеразы (например, этопозид; фосфат этопозида; тенипозид; амсакрин); таксаны (например, паклитаксел); антифолаты (например, метотрексат; триметоприм, пириметамин; пеметрексед); ингибиторы ангиогенеза (например, витаксин; анекорват, ангиостатин; эндостатин; свкаламин; антиангиогенные фрагменты триптофанил-т-РНК-синтетазы, такие как T2-TrpRS); противоопухолевые моноклональные антитела (например, бевацизумаб; тивозаниб; вандетаниб; ваталаниб; алемтузумаб; цетуксимаб; гемтузумаб; ибритумомаб; панитумумаб; ритуксимаб; тозитумомаб; трастузумаб); и другие антинеопластические или химиотерапевтические средства, такие как цитотоксические антибиотики (например, актиномицин; блеомицин; пликамицин; митомицин); антрациклиновые антибиотики (например, доксорубицин; эпирубицин; даунорубицин; валрубицин; идарубицин); ингибиторы тритерпеноида Stat3 (например, урсоловая кислота; 2-циано-3,12-диоксоолеана-1,9-диен-28-овый сложный эфир; 2-циано-3,12-диоксоолеана-1,9-диен-28-овый амид, такой как 1-[2-циано-3,12-диоксоолеана-1,9(11)-диен-28-оил]имидазол (известный также как DDO-Im)); и т.п., а также их физиологически приемлемые соли и пролекарства.
В некоторых предпочтительных вариантах осуществления химиотерапевтическое средство представляет собой противоопухолевое средство, такое как агонист или антагонист рецептора или лиганд рецептора, вовлеченный в рост опухоли.
Режимы дозирования для комплексов нацеленная липосома/химиотерапевтическое средство или содержащих их композиций основаны на нескольких факторах, таких как возраст, масса, пол и тип медицинского состояния пациента, тяжесть состояния, способ введения и активность связывания конкретной используемой нацеливающей молекулы. Режим дозирования можно менять в зависимости от вышеупомянутых факторов. Уровни дозирования порядка от приблизительно 0,01 миллиграмм до приблизительно 1000 миллиграмм на килограмм массы тела являются пригодными для лечения вышеупомянутых медицинских состояний. Предпочтительные уровни дозирования лежат в диапазоне от приблизительно 0,01 миллиграмм до приблизительно 100 миллиграмм на килограмм массы тела.
Для введения посредством инъекции комплекс нацеленная липосома/химиотерапевтическое средство или содержащую его композицию, воплощающие настоящее изобретение, составляют с фармацевтически приемлемым носителем, таким как вода, солевой раствор или водный раствор декстрозы. Для инъекции типичная ежесуточная доза составляет от приблизительно 0,01 милиграмм до приблизительно 100 милиграмм на килограмм массы тела, инъецированных ежесуточно в форме однократной дозы или в форме множественных доз в зависимости от вышеупомянутых факторов.
Следующие неограничивающие примеры дополнительно иллюстрируют конкретные аспекты настоящего изобретения.
ПРИМЕР 1: Составление и характеризация нацеленных на легумаин наночастиц
Композиции наночастиц. Синтез R-11a описан в литературе. См., например, Ekici, O.D., et al. Aza-peptide Michael acceptors: a new class of inhibitors specific for caspases and other clan CD cysteine proteases. J Med Chem 47, 1889-1892 (2004) или Ovat, A., et al. Aza-peptidyl Michael acceptor and epoxide inhibitors-potent and selective inhibitors of Schistosoma mansoni and Ixodes ricinus legumains (asparaginyl endopeptidases). J Med Chem 52, 7192-7210 (2009). Все фосфолипиды (Avanti Polar Lipids) растворяли в хлороформе. Для достижения нацеливания конец карбоновой кислоты аза-пептида модифицировали активацией этой группы гидрохлоридом 1-(3-диментиламинопропил)-3-этилкарбодимида (EDC) с последующей реакцией с N-гидроксисукцинамидом для получения NHS-сложного эфира. RR-11a синтезировали в WuXi AppTec Co. Ltd. Во-первых, получали конъюгированные с RR-11a NP, реакцией RR-11a с 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламином (DOPE) при молярном соотношении приблизительно 1:1 в присутствии триэтиламина (TEA) в течение приблизительно 24 часов при окружающей комнатной температуре (RT). Во-вторых, полученное соединение объединяли с 1,2-ди-(9Z-октадеценоил)-sn-глицеро-3-фосфохолином (DOPC), DOPE, холестерином и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликолем)-2000] (DOPE-PEG) при молярном соотношении приблизительно 1,1:6,7:6,7:2,2:1, как описано ранее для другой липосомной системы. См.: Hood, J.D., et al. Tumor regression by targeted gene delivery to the neovasculature. Science 296, 2404-2407 (2002). Распределение размеров определяли динамическим световым рассеянием на анализаторе светового рассеяния ZETASIZER NANO® (Malvern).
Загрузка доксорубицина в наночастицы. Доксорубицин загружали в NP следующим образом. Кратко, липидную пленку регидратировали в приблизительно 1 мл стерильного буфера фосфата аммония (300 мМ, pH 7,4) и перемешивали в течение минимум приблизительно 1 часа с последующей обработкой ультразвуком для получения SUV. Внешний буфер фосфат аммония заменяли на PBS (pH 7,4) посредством гель-фильтрационной хроматографии на колонках NAP-10 (GE Healthcare). Затем добавляли доксорубицин в воде в форме 10 мМ раствора, и смесь инкубировали в течение ночи при RT. Наконец, липосомы с включенным доксорубицином очищали посредством гель-фильтрационной хроматографии с помощью колонок NAP-10 с использованием буфера PBS (pH 7,4) в качестве элюента. Композицию конъюгированных с RR-11a липосомных NP, нагруженных доксорубицином, обозначили RDZ-218.
Конъюгации RR-11a с DOPE достигали, сначала модифицируя конец карбоновой кислоты аза-пептида посредством активации этой группы гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодимида (EDC), с последующей реакцией с N-гидроксисукцинамидом для получения сложного эфира NHS и присоединения к аминогруппе DOPE в хлороформе, с использованием триэтиламина в качестве катализатора; см. ФИГ.1, панель (a). Гипоксию опухоли детектировали окрашиванием с помощью антитела Glut-1 и визуализировали с использованием конъюгированного с флуоресцеином вторичного антитела. Ядра клеток визуализировали окрашиванием DAPI. Масштабные линейки, 100 мкм; см. ФИГ.1, панель (b). Аффинность mAb против легумаина мыши для экспрессированного на мембране клеток легумаина определяли анализом Скэтчарда; см. ФИГ.1, панель (c). Средняя рассчитанная Kd для контрольных и обработанных CoCl2 клеток составляла приблизительно 1,107±0,232 нМ и приблизительно 1,208±0,107 нМ, соответственно. Рассчитанное количество участков связывания для контрольных и обработанных CoCl2 составляло приблизительно 46760 и приблизительно 117800 участков/клетку, соответственно. NP составляли в присутствии липида с DOPE-родамином B, обладающего красной флуореценцией. Клетки карциномы молочной железы 4T1 и 4TO7 и карциномы ободочной кишки CT26 мыши культивировали в течение приблизительно 24 часов с приблизительно 100 мкМ CoCl2, после чего к клеткам добавляли RR-11a- (не нацеленные) или RR-11a+ (нацеленные) NP; см. ФИГ.1, панель (d). После указанных периодов времени NP удаляли, и немедленно получали изображения клеток с использованием флуоресцентной микроскопии, и количественно оценивали процент положительных по родамину B клеток; n=3 лунки на группу. Данные представляют собой среднее±s.e.m. Самкам мышей BALB/c с прижившимися ортотопическими опухолями молочной железы 4T1 один раз инъецировали не нацеленные или нацеленные NP. Мышей умерщвляли через приблизительно 24 часа, и органы анализировали флуоресцентной микроскопией для визуализации распределения NP, как показано по флуоресценции родамина B; n=2 мыши на группу; масштабные линейки, 100 мкм; см. ФИГ.1, панель (e).
ПРИМЕР 2: Нацеливание на легумаин усиливает поглощение инкапсулированного в PEG-липосомы доксорубицина и улучшает опосредованную NP доставку лекарственного средства к первичным опухолям молочной железы
Животные и линии клеток. Самок мышей BALB/c закупали из отдела разведения грызунов The Scripps Research Institute. Все эксперименты на животных проводили согласно Руководству NIH по содержанию и использованию лабораторных животных и с одобрения Комитета по содержанию животных The Scripps Research Institute. Линии клеток карциномы молочной железы мыши 4T1 и 4TO7 предоставлены Suzanne Ostrand-Rosenberg (University of Maryland, College Park, Maryland, USA). Клетки карциномы ободочной кишки мыши CT26 закупали из ATCC.
Исследование связывания и анализ Скэтчарда. Антитело против легумаина мыши (приблизительно 40 мкг) (R&D Systems) инкубировали в течение приблизительно 30 минут (мин) на льду с приблизительно 0,5 мкКи 125I (Amersham) в полистироловых пробирках, покрытых приблизительно 100 мкг реагента IODO-GEN® (Pierce Chemical Co.). Не включенный 125I удаляли гель-фильтрацией на колонках PD-10 (GE Healthcare). Клетки 4T1 (5×105) культивировали в присутствии или в отсутствие 100 мкМ CoCl2 в течение приблизительно 24 часов (час), с последующей инкубацией с приблизительно 14 нМ серийно разведенного 125I-меченного антитела в течение приблизительно 2 часов при приблизительно 4 мкКи. Клетки промывали три раза PBS, содержащим 1% бычий сывороточный альбумин (BSA), и количество связанной радиоактивной метки определяли в α-сцинцилляционном счетчике. Соответствующее количество импульсов в минуту (CPM) использовали для анализа графика Скэтчарда с помощью программного обеспечения PRISM® (GraphPad) и использовали для расчета количества участков связывания легумаина.
Поглощение наночастиц in vitro. Клетки опухолей рассевали при приблизительно 0,3×106 клеток/лунку в 6-луночный планшет. Приблизительно за 24 часа до добавления NP клетки обрабатывали 100 мкМ хлоридом кобальта для стимуляции гипоксии. Конъюгированные с RR-11a или свободные от RR-11a NP, либо пустые, либо нагруженные 0,2 нМ доксорубицином (Sigma), добавляли к клеткам и инкубировали в течение приблизительно 15 и 30 мин или приблизительно 1, 2, 3, 4 и 6 часов, после чего эти клетки промывали PBS и фиксировали 10% цинк-формалином (Fisher Scientific) и немедленно анализировали флуоресцентной микроскопией для визуализации поглощения доксорубицина. Для анализа проточной цитометрией, клетки обрабатывали трипсином после удаления NP, ресуспендировали в буфере FACS и немедленно анализировали среднюю интенсивность флуоресценции.
Анализ биораспределения. Мышам, несущим ортотопические опухоли 4TO7 размером приблизительно 500 мм3, инъецировали i.v. однократной дозой конъюгированных с RR-11a NP (RR-11a+) или свободных от RR-11a NP (RR-11a-), меченных родамином B. Альтернативно, мышам инъецировали три раза с интервалами приблизительно 48 часов RDZ-218, NP-Dox, свободный Dox или PBS. Через 24 часа после последней обработки животных умерщвляли и селезенку, почки, легкие, печень, сердце и опухоль собирали, замораживали в соединении OCT (Tissue-Tek) и немедленно нарезали и получали изображения посредством флуоресцентной микроскопии.
Статистический анализ. Статистическую значимость обнаруженных различий между экспериментальными группами и контролем определяли по 2-стороннему t-критерию Стьюдента с использованием программного обеспечения PRISM® (GraphPad). Обнаружения считали значимыми при <0,05.
Доксорубицин загружали в RR-11a+ NP с использованием градиента фосфата для получения RDZ-218. Доксорубицин также загружали в RR-11a- NP (NP-Dox) в качестве контроля. Как проиллюстрировано на ФИГ.2, панель (a), клетки 4T1 и 4TO7 культивировали с CoCl2 в течение приблизительно 24 часов и затем инкубировали с RDZ-218, NP-Dox или свободным Dox в течение указанных периодов времени, с последующим анализом проточной цитометрией для определения средней интенсивности флуоресценции (MFI) доксорубицина; n=3 лунки на группу для каждой временной точки. Данные представляют собой среднее±s.e.m. Процент поглощенной концентрации лекарственного средства определяли сравнением обработанных MFI RDZ-218, NP-Dox и свободным Dox-клеток с клетками, обработанными серийно разведенным доксорубицином; см. ФИГ.2, панель (b). Относительный процент мертвых клеток 4T1 и 4TO7 приблизительно через 24 часа после обработки RDZ-218, NP-Dox, свободным Dox, свободным RR-11a или пустыми RR-11a+ NP (NP-RR-11a) определяли анализом графика прямого и бокового рассеяния при проточной цитометрии; см. ФИГ.2, панель (c). Данные показаны относительно необработанных клеток (контроль); n=3 лунки на группу. Данные представляют собой среднее±s.e.m. *p<0,05, **p<0,005. Клетки 4TO7 инъецировали в жировое тело паховой молочной железы самок мышей BALB/c. Опухолям позволяли приживаться в течение приблизительно 5 суток, до размера приблизительно 500 мм3, после чего мышам вводили две i.v. инъекции RDZ-218, NP-Dox или свободного Dox. Мышей умерщвляли приблизительно через 24 часа после последней инъекции, и ткани выделяли и немедленно анализировали флуоресцентной микроскопией для детекции распределения доксорубицина; см. ФИГ.2, панель (d). Срезы тканей также окрашивали DAPI для визуализации ядер клеток; n=2 мыши на группу; масштабные линейки, 100 мкм.
ПРИМЕР 3: Терапевтическая обработка мышей RDZ-218 приводит к полной супрессии роста первичной опухоли молочной железы без токсичности
В жировое тело грудных молочных желез самок мышей BA