Упрощение способа получения соединения-предшественника
Иллюстрации
Показать всеИзобретение относится к способу получения радиофармацевтических предшественников для позитрон-эмиссионной томографии, конкретно к способу получения соединения формулы (II). Предлагаемый способ включает стадии (а)-(г). На стадии (а) осуществляют дебензилирование соединения формулы Ia с получением соединения формулы Ib. На стадии (б) осуществляют превращение соединения формулы Ib, полученного непосредственно на стадии (а), в соединение формулы I, где указанное превращение осуществляют путем взаимодействия указанного соединения формулы Ib с подходящей формой X, причем указанное соединение формулы I получают в количестве 100 г или более. На стадии (в) осуществляют взаимодействие соединения формулы I, полученного на стадии (б), с подходящим источником 18F-фторида с получением соединения формулы IIa. На стадии (г) осуществляют снятие защиты с соединения формулы IIa, полученного на стадии (в), для удаления R31 и R32. В указанных формулах x, v, w, n и y являются целым числом от 0 до 4; R11, R21, R1 и R31 представляют собой С1-5алкильную группу с прямой или разветвленной цепью; R12, R22, R2 и R32 представляют собой амино-защитную группу; X представляет собой уходящую группу, выбранную из галогена или группы -O-SO2-R3, где R3 представляет собой галоген, С1-10алкил с прямой цепью или разветвленной цепью, С1-10галогеналкил с прямой цепью или разветвленной цепью и С6-10арил. Предлагаемый способ позволяет проводить процесс без очистки вещества, полученного на стадии дебензилирования, и пригоден для упрощенного получения относительно больших количеств целевого продукта. 14 з.п. ф-лы, 8 пр.
Реферат
Область изобретения
Настоящее изобретение относится к способу получения радиофармацевтических предшественников и, в частности, к защищенным производным аминокислот, которые используют в качестве предшественников для получения аминокислот, меченных радиоактивным изотопом, для применения в методиках визуализации in vivo, таких как позитрон-эмиссионная томография (PET). Кроме того, изобретение включает способ получения указанных меченных радиоактивным изотопом аминокислот.
Предшествующий уровень техники
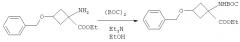
В последние годы в качестве новых радиофармацевтических средств был разработан ряд соединений, представляющих собой меченные радиоактивным галогеном аминокислоты, включая [18F]1-амино-3-фторциклобутанкарбоновую кислоту ([18F]-FACBC). [18F]-FACBC считается эффективной в качестве диагностического агента в отношении высокопролиферативных опухолей, поскольку обладает свойством специфично переноситься переносчиками аминокислот. В EP 1978015 (A1) предложены предшественники соединения [18F]-FACBC и способы получения указанных предшественников. В EP 1978015 (A1) конкретно описан способ получения предшественника - этилового эфира 1-(N-(трет-бутоксикарбонил)амино)-3-[((трифторметил)сульфонил)окси]-циклобутан-1-карбоновой кислоты, включающий следующие стадии:
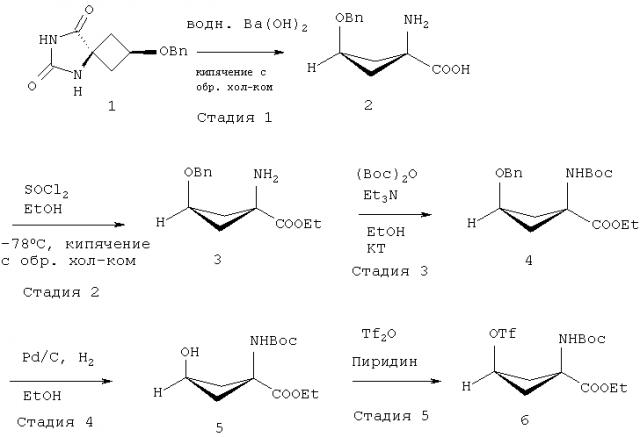
В EP 1978015 (A1) описано, что стадия 1 на приведенной выше реакционной схеме включает гидролиз син-5-(3-бензилоксициклобутан)-гидантоина 1 путем добавления гидроксида бария Ba(OH)2 к раствору и кипячения с обратным холодильником этой смеси при 114°C в течение 24 часов или больше. Син-1-Амино-3-бензилоксициклобутан-1-карбоновую кислоту 2 на стадии 2 образования сложного этилового эфира растворяют в этаноле (EtOH) и подвергают взаимодействию с тионилхлоридом (SOCl2), получая этиловый эфир син-1-амино-3-бензилоксициклобутан-1-карбоновой кислоты 3. Стадия 3 включает присоединение трет-бутоксикарбонила (Boc) к аминной функциональной группе путем взаимодействия соединения 3 с трет-бутилдикарбонатом (Boc)2O, и полученное вещество очищают хроматографией, получая этиловый эфир син-1-(N-(трет-бутоксикарбонил)амино)-3-бензилокси-циклобутан-1-карбоновой кислоты 4. Затем на стадии 4 с бензил-защищенного промежуточного соединения 4 снимают защиту путем растворения соединения 4 в этаноле (EtOH), добавления палладия на активированном угле (Pd/C) и приложения к реакционной смеси небольшого положительного давления H2. Полученное вещество очищают хроматографией, получая этиловый эфир син-1-(N-(трет-бутоксикарбонил)амино)-3-бензилокси-циклобутан-1-карбоновой кислоты 5 для использования на стадии 5, которая включает взаимодействие соединения 5 с трифторметансульфоновым ангидридом (Tf2O), за которым следует хроматографическая очистка с последующей перекристаллизацией вещества с получением этилового эфира син-(N-(трет-бутоксикарбонил)амино)-3-[((трифторметил)сульфонил)окси]-циклобутан-1-карбоновой кислоты 6. Похожие способы описаны в EP 2230229 и US 2010016626. Способы, раскрытые во всех этих документах предшествующего уровня техники, подходят для мелкомасштабного получения для научных целей.
Было бы желательно снизить сложность вышеописанной многостадийной химической реакции с целью уменьшения времени осуществления способа, количества используемого оборудования и химических реагентов и облегчения масштабирования.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу получения соединений-предшественников для [18F]-FACBC и подобных соединений, который является более простым относительно известных способов. В способе по этому изобретению исключена одна из стадий очистки, предложенная в предшествующем уровне техники, и это по существу дает возможность получать соединения-предшественники более эффективным по экономическим и временным параметрам образом.
Подробное описание изобретения
В одном аспекте настоящее изобретение относится к способу получения соединения формулы I:
,
где:
R1 представляет собой С1-5алкильную группу с прямой или разветвленной цепью;
R2 представляет собой амино-защитную группу;
X представляет собой уходящую группу, выбранную из галогена или группы -O-SO2-R3, где R3 представляет собой галоген, C1-10алкил с прямой цепью или разветвленной цепью, C1-10галогеналкил с прямой цепью или разветвленной цепью и C6-10арил; и
n является целым числом от 0 до 4;
включающему:
(a) дебензилирование соединения формулы Ia:
,
где R11, R12 и v являются такими, как определено для R1, R2 и n в формуле I, соответственно;
с получением соединения формулы Ib:
,
где R21, R22 и w являются такими, как определено для R1, R2 и n в формуле I, соответственно;
(б) превращение соединения формулы Ib, полученного непосредственно на стадии (a), в соединение формулы I путем взаимодействия с подходящей формой X, как определено выше для формулы I.
Термин "алкил", используемый отдельно или в комбинации, означает группу с прямой цепью или разветвленной цепью, имеющую общую формулу CnH2n+1. Величина n в этой общей формуле указана в конкретных случаях. Примеры некоторых предпочтительных алкильных групп включают метильную, этильную, 1-пропильную или изопропильную группы.
Под термином "защитная группа" понимают группу, которая ингибирует или подавляет нежелательные химические реакции, но которая предназначена быть достаточно реакционноспособной, чтобы она могла отщепляться от рассматриваемой функциональной группы в достаточно мягких условиях, при которых остальная часть молекулы не изменяется, с получением целевого продукта. Защитные группы хорошо известны специалистам в данной области и описаны в "Protective Groups in Organic Synthesis", Theorodora W. Greene and Peter G.M. Wuts (Fourth Edition, John Wiley & Sons, 2007). Подходящие амино-защитные группы хорошо известны в данной области. Подходящей амино-защитной группой R2 является карбамат. Предпочтительно R2 выбран из: трет-бутилкарбамата (BOC), 9-флуоренилметилкарбамата (Fmoc), метилкарбамата, этилкарбамата, 2-хлор-3-инденилметилкарбамата (Climoc), бенз[f]инден-3-илметилкарбамата (Bimoc), 2,2,2-трихлорэтилкарбамата (Troc), 2-хлорэтилкарбамата, 1,1-диметил-2,2-дибромэтилкарбамата (DB-t-BOC), 1,1-диметил-2,2,2-трихлорэтилкарбамата (ТСВОС), бензилкарбамата (Cbz) и дифенилметилкарбамата. Для получения N-трет-бутоксикарбонила R2 наиболее предпочтительно представляет собой трет-бутилкарбамат.
Термин "уходящая группа" относится к группировке, подходящей для нуклеофильного замещения, и означает молекулярный фрагмент, уходящий с электронной парой при гетеролитическом разрыве связи.
Термин "галоген" или "галогено-", используемый отдельно или в комбинации, относится к заместителю, выбранному из фтора, хлора, брома или йода.
Термин "C1-10галогеналкил" относится к алкильной группе, которая определена выше, содержащей 1-10 атомов углерода, где по меньшей мере один водород заменен галогеном, при этом галоген является таким, как определено выше.
Термин "C6-10арил" относится к моновалентному ароматическому углеводороду, имеющему единственное кольцо (то есть фенилу) или конденсированные кольца (то есть нафталину). Если не указано иное, такие арильные группы обычно содержат от 6 до 10 кольцевых атомов углерода.
Термин "дебензилирование" относится к отщеплению от соединения бензильного заместителя. Термин "бензил" относится к группе с химической структурой C6H5CH2-. Дебензилирование является способом, хорошо известным в данной области, и его обычно осуществляют посредством "каталитического гидрирования", представляющего собой реакцию, в результате которой углерод-углеродная связь расщепляется или подвергается "разрушению" под действием водорода. Гидрогенолиз обычно осуществляют каталитическим методом, например, с использованием палладия на угле (Pd/C) в качестве катализатора. Если на стадии дебензилирования используют такой катализатор, как Pd/C, то удаление катализатора из реакционной смеси осуществляют путем фильтрования перед началом следующей стадии. Термин "фильтрование" относится к механическому отделению твердых веществ от жидкостей. Неограничивающие примеры подходящих средств для фильтрования для применения в настоящем изобретении включают воронку с фильтром из пористого стекла или воронку для фильтрования, дополненную фильтром из стекловолокна, хотя также подходят и другие более специализированные методы фильтрования. В общем случае после стадии дебензилирования (а) и перед стадией превращения (б) реакционный растворитель удаляют путем сушки. Сушка может быть осуществлена методами, хорошо известными специалисту в данной области, например путем упаривания в токе азота и/или вакуумной сушки.
Термин "полученный непосредственно" означает то, что после стадии (а) и перед стадией (б) никаких стадий очистки реакционной смеси не выполняют. В частности, реакционную смесь, полученную в результате выполнения стадии (а), далее не очищают хроматографией перед выполнением стадии (б). Альтернативная формулировка: стадию (а) выполняют при условии, что реакционную смесь, полученную на стадии (а), не очищают перед выполнением стадии (б) и, в частности, при условии, что реакционную смесь со стадии (а) не очищают хроматографией после стадии (а) и перед стадией (б). Термин "хроматография" хорошо известен в данной области техники и относится к лабораторному методу разделения химических веществ друг от друга в смеси разных веществ. Хроматографическое разделение включает пропускание смеси, растворенной в подвижной фазе, через неподвижную фазу, на которой происходит отделение представляющей интерес молекулы от других молекул в этой смеси, основанное на неодинаковом распределении между подвижной и неподвижной фазами.
Термин "подходящая форма X" означает X, как он определен в данном описании, в форме, которая может заместить гидроксильную функциональную группу в реакции замещения.
Соединения формулы 1а можно получить, следуя описанным в EP 1978015 (A1) способам или адаптируя их. Например, соединение 4, конкретно описанное в EP 1978015 (A1), является соединением формулы Ia, подходящим для применения в способе по настоящему изобретению. Способ, описанный в EP 1978015 (A1) с получением указанного соединения 4, проиллюстрирован ниже на Схеме 1:
Способы получения соединений формулы Ia также описаны McConathy et al (Appl Rad Isotop 2003; 58: 657-666). Соединение 6 на Фиг.2 из McConathy et al является соединением формулы Ia. Способ получения указанного соединения 6, описанный в McConathy et al, проиллюстрирован ниже на Схеме 2:
Гидантоин 1 обрабатывали 3 н. водным гидроксидом натрия при 180°C, затем ди-трет-бутилдикарбонатом, получая N-Вос-кислоту 5. Метиловый эфир 6 получали с высоким выходом путем взаимодействия соединения 5 с триметилсилилдиазометаном.
В компетенции специалиста в данной области адаптировать описанные выше способы предшествующего уровня техники для получения других соединений формулы Ia, которые подпадают под определение настоящего изобретения. Если исходное гидантоиновое соединение включает смесь син- и ати-энантиомеров, то это приемлемо. Нет необходимости в активном разделении энантиомеров на какой-либо стадии способа.
В предпочтительном воплощении изобретения X представляет собой группу -O-SO2-R3. Когда X представляет собой -O-SO2-R3, то X наиболее предпочтительно выбран из группы, состоящей из толуолсульфоновой кислоты, нитробензолсульфоновой кислоты, бензолсульфоновой кислоты, трифторметансульфоновой кислоты, фторсульфоновой кислоты и перфторалкилсульфоновой кислоты. В особенно предпочтительном воплощении -O-SO2-R3 представляет собой трифторметансульфоновую кислоту. Группа -O-SO2-R3 может быть присоединена на стадии (б) способа по изобретению путем взаимодействия соединения формулы Ib с электрофильным производным желаемой группы -O-SO2-R3, которое является примером "подходящей формы X". Например, если желательно присоединить трифторметансульфоновую кислоту, то соединение формулы Ib можно подвергнуть взаимодействию с трифторметансульфоновым ангидридом.
В альтернативном предпочтительном воплощении X представляет собой галоген. Если X представляет собой галоген, то наиболее предпочтительно представляет собой бром или хлор. Стадия (б) способа по изобретению, где X представляет собой галоген, может быть осуществлена способами, хорошо известными специалистам в данной области. Например, соединение формулы I, где X представляет собой хлор, может быть получено путем взаимодействия соединения формулы Ib с хлорид-содержащим реагентом, таким как тионилхлорид, пентахлорид фосфора (PCl5), трихлорид фосфора (PCl3), каждый из которых является примером "подходящей Формы X". Соединение формулы I, где X представляет собой бром, может быть получено путем взаимодействия соединения формулы Ib с бром-содержащим реагентом, таким как бромистоводородная кислота (HBr) или трибромид фосфора (PBr3), каждый из которых опять является примером "подходящей формы X".
Предпочтительно R1 представляет собой метил или этил; наиболее предпочтительно представляет собой этил. Такое предпочтительное определение для R1 равно применимо к R11 и R21.
R2 предпочтительно представляет собой карбонатную сложноэфирную защитную группу, где термин "карбонатный сложный эфир" относится к функциональной группе, состоящей из карбонильной группы с двумя алкоксигруппами, расположенными по обеим ее сторонам, имеющей общую структуру RxO(C=O)ORy. Наиболее предпочтительно R2 представляет собой трет-бутоксикарбонильную группу. Такое предпочтительное определение для R2 равно применимо к R12 и R22.
Предпочтительно n равно 0 или 1 и наиболее предпочтительно равно 0. Такое предпочтительное определение для n равно применимо к v и w.
В особенно предпочтительном воплощении способа по настоящему изобретению указанное соединение формулы I представляет собой:
,
указанное соединение формулы Ia представляет собой:
,
и указанное соединение формулы Ib представляет собой:
,
где Et представляет собой этил, OTf представляет собой трифторметансульфоновую кислоту, а Boc представляет собой трет-бутилоксикарбонил.
Способ по настоящему изобретению уменьшает продолжительность процесса и снижает стоимость товара по сравнению со способами предшествующего уровня техники, поскольку является возможным проведение двух следующих друг за другом стадий реакции без очистки вещества, полученного на стадии дебензилирования. Внедрение этой модификации способа уменьшает время работы вследствие удаления одной стадии хроматографической очистки. Превращение неочищенного продукта, содержащего соединение формулы Ib, осуществляют просто путем перерастворения вещества и последующего выполнения стадии (б) способа. В нижеследующих экспериментальных примерах продемонстрировано, что в сравнении со способом предшествующего уровня техники способ по изобретению приводит к получению целевого соединения формулы 1 с аналогичной чистотой. Существенное преимущество способа по изобретению заключается в том, что он поддается масштабированию, тогда как способы предшествующего уровня техники нет. Таким образом, способ по изобретению особенно полезен при крупномасштабном получении, например при получении 100 граммов или больше, например, 300 граммов или до 500 граммов или больше.
Соединение формулы I, полученное способом по изобретению, представляет собой соединение-предшественник, полезное в радиохимическом синтезе некоторых 18F-меченных соединений. Таким образом, согласно настоящему изобретению также предложен способ получения соединения формулы II:
,
где x является таким, как определено для n выше;
и где указанный способ включает способ, который определен в данном описании для получения соединения формулы I, и дополнительные стадии:
(в) взаимодействие соединения формулы I, которое определено в данном описании, с подходящим источником 18F-фторида с получением соединения формулы IIa:
,
где R31, R32 и y являются такими, как определено в данном описании для R1, R2 и n, соответственно; и
(г) снятие защиты с соединения формулы IIa, полученного на стадии (в), для удаления R31 и R32.
В типичном случае [18F]-фторид-ион получают в виде водного раствора, который представляет собой продукт облучения мишени - [18O]-воды. Обычно для превращения [18F]-фторида в реакционноспособный нуклеофильный реагент, такой, который подходит для использования в реакциях нуклеофильного мечения радиоактивным изотопом, проводят различные стадии. Как и в случае нерадиоактивного фторирования, эти стадии включают удаление воды от [18F]-фторид-иона и предоставление подходящего противоиона (Handbook of Radiopharmaceuticals 2003, Welch & Redvanly eds., Chapter 6, pp.195-227). Затем проводят реакцию радиофторирования с использованием безводных растворителей (Aigbirhio et al., 1995, J Fluor Chem, 70: pp.279-87).
Для улучшения реакционной способности [18F]-фторид-иона в отношении реакций фторирования добавляют катионный противоион, после чего удаляют воду. Чтобы растворимость [18F]-фторид-иона сохранилась, противоион должен обладать достаточной растворимостью в безводном реакционном растворителе. Таким образом, используемые противоионы включают большие, но "мягкие" ионы металлов, таких как рубидий или цезий, калий в комплексе с криптандом, таким как Kryptofix™, или соли тетраалкиламмония. Предпочтительным противоионом в отношении реакций фторирования является калий в комплексе с криптандом, таким как Kryptofix™, вследствие его хорошей растворимости в безводных растворителях и улучшенной реакционной способности по отношению к фторидам.
Стадию снятия защиты (г) осуществляют способами, которые хорошо известны специалистам в данной области. Большое разнообразие защитных групп, а также способы их удаления описаны в "Protective Groups in Organic Synthesis", Theorodora W. Greene and Peter G.M. Wuts (Fourth Edition, John Wiley & Sons, 2007). В предпочтительном воплощении перед удалением амино-защитной группы R32 удаляют карбокси-защитную группу R31. Например, если R31 представляет собой Et, то ее можно удалить основным гидролизом, и если R32 представляет собой Boc, то ее можно удалить потом кислотным гидролизом.
Диапазон подходящих и предпочтительных определений для n, как они предложены выше, равно применим к x и y в формулах II и IIa.
Диапазон подходящих и предпочтительных определений R1 и R2, как они предложены выше, равно применим к R31 и R32 соответственно в формулах II и IIa.
В предпочтительном воплощении указанное соединение формулы II представляет собой:
,
а указанное соединение формулы IIa представляет собой:
,
где Et представляет собой этил, и Boc представляет собой трет-бутилоксикарбонил.
В предпочтительном воплощении стадии (в) и (г) осуществляют на автоматическом синтезаторе. Радиоактивные [18F]-индикаторы в настоящее время часто в целях удобства получают на автоматическом приборе для радиохимического синтеза. В продаже имеется несколько вариантов такого прибора, включая Tracerlab™ и Fastlab™ (оба от GE Healthcare Ltd.). Такой прибор обычно содержит "кассету", часто одноразовую, в которой проводят радиохимические превращения, которая вставляется в данный прибор для осуществления радиохимического синтеза. Кассета обычно содержит каналы для жидкостей, реакционный сосуд и отверстия для присоединения содержащих реагенты флаконов, а также любых картриджей для твердофазной экстракции, используемых на стадиях очистки после радиохимического синтеза.
Типичная кассета для автоматизированного синтеза соединения формулы II включает:
(1) сосуд, содержащий соединение формулы I, которое определено в данном описании; и
(2) средство для элюирования содержимого сосуда подходящим источником [18F]-фторида, который определен в данном описании;
(3) ионообменный картридж для удаления избытка [18F]-фторида и
(4) картридж для снятия защиты с соединения формулы IIa для образования соединения формулы II.
Далее изобретение будет описано с использованием нижеследующих экспериментальных примеров.
Краткое описание примеров
В примере 1 описан синтез 5-(3-бензилоксициклобутан)гидантоина.
В примере 2 описан синтез 1-амино-3-(бензилокси)циклобутан-карбоновой кислоты.
В примере 3 описан синтез этилового эфира 1-амино-3-бензилокси-циклобутанкарбоновой кислоты.
В примере 4 описан синтез соединения 1a.
В примере 5 описан синтез очищенного соединения 1b.
В примере 6 описан синтез соединения 1b без очистки.
В примере 7 описан синтез соединения 1 из предшествующего уровня техники с использованием очищенного соединения 1b.
В примере 8 описан синтез по данному изобретению соединения 1 с использованием неочищенного соединения 1b.
Список сокращений, использованных в примерах
| DCM | дихлорметан |
| EtOAc | этилацетат |
| Et2O | диэтиловый эфир |
| Et3N | триэтиламин |
| г | грамм(ы) |
| ч | час(ы) |
| л | литр(ы) |
| мин | минута(ы) |
| мл | миллилитр(ы) |
| моль | моль(и) |
| насыщ. водн. | насыщенный водный, |
| TLC | тонкослойная хроматография |
| масс./масс. | отношение массы к массе |
Примеры
Пример 1. Синтез 5-(3-бензилоксициклобутан)гидантоина
В реактор загружали карбонат аммония (1250 г, 13,0 моль), хлорид аммония (279,9 г, 5,23 моль) и воду (9,0 л). Полученную смесь перемешивали при температуре окружающей среды в атмосфере N2. К водному раствору медленно в течение 108 минут добавляли 3-бензилоксициклобутан-1-он (полученный согласно способу, описанному McConathy et al. в Appl Radiat Isotop 2003, 58: 657-666) (230,0 г, 1,31 моль), растворенный в этаноле (8,51 л), полученную смесь перемешивали в течение 70 минут, затем добавляли KCN (383,8 г, 5,89 моль). Полученную смесь нагревали до 60°C, перемешивали в течение 18 часов, охлаждали до температуры окружающей среды и упаривали в вакууме при 53-56°C.
К неочищенному продукту добавляли воду (1,7 л) с образованием суспензии, которую осторожно перемешивали в течение 45 минут. Суспензию фильтровали через воронку с фильтром из пористого стекла (размер пор 3), осадок на фильтре промывали холодной водой (1,2 л, 9,5°C) и сушили в вакууме при 27°C в течение 16 часов 10 минут.
Твердое вещество после вакуумной сушки (257,2 г) растворяли в смеси вода-изопропанол (15,0 л, 1:1). Раствор перемешивали при температуре окружающей среды в течение 70 минут и нерастворившиеся частицы удаляли фильтрованием через фильтр из пористого стекла (размер пор 3). Фильтрат упаривали в вакууме при 45-49°C до приблизительно 1/3 от исходного объема. Полученную суспензию охлаждали до 7,6°C, фильтровали через воронку с фильтром из пористого стекла (размер пор 3) и промывали холодной водой (2,0 л; ниже 7°C). Осадок на фильтре переносили в стеклянную бутыль от Schott Duran и выдерживали в вакууме при 36°C в течение 18 ч 40 мин. Выход: 229,6 г (71%).
1H-ЯМР (ядерный магнитный резонанс) (500 МГц, DMSO (диметил-сульфоксид)-d6) δ (млн-1): 10.63 (s, 1Н, NH), 8.24 (s, 1Н, NH), 7.38-7.27 (m, 5Н, Bz), 4.32 (s, 1Н, CH2-Bz), 4.06-3.98 (m, 1Н, CH-кольцо), 2.68-2.61 (m, 2Н, CH2-кольцо) и 2.24-2.16 (m, 2Н, CH2-кольцо).
Пример 2. Синтез 1-амино-3-(бензилокси)циклобутанкарбоновой кислоты
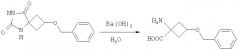
В реактор загружали Ва(OH)2 (450,5 г, 2,63 моль) и воду (8,1 л). Полученную смесь перемешивали при температуре окружающей среды с использованием механической мешалки. К реакционной смеси добавляли 5-(3-бензилоксициклобутан)гидантоин (229,6 г, 0,93 моль); остатки 5-(3-бензилоксициклобутан)гидантоина в бутыли переносили в реактор, используя промывание водой (1,2 л). Полученную смесь кипятили с обратным холодильником в течение 67 часов и 10 минут (в процессе HPLC отбирали образцы для контролирования протекания реакции).
Реакционную смесь охлаждали до температуры окружающей среды, добавляли H2SO4 (110 мл, 1М) и перемешивали в течение 8 мин; измеренное значение pH смеси составило 7. Выпавшие в осадок соли бария удаляли фильтрованием на воронке с фильтром из пористого стекла (размер пор 3), осадок на фильтре промывали водой (2,3 л) и фильтрат упаривали в вакууме при 55-60°C. 1-Амино-3-(бензилокси)циклобутанкарбоновую кислоту далее сушили в вакуумном сушильном шкафу при 50-60°C в течение 20 ч 54 мин. Выход: 202,7 г (98,3%).
1H ЯМР (500 МГц, D2O) δ (млн-1): 7.37-7.28 (m, 5Н, Bz), 4.40 (s, 2Н, CH2), 4.30-4.23 (m, 1Н, CH-кольцо), 2.79-2.71 (m, 2H, CH2-кольцо) и 2.26-2.18 (m, 2Н, CH2-кольцо).
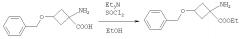
Пример 3. Синтез этилового эфира 1-амино-3-бензилокси-циклобутанкарбоновой кислоты
В реактор с загруженной 1-амино-3-бензилокси-циклобутанкарбоновой кислотой (202,7 г, 0,94 моль) добавляли этанол (7,0 л); смесь перемешивали при температуре окружающей среды с механическим перемешиванием в атмосфере N2 в течение 18 минут. К реакционной смеси добавляли Et3N (350 мл, 2,51 моль), охлаждали до -1,8°C и осторожно добавляли SOCl2 (170 мл, 2,4 моль), поддерживая температуру реакционной смеси ниже 10°C. Реакционную смесь кипятили с обратным холодильником в течение 20 часов 10 минут (за протеканием реакции следили посредством TLC). По окончании реакции реакционную смесь охлаждали до 20°C и упаривали в вакууме при 35°C. Масса неочищенного продукта, включая соли, составила 631,2 г.
1H ЯМР (500 МГц, DMSO-d6) δ (млн-1): 7.38-7.27 (m, 5Н, Bz), 4.41 (s, 2Н, CH2), 4.16 (q, 2Н, CH2), 4.07-4.01 (m, 1Н, CH-кольцо), 2.77-2.70 (m, 2Н, CH2-кольцо), 2.26-2.19 (m, 2Н, CH2-кольцо) и 1.22 (t, 3H, CH3).
Пример 4. Синтез соединения 1a
В реактор с загруженным этиловым эфиром 1-амино-3-бензилокси-циклобутанкарбоновой кислоты (631,2 г, 2,53 моль) добавляли этанол (18,5 л) и полученную смесь перемешивали при температуре окружающей среды с механическим перемешиванием в атмосфере N2. Добавляли Et3N (2,0 л, 14,3 моль) и смесь охлаждали до -8,5°C, затем осторожно добавляли ди-трет-бутил-дикарбонат (602,5 г, 2,76 моль). Полученную смесь оставляли охлаждаться до температуры окружающей среды и перемешивали в течение 20 часов (за протеканием реакции следили посредством TLC). По окончании реакции реакционную смесь упаривали в вакууме при 35°C.
Неочищенный продукт суспендировали в холодном EtOAc (12,0 л, 3,8°C), переносили в реактор с механическим перемешиванием и перемешивали в течение 15 мин. Добавляли воду (6,0 л) и смесь интенсивно перемешивали, фазы разделяли и водную фазу отбрасывали. Органическую фазу промывали холодной HCl (12,0 л, 0.5М, 4,7°C), водой (6,0 л, 2х), NaHCO3 (6,0 л, насыщ. водн.), водой (6,0 л) и NaCl (6,0 л, насыщ. водн., 2х) и сушили над безводным Na2SO4 (2,52 кг, безводный) в течение 1 часа. Смесь фильтровали через воронку с фильтром из пористого стекла (размер пор 3), осадок на фильтре промывали EtOAc (2,6 л) и фильтрат упаривали в вакууме при 38°C, получая неочищенный продукт (276 г). Неочищенный продукт перерастворяли в DCM (1000 мл) и адсорбировали на SiO2 (611,5 г).
Неочищенный продукт очищали хроматографией, используя флэш-систему от Biotage с SiO2-картриджем (5 кг), градиентное элюирование 10-50% EtOAc в гептане. Фракции, содержащие продукт, объединяли и упаривали в вакууме при 33°C, что позволило получить соединение 1а, выход: 233,7 г (73%).
1H ЯМР (500 МГц, DMSO-d6) δ (млн-1): 7.73 (1Н, NH), 7.38-7.26 (m, 5Н, Bz), 4.37 (s, 2Н; CH2), 4.15-3.95 (m, 2Н, CH2 и m, 1Н, CH-кольцо), 2.80-2.71 (m, 2Н, CH2-кольцо), 2.10-2.02 (m, 2Н, CH2-кольцо), 1.37 (s, 9Н, CH3, BOC), 1.22-1.11 (m, CH3). Минорный конформер в ЯМР-спектрах не указан.
Пример 5. Синтез и очистка соединения 1b
В реакционную колбу с загруженным соединением 1а (31,83 г, 91 ммоль) добавляли этанол (600 мл) и уксусную кислоту (8 мл, 139 ммоль), прикладывали атмосферу N2; кроме того, реакционную колбу подсоединяли к источнику H2. К смеси добавляли увлажненный Pd на угле (6,28 г, 10% масс./масс.) и в реакционную смесь доставляли газообразный H2. Реакционную смесь перемешивали при температуре окружающей среды в течение 2 суток до полной конверсии (за протеканием реакции следили посредством TLC). Реакционную смесь фильтровали через стекловолоконный фильтр, осадок на фильтре промывали этанолом (160 мл) и фильтрат упаривали в вакууме при температуре ниже 40°C, что позволило получить неочищенное соединение 1b (24,64 г). Неочищенный продукт перерастворяли в DCM (500 мл) и адсорбировали на SiO2 (65 г).
Неочищенный продукт очищали флэш-хроматографией, используя колонку с SiO2 (360 г), градиентное элюирование 30-70% EtOAc в гептане, используя гептан с 30% EtOAc в качестве элюента. Фракции, содержащие продукт, объединяли и упаривали в вакууме при 38°C, что позволило получить соединение 1b (20,1 г, 86%), чистота по ГХ (газовая хроматография) 99,8%.
1H ЯМР (500 МГц, DMSO-d6) δ (млн-1): 7.64 (1Н, NH), 5.15 (1Н, ОН), 4.12-3.99 (m, 1Н, СН-кольцо и m, 2Н, CH2), 2.75-2.66 (m, 2Н, CH2-кольцо), 2.02-1.93 (m, 2Н, CH3-кольцо), 1.37 (s, 9Н, BOC) и 1.22-1.12 (m, 3H, CH3).
Пример 6. Синтез соединения 1b без очистки, предшествующей использованию на следующей реакционной стадии
В реакционную колбу с загруженным соединением 1а (8,5 г, 24,3 ммоль) добавляли этанол (155 мл) и уксусную кислоту (2,13 мл, 37,2 ммоль), прикладывали атмосферу N2; кроме того, реакционную колбу подсоединяли к источнику H2. К смеси добавляли увлажненный Pd на угле (2,13 г, 10% масс./масс.) и в реакционную смесь доставляли газообразный H2. Реакционную смесь перемешивали при температуре окружающей среды в течение 2,25 суток, до полной конверсии (за протеканием реакции следили посредством TLC). Реакционную смесь фильтровали через фильтр из пористого стекла, осадок на фильтре промывали этанолом (40 мл) и фильтрат упаривали в вакууме при температуре ниже 40°C, что позволило получить неочищенное соединение 1b (6,21 г). Это вещество использовали на следующей реакционной стадии без какой-либо дополнительной очистки.
ЯМР-спектры на этой реакционной стадии не регистрировали.
Пример 7. Синтез соединения 1 с использованием очищенного соединения 1b (способ предшествующего уровня техники)
В реакционную колбу с загруженным соединением 1b (20,1 г, 78 ммоль) добавляли дихлорметан (500 мл) и пиридин (19 мл, 235 ммоль), полученную смесь охлаждали до температуры ниже 5°C. К смеси порциями в течение 30 минут добавляли трифторметансульфоновый ангидрид (19,5 мл, 115 ммоль), поддерживая во время добавления температуру реакционной смеси ниже 5°C. Полученную смесь перемешивали на ледяной бане в течение 1 часа (за протеканием реакции следили посредством TLC) и по завершении реакции добавляли воду (500 мл) для гашения реакции.
Реакционную смесь экстрагировали Et2O (950 мл), водную фазу отбрасывали, органическую фазу промывали HCl (500 мл, 1М), рассолом (500 мл, насыщ. водн.) и сушили над Na2SO4 (56 г). Смесь фильтровали через фильтр из пористого стекла, осадок на фильтре промывали Et2O (100 мл) и фильтрат упаривали в вакууме при температуре ниже 30°C, что позволило получить неочищенное соединение 1 (28,11 г). Неочищенный продукт перерастворяли в дихлорметане (400 мл) и адсорбировали на SiO2 (80 г).
Неочищенный продукт очищали флэш-хроматографией, используя колонку с SiO2 (330 г), изократическое элюирование смесью пентан:диэтиловый эфир (3:1). Фракции, содержащие продукт, объединяли и упаривали в вакууме при температуре ниже 30°C, что позволило получить соединение 1 (21,9 г).
Соединение 1 далее очищали перекристаллизацией путем растворения данного вещества в диэтиловом эфире (50 мл) и медленного перемешивания смеси при температуре ниже 35°C до тех пор, пока все твердые вещества не растворились. Реакционную смесь медленно охлаждали до 25°C в течение 1 часа 5 минут и затем перемешивали при этой температуре в течение 1 часа 20 минут. Затем раствор охлаждали до температуры ниже 5°C и осторожно перемешивали в течение 20 минут, охлаждали далее до температуры ниже -20°C в течение 15 минут и перемешивали в течение 1 часа 30 минут, добавляли ледяной гептан (110 мл) и раствор осторожно перемешивали в течение 1 часа 20 минут. Образовавшиеся кристаллы собирали фильтрованием, используя предварительно охлажденный фильтр из пористого стекла, и промывали ледяным гептаном (110 мл, ниже -5°C). В результате реакции получали соединение 1 (19,47 г, 64%), чистота по ЯМР +99%.
1H ЯМР (500 МГц, DMSO-d6) δ (млн-1): 5.44-4.95 (m, 1Н, CH-кольцо и s, br, 1Н, NH), 4.26 (q, 2Н, CH2), 3.15-2.68 (m, 4Н, 2×CH2-кольцо), 1.45 (s, 9Н, BOC) и 1.31 (t, 3H, CH3)
Пример 8. Синтез соединения 1 с использованием неочищенного соединения 1b (способ по настоящему изобретению)
Используемые в этой реакции вещества не очищали в соответствии с методикой предшествующего уровня техники. Единственная выполненная очистка в отношении исходного соединения 1b заключалась в фильтровании через воронку с фильтром из пористого стекла с последующим упариванием в вакууме досуха.
В реакционную колбу с загруженным соединением 1b (3,0 г, 12 ммоль) добавляли дихлорметан (77,5 мл) и пиридин (2,95 мл, 36,6 ммоль) и полученный раствор охлаждали до температуры ниже 5°C. К этой смеси порциями в течение 23 минут добавляли трифторметансульфоновый ангидрид (3,01 мл, 17,9 ммоль), поддерживая во время добавления температуру реакционной смеси ниже 5°C. Полученную смесь перемешивали на ледяной бане в течение 31 минуты (за протеканием реакции следили посредством TLC) и по завершении реакции добавляли воду (70 мл) для гашения реакции.
Реакционную смесь экстрагировали Et2O (150 мл), водную фазу отбрасывали, органическую фазу промывали HCl (75 мл, 1М), рассолом (75 мл, насыщ. водн.) и сушили над Na2SO4. Смесь фильтровали через фильтр из пористого стекла и фильтрат упаривали в вакууме при температуре ниже 30°C, что позволило получить неочищенное соединение 1. Неочищенный продукт перерастворяли в дихлорметане (40 мл) и адсорбировали на SiO2 (9,5 г).
Неочищенный продукт очищали флэш-хроматографией, используя колонку с SiO2, изократическое элюирование смесью пентан:дизтиловый эфир (3:1). Фракции, содержащие продукт, объединяли и упаривали в вакууме при температуре ниже 30°C, что позволило получить соединение 1 (3,22 г).
Соединение 1 далее очищали перекристаллизацией путем растворения данного вещества в диэтиловом эфире (7,7 мл) и медленного перемешивания смеси при температуре ниже 35°C до тех пор, пока все твердые вещества не растворялись. Реакционную смесь медленно охлаждали до 25°C в течение 45 минут и затем перемешивали при этой температуре в течение 1 часа 25 минут. Затем раствор охлаждали до температуры ниже 5°C и осторожно перемешивали при этой температуре в течение 54 минут, охлаждали далее до температуры ниже -20°C и перемешивали при этой температуре в течение 1 часа 4 минут, добавляли ледяной гептан (25 мл) и раствор осторожно перемешивали в течение 1 часа 20 минут. Образовавшиеся кристаллы собирали фильтрованием, используя предварительно охлажденный фильтр из пористого стекла, и промывали ледяным гептаном (25 мл, ниже -5°C). В результате реакции получали соединение 1 (2,86 г; 61%).
1. Способ получения соединения формулы (II) ,где x является целым числом от 0 до 4,включающий:(а) дебензилирование соединения формулы Ia ,гдеR11 представляет собой С1-5алкильную группу с прямой или разветвленной цепью,R12 представляет собой амино-защитную группу иv является целым числом от 0 до 4;с получением соединения формулы Ib