Левовращающие изовалерил-спирамицины 1, ii, iii, их препараты, способ приготовления и употребление
Иллюстрации
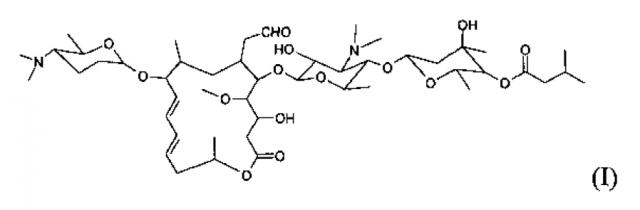
Показать всеИзобретение относится к кристаллическому соединению левоизовалерилспирамицина I, характеризующемуся химической структурной формулой (I)
с температурой плавления 116~122°С и дифракцией рентгеновских лучей на порошке кристаллического соединения левоизовалерилспирамицина I, измеренной с применением излучения Cu-Kα, с характерными пиками при 2θ=7,6°, 8,0°, 10,0°, 11,4°, 16,4°, 17,0°, 17,5°, 17,9°, 19,5°, 22,7°, 23,7° и 24,4°; препарату на его основе для лечения инфекционных заболеваний, а также способу приготовления указанного соединения, который включает растворение твердого соединения левоизовалерилспирамицина I в смешанном растворе этилацетата, абсолютного этилового спирта и безводного ацетона, добавление дистиллированной воды при одновременном перемешивании смеси, охлаждение до 5°С~15°С после добавления дистиллированной воды, продолжение перемешивания при охлаждении, затем получение кристаллического соединения левоизовалерилспирамицина I, при этом объемное соотношение этилацетата, абсолютного этилового спирта и безводного ацетона в смешанном растворителе составляет 1:0,1~10:0,5~1. Предложено новое кристаллическое вещество, эффективное для лечения бактериальных инфекций. 5 н. и 9 з.п. ф-лы, 56 пр., 10 табл., 7 ил.
Реферат
Техническая область
Изобретение относится к новым макролидным антибиотикам в генной инженерии, и особенно левовращающим изовалерил-спирамицинам I, II, III, их кристаллам, их фармацевтическим препаратам, способам приготовления и их употреблению в противоинфекционных средствах.
Техническая среда
Макролидные антибиотики занимают важное место в клинике, обладают хорошей активностью в отношении грамположительных бактерий и микоплазмы, также действуют на грамотрицательные бактерии, обладают благоприятной антибактериальной активностью и проницаемостью тканей в отношении распространяющихся токсоплазмов, легионелл и других трудно контролируемых возбудителей, при пероральном употреблении быстро поглощаются с редкими неблагоприятными действиями, в принципе не оказывают отрицательное воздействие на функцию печени и почки, обладают также потенциальной иммунологической регуляцией, в девяностых годах прошлого года считались соперником β-лактамных препаратов при лечении инфекционных заболеваний дыхательных путей взрослых.
Хиральность (Chirality) - основное свойство трехмерных предметов, является одним из основных свойств природы. В качестве важной основы жизненной деятельности, почти все биологические макромолекулы, как протеин, полисахарид, нуклеиновая кислота, ферменты и т.д., хиральные, и эти макромолекулы, как правило, исполняют важную физиологическую функцию внутри тела. Под хиральными лекарствами (chiral drug) понимаются пары оптических антиподов, являющихся зеркальными отражениями друг друга и полученных после ввода хирального центра в молекулярную структуру лекарства. Эти оптические антиподы обладают принципиально аналогичными физико-химическими свойствами, отличаются только оптической активностью, откуда и выделились R (правовращающие) или S (левовращающие), рацемические. За последние 20 лет углубленные изучения в фармацептии доказали различную стереоспецифичность (stereoselectivity) антиподов лекарственных веществ, они имеют различный аффинитет с рецепторами, в результате чего сильно отличаются фармакологические свойства. Антиподы хиральных лекарств, имеющие повышенную активность, называют оптимальными антиподами (Eutomer); а антиподы, имеющие низкую активность или не имеющие активности, называют неактивными антиподами (Distomer). В большинстве случаев, неактивные антиподы не дают эффективности, но они еще частично нейтрализуют эффективность оптимальных антиподов, иногда даже вызывают серьезные токсичные и побочные реакции, что доказало сложность в разнице эффективности лекарственных средств и значительное отличие терапевтического индексантипод одного антипода от его рацемата, как всем известно, что терапевтическая эффективность синтомицина DL-(+-) составляет только половину хлорамфеникола D(-); а активность L-изомера пропранолола (propranolol) в 100 раз больше чем D-изомер; (-) метадон представляет собой сильное болеутоляющее средство, а (+) не действующее. Сильно отличается и токсичность, например, оба антипода талидомида (thalidomide) обладают аналогичным успокаивающим действием в отношении мышей, но только S(-) изомер и его метаболит обладают зародышевой токсичностью и тератогенезом; кетамин - широко распространенные наркотические и болеутоляющие средства, но они дают галлюцинацию и другие побочные действия. Изучения показали, что S(+) дает эффект в 3-4 раза больше R(-), а токсичные и побочные действия явно связаны с последним. Значительное различие в терапевтической эффективности хиральных лекарств стимулировало развитию работ по разработке, разделению и анализу хиральных лекарств. Применение техники «Хиральность» позволило удалять из лекарственных средств составы, не дающие эффекта или имеющие токсичные и побочные действия, производить чистые хиральные лекарственные вещества, имеющие структуру с одним направлением, что позволило повышать чистоту состава препарата, быстро проявлять терапевтическую эффективность и сокращать курс лечения. В связи с этим, разработка хиральных лекарств стала одним из новых направлений в разработке новых лекарственных средств мира. Правительства и крупные фармацевтические фирмы начали вносить большие средства в разработку хиральных лекарственных препаратов, хирального сырья и хиральных интермедиатов, чтобы завоевать фармацевтический рынок мира хиральных лекарственных веществ. Более того, с непрерывным улучшением хиральной технологии и быстрым распространением жидкостной хроматографии была продвинута работа по разделению, анализу и определению антиподов хиральных лекарств. Хиральные моноэнантиомерные средства получили широкое применение. Карримицин (Carrimycin) - дериват спирамицина нового поколения, разработанный с помощью генной инженерии, носил первоначальное название «Biotechspiramycin», также биотехмицин, Biotechmycin [патент №: ZL97104440.6]. Согласно «Принципу выбора названий лекарственных препаратов Китая» в результате технической проверки и изучения Государственной фармакопейной комиссией Китая было принято решение переименовать Biotechspiramycin в Карримицин (Carrimycin), название на английском языке «Carrimycin». С точки зрения химической структуры основным составом Карримицин (Carrimycin) является 4″-изовалерил-спирамицин, включающий 4″-изовалерил-спирамицины I, II, III, кроме этого, Карримицин (Carrimycin) содержит и примерно 6 видов спирамицином с ацилированной 4-оксигруппой, поэтому он носит общее химическое название «4"-ацилированный спирамицин».
Химическая структура основного состава Карримицин (Carrimycin) показана на (1):
Где: P в изовалерил-спирамицине I выбирают из Ч;
P в изовалерил-спирамицине II выбирают из COCH3;
R в изовалерил-спирамицине III выбирают из COCH2CH3.
Карримицин (Carrimycin) представляет собой шестнадцатичленные макролидные антибиотики, механизм действия заключается в сочетании с тельцем Паладе бактерий для ингибирования синтеза белков.
Результаты фармакокинетических исследований показали, что в Карримицине (Carrimycin) самыми активными составами являются изовалерил-спирамицины I, II, III. После поступления в организм карримицин (Carrimycin) быстро метаболирует с образованием спирамицина, расчет суммы AUC0-t материнских средств изовалерил-спирамицинов I, II, III и активных метаболитов - спирамицинов I, II, III показал, что при пероральном применении абсолютная биодоступность составляет в среднем 91,6%. По источникам, абсолютная биодоступность спирамицина при пероральном применении для человека составляет в пределах 30-40% (Frydman AM et al. J Antimicrob Chemother. 1988, 22(suppl B):93-103). Чем доказано, что структура изовалерил-спирамицина в значительной степени улучшила биологическую доступность активного вещества - спирамицина. Разовый прием Карримицина (Carrimycin) медленно дает эффект, T1/2 в пределах 23-27 ч
Результаты теста in vitro показали, что Карримицин (Carrimycin) хорошо воздействует на грамположительные бактерии, особенно некоторые лекарственно-устойчивые микробы (к примеру, золотистый стафилококк, стойкий к β-лактаму, золотистый стафилококк, стойкий к эритромицину и т.д.), не имеет заметной перекрестной устойчивости к подобным лекарственным средствам. Тем временем, обладает хорошей антибактериальной активностью в отношении микоплазмы и хламидии, части грамотрицательных бактерий, обладает благоприятной антибактериальной активностью и проницаемостью тканей в отношении токсоплазм, легионеллы, а также потенциальной иммунологической регуляцией. Антибактериальная активность внутри организма превосходит активность вне организма (ZL200310122420.9). Клинические исследования показали, что прием таблеток Карримицин (Carrimycin) в течение 5-7 дней по 200 мг-400 мг в день, дает положительные эффекты в лечении острого бактериального фарингита и острого гнойного тонзиллита, вызванного streptococcus pyogenes; бактериального хронического синусита и острого бронхита, вызванного сенситивными бактериями; не сильной пневмонии, вызванной пневмококком, гемофильной палочкой и микоплазмой пневмония; негонококкового уретрита, вызванного микоплазмой, хламидией; инфекции кожи и мягких тканей, периодонтита, тимпанита и других инфекционных болезней, вызванных сенситивными бактериями. Общий коэффициент полезного действия составляет 92,68%.
Клинические исследования показали, что Карримицин (Carrimycin) является безопасным и эффективным для перорального применения антибиотиком. Тем не менее Карримицин (Carrimycin) является многокомпонентным лекарственным средством, полученным в результате ферментации, его дальнейшее отделение и очистка оказывается очень трудно. В настоящее время создание высокоэффективной жидкостной хроматографии позволяет отделить образцы Карримицин (Carrimycin) от ацилированных спирамицинов, например, степень отделения изовалерил-спирамицин II от изобутирил-спирамицина III, степень отделения изобутирил-спирамицин II от пропионил-спирамицина III, степень отделения пропионил-спирамицина III от его предыдущих малых компонентов, степень отделения пропионил-спирамицина II от ацетилспирамицина III более 1,5, установленной Китайской фармакопеей; а степень отделения ацетилспирамицин III от его предыдущих малых компонентов составляет 1,2.
В результате многочисленных исследований, регулирования и оптимизации условий культивирования и ферментации изобретателем был получен левовращающий Карримицин (Carrimycin), который обладает более благоприятной противоинфекционной активностью.
В настоящее время применяется высокоэффективная жидкостная хроматография для определения 9 видов ацилированных спирамицинов Карримицина (Carrimycin), в т.ч. общее содержание изовалерил-спирамицинов (I+II+III) не менее 60%, общее содержание ацилированных спирамицинов не менее 80%. В отношении многокомпонентного антибиотика, полученного в результате ферментации, трудно достигать критерия контроля качества средств для инъекций среди химикатов, но в отношении тяжелых больных или больных, которым не подходит пероральное применение лекарства, инъекция дает результаты быстро, ввиду этого разработка однокомпонентного препарата изовалерил-спирамицина имеет очень глубокий смысл. В результате дальнейших исследований левовращающего Карримицина (Carrimycin) был получен однокомпонентный левовращающий изовалерил-спирамицин I чистотой до 98% (масс).
Общее описание изобретения
Первый объект изобретения относится к левовращающему изовалерил-спирамицину I, левовращающему изовалерил-спирамицину II, левовращающему изовалерил-спирамицину III.
Второй объект изобретения относится к препаратам, содержащим левовращающий изовалерил-спирамицин I, левовращающий изовалерил-спирамицин II, левовращающий изовалерил-спирамицин III соответственно.
Третьим объектом изобретения является способ приготовления левовращающего изовалерил-спирамицина I, левовращающего изовалерил-спирамицина II, левовращающего изовалерил-спирамицина III.
Четвертым объектом изобретения также является употребление левовращающего изовалерил-спирамицина I, левовращающего изовалерил-спирамицина II, левовращающего изовалерил-спирамицина III.
Пятым объектом изобретения также являются кристаллы левовращающего изовалерил-спирамицина I, левовращающего изовалерил-спирамицина II и левовращающего изовалерил-спирамицина III, а также препараты, содержащие указанные виды кристалла.
Для осуществления цели изобретения приняли следующие технические решения: Изобретение относится к левовращающему изовалерил-спирамицину I, химическая структура указанного левовращающего изовалерил-спирамицина I приведена в (I),
.
удельная постоянная вращения составляет [α]D=-49°--62°, предпочтительно -51°--60°, более предпочтительно -60°--62°, более предпочтительно -51°--58°, более предпочтительно -53°--58°, более предпочтительно -55°--58°, более предпочтительно -55°--57°, более предпочтительно -58°--60°, более предпочтительно -51°--55°, более предпочтительно -53°--55°, более предпочтительно -49°--51° (C=0,02 г/мл, CHCl3, 25°C, λ=589,3 нм); точка плавления составляет 116-122°C, предпочтительно 118-120°C;
Изобретение относится к левовращающему изовалерил-спирамицину II, химическая структура указанного левовращающего изовалерил-спирамицина II приведена в (II),
Удельная постоянная вращения составляет [α]D=-55°--61°, предпочтительно -57°--59° (С=0,02 г/мл, CHCl3, 25°C, λ=589,3 нм); точка плавления 120-128°C, предпочтительно 123-125°C;
Изобретение относится к левовращающему изовалерил-спирамицину III, химическая структура указанного левовращающего изовалерил-спирамицина III приведена в (III),
Удельная постоянная вращения составляет [α]D=(-) -49°--51° (C=0,02 г/мл, CHCl3, 25°C, λ=589,3 нм); точка плавления составляет 116-118°C.
Изобретение относится к препаратам левовращающего изовалерил-спирамицина I, отличающимся тем, что указанные препараты содержат изовалерил-спирамицин I, фармацевтическую соль изовалерил-спирамицина I, фармацевтически приемлемые для изовалерил-спирамицина I и вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли изовалерил-спирамицина I вспомогательные материалы. Чистота указанного изовалерил-спирамицина I более 90% (масс.), предпочтительная чистота более 95% (масс.), более предпочтительная чистота более 98% (масс.).
Изобретение относится к препаратам левовращающего изовалерил-спирамицина II, отличающимся тем, что указанные препараты содержат изовалерил-спирамицин II, фармацевтическую соль изовалерил-спирамицина II, фармацевтически приемлемые для изовалерил-спирамицина II и вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли изовалерил-спирамицина II вспомогательные материалы. Чистота указанного изовалерил-спирамицина II более 90 масс.%, предпочтительная чистота более 95 масс.%, более предпочтительная чистота - более 98 масс.%.
Изобретение относится к препаратам левовращающего изовалерил-спирамицина III, отличающимся тем, что указанные препараты содержат изовалерил-спирамицин III, фармацевтическую соль изовалерил-спирамицина III, фармацевтически приемлемые для изовалерил-спирамицина III и вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли изовалерил-спирамицина III вспомогательные материалы. Чистота указанного изовалерил-спирамицина III более 90 масс.%, предпочтительная чистота более 95 масс.%, более предпочтительная чистота более 98 масс.%.
Первый предпочтительный вариант изобретения: препараты изобретения могут быть жидкими, твердыми, полутвердыми или газообразными; указанный жидкий препарат выбирают среди раствора для инъекции, трансфузионной среды, раствора, микстуры, сахарного сиропа, настойки, золи, ароматизированной воды, глицеринового раствора, коллоидального раствора, слизи, взвеси или эмульсии; указанный твердый препарат выбирают среди порошка для инъекций, лиофилизированного порошка, таблеток, желатиновых капсул, порошка, пилюль или пленок; указанный полутвердый препарат выбирают среди мази, пластыри, свечи; суппозитория, экстракта, желатинирующего вещества; указанный газообразный препарат выбирают среди аэрозоли или распыляемого раствора, предпочтительны раствор для инъекций, порошок для инъекций и лиофилизированный порошок для инъекций.
Второй предпочтительный вариант изобретения: единичные дозы изовалерил-спирамицина I, содержимого в препаратах изобретения, составляют 10-1500 мг, предпочтительно 50-1000 мг, более предпочтительно 100-500 мг; единичные дозы изовалерил-спирамицина II, содержимого в препаратах изобретения, составляют 10-1500 мг, предпочтительно 50-1000 мг, более предпочтительно 100-500 мг; единичные дозы изовалерил-спирамицина II, содержимого в препаратах изобретения, составляют 10-1500 мг, предпочтительно 50-1000 мг, более предпочтительно 100-500 мг.
Третий предпочтительный вариант изобретения: в препаратах массовый процент левовращающего изовалерил-спирамицина I составляет 10-95%, предпочтительно 50-95%), более предпочтительно 75-95%; в препаратах массовый процент левовращающего изовалерил-спирамицина II составляет 10-95%, предпочтительно 50-95%, более предпочтительно 75-95%; в препаратах массовый процент левовращающего изовалерил-спирамицина III составляет 10-95%, предпочтительно 50-95%, более предпочтительно 75-95%.
Изобретение также относится к препаратам, содержащим левовращающий изовалерил-спирамицин I, или левовращающий изовалерил-спирамицин II или левовращающий изовалерил-спирамицин III.
Указанные препараты включают раствор для инъекций, порошок для инъекций или лиофилизированный порошок для инъекций, приготовленный из изовалерил-спирамицина I и, по крайней мере, одного среди лимоннокислоты, адипиновой кислоты, малеиновой кислоты. Указанные препараты включают раствор для инъекций, порошок для инъекций или лиофилизированный порошок для инъекций, приготовленный из изовалерил-спирамицина II и, по крайней мере, одного среди лимоннокислоты, адипиновой кислоты, малеиновой кислоты. Указанные препараты включают раствор для инъекций, порошок для инъекций или лиофилизированный порошок для инъекций, приготовленный из изовалерил-спирамицина III и, по крайней мере, одного среди лимоннокислоты, адипиновой кислоты, малеиновой кислоты.
В т.ч. мольное отношение левовращающего изовалерил-спирамицина I к лимоннокислоте составляет 1:0,8-1, мольное отношение левовращающего изовалерил-спирамицина I к адипиновой кислоте составляет 1:0,8-1.2, мольное отношение левовращающего изовалерил-спирамицина I к малеиновой кислоте составляет 1:0,8-1,2; мольное отношение левовращающего изовалерил-спирамицина II к лимоннокислое составляет 1:0,8-1,2, мольное отношение левовращающего изовалерил-спирамицина II к адипиновой кислоте составляет 1:0,8-1,2, мольное отношение левовращающего изовалерил-спирамицина II к малеиновой кислоте составляет 1:0,8-1,2; мольное отношение левовращающего изовалерил-спирамицина III к лимоннокислое составляет 1:0,8-1,2, мольное отношение левовращающего изовалерил-спирамицина III к адипиновой кислоте составляет 1:0,8-1,2, мольное отношение левовращающего изовалерил-спирамицина III к малеиновой кислоте составляет 1:0,8-1,2.
Изобретение также относится к способу приготовления левовращающих изовалерил-спирамицинов I, II или III, включающему приготовление левовращающего Карримицина (Carrimycin), очистку левовращающих изовалерил-спирамицинов I, II или III.
В т.ч. процесс приготовления левовращающего Карримицина (Carrimycin) включает культивирование клонированного штамма WSP-195 бактерий, продуцирующих спирамицин, с содержанием гена 4"-изовалерил-трансферазы, биологическое сбраживание и экстрагирование сбраживаемой жидкости; сбраживание при уровне pH 6,0-9,0, предпочтительно 6,0-8,0, более предпочтительно 6,0-7,5, зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворяет уравнению y1=k1x1+6,0, где 0,0227≤k1≤0,1364, 0<x1≤22; второй этап удовлетворяет уравнению y2 =k2x2+b2, где -0,0735≤<k2<0, 6,5<b2≤10,62, 22≤x2≤56, третий этап удовлетворяет уравнению y3=k3x3+b3, где 0<k3≤0,0078, 6,06≤b3<6,5, 56≤x3≤120. Регулировали и оптимизировали условия культивирования и сбраживания, особенно регулировали уровень pH в процессе сбраживания с помощью средства для регулирования уровня рН, чтобы зависимость уровня pH от времени в процессе сбраживания показывала три непрерывных этапа, каждый из этапов удовлетворяет определенному уравнению, таким образом, получали левовращающий Карримицин (Carrimycin) с оптической активностью. Следовательно, получали левовращающий изовалерил-спирамицин I, левовращающий изовалерил-спирамицин II, левовращающий изовалерил-спирамицин III.
Предпочтительно, что условия биологического сбраживания: клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4″-изовалерил-трансферазы, культивировали в течение 8-15 сут. при pH 6,5-7,5 и 28~38°C на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, CaCO3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, CaCO3 0,5%, рыбный пептон 0,3% и KH2PO4 0,05%, культивировали в течение 40-80 ч при pH 6,5-7,5 и 25~30°C, далее засевали прививочную дозу 0,1-20% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, CaCCO3 0,5%, КН2РO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%, культивировали в течение 72-120 ч при pH 6,5-7,5 и 26~30°C, таким образом, получали сбраживаемую жидкость;
В качестве указанного средства для регулирования уровня pH выбирают, по крайней мере, один среди соляной кислоты, уксусной кислоты, нашатырного спирта, каустической соды, гидроокиси калия.
Предпочтительно, что экстрагирование биологически сбраживаемой жидкости по следующим шагам: обрабатывали полученную сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 8,5-9,0, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,0-2,5 для получения водофазного экстракта, регулировали уровень pH до 4,5-5,5, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,5-9,0, осаждали, орошали очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
В т.ч. для регулирования уровня pH применяли, по крайней мере, одну среди соляной кислоты, уксусной кислоты, лимоннокислоты, каустической соды, гидроокиси калия, натрия гидрокарбоната, углекислого натрия.
В т.ч. подробный процесс очистки изовалерил-спирамицинов I, II, III включает: очистку образцов левовращающего. Карримицина (Carrimycin) хроматографическим разделением, градиентную элюцию хроматографической колонной ODS с помощью ацетонитрила и буферного раствора уксуснокислого аммония, выделение целевого пика состава левовращающего изовалерил-спирамицина I, целевого пика состава левовращающего изовалерил-спирамицина II или целевого пика состава левовращающего изовалерил-спирамицина III.
Предпочтительно, что в процессе очистки левовращающих изовалерил-спирамицинов I, II, III, принимали припрепаративную высокоэффективную жидкостную хроматографию, ультрафиолетовый контроль, регистрировали ультрафиолетовую спектрограмму. Собирали образцы согласно времени выдержки левовращающего изовалерил-спирамицина I - 44,759 мин, собирали образцы согласно времени выдержки левовращающего изовалерил-спирамицина II - 43,34 мин, собирали образцы согласно времени выдержки левовращающего изовалерил-спирамицина III - 48,009 мин.
Более предпочтительно, что в процессе очистки левовращающего изовалерил-спирамицина I, II, III, очищали собранные левовращающие изовалерил-спирамицины I, II или III от ацетонитрила вращающим испарением, потом экстрагировали этилацетатом, удаляли этилацетат из экстракта испарением, получали пастообразные образцы; перерастворяли полученные образцы петролейным эфиром, удаляли петролейный эфир испарением, получали белые порошковые частицы левовращающих изовалерил-спирамицинов I, II или III соответственно.
В т.ч. указанной подвижной фазой является смешанный растворитель ацетонитрила A и водного раствора уксуснокислого аммония pH=8,5,150 мМ.
Конкретные условия очистки левовращающего изовалерил-спирамицина I, II или III: применяли линейный градиент: 0-60 мин., A: 25%-65%; 61-90 мин., A: 65%-90%;
Скорость потока: 260 мл/мин;
Объем вводимого образца: 10 мл;
Концентрация вводимого образца: 0.5 г/мл;
Контрольная длина волны: 231 нм;
Способ сбора: ультрафиолетовый пуск
Изобретение также относится к кристаллам левовращающего изовалерил-спирамицина I, порошковая рентгеновская дифракция, измеренная Cu-Kα-лучами, показывала характеристический пик при 2θ, равном, 7,6°, 8,0°, 10,0°, 11,4°, 16,4°, 17,0°, 17,5°, 17,9°, 19,5°, 22,7°, 23,7° и 24,4°. Диаграмма порошковой рентгеновской дифракции показана на Рис.5.
Способ приготовления указанных кристаллов левовращающего изовалерил-спирамицина I заключается в том, что сначала растворяют твердые частицы левовращающего изовалерил-спирамицина I в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, потом наливают очищенную воду с одновременным перемешиванием, после налива очищенной воды температура снижается до 5-15°C, при этом продолжают перемешивание до получения кристаллов левовращающего изовалерил-спирамицина I.
В т.ч. первое предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина I заключается в том, что объем вводимой очищенной воды в 2-9 раз больше суммы объема этилацетата, абсолютного этилового спирта и безводного ацетона, предпочтительно 2,5-7,5 раза; скорость ввода очищенной воды 4-10 мл/мин, предпочтительно 6-8 мл/ мин.
Второе предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина I заключается в том, что в примененной смеси растворителей отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляет 1:0,1-10:0,5-1, предпочтительно 1:2-8:0,8-1.
Третье предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина I заключается в том, что скорость перемешивания вводимой очищенной воды 30-60 р/мин, предпочтительно 45-60 р/мин; после ввода очищенной воды скорость перемешивания 10-30 р/мин, предпочтительно 10-20 р/мин.
Четвертое предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина I заключается в том, что скорость охлаждения после ввода очищенной воды 1-3°C /ч, предпочтительно 1-1.5°C 1 ч,
Изобретение также относится к кристаллам левовращающего изовалерил-спирамицина II, порошковая рентгеновская дифракция, измеренная Cu-Kα-лучами, показывала характеристический пик при 2θ, равном, 10,0°, 11,6°, 16,4°, 17,3°, 19,1°, 21,2°, 22,1°, 22,7°, 26,4°, 26,9°, 27,5°, и 31,5°. Диаграмма порошковой рентгеновской дифракции показана на Рис.6.
Способ приготовления указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что сначала растворяют твердые частицы левовращающего изовалерил-спирамицина II в смеси растворителей безводного метанола, безводного ацетона и абсолютного этилового спирта, потом наливают очищенную воду с одновременным перемешиванием, после налива очищенной воды температура снижается до 5-15°C, при этом продолжают перемешивание до получения кристаллов левовращающего изовалерил-спирамицина II.
В т.ч. первое предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина II заключается в том, что объем вводимой очищенной воды в 2-9 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона, предпочтительно 2,5-7,5 раза; скорость ввода очищенной воды 4-10 мл/мин, предпочтительно 6-8 мл/мин.
Второе предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина II заключается в том, что в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляет 1:0,1-10:0,5-1, предпочтительно 1:2-8:0,8-1.
Третье предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что скорость перемешивания вводимой очищенной воды 30-60 р/мин, предпочтительно 45-60 р/мин; после ввода очищенной воды скорость перемешивания 10-30 р/мин, предпочтительно 10-20 р/мин.
Четвертое предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что скорость охлаждения после ввода очищенной воды 1-3°C /ч, предпочтительно 1-1,5°C 1 ч.
Изобретение также относится к кристаллам левовращающего изовалерил-спирамицина III, порошковая рентгеновская дифракция, измеренная Cu-Kα-лучами, показывала характеристический пик при 2θ, равном, 8,0°, 10,0°, 11,2°, 11,7°, 16,4°, 19,1°, 19,6°, 20,0°, 21,4°, 22,9°, 23,6° и 29,4°. Диаграмма порошковой рентгеновской дифракции показана на Рис.7.
Способ приготовления указанных кристаллов левовращающего изовалерил-спирамицина III заключается в том, что сначала растворяют твердые частицы левовращающего изовалерил-спирамицина III в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, потом наливают очищенную воду с одновременным перемешиванием, после налива очищенной воды температура снижается до 5-15°C, при этом продолжают перемешивание до получения кристаллов левовращающего изовалерил-спирамицина III.
В т.ч. первое предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина III заключается в том, что объем вводимой очищенной воды в 2-9 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона, предпочтительно 2,5-7,5 раза; скорость ввода очищенной воды 4-10 мл/мин, предпочтительно 6-8 мл/мин.
Второе предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина III заключается в том, что в примененной смеси растворителей отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляет 1:0,1-10:0,5-1, предпочтительно 1:2-8:0,8-1.
Третье предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина III заключается в том, что скорость перемешивания вводимой очищенной воды 30-60 р/мин, предпочтительно 45-60 р/мин; после ввода очищенной воды скорость перемешивания 10-30 р/мин, предпочтительно 10-20 р/мин.
Четвертое предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина III заключается в том, что скорость охлаждения после ввода очищенной воды 1-3°C 1 ч, предпочтительно 1-1.5°C 1 ч.
В элементарных ячейках различных форм молекулы имеют различную пространственную конфигурацию, конфирмацию и расположение, их растворимость тоже сильно отличается, препараты имеют различную скорость растворения внутри тела, что оказывало непосредственное воздействие на поглощение, распределение, экскрецию и метаболизм препаратов в теле, в результате чего различная биологическая доступность приведет к получению различных клинических эффектов. В изобретении проводили соответственное сравнение терапевтической эффективности приготовленных кристаллов левовращающего изовалерил-спирамицина I, кристаллов левовращающего изовалерил-спирамицина II или кристаллов левовращающего изовалерил-спирамицина III с эффективностью левовращающего изовалерил-спирамицина I, левовращающего изовалерил-спирамицина II или левовращающего изовалерил-спирамицина III, и было обнаружено, что терапевтическая эффективность приготовленных по изобретению кристаллов левовращающего изовалерил-спирамицина I, превосходит эффективность левовращающего изовалерил-спирамицина I, терапевтическая эффективность приготовленных по изобретению кристаллов левовращающего изовалерил-спирамицина II, превосходит эффективность левовращающего изовалерил-спирамицина II, терапевтическая эффективность приготовленных по изобретению кристаллов левовращающего изовалерил-спирамицина IIII, превосходит эффективность левовращающего изовалерил-спирамицина III.
Изобретение относится также к препаратам кристаллов левовращающего изовалерил-спирамицина I, указанные препараты включают кристаллы изовалерил-спирамицина I, фармацевтическую соль кристаллов левовращающего изовалерил-спирамицина I, фармацевтически приемлемые для кристаллов изовалерил-спирамицина I вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли кристаллов изовалерил-спирамицина I вспомогательные материалы, чистота указанных кристаллов изовалерил-спирамицина I более 99 масс.%.
Изобретение относится также к препаратам кристаллов левовращающего изовалерил-спирамицина II, указанные препараты включают кристаллы изовалерил-спирамицина II, фармацевтическую соль кристаллов левовращающего изовалерил-спирамицина II, фармацевтически приемлемые для кристаллов изовалерил-спирамицина II вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли кристаллов изовалерил-спирамицина II вспомогательные материалы, чистота указанных кристаллов изовалерил-спирамицина II более 99 масс.%.
Изобретение относится также к препаратам кристаллов левовращающего изовалерил-спирамицина III, указанные препараты включают кристаллы изовалерил-спирамицина III, фармацевтическую соль кристаллов левовращающего изовалерил-спирамицина III, фармацевтически приемлемые для кристаллов изовалерил-спирамицина III вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли кристаллов изовалерил-спирамицина III вспомогательные материалы, чистота указанных кристаллов изовалерил-спирамицина III более 99 масс.%.
Изобретение относится также к употреблению изоамил-спирамицина I или его кристаллов, и его препаратов в приготовлении лечебных и/или профилактических средств против инфекционных заболеваний. Изобретение относится также к употреблению изоамил-спирамицина II или его кристаллов, и его препаратов в приготовлении лечебных и/или профилактических средств против инфекционных заболеваний. Изобретение относится также к употреблению изоамил-спирамицина III или его кристаллов, и его препаратов в приготовлении лечебных и/или профилактических средств против инфекционных заболеваний. Указанные инфекционные заболевания вызваны заражением грамположительными бактериями, золотистым Стафилококком, пневмококком, микоплазмой пневмония, хламидией пневмониз, уреаплазмой уреалитикум, трахоматозными хламидиями, streptococcus pyogenes, микрококком катаральным, нейссерией гонорея, гемофильной палочкой, легионеллой или анаэробными бактериями.
Изобретение относится также к употреблению изоамил-спирамицина I или его кристаллов, и его препаратов в приготовлении антибактериальных средств, изобретение относится также к употреблению изоамил-спирамицина II или его кристаллов, и его препаратов в приготовлении антибактериальных средств, изобретение относится также к употреблению изоамил-спирамицина III или его кристаллов, и его препаратов в приготовлении антибактериальных средств, указанные бактерии: пневмококк, стрептококк группы A, streptococcus pyogenes, энтерококк, золотистый стафилококк, эпидермальный стафилококк, микрококк катаральный, нейссерия гонорея, гемофильная палочка, колибацилла или кишечная палочка, энтеротоксигенные кишечные палочки, патогенная кишечная палочка, enteroinvasive escherichia coli, синегнойная палочка, клебсиелла пневмонии, протеус вульгарис, тифозная палочка, акинетобактерии, лимоннокислота, цитробактер, serratia marcescens, шигелла зонне, шигелла Флекснера, бацилла, tritirachium album; легионеллы, как легионеллезная пневмония, legionella gormanii, legionella bozemanii, legionella dumoffii, legionella jordanis, legionella micdadei; анаэробные бактерии, как бактероиды фрагилис, bacteroides thetaiotaomicron, бактероиды вульгатус, Bacteroides distasonis, bacteroides ruminicola, prevotella asaccharolyticus, prevotella oralis, палочка Плаута, fusobacterium russii, бифидобактерии, лактобацилла, пептострептококки, пропионибактерии акне, клостридии перфрингенс, дрожжеподобный гриб.
Ниже приведено подробное описание изобретения.
Изобретение относится к левовращающему изовалерил-спирамицину I, который получали путем регулирования и оптимизирования условий культивирования и сбраживания, а также строгого контролирования уровня pH раствора.
Изобретение относится к левовращающему изовалерил-спирамицину II, который получали путем регулирования и оптимизирования условий культивирования и сбраживания, а также строгого контролирования уровня pH раствора.
Изобретение относится к левовращающему изовалерил-спирамицину III, который получали путем регулирования и оптимизирования условий культивирования и сбраживания, а также строгого контролирования уровня pH раствора.
Левовращающие изовалерил-спирамицины I, II и III обладают повышенной антибактер