Способ лечения табакокурения и других форм никотиновой зависимости, а также профилактики рецидивов табакокурения
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложен способ лечения табакокурения и, других форм никотиновой зависимости, а также профилактики рецидивов табакокурения, средством, содержащим активное начало на основе цитизина и вспомогательные вещества путем интраназальных впрыскиваний перед, во время или непосредственно после введения никотина; при этом средство содержит от 1 мг/мл до 100 мг/мл цитизина и его вводят в организм в виде дробных доз, каждая из которых составляет от 25 до 500 мкл. Технический результат состоит в длительности действия способа, в снижении вероятности развития побочных эффектов, в подавлении эффектов никотина, ответственных за поддержание зависимости и в практически полном отказе от курения пациента при контрольном анализе через 12 месяцев. 4 з.п. ф-лы, 3 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области медицины, а именно к средствам для лечения табакокурения и других форм никотиновой зависимости и способам их применения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Никотин является основным психоактивным веществом, содержащимся в табачных листьях и ответственным за формирование и поддержание данного вида химической зависимости. В настоящее время основными лекарственными препаратами, применяемыми для лечения табакокурения, являются различные агонисты никотиновых рецепторов, включая сам никотин в форме пластырей, жевательной резинки, рассасывающихся таблеток и ингаляторов. Помимо никотина клиническое применение имеют два агониста никотиновых рецепторов - варениклин и цитизин. Еще один агонист никотиновых рецепторов, лобелии, исследован очень мало - многоцентровое исследование эффективности сублингвальных таблеток лобелина, проведенное компанией Dynagen в 1997 году, не подтвердило клиническую эффективность лобелина. Эффективность методов специфической фармакологической блокады никотиновых рецепторов посредством антагониста никотиновых рецепторов мекамиламина или иммунизации антителами к никотину также не выражена (Cahill K, Stevens S, Perera R, Lancaster Т. Pharmacological interventions for smoking cessation: an overview and network meta-analysis. Cochrane Database Syst Rev. 2013 May 31; 5:CD009329. doi: 10.1002/14651858.CD009329.pub2).
Ранее был предложен метод применения «по необходимости» дробных доз агонистов никотиновых рецепторов на основании признаков развившегося или приближающегося абстинентного состояния (US Patent 5,780,051, 14 июля 1998). Этот метод основан исключительно на способности никотина и других агонистов никотиновых рецепторов подавлять абстинентное состояние и тем самым предотвращать прием никотина нежелательным способом, таким как табакокурение.
НИКОТИН. Эффективность терапии препаратами никотина в лечении табакокурения изучалась в многочисленных двойных слепых рандомизированных плацебо-контролируемых исследованиях (Stead LF, Perera R, Bullen C, Mant D, Hartmann-Boyce J, Cahill K, Lancaster T. Nicotine replacement therapy for smoking cessation. Cochrane Database of Systematic Reviews 2012, Issue 11. Art. No.: CD000146. DOI: 10.1002/14651858.CD000146.pub4.). Выявлена большая эффективность препаратов никотина по сравнению с плацебо как по клиническим показателям продолжительности периода полной абстиненции (т.е. полного воздержания от табакокурения), так и по биохимическим показателям (например, содержание монооксида углерода в выдыхаемом воздухе, концентрация котинина в плазме или моче).
Основным недостатком терапии препаратами, содержащими никотин, является ограниченная эффективность в долгосрочной перспективе. Если на фоне терапии состояние полной абстиненции может достигать 50-75% пациентов (Cahill K, Stevens S, Perera R, Lancaster Т. Pharmacological interventions for smoking cessation: an overview and network meta-analysis. Cochrane Database Syst Rev. 2013 May 31; 5:CD009329. doi: 10.1002/14651858.CD009329.pub2), то через 3-6 месяцев после окончания терапии этот показатель снижается до 5-10% (Scherphof CS, van den Eijnden RJJM, Engels RCME, Vollebergh WAM. Long-term efficacy of nicotine replacement therapy for smoking cessation in adolescents: A randomized controlled trial. Drug and Alcohol Dependence 140 (2014) 217-220). Подобные ограничения долгосрочной эффективности являются характерными для заместительной терапии и поэтому в более или менее равной мере вероятны для различных лекарственных форм, содержащих никотин.
К числу недостатков заместительной терапии препаратами, содержащими никотин, относятся также побочные эффекты, связанные с необходимостью обеспечивать относительно постоянную концентрацию никотина в организме на уровне, адекватном для стимуляции никотиновых рецепторов. Ввиду многообразия подтипов никотиновых рецепторов, эффективная концентрация никотина в более или менее равной мере приводит к стимуляции подтипов никотиновых рецепторов, ответственных как за терапевтическое действие, так и за побочное действие в центральной нервной системе и других тканях и органах.
ВАРЕНИКЛИН. В 2006 в США и странах Европейского Союза зарегистрирован препарат Chantix/Champix (активное действующее начало - варениклин) компании Pfizer, как средство лечения табакокурения. Мета-анализ значительного количество клинических исследований показывает, что варениклин является одним из наиболее эффективных средств терапии табакокурения (Cahill K, Stevens S, Perera R, Lancaster Т. Pharmacological interventions for smoking cessation: an overview and network meta-analysis. Cochrane Database Syst Rev. 2013 May 31; 5:CD009329. doi: 10.1002/14651858.CD009329.pub2).
Эффективность варениклина связывают с его свойствами частичного агониста никотиновых рецепторов - агонистической активности должно быть достаточно для предотвращения и подавления абстинентного состояния («заместительная терапия»), в то время как в присутствии никотина положительно подкрепляющее и эйфоризирующее действие последнего должно ограничиваться (Rollema Н, Сое JW, Chambers LK, Hurst RS, Stahl SM, Williams KE (2007) Rationale, pharmacology and clinical efficacy of partial agonists of [alpha]4[beta]2 nACh receptors for smoking cessation. Trends in Pharmacological Sciences 28: 316-325).
Основным недостатком терапии варениклином является необходимость постоянного присутствия вещества в организме для обеспечения его механизма действия. Как вероятное следствие, постмаркетинговые исследования выявили связь между приемом варениклина и депрессией, суицидальным мышлением и поведением, а также сердечнососудистыми эффектами (Cahill K, Stead LF, Lancaster Т. Nicotine receptor partial agonists for smoking cessation. Cochrane Database of Systematic Reviews 2012, Issue 4. Art. No.: CD006103. DOI: 10.1002/14651858.CD006103.pub6). Последние имеют скорее всего большее клиническое значение, так как выраженность нейропсихиатрических побочных эффектов может быть малозначительна (Thomas KH, Martin RM, Knipe DW, Higgins JPT, Gunnell D. Risk of neuropsychiatric adverse events associated with varenicline: systematic review and meta-analysis. BMJ 2015; 350:h1109. doi: 10.1136/bmj.h1109).
Хотя для терапевтической эффективности наиболее важную роль приписывают подтипу никотиновых рецепторов, содержащих субъединицы α4 и β2, селективность варениклина в отношении этого подтипа ограничена, что вероятно определяет развитие побочных эффектов (Arias HR, Feuerbach D, Targowska-Duda K, Kaczor AA, Poso A, Jozwiak K. Pharmacological and molecular studies on the interaction of varenicline with different nicotinic acetylcholine receptor subtypes. Potential mechanism underlying partial agonism at human α4β2 and α3β4 subtypes. Biochim Biophys Acta 2015; 1848: 731-41).
ЦИТИЗИН. Этот препарат фициально зарегистрирован в качестве средства для лечения никотиновой зависимости (Etter JF, Lukas RJ, Benowitz NL, West R, Dresler CM. Cytisine for smoking cessation: A research agenda. Drug and Alcohol Dependence 2008; 92: 3-8). По механизму действия цитизин очень близок к варениклину, но возможно хуже проникает в центральную нервную систему при системном введении (Rollema Н, Сое JW, Chambers LK, Hurst RS, Stahl SM, Williams KE (2007) Rationale, pharmacology and clinical efficacy of partial agonists of [alpha]4[beta]2 nACh receptors for smoking cessation. Trends in Pharmacological Sciences 28: 316-325). Исследования на лабораторных животных показали эффективность системного введения цитизина на классических моделях никотиновой зависимости - модели внутривенного самовведения никотина, метода лекарственной дифференцировки никотинов в качества тренировочного стимула, модели активации внутримозговой системы «награды» (Igari М, Alexander JC, Ji Y, Qi X, Papke RL, Bruijnzeel AW. Varenicline and cytisine diminish the dysphoric-like state associated with spontaneous nicotine withdrawal in rats. Neuropsychopharmacology 2014; 39:455-465; Radchenko EV, Dravolina OA, Bespalov AY. Agonist and antagonist effects of cytisine in vivo. Neuropharmacology 2015; 95: 206-214). С использованием этих способов, а также методов анализа локомоторной активности были продемонстрированы как никотиноподобные свойства цитизина, так и его способность подавлять эффективность никотина (Radchenko EV, Dravolina OA, Bespalov AY. Agonist and antagonist effects of cytisine in vivo. Neuropharmacology 2015; 95: 206-214). Эти свойства цитизина как частичного агониста никотиновых рецепторов согласуются с данными, полученными для варениклина (Rollema Н, Сое JW, Chambers LK, Hurst RS, Stahl SM, Williams KE (2007) Rationale, pharmacology and clinical efficacy of partial agonists of [alpha]4[beta]2 nACh receptors for smoking cessation. Trends in Pharmacological Sciences 28: 316-325).
Клинические исследования указывают на значительную клиническую эффективность цитизина (Cahill K, Stead LF, Lancaster Т. Nicotine receptor partial agonists for smoking cessation. Cochrane Database of Systematic Reviews 2012, Issue 4. Art. No.: CD006103. DOI: 10.1002/14651858.CD006103.pub6). Сравнительные исследования цитизина и других агонистов никотиновых рецепторов не проводились (за исключением: Walker N, Howe С, Glover М, McRobbie Н, Barnes J, Nosa V, Parag V, Bassett B, Bullen C. Cytisine versus nicotine for smoking cessation. N Engl J Med. 2014; 371: 2353-62), но анализ клинических и экономических показателей указывает на вероятную эквивалентность цитизина и варениклина (Leaviss J, Sullivan W, Ren S, Everson-Hock E, Stevenson M, Stevens JW. What is the clinical effectiveness and cost-effectiveness of cytisine compared with varenicline for smoking cessation? A systematic review and economic evaluation. Health Technol Assess 2014; 18(33)).
Недостатками существующей терапии табакокурения и других форм никотиновой зависимости при использовании как цитизина, так и для других агонистов никотиновых рецепторов являются следующие.
Во-первых, обладая ограниченной селективностью в отношении подтипов никотиновых рецепторов, эти вещества при системном введении влияют не только на рецепторы, ответственные за формирование и поддержание никотиновой зависимости и расположенные в центральной нервной системе, но и периферические рецепторы, взаимодействие с которыми может определять развитие побочных эффектов, препятствуя эффективному дозированию этих лекарственных средств.
Во-вторых, недостатками этих препаратов является необходимость длительного ежедневного приема таблеток, что поддерживает вероятность развития побочных эффектов на относительном стабильном уровне.
В-третьих, хотя вещества типа варениклина и цитизина являются частичными агонистами и способны блокировать эффекты никотина (Radchenko EV, Dravolina OA, Bespalov AY. Agonist and antagonist effects of cytisine in vivo. Neuropharmacology 2015; 95: 206-214; Rollema H, Сое JW, Chambers LK, Hurst RS, Stahl SM, Williams KE (2007) Rationale, pharmacology and clinical efficacy of partial agonists of [alpha]4[beta]2 nACh receptors for smoking cessation. Trends in Pharmacological Sciences 28: 316-325), их клиническая эффективность основана на способности замещать никотин, а антагонистические свойства не проявляются в полной мере, оказывая биологическое действие как в присутствии никотина, так и в его отсутствие, создавая предпосылки для побочных эффектов.
В-четвертых, заместительная терапия создает относительно короткий терапевтический эффект - после окончания терапии частота рецидивов табакокурения нарастает, практически сравниваясь с группами плацебо контроля (Agboola SA, Coleman Т, McNeill A, Leonardi-Bee J. Abstinence and relapse amongst smokers who use varenicline in a quit attempt - a pooled analysis of randomized controlled trials. Addiction 2015; Apr 6. doi: 10.1111/add.12941).
Известен способ обеспечения снижения потребности в курении или употреблении табака путем применения многокомпонентной интраоральной лекарственной формы, включающей ингредиент для лечения табачной зависимости, выбранный из группы, содержащей: варениклин, бупропион, нортриптилин, доксепин, флуоксетин, имипрамин, моклобемид и/или цитизин (Заявка на изобретение РФ №2011119494, основанная на международной заявке (публикация WO 2010/044736, РСТ SE 2009/051163).
Способ заключается во введении многокомпонентной лекарственной формы посредством спреев для полости рта, спреев для носа, трансдермальных пластырей, ингаляторов, пастилок, таблеток и парентеральных способов, подкожных и чресслизистых способов, использование табака, и/или поведенческую терапию.
Способ способствует отказу от курения, посредством введения вещества, имитирующего никотин в любой форме, из лекарственной формы в слюну в ротовой полости и всасывания в системный кровоток пациента.
Для указанного способа характерны недостатки, приведенные выше (системное воздействие с вероятностью развития системных побочных эффектов и соответствующих противопоказаний, возможность передозировки).
Механизм действия основан на замещении никотина, в то время как долгосрочная эффективность заместительной терапии никотиносодержащими препаратами достаточно низка.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Изобретение направлено на разработку эффективного и удобного в применении способа с использованием средства, включающего цитизин для лечения табакокурения и других форм никотиновой зависимости, обеспечивающего длительность действия.
1. Разработан способ лечения табакокурения и других форм никотиновой зависимости средством, содержащим активное начало на основе цитизина и вспомогательных веществ. Средство содержит от 1 мг/мл до 100 мг/мл цитизина в растворе, содержащем вспомогательные вещества, средство вводят в организм в виде дробных доз, каждая из которых содержит от 25 до 500 мкл, путем интраназальных впрыскиваний перед, во время или непосредственно после применения никотина.
Разработанный способ обеспечивает преимущественное поступление цитизина в организм в то время, когда пациент посредством курения табака или другим способом повышает концентрацию никотина в тканях, никотиновые рецепторы в которых ответственны за развитие никотиновой зависимости. Таким образом, этот способ ограничивает концентрацию цитизина в организме в то время, когда нет необходимости в нейтрализации действия никотина, что снижает вероятность развития побочных эффектов.
Разработанный способ интраназального введения цитизина обеспечивает более благоприятное соотношение центральных и периферических эффектов, что снижает вероятность развития побочных эффектов.
Как правило, средство вводят непосредственно перед введением никотина (например, посредством курения табака), однако по необходимости возможно отсроченное введение (например, во время курения табака).
Для введения средство используют в растворе, состоящем из компонентов, разрешенных для использования в здравоохранении для интраназального введения.
Раствор для интраназальных впрыскиваний содержит: цитизин в количестве от 1 мг/мл до 100 мг/мл.
Раствор содержит вспомогательные вещества вес %: минеральные соли (0,05-2%), антиоксидант (0,01-0,2%), консервант (0,01-0,2%), сорастворитель (0,01-10%), регулятор кислотности (до рН 5,0-8,0), вода (до 100%).
Концентрация цитизина в растворе может быть снижена до 1 мг/мл или повышена до 100 мг/мл так как: а) получаемая разовая доза цитизина находится в прямой зависимости от разового объемы впрыскивания, который может варьироваться от 25 до 500 мкл, б) впрыскивание может производиться в одну ноздрю или обе, в) эффективность всасывания зависит от состояния слизистой носовой полости, г) соотношение количества цитизина, попадающего после всасывания со слизистой носовой полости в системный кровоток, и количества, проникающего в ЦНС, может зависеть от физико-химических свойств раствора, композиции раствора и размера впрыскиваемых или распыляемых частиц.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ.
В качестве растворов, приведены примеры композиций, содержащие гидрофосфат натрия и дигидрофосфат натрия - регуляторы кислотности, ЭДТА, метилпарабен и пропилпарабен - консерванты, натрий хлорид - соль, полисорбат - сорастворитель, лимонная кислота антиоксидант.
ПРИМЕРЫ КОМПОЗИЦИИ:
Пример композиции 1
Содержание цитизина в растворе - 40 мг/мл
ЭДТА - 10 мг
Лимонная кислота - 30 мг
Гидрофосфат натрия - 600 мг
Дигидрофосфат натрия - 750 мг
Метилпарабен - 300 мг
Пропилпарабен - 75 мг
Натрия хлорид - 8400 мг
Полисорбат 800 мг
Очищенная вода - до 1000 мл
Пример композиции 2
Содержание цитизина в растворе - 1 мг/мл
Состав раствора.
ЭДТА - 10 мг
Лимонная кислота - 10 мг
Гидрофосфат натрия - 200 мг
Дигидрофосфат натрия - 250 мг
Метилпарабен - 300 мг
Пропилпарабен - 7, мг
Натрия хлорид - 8400 мг
Полисорбат 500 мг
Очищенная вода - до 1000 мл
Пример композиции 3
Содержание цитизина в растворе - 100 мг/мл
Состав раствора.
ЭДТА - 10 мг
Лимонная кислота - 40 мг
Гидрофосфат натрия - 600 мг
Дигидрофосфат натрия - 750 мг
Метилпарабен - 300 мг
Пропилпарабен - 7,5 мг
Натрия хлорид - 8400 мг
Полисорбат 500 мг
Очищенная вода - до 1000 мл.
ПРИМЕНЕНИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ТАБАКОКУРЕНИЯ.
Непосредственно перед курением табака средство, содержащее 40 мг/мл цитазина на основе раствора композиции 1, вводят посредством интраназального впрыскивания в каждую ноздрю 100 мкл. Процедура повторяется перед каждым актом курения (сигареты или иного никотиносодержащего продукта).
ПРИМЕНЕНИЕ СРЕДСТВА ДЛЯ ПРОФИЛАКТИКИ РЕЦИДИВОВ ТАБАКОКУРЕНИЯ.
Непосредственно перед курением табака композицию, содержащую цитизин, вводят посредством интраназального впрыскивания в каждую ноздрю 100 мкл водного раствора цитизина (40 мг/мл). Процедура выполняется только перед актом курения (сигареты или иного никотиносодержащего продукта).
Далее приведены исследования, подтверждающие применение раствора цитизина интраназально для достижения рецепторов-мишеней в центральной нервной системе.
В экспериментах использовали самцов крыс стока Wistar (Питомник лабораторных животных РАМН «Рапполово», Санкт-Петербург, Россия). (-)-никотина гидроген тартрат (Sigma-Aldrich Co., США) растворяли в фосфатном буфере (рН=7.4). Раствор никотина (0,6 мг/кг) приготовляли непосредственно перед инъекцией вводили в объеме 1 мл/кг. Цитизин (Sequoia Research Product Ltd, Pangbourne, Великобритания) растворяли в 0,9% водном растворе NaCl из расчета 30 мг/мл.
Было выполнено несколько серий эксперимента с использованием разных способов интраназального введения цитизина: при помощи полиэтиленовой трубочки, надетой на иглу микрошприца, или шприца высокого давления (Penn-Century, INC., США; Model АО-250) с микроспрейером (Penn-Century, INC., США; Model IA-1C s/n 2970).
Тесты выполняли с интраназальным введением раствора цитизина (30 мг/мл) или растворителя (0,9% водный раствор NaCl) за 15 мин до посадки в бокс и за 10 мин до введения никотина. Порядок проведения тестов определяли по схеме «латинский квадрат». При использовании микроспрейера каждой крысе (средний вес крыс: 249±3,7 - в начале эксперимента; 341±7,2 - в конце эксперимента) вводили 25 мкл, а при использовании микрошприца - 40 мкл. Таким образом, в первом случае каждая крыса (весом 250 г) получала 0,75 мг (около 3 мг/кг), а во втором - 1,2 мг (около 4,8 мг/кг).
Статистическую обработку полученных данных проводили с использованием пакета статистических программ SPSS (версия 16, США). При парных сравнениях двух повторных измерений выполняли парный t-тест; в случае множественных повторных измерений - дисперсионный анализ с последующими post hoc сравнениями. Межгрупповые сравнения (тест Бонферрони) проводили только при условии, что значимый эффект был выявлен процедурой дисперсионного анализа. Различия считали значимыми при Р<0,05.
Эксперимент №1 «Локомоторная активность»
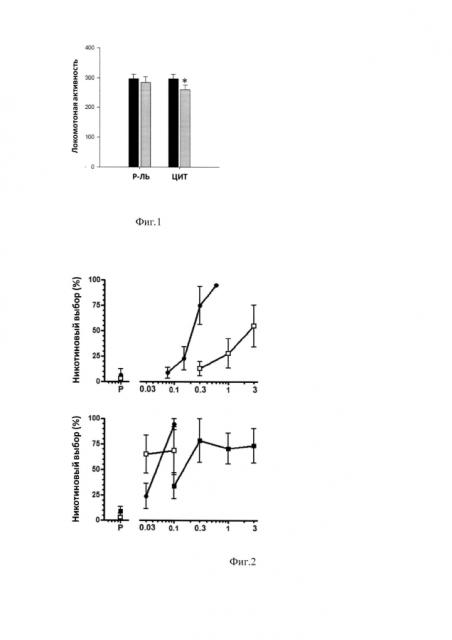
Для эксперимента отбирали крыс, чувствительных к стимулирующему действию никотина (0,6 мг/кг), для чего оценивали двигательную активность животных под действием никотина в течение 7 дней. Длительность тестов составляла 60 мин. На Рисунке 1 показана горизонтальная двигательная активность соответствующих групп крыс на 7-й день введения никотина и после получения ими никотина (0,6 мг/кг, sc) и цитизина с помощью микрошприца приводило к небольшому (около 10%), но статистически значимому уменьшению горизонтальных перемещений крыс по сравнению с исходным уровнем.
На фиг. 1 приведено влияние интраназального введения цитизина на потенцирование двигательной активности крыс никотином. Никотин (NIC; 0,6 мг/кг, п/к) вводили за 5 мин до посадки в боксы «Актометра». Цитизин (ЦИТ) с его растворителем (Р-ЛЬ) вводили за 15 мин до экспериментальной сессии путем впрыскивания с помощью силиконовой трубочки, надетой на иглу инсулинового шприца (серые столбики). По оси ординат - средние значения (M±m) числа последовательных пересечений лучей фотодатчиков за 60 мин теста. * P<0,05 (тест Стьюдента) по сравнению с исходными показателями (7-ой день введения никотина, черные столбики). N=19. Полученные результаты свидетельствуют о том, что цитизин может применяться интраназально для достижения рецепторов-мишеней в центральной нервной системе.
Эксперимент №2 «Лекарственная дифференцировка»
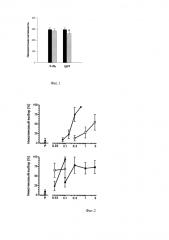
Крысы были обучены процедуре лекарственной дифференцировки и во время контрольных сессий с тренировочной дозой никотина и физиологическим раствором количество нажатий на подкрепляемую педаль превышало 95% от общего числа нажатий на обе педали за сессию. При проведении тестов генерализации повышение дозы никотина дозозависимо увеличивало вероятность выбора крысами «никотиновой» педали, но не оказывало влияния на частоту оперантной реакции. Цитизин также обладал никотиноподобными дискриминативными стимульными свойствами как при системном пути введения, так и при внутрижелудочковом и интранальном введении (Фиг 2).
На Фиг. 2 приведены дискриминативные стимульные свойства цитизина у крыс, обученных различать никотин. Никотин, цитизин или их растворитель (Р) вводили за 5 минут до сессии либо подкожно (верхний график), либо местно (нижний график). По оси ординат - % выбора никотиновой педали (M±m). N=8. По оси абсцисс - доза никотина или цитизина в мг/кг (верхний график) или микромоль (нижний график). Черные кружки - никотин, белые квадраты - подкожное или внутрижелудочковое введение цитизина, черные квадраты - интраназальное введение цитизина.
Полученные результаты свидетельствуют о том, что при интраназальном введении раствора, содержащего цитизин, он обладает специфической и дозазависимой активностью, которая отражает его действие на рецепторы-мишени в центральной нервной системе. Метод лекарственной дифференцировки может быть использовать для определения эффективных доз цитизина.
Эксперимент №3 «Внутривенное самовведение»
Крысы были обучены процедуре внутривенного самовведения никотина (0,01 мг/кг никотина на инъекцию, трехчасовые сессии). После выработки устойчивого навыка самовведения (критерий - не менее 10 инфузий никотина в час) животным вводили цитизин или его растворитель внутрижелудочково одновременно с каждой инфузией никотина, а экспериментальные сессии продлевали до 6 часов. Ежедневное введение цитизина приводило к постепенному угасанию навыка самовведения.
На фиг. 3 приведено внутривенное самовведение никотина на фоне введения цитизина. Цитизин (внутрижелудочково, 0,03 микромоль за инъекцию) или его растворитель вводили одновременно с внутривенными инфузиями никотина. После каждой инфузии никотина в течение 10 минут оперантные реакции (нажатия на педаль) регистрировали, но они не имели последствий («тайм-аут»). По оси ординат - общее количество нажатий на никотиновую педаль (M±m) за шесть часов. N=12. По оси абсцисс - последовательные дни эксперимента (К - последний день выработки навыка самовведения никотина, 1-14 - дни введения цитизина и его растворителя).
Полученные результаты свидетельствуют о том, что при прямом введении в центральную нервную систему цитизин способен вызывать явление фармакогенного угашения ранее выученного навыка внутривенного самовведения никотина. Эти данные указывают на то, что благодаря свойствам частичного агониста цитизин способен подавлять эффекты никотина, ответственные за поддержание зависимости, что может приводить к постепенному угашению никотиновой зависимости.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Пример. Пациент X., 1969 г. р., начал курить с 19 лет. Курил сигареты «Lucky Strike» 20-25 штук в день. Пытался бросить самостоятельно, не получилось. Пациенту было предложено использовать интраназальное введение дробных доз цитизина, вводимого в растворе в эффективной дозе сразу перед или во время курения (50 мкл на прием). Пациенту было рекомендовано постоянно носить раствор цитизина вместе сигаретами для того, чтобы обеспечить максимально возможный процент эпизодов курения на фоне введения цитизина. После 4 недель терапии количество ежедневно выкуриваемых сигарет сократилось до 4-5. Пациенту было рекомендовано продолжать терапию. В течение последующего года количество ежедневно выкуриваемых сигарет сохранялось на низком уровне и при контрольном анализе через 12 месяцев пациент практически полностью отказался от курения. Эффект лечения подтвержден отсутствием метаболитов никотина в моче и выдыхаемом воздухе, а также свидетельствами членов семьи.
СОСТАВ СРЕДСТВА соответствует композиции 1, включающей 40 мг/мл цитизина в растворе.
1. Способ лечения табакокурения и других форм никотиновой зависимости средством, содержащим активное начало на основе цитизина и вспомогательных веществ, отличающийся тем, что средство содержит от 1 мг/мл до 100 мг/мл цитизина в водном растворе, содержащем вспомогательные вещества, средство вводят в организм в виде дробных доз, каждая из которых составляет от 25 до 500 мкл, путем интраназальных впрыскиваний перед, во время или непосредственно после введения никотина.
2. Способ по п. 1, отличающийся тем, что средство вводят одновременно с введением никотина во время курения табака.
3. Способ по п. 1, отличающийся тем, что средство вводят после введения никотина непосредственно после курения табака.
4. Способ по п. 1, отличающийся тем, что средство вводят путем ингаляций.
5. Способ по п. 1, отличающийся тем, что средство вводят в количестве 1 мг/мл до 100 мг/мл цитизина в растворе, содержащем вспомогательные вещества в вес.%: минеральные соли (0,05-2%), антиоксидант (0,01-0,2%), консервант (0,01-0,2%), сорастворитель (0,01-10%), регулятор кислотности (до рН 5,0-8,0), вода (до 100%).