Трансгенное растение осины с повышенной продуктивностью и модифицированной древесиной
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к трансгенному растению осины со следующими признаками повышенной продуктивности - увеличенным выходом биомассы, листьями большего размера, увеличенной активностью глутаминсинтетазы и повышенной эффективностью использования азота, а также с модифицированной древесиной по сравнению с нетрансформированным растением осины, содержащему нуклеиновую кислоту, кодирующую глутаминсинтетазу, а также к способу его получения. Изобретение позволяет эффективно получать растение осины с повышенной продуктивностью, а также модифицированной древесиной. 2 н. и 3 з.п. ф-лы, 5 ил., 3 табл., 10 пр.
Реферат
Область техники, к которой относится изобретение.
Настоящее изобретение относится к области генной инженерии растений и связано с получением трансгенных растений осины, обладающих повышенной продуктивностью и модифицированной древесиной. Результаты данного изобретения могут быть использованы в лесном хозяйстве, строительстве, целлюлозно-бумажной промышленности, производстве древесных композиционных материалов, производстве различных видов биотоплива и многих других отраслях народного хозяйства, использующих осину в качестве сырья.
Уровень техники.
Осина в России произрастает почти повсеместно и находится на втором месте по занимаемой площади среди лиственных пород (1/7 этой площади). Древесина осины не дает сильно коптящего пламени, поэтому она служит основным сырьем для спичечной промышленности. Используется в строительстве, а также для внутренней отделки русских бань и саун, для токарных и резных изделий. Древесина осины применяется для производства древесноволокнистых плит, целлюлозы, картона, фанеры, в лесохимическом производстве и других отраслях. Наряду с видами тополя и ивы осина относится к важнейшим видам древесных пород для лесных плантаций короткого цикла целевого назначения, как правило, для использования в качестве биотоплива. Однако применение осины ограничивается из-за часто встречающейся в растущих деревьях сердцевинной гнили.
По цвету коры и качеству древесины выделяют три разновидности осины: зеленокорую, темнокорую и серокорую. Наибольшее распространение имеет серокорая осина. Зеленокорая осина более устойчива к заболеванию сердцевинной гнилью и опережает в росте по диаметру и запасу древесины серокорую на один класс возраста, что позволяет сократить оборот в ее насаждениях на 10 лет. Еще большее повышение продуктивности генотипов осины, обладающих устойчивостью к сердцевинной гнили, делает такие растения идеальными кандидатами для создания лесных плантаций с коротким циклом ротации. Наиболее перспективным способом такого повышения продуктивности является применение методов генной инженерии, позволяющих путем встраивания конкретных генов придать растениям конкретный признак.
Для повышения скорости роста древесных растений использовали ряд генно-инженерных подходов, направленных на модификацию различных сфер метаболизма растений. Положительный эффект был достигнут при суперэкспрессии гена ксилоглюканазы из Aspergillus aculeatus в растениях тополя белого (Park et al., 2004, FEBS Lett., 564:183-187), гена пероксидазы хрена prxC1a в растениях осины (Kawaoka et al., 2003, Plant Physiol., 132:1177-1185), гена гемоглобина vhb из Vitreoscilla spp. в растениях тополя белого (Zelasco et al., 2006, Mol. Breed., 17:201-216), а также при суперэкспрессии ключевых генов биосинтеза гиббереллинов в растениях гибридной осины (Eriksson et al., 2000, Nat. Biotechnol., 18:784-788). Однако наиболее детальное освещение в научной литературе получил способ повышения скорости роста путем модификации метаболизма азота за счет суперэкспрессии гена глутаминсинтетазы (GS). Связано это с тем, что доступность неорганического азота в почве зачастую является лимитирующим фактором в росте и развитии растения. Фермент глутаминсинтетаза играет центральную роль в метаболизме азота у растений, катализируя превращение аммония в глутамин, который является аминокислотным предшественником глутамата и всех азотсодержащих компонентов, необходимых для роста растения. Растительная GS - это голофермент, состоящий из 8 идентичных полипептидных субъединиц и включающий два основных изофермента, GS1 и GS2, которые локализуются в различных внутриклеточных компартментах, цитозоле и хлоропластах, соответственно (Kirby et al., 2006, Silvae Genet., 55:278-284). Генетические и молекулярные исследования показала, что GS может играть ключевую роль в эффективном использовании азота растениями (Hirel et al., 1992, Plant Mol. Biol., 20:207-218; Obara et al., 2001, J. Exp. Bot., 52:1209-1217). Продукты GS - глутамат и глутамин - являются предшественниками всех азотных соединений растения (Ireland and Lea, 1999, in: Plant Amino Acids: Biochemistry and Biotechnology, pp. 49-109, edited by В. K. Singh, Marcel Dekker Inc., New York). Поэтому генетическая модификация процессов, катализируемых ферментами GS1 и GS2, может очень результативным подходом повышения продуктивности лесных древесных растений, особенно в случаях их выращивания на бедных по азоту почвах. В работе Gallardo et al. (1999, Planta, 210:19-26) было продемонстрировано положительное влияние встраивания гена глутаминсинтетазы на скорость роста трансгенных растений гибрида осины и тополя (Populus tremula × Р. alba) в теплице. Трехлетние полевые испытания этих растений также подтвердили их ускоренный рост (Jing et al., 2004, New Phytol., 164:137-145). Таким образом, встраивание гена глутаминсинтетазы в растения является перспективным способом повышения их продуктивности.
Целлюлозно-бумажная промышленность является одной из важнейших отраслей мировой промышленности. Объем производства бумаги и картона в 2008 составил 370 млн. т. Основной проблемой при переработке древесины целлюлозно-бумажными комбинатами является лигнин, содержание которого в древесине составляет около 30%. Существуют различные способы удаления лигнина из древесной массы, но все они использованы на применении сильнодействующих химических веществ, кислот и щелочей, что кроме сложностей технологического процесса еще и неблагоприятным образом влияет на окружающую среду. Лигнины также существенно усложняют переработку древесины в жидкие виды биотоплива. Поэтому для повышения ценности древесины, а также повышения эффективности производства и улучшения его экологичности обходимо решить проблему удаления лигнинов путем снижения их общего количества или изменения состава, желательно одновременно с повышением содержания в древесине целлюлозы. По этим причинам данное направление является основным в генной инженерии лесных пород древесных растений (см. обзоры Chen et al., 2001, Euphytica, 118:185-195, 2001; Baucher et al, 2003, Crit. Rev. Biochem. Mol. Biol., 38:305-350; Chiang, 2006, Environ. Chem. Lett., 4:143-146; Mellerowicz et al., 2008, Curr. Opin. Plant Biol., 11:293-300). На этом пути есть определенные успехи, но часто в силу недостаточной изученности биохимии и физиологии древесных растений снижение содержания лигнина сопровождается нежелательными побочными эффектами, например, значительному замедлению роста (Coleman et al., 2008, Plant Physiol., 148:1229-1237). Идеальным было бы создание дерева, сочетающего повышенную продуктивность с пониженным содержанием лигнина и/или повышенным содержанием целлюлозы, однако вероятность его получения достаточно низка, так как к возможным нежелательным эффектам от снижения содержания лигнина добавляются значительные технические сложности переноса в растения сразу нескольких генов.
Известно, что фенилпропаноидные составляющие лигнина синтезируются из фенилаланина и тирозина, на синтез которых через глутамин и глутаминовую кислоту может влиять глутаминсинтетаза (Gallardo et al., 2003, Plant Physiol. Biochem., 41:587-594). Таким образом, встраивание гена глутаминсинтетазы, изменяющего метаболизм азота в растениях, помимо повышения продуктивности теоретически может влиять и на биосинтез лигнина, в том числе и в сторону снижения его содержания. На настоящий момент известно только одно древесное растение со встроенным геном глутаминсинтетазы - гибрид осины и тополя (Populus tremula × P. alba). Эти трансгенные растения демонстрировали ускоренный рост в теплице (Gallardo et al., 1999, Planta, 210:19-26) и в полевых условиях (Jing et al., 2004, New Phytol., 164:137-145). Анализы древесины этих растений не показали изменения общего содержания лигнинов, но отмечалось незначительное (на 2,7%) увеличение длины древесных волокон.
Раскрытие изобретения.
Задачей настоящего изобретения было получение трансгенной осины, отличающейся повышенной продуктивностью и модифицированной древесиной, на основе элитного генотипа P. tremula PtV22, который относится к зеленокорой форме осины и характеризуется быстрым ростом и устойчивостью к серцевинной гнили.
Используемый в настоящем описании термин «растение» охватывает целые растения, предшественники и потомство растений и части растений, включая семена, побеги, стебли, листья, корни, цветки и ткани и органы, причем все они содержат нуклеотидную последовательность с SEQ ID NO: 1. Термин «растение» также охватывает клетки растений, суспензионные культуры, каллусную ткань, зародыши, меристемы, гаметофиты, спорофиты, пыльцу и микроспоры, причем все они, опять же, содержат нуклеотидную последовательность с SEQ ID NO: 1.
Хотя осина по сравнению с большинством древесных растений трансформируется и регенерирует относительно легко, но вероятность получения целого трансгенного растения, в котором сочетаются: 1) уровень экспрессии встроенного гена, достаточный для проявления соответствующего фенотипического признака, 2) ненарушенная экспрессия эндогенных генов растения, 3) модифицированный состав древесины вследствие неспецифического изменения биосинтеза лигнинов и/или других ее компонентов, весьма мала, и поэтому получение положительного результата при решении поставленной задачи не являлось очевидным фактом.
В качестве трансформирующего агента при получении трансгенной осины по изобретению использовали бинарный вектор pGS, включающий нуклеотидную последовательность глутаминсинтетазы. Структура вектора представлена на фиг. 1.
В первом аспекте настоящее изобретение относится к растению осины с повышенной продуктивностью и модифицированной древесиной, где указанное растение осины трасформировано молекулой нуклеиновой кислоты, которая кодирует глутаминсинтетазу.
Молекула нуклеиновой кислоты может представлять собой кДНК, РНК или их гибридную молекулу. Предпочтительно молекулой нуклеиновой кислоты является молекула кДНК, кодирующая глутаминсинтетазу. Наиболее предпочтительно молекула кДНК имеет нуклеотидную последовательность, представленную в SEQ ID NO: 1.
Молекулу нуклеиновой кислоты глутаминсинтетазы можно выделить из любого вида растений. Предпочтительно растение представляет собой Pinus sylvestris.
Растение осины, трансформированное молекулой нуклеиновой кислоты глутаминсинтетазы, может представлять любой вид осины из рода Populus. Предпочтительно растение осины принадлежит к виду P. tremula.
Во втором аспекте настоящее изобретение относится к трансгенному растению осины, содержащему молекулу нуклеиновой кислоты, кодирующей глутаминсинтетазу, где экспрессия данной молекулы приводит к получению трансгенного растения, которое демонстрирует следующие признаки повышения продуктивности: увеличенный выход биомассы, листья большего размера, увеличенная активность глутаминсинтетазы, повышенная эффективность использования азота по сравнению с аналогом дикого типа.
Экспрессия молекулы нуклеиновой кислоты, кодирующей глутаминсинтетазу, приводит также к получению трансгенного растения, которое демонстрирует один или более из следующих признаков модификации древесины: измененное содержание лигнина, измененное содержание целлюлозы, измененное содержание гемицеллюлозы, измененный состав лигнина, измененные параметры древесных волокон по сравнению с аналогом дикого типа. Эффекты экспрессии нуклеиновой молекулы глутаминсинтетазы могут не ограничиваться вышеприведенными признаками модификации древесины.
В третьем аспекте настоящее изобретение относится к способу получения трансгенного растения осины с повышенной продуктивностью и модифицированной древесиной, где способ включает стадии:
а) агробактериальной трансформации эксплантов осины in vitro молекулой нуклеиновой кислоты, кодирующей глутаминсинтетазу;
б) регенерации целых растений из трансформированных клеток;
в) идентификации молекулы нуклеиновой кислоты, кодирующей глутаминсинтетазу, в регенерированных растениях или их потомстве;
г) отбора растений осины с повышенной продуктивностью по сравнению с растениями того же генотипа, не содержащими молекулу нуклеиновой кислоты, кодирующей глутаминсинтетазу;
д) отбор растений осины с модифицированной древесиной по сравнению с растением того же генотипа, которое не содержит молекулу нуклеиновой кислоты, кодирующей глутаминсинтетазу.
В еще одном варианте осуществления способ дополнительно включает стадию трансформации растения осины нуклеотидной последовательностью, кодирующей селективный или репортерный ген, который функционально связан с молекулой нуклеиновой кислоты, кодирующей глутаминсинтетазу, посредством чего облегчается отбор трансгенного растения осины среди регенерированных растений.
Краткое описание чертежей.
Фиг. 1 - схема основных генетических элементов трансформационного вектора pGS.
Фиг. 2 - результат проведения рестрикционной проверки вектора pGS рестриктазами XbaI и SacI.
Фиг. 3 - результат проведения рестрикционной проверки вектора pGS рестриктазой BglII.
Фиг. 4 - результат регенерации побегов осины после трансформации вектором pGS.
Фиг. 5 - результат проведения ПЦР на фрагмент гена глутаминсинтетазы на ДНК трансформированных линий осины.
Осуществление изобретения.
Пример 1. Ген глутаминсинтетазы.
Целью выделения являлась нуклеотидная последовательность мРНК глутаминсинтетазы из P.sylvestris (GenBank Х69822), представленная в SEQ ID NO: 1. Тотальную РНК выделяли из 7-10-дневных проростков сосны по методике Gehrig et.al. (2000, Plant Mol. Biol. Rep., 18:369-376) с использованием готовых наборов экстракции фирмы BioRad (США). Электрофорез выделенной РНК проводили в специальном буфере (10x MOPS) в электрофорезной камере фирмы Amersham (США). Препарат РНК перед нанесением денатурировали путем приготовления следующей смеси: 2 мкл препарата тотальной РНК, 0,9 мкл 10х MOPS, 1,7 мкл формалина (37% раствор формальдегида в воде, рН не выше 4), 4,5 мкл формамида. После этого смесь инкубировали при 65°С 15 мин и наносили в лунки агарозного геля в сочетании со стандартным буфером. Оценку количества полученного препарата проводили стандартным спектрофометрическим методом. Для клонирования одного гена необходимо экстрагировать не менее 10 мкг тотальной РНК.
Для получения кДНК копии гена глутаминсинтетазы методом реакции обратной транскрипции использовали фермент обратную транскриптазу фирмы Fermentas (США), олиго-dT (Синтол, Россия) и комплект буферов и нуклеотидов Fermentas. Для синтеза кДНК гена глутаминсинтетазы брали 2-5 мкг РНК, добавляли 1-2 мкМ олиго-dT и доводили объем до 10 мкл водой, обработанной ДЭПК. После этого смесь инкубировали при 70°С в течение 10 минут с последующим переносом на лед. По окончанию инкубации добавляли ревертазную смесь общим объемом 20 мкл, содержащую 10% DTT, 5 единиц ревертазы, буфер для ревертазы, 0,5 мМ нуклеотидов и 2-5 единиц ингибитора РНК-азы. Смесь инкубировали в течение часа при 42°С, после чего прогревали при 70°С 15 минут и далее разбавляли реакционную смесь бидистиллированной водой до 100 мкл.
Для проведения амплификации целевого фрагмента с кДНК копии использовали термоциклер (амплификатор) типа Mastercycler фирмы Eppendorf (Германия), полимеразу Pfu с соответствующим буфером и набор нуклеотидов от фирмы Fermentas. Условия ПЦР на ген глутаминсинтетазы были следующие: 5 минут при 93°С (горячий старт), 45 секунд при 93°С (денатурация), 30 секунд при 63°С (отжиг), 30 секунд при 72°С (элонгация). циклов амплификации 30. Использовали праймеры GS1-UTR-1 (SEQ ID NO: 2) и GS1-UTR-2 (SEQ ID NO: 3). Ожидаемый размер фрагмента 1443 п. о. Электрофорез сплайсированных фрагментов ДНК проводили в 1% агарозном геле в электрофорезной камере фирмы Amersham (США).
Пример 2. Клонирование гена глутаминсинтетазы в вектор pGEM-T Easy.
5′- и 3′-концы фрагмента ДНК из примера 1, кодирующего ген глутаминсинтетазы с сайтами рестрикции XbaI и SacI подвергали обработке соответствующими рестриктазами для образования липких кончиков. Далее для очистки полученных препаратов от примесей ферментов и нежелательных фрагментов ДНК образцы разделяли путем электрофореза в агарозе. Для выделения фрагментов ДНК из агарозного геля использовали фирменный кит MBI Fermentas (#K0513).
В качестве промежуточного вектора использовали вектор pGEM-T Easy (Promega) который также обрабатывали рестриктазами XbaI и SacI. Перед лигированием для удаления фосфата на 5′ конце вектор обрабатывали щелочной фосфатазой из кишечника теленка MBI Fermentas. Реакцию лигирования проводили Т4 ДНК лигазой MBI Fermentas в течение 12 часов при 12°С. Фермент инактивировали 10 мин при 65°С, а затем лигазной смесью трансформировали E. coli.
Компетентные клетки E. coli трансформировали лигазной смесью кальциевым методом и высевали на агар LB, содержащий канамицин для отбора клеток E. coli, трансформированных вектором. Количество колоний-трансформантов оценивали после 16-18 часов инкубации при 37°С. Трансформированные колонии E. coli тестировали на присутствие гена глутаминсинтетазы в векторе амплификацией ПЦР фрагмента гена глутаминсинтетазы после предварительной обработки рестриктазами SacI и XbaI. У целевых клонов после рестрикции с данными рестриктазами на агарозном гельэлектрофорезе видна вставка соответствующего размера.
Пример 3. Конструирование вектора pGS, содержащего ген глутаминсинтетазы.
Отобранные в примере 2 колонии использовали для инокуляции среды LB и получения ночной культуры бактерий, из которой далее выделяли плазмидную ДНК щелочным методом (Маниатис и др., Методы генетической инженерии. Молекулярное клонирование, 1984). Секвенирование клонов со вставками целевых фрагментов проводили в фирме ЗАО «Евроген» (Россия).
В качестве вектора использовали бинарный вектор pBI121 размером 14758 п.о., из которого по сайтам XbaI и SacI путем обработки соответствующими рестриктазами удаляли фрагмент длиной 1900 п.о. (ген β-глюкуронидазы). Базовую часть вектора длиной 12858 п. о. (фрагмент pBI-XbaI-SacI) использовали для дальнейшего клонирования. Вставку гена глутаминсинтетазы получали путем обработки плазмидной ДНК рестриктазами XbaI и SacI. 5′- и 3′-концы фрагмента ДНК, кодирующего глутаминсинтетазу, обрабатывали щелочной фосфатазой. Лигирование фрагментов pBI-XbaI-SacI и ДНК, кодирующей глутаминсинтетазу, проводили при температуре 4°С в присутствии Т4 ДНК лигазы (Fermentas) с образованием вектора pGS. Перенос вектора в клетки E. coli, выделение плазмидной ДНК и проверку вставки гена глутаминсинтетазы выполняли, как описано в примере 2.
Рестрикционную проверку полученного вектора pGS проводили путем обработки рестриктазами XbaI и SacI (должны быть получены полосы 12,7 т.п.о. и 1,3 т.п.о) и BglII (должны быть получены полосы 8,2 т.п.о., 2,5 т.п.о. и 3,6 т.п.о.). Результаты проверки показаны на Фиг. 2 и Фиг. 3, соответственно.
Перенос бинарного вектора pGS в агробактериальный штамм СВЕ21 проводили по стандартной методике. Селекцию колоний осуществляли на среде, содержащей 50 мг/л канамицина.
Пример 4. Подготовка штамма бактерий A. tumefaciens СВЕ21 (рСВЕ21, pGS) для трансформации растений.
Для трансформации растений используют ночную культуру бактерий A.tumefaciens. Для этого 100 мкл суспензии клеток бактерий A. tumefaciens СВЕ21 (рСВЕ21, pGS) добавляют к 50 мл жидкой среды LB, содержащей 50 мг/л канамицина и инкубируют в течение ночи на термостатируемом орбитальном шейкере при 28°С и 120-150 об/мин, после чего центрифугируют полученную суспензию 5 минут при 4000 об/мин, осадок промывают жидкой средой MS и повторяют центрифугирование и промывание. После осаждения клеток их заливают 50 мл жидкой среды MS и ресуспендируют.
Пример 5. Подготовка растительного материала осины in vitro для трансформации.
Для трансформации растений осины используют междоузлия растений in vitro. Размножение культуры осины проводят на безгормональной питательной среде WPM (Lloyd and McCown, 1980, Combined Proceedings of International Plant Propagators' Society, 30:421-427), содержащей 1 мг/л витаминов MS, 30 г/л сахарозы и 7 г/л агара. Растения выращивают при фотопериоде 16/8 часов, температуре 22-24°С и освещенности 3000-3500 люкс.
Пример 6. Трансформация растений осины клетками бактерий A.tumefaciens СВЕ21 (pCBE21, pGS).
Для трансформации используют междоузлия растений возрастом 3-4 недели, нарезанные на сегменты 5-10 мм. Междоузлия помещают в 9 мл жидкой среды MSm и добавляют 1 мл агробактериальной суспензии. Инокуляцию проводят в течении 30 мин при слабом помешивании, после чего экспланты помещают на стерильную фильтровальную бумагу, немного подсушивают и размещают на фильтрах, расположенных в чашках Петри на поверхности среды для кокультивации, содержащей минеральные соли MSm, витамины MS, 0,5 мг/л 2,4-Д, 30 г/л сахарозы и 7 г/л агара. В каждую чашку помещают по 20 эксплантов. Кокультивацию проводят в течение 6 суток.
Пример 7. Регенерация растений осины из трансформированных эксплантов.
После периода кокультивации экспланты промывают в дистиллированной воде с добавлением 1 г/л цефотаксима в течение 20-30 минут и затем дважды в воде без цефотаксима. Отмытые экспланты подсушивают на фильтрах и переносят на среду для регенерации и селекции трансформантов того же состава, как и среда для кокультивации, содержащую вместо 0.5 мг/л 2,4-Д 0,5 мг/л зеатина и дополнительно 30 мг/л канамицина и 500 мг/л цефотаксима. На этой среде экспланты выдерживают в условиях 16-часового светового дня при 22-23°С с пересадкой каждые 4 недели. Результаты регенерации показаны на Фиг. 4. Регенерированные побеги пересаживают на среду для размножения, содержащую 30 мг/л канамицина и 250 мг/л цефотаксима.
Пример 8. Идентификация фрагмента последовательности гена глутаминсинтетазы в регенератах осины методом ПЦР.
Присутствие гена GS в трансгенных растениях осины подтверждают методом ПЦР с праймерами GS1 (SEQ ID NO: 4) и GS2 (SEQ ID NO: 5), специфичными для кодирующей области трансгенной конструкции.
Геномную ДНК из растений осины выделяют по методу Rogers and Bendich (1994, in: Gelvin SB, Schilperoort RA (eds) Plant Molecular Biology Manual. Boston, MA: Kluwer Academic Publishers, D 1: 1-8). Для выделения используют листья растений in vitro (около 100 мг). Полученную растительную ДНК используют в качестве матрицы в ПЦР-анализах. Реакционная смесь содержит 67 мМ Tris-HCI, рН 9.0, 16 мМ (NH4)2SO4, 2 мМ MgCI2, 0,01% желатина, по 0,2 мМ каждого dNTP, 0,6 мкМ конечной концентрации каждого праймера и 0,2 единицы/мкл Taq полимеразы. Реакцию проводят в объеме 25 мкл при следующих условиях: 92°С - 3 мин; 35 циклов: 92°С - 20 сек, 62°С - 10 сек, 72°С - 1 мин, затем 72°С - 5 мин.
Продукты ПЦР анализируют в 1,8% агарозном геле с добавлением бромистого этидия. Гель фотографируют в ультрафиолете при длине волны 260-280 нм. Появление продукта ПЦР (ДНК размером 1190 н.п.) при использовании указанных праймеров, а также при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствует о присутствии искомого гена в ДНК исследуемых растений (Фиг. 5).
Пример 9. Отбор трансгенных растений осины с повышенной продуктивностью.
Укорененные в условиях in vitro растения осины (линии, по итогам ПЦР содержащие ген глутаминсинтетазы и нетрансформированный контроль) высаживали в теплицу в пластиковые кассеты. В качестве субстрата использовали пропаренную смесь торфа и песка (3:1), обогащенную 20 г комплексного минерального удобрения "Кристаллин" на 1 кг смеси. На период адаптации растений накрывали полиэтиленовой пленкой, которую снимали через один месяц. Оценку продуктивности проводили путем измерения биомассы растения, площади листьев, активность глутаминсинтетазы, эффективности использования азота.
Биомассу растений определяли в конце первого сезона вегетации. Корневую систему отмывали от субстрата, растение высушивали при 105°С в течение 24 ч и взвешивали на весах с точностью до 0,1 г.
Площадь листьев определяли в период вегетации. Листья, срезанные из средней части побега, сканировали с разрешением 300 dpi и площадь определяли с помощью программы ImageJ.
Активность глутаминсинтетазы определяли в листовой ткани в период вегетации по методу Cai et al. (2009, Plant Cell Rep, 28:527-537).
Эффективность использования азота определяли в конце первого сезона вегетации по методу Finzi et al. (2007, Proc Natl Acad Sci USA, 104:14014-14019).
Результаты показаны в таблице 1.
В таблице 1 показано превышение различных показателей продуктивности растений осины с геном глутаминсинтетазы по сравнению с нетрансформированным контролем на 7-74%.
Пример 10. Отбор трансгенных растений осины с модифицированной древесиной.
Растения осины, отобранные по признаку повышенной продуктивности, анализировали на содержание целлюлозы, лигнина, пентозанов и параметры древесного волокна.
Для анализа удельного содержания целлюлозы воздушно-сухую навеску измельченного растительного образца массой около 0,3 г помещали в коническую колбу объемом 250 мл с притертой крышкой и заливали 35 мл азотно-спиртовой смеси. Смесь готовили непосредственно перед использованием сливанием концентрированной азотной кислоты и 96% этанола в соотношении 1:4 (объем:объем). Кипятили раствор в колбе с обратным холодильником в течение часа, после чего целлюлоза оседала на дно колбы. Реакционный раствор декантировали с осадка целлюлозы на фильтре Шота размер пор 16, предварительно высушенный до постоянной массы. Реакционную смесь осторожно, не взмучивая осадок целлюлозы, небольшими порциями переносили на фильтр пипеткой, подсоединяли к водоструйному насосу и отфильтровывали. Оставшийся осадок заливали 25 мл свежей азотно-спиртовой смеси, и кипятили с обратным холодильником 1 час. Эта процедура повторялась три раза. Фильтр всегда использовали для всех трех фильтраций один и тот же.
После делигнификации белоснежные волокна целлюлозы полностью переносили на фильтр, использованный ранее для фильтрации. Отмывали целлюлозу от азотно-спиртовой смеси горячей водой на фильтре. Полноту отмывки проверяли, измеряя рН промывочной воды с помощью индикаторной бумаги. Затем фильтр с целлюлозой высушивали в сушильном шкафу при температуре 103°С±2° до постоянной массы. Удельное содержание целлюлоза определяли по формуле:
Уд. Содерж. Целл. = (М1-М/М2*К Сухости)*100%,
где
M1 - масса фильтра с целлюлозой;
М - масса пустого фильтра;
М2 - масса воздушно-сухой навески растительного образца.
Для анализ удельного содержания пентозанов навеску воздушно-сухих опилок массой 0,1000-0,1100 г, взятую на аналитических весах с точностью до четвертого знака помещали в колбу, добавляли 20 мл 13% соляной кислоты и присоединяли ее к перегонному аппарату. Колбу нагревали на воздушной бане и отгоняют фурфурол со скоростью 0,8-1,0 мл в минуту. Одновременно из капельной воронки добавляли соляную кислоту с такой скоростью, чтобы уровень кислоты в перегонной колбе оставался постоянным. Отогнанный дистиллят из первого приемника переносили в мерную колбу на 100 мл, доводили объем до метки дистиллированной водой, закрывали колбу притертой пробкой и тщательно перемешивали. Полученный раствор разбавляли в 25 раз. Для этого в три мерные колбы на 50 мл помещали по 2 мл исходного раствора, доводили объем до метки дистиллированной водой и перемешивали. В колбу на 50 мл переносили отгон из второго приемника и доводили объем до метки.
Количественный анализ фурфурола осуществляли спектрофотометрическим методом (на спектрофотометре UV-160A "Shimadzu" Япония), определяя оптическую плотность растворов при λ макс 278 нм. Для расчетов использовали значение молярной экстинкции фурфурола в воде равное 15000 (Казицина и Куплетская, 1979, Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии, 1979, с. 11-45).
Процентное содержание пентозанов в образце древесины в основной порции отгона рассчитывали по формуле А1 (%)=Dx96,09x10x25x1.52:15000:н, где D - средняя из трех измерений оптическая плотность раствора фурфурола, 96,09 - его молекулярный вес, 25 - разбавление первоначального раствора, 1.52 - коэффициент пересчета фурфурола в пентозаны для лиственных пород, н - навеска взятого на анализ образца за вычетом влажности (абсолютно сухая навеска) в мг.
Процентное содержание пентозанов в образце древесины в дополнительной порции отгона рассчитывали по формуле А2 (%)=Dx96,09x5x1.52:15000:н.
Суммарное содержание пентозанов в образце равно А общ (%)=А1+А2
Анализ повторяли дважды, вычисляя среднее значение и отклонение от среднего значения. В случае если отклонение составляло более 0,5%, анализ повторяли третий раз.
Для анализа удельного содержания лигнинов воздушно-сухую навеску измельченного растительного образца массой около 0,3 грамма помещали в коническую колбу объемом 500 мл с притертой крышкой. В колбу аккуратно, во избежание образование комков, добавляли 15 мл 78% серной кислоты и оставляли на 2,5 часа в термостате при температуре 30°С. Затем в колбу наливали 200 мл дистиллированной воды до конечной концентрации кислоты 5%. К колбе присоединяли обратный холодильник и кипятили реакционную смесь в течение 2-х часов.
Фильтрование лигнина проводили на следующий день после кипячения на фильтре Шота размер пор 16, предварительно высушенном до постоянной массы. Осадок лигнина тщательно отмывали горячей водой. Полноту отмывки проверяли, измеряя рН промывочной воды с помощью индикаторной бумаги. Затем фильтр с целлюлозой высушивали в сушильном шкафу при температуре 103±2°С до постоянной массы. Удельное содержание лигнина определяли по формуле:
Уд. Содерж. Лигнина = (М1-М/М2*К Сухости)*100%,
где
M1 - масса фильтра с лигнином;
М - масса пустого фильтра;
М2 - масса воздушно-сухой навески растительного образца.
Определение кислоторастворимого лигнина проводили по поглощению фильтрата, полученного сразу после фильтрации первой порции лигнина, при 205 нм. Расчет проводили по формуле Takahashi (1976, Wood Research, 61:1-10):
Кислоторастворимый лигнин = ((А1-А2)*V/110*М*Ксухости)*100,
где
А1 - поглощение образца при 205 нм;
А2 - Поглощение кюветы с водой;
V - объем фильтрата в литрах;
М - масса воздушно-сухой навески.
Общее содержание лигнина определялось как сумма кислоторастворимого и кислотонерастворимого лигнина.
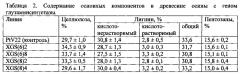
Результаты анализа древесины осины на содержание целлюлозы, лигнина и пентозанов показаны в таблице 2.
В таблице 2 показано повышение содержания целлюлозы в древесине осины с геном глутаминсинтетазы по сравнению с нетрансформированных контролем на 12-15% (для 3 линий из 4) и снижение содержания лигнина на 6-8% (для 3 линий из 4).
Для определения параметров древесных волокон древесную стружку, приготовленную с помощью лезвия из средней части годичного слоя, мацерировали в смеси 10% азотной кислоты и хромового ангидрида, после чего готовили временные препараты в глицерине. Просмотр проводили под микроскопом с увеличением ок.×7; об.×3,5; замеры - с помощью окуляр-микрометра. Для замеров ширины и толщины стенки древесных волокон использовали винтовой окуляр-микрометр при увеличении ок.×15; об.×40. Результаты измерений параметров древесных волокон представлены в таблице 3.
В таблице 3 показано превышение длины древесных волокон растений осины с геном глутаминсинтетазы по сравнению с нетрансформированных контролем на 2-15%, ширины древесных волокон - на 89-213% и толщины стенок древесных волокон - на 93-152%.
Перечень последовательностей.
SEQ ID NO: 1 - нуклеотидная последовательность мРНК глутамин синтетазы из P. sylvestris (GenBank Х69822):
1. Трансгенное растение осины со следующими признаками повышенной продуктивности - увеличенным выходом биомассы, листьями большего размера, увеличенной активностью глутаминсинтетазы и повышенной эффективностью использования азота, а также с модифицированной древесиной по сравнению с нетрансформированным растением осины, содержащее нуклеиновую кислоту, кодирующую глутаминсинтетазу с SEQ ID NO: 1, полученное в результате трансформационного акта между молекулой нуклеиновой кислоты, кодирующей глутаминсинтетазу, и геномной ДНК осины.
2. Трансгенное растение по п. 1, где молекула нуклеиновой кислоты представляет собой молекулу кДНК, выделенную из сосны обыкновенной (Pinus sylvestris L.), имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 1.
3. Трансгенное растение по п. 1, где осина является представителем вида Populus tremula L.
4. Трансгенное растение по п. 1, которое демонстрирует один или более из следующих признаков модификации древесины, но не ограничивается ими: измененное содержание лигнина, измененное содержание целлюлозы, измененное содержание гемицеллюлозы, измененный состав лигнина, измененные параметры древесных волокон по сравнению с аналогом дикого типа.
5. Способ получения трансгенного растения осины по п. 1, включающий:а) агробактериальную трансформацию эксплантов осины in vitro молекулой нуклеиновой кислоты, кодирующей глутаминсинтетазу с SEQ ID NO: 1;б) регенерацию растений из трансформированных клеток эксплантов;в) идентификацию молекулы нуклеиновой кислоты, кодирующей глутаминсинтетазу с SEQ ID NO: 1 в растениях;г) отбор растений с повышенной продуктивностью по сравнению с растением того же генотипа, которое не содержит молекулу нуклеиновой кислоты, кодирующую глутаминсинтетазу с SEQ ID NO: 1;д) отбор растений с модифицированной древесиной по сравнению с растением того же генотипа, которое не содержит молекулу нуклеиновой кислоты, кодирующую глутаминсинтетазу с SEQ ID NO: 1.