Способ получения ex vivo культур альвеолярных макрофагов из операционного материала больных туберкулезом легких и способ оценки вирулентности mycobacterium tuberculosis с использованием полученных ex vivo культур альвеолярных макрофагов
Иллюстрации
Показать всеИзобретение относится к области биохимии. Заявлен способ получения ex vivo культуры альвеолярных макрофагов из операционного материала больных туберкулезом легких для оценки вирулентности М. tuberculosis. Получают клеточную взвесь путем измельчения образца ткани легкого, гомогенизации с помощью протирки через сито с диаметром пор 0.5-2.0 мм, освобождения клеточной взвеси от негомогенизированных остатков путем их пассивного осаждения. Клеточную взвесь центрифугируют 4-5 мин при 800-1200 об/мин и +20-25°С. Культивирование клеток осуществляют в течение 12-20 часов. Также заявлен способ оценки вирулентности М. tuberculosis, отличающийся тем, что в полученной ex vivo культуре альвеолярных макрофагов оценивают долю макрофагов, содержащих микобактерии, от общего числа макрофагов, наличие и долю макрофагов, содержащих колонии размножающихся микобактерий без корд-морфологии роста и с корд-морфологией роста, от общего числа макрофагов, содержащих микобактерии. Изобретение позволяет повысить жизнеспособности клеток в полученной культуре, оценить вирулентность М. tuberculosis применительно к конкретному пациенту, сократить длительность осуществления способа. 2 н.п. ф-лы, 12 ил., 3 табл., 8 пр.
Реферат
Изобретение относится к области медицины, в частности фтизиатрии, а именно к получению культур альвеолярных макрофагов больных туберкулезом легких и оценке вирулентности микобактерий, их инфицирующих.
Туберкулез, возбудителем которого является внутриклеточная паразитарная бактерия М. tuberculosis, уносит ежегодно около 2 млн человеческих жизней и занимает лидирующие позиции по числу смертей от инфекционного заболевания, вызываемого этим возбудителем. По данным ВОЗ треть населения Земли инфицирована М. tuberculosis, при этом вероятность развития активной формы туберкулеза в течение жизни у латентных носителей патогенного микроорганизма не превышает 10%, что соответствует ежегодному возникновению до 8-9 млн новых случаев заболевания, из которых до 80% приходится на туберкулез легких (1-5). В основе развития туберкулеза лежит внутриклеточная персистенция микобактерий в макрофагах организма-хозяина (6-8). Макрофаги являются клетками врожденного иммунного ответа и участвуют в защитной реакции организма, направленной на уничтожение фагоцитированных инфекционных агентов, в том числе М. tuberculosis. Однако при заражении микобактериями в некоторых макрофагах не происходит слияния фагосом, содержащих микобактерии, с лизосомами клетки-хозяина и, соответственно, происходит выживание и размножение патогена (6-8). В настоящее время отмечено появление и широкое распространение резистентных (MDR) и мультирезистентных (XDR) штаммов М. tuberculosis, устойчивых одновременно к нескольким лекарственным препаратам. Несмотря на важность контроля количества и состояния микобактерий в альвеолярных макрофагах больных с различными формами остро прогрессирующего легочного туберкулеза, мало известно об их содержании и функциональном статусе в клетках человека - носителя инфекции (6-8). Необходимы новые методы для анализа вирулентности микобактерий как одного из основных факторов, влияющих на течение инфекции и исход заболевания, в том числе при активизации туберкулезного процесса в легких человека.
Известные способы получения ex vivo культур альвеолярных макрофагов от больных заболеваниями легких
Известен способ получения культур клеток легких ex vivo из операционного материала больных хронической обструктивной болезнью легких, включающий получение образца ткани легкого из операционного материала, вымывание клеток из образца ткани легкого путем перфузии раствором 0.1 М NaCl, центрифугирование полученной клеточной взвеси при комнатной температуре в течение 10 мин при 1500 об/мин; разведение осадка с клетками в ростовой среде RPMI 1640, наслаивание полученной клеточной взвеси на градиент фиколла, центрифугирование при тех же условиях, отбор жизнеспособных клеток по отсутствию окрашивания раствором трипанового синего, культивирование отобранных клеток легкого в лунках 96-луночных пластиковых планшетов в концентрации 1×106 клеток/мл (100000 клеток в каждую лунку планшета) в полной ростовой среде RPMI 1640 с 10% сыворотки плодов коров, 2 мМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина при +37°С в атмосфере 5% СО2 в течение 2 часов, удаление клеточной взвеси, содержащей неприкрепившиеся к поверхности лунок клетки, путем замены полной ростовой среды на свежую, продолжение культивирования клеток в лунках планшета в течение 2-48 ч при тех же условиях (9). К недостаткам способа относится то, что полученные культуры клеток легкого ex vivo содержат помимо альвеолярных макрофагов альвеоциты, фибробласты, дендритные клетки, нейтрофилы. Между тем, для последующей оценки в культуре клеток вирулентности Mycobacterium tuberculosis данная культура может маскировать альвеолярные макрофаги в общем клеточном пуле, что затрудняет подсчет в них микобактерий. Кроме того, указанный способ не позволяет получить достаточное количество жизнеспособных клеток, включая альвеолярные макрофаги, т.к. при использовании градиента фиколла необходимо для осаждения клеток использовать центрифугирование при скорости не менее 1500 об/мин в течение не менее 10 мин, чтобы клетки могли перераспределиться вдоль градиента в соответствии с их плавучей плотностью. Данные режимы центрифугирования приводят к травмированию клеток и снижению их жизнеспособности (10).
Наиболее близким к заявляемому является способ получения культур клеток легких ex vivo из операционного материала больных хронической обструктивной болезнью легких, включающий получение образца ткани легкого из операционного материала, получение клеточной взвеси путем вымывания клеток из образца ткани легкого путем перфузии раствором 0.1 М NaCl, фильтрование полученной клеточной взвеси через фильтр с размером пор 100 мкм, осаждение клеток из профильтрованной клеточной взвеси путем центрифугирования при 1500 об/мин в течение 10 мин при +4°С, разведение осадка с клетками в полной ростовой среде RPMI 1640 с добавлением 10% сыворотки плодов коров, 2 мМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина, культивирование клеток в лунках 96-луночных пластиковых планшетов в полной ростовой среде RPMI 1640 с 10% сыворотки плодов коров, 2 мМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина при +37°С в атмосфере 5% СО2 в течение 1 часа; удаление из лунки клеточной взвеси, содержащей неприкрепившиеся к поверхности лунок клетки, путем замены полной ростовой среды на свежую, продолжение культивирования клеток в лунках планшета в течение 24 часов при тех же условиях (11). Указанный способ имеет те же недостатки: небольшая доля альвеолярных макрофагов в общем пуле клеток легкого, низкая жизнеспособность клеток, о чем свидетельствуют их фотографии, приведенные в источнике (11), обусловленная использованием травматичного режима центрифугирования, недостаточный выход клеток, обусловленный использованием процедуры вымывания их из образца ткани легкого, а не выделением из гомогената ткани.
Способы получения культуры альвеолярных макрофагов ex vivo из тканей или клеток легких пациентов, больных туберкулезом легких, неизвестны.
Задачей, на решение которой направлено изобретение, является получение культуры альвеолярных макрофагов ex vivo от больных туберкулезом легких, пригодной для оценки вирулентности М. tuberculosis применительно к конкретному пациенту, повышение жизнеспособности клеток.
Решение поставленной задачи достигается тем, что образцы ткани легкого предварительно измельчают, проводят гомогенизацию измельченной ткани легкого с помощью протирки через сито с диаметром пор 0.5-2.0 мм с добавлением физиологически приемлемого раствора, клеточную взвесь получают путем пассивного осаждения из гомогената негомогенизированных остатков ткани легкого; осаждение клеток из клеточной взвеси путем центрифугирования проводят при скорости 800-1200 об/мин в течение 4-5 мин при комнатной температуре +20-25°С, культивирование клеток в емкостях для культивирования клеток осуществляют на покровных стеклах в течение 12-20 часов, для удаления неприкрепившихся к покровным стеклам клеток полную ростовую среду с неприкрепившимися клетками предварительно заменяют на физиологически приемлемый раствор, после чего заменяют его на свежую полную ростовую среду.
Известные способы оценки вирулентности Mycobacterium tuberculosis
Вирулентностью называют способность микроорганизма размножаться и вызывать патологические изменения или гибель животных определенного вида в точно определенных условиях (1, 3-5, 12). Степень вирулентности, прежде всего, измеряется в количестве клеток инфекционного агента, необходимых для заражения организма. Для определения степени вирулентности микобактерий пользуются различными дозами микобактерий и показателем продолжительности жизни зараженных животных (для М. tuberculosis - морских свинок, мышей и хомяков). Показателями вирулентности являются условные величины - минимальная летальная доза, 50%-ная летальная или инфицирующая доза (1, 4, 12). Факторами, определяющими вирулентность многих бактерий, вызывающих инфекционные заболевания человека, являются продуцируемые ими токсины (белки, липиды, гликолипиды), вызывающие повреждение тканей зараженного организма. В настоящее время в большинстве случаев именно по продукции и секреции токсинов бактерий судят об их вирулентности. В случае микобактерий туберкулезного комплекса М. tuberculosis более чем столетние исследования не позволили идентифицировать подобно другим бактериям токсины, определяющие вирулентность микобактерий (1, 3-5). Вопрос о степени вирулентности М. tuberculosis является очень важным для определения прогноза и тактики лечения заболевания. Отмечают, что в доброкачественно протекающих случаях заболевания чаще выделяют штаммы микобактерий с умеренной вирулентностью (1, 4).
Известен способ оценки вирулентности микобактерий М. tuberculosis, включающий выделение тканей легкого из операционного материала туберкулезных больных, измельчение тканей легкого до получение гомогената, высев гомогената на специальные жидкие питательные среды для стимулирования размножения микобактерий, культивирование микобактерий в течение 1-2 месяцев, приготовление доз культур микобактерий, равных 10-1, 10-4, 10-6 мг соответственно, заражение морских свинок путем подкожного введения одной из указанных доз (от 2 до 5 животных в каждой группе), определение степени вирулентности микобактерий по следующим критериям: при развитии прогрессивного туберкулеза через 120 дней после введения дозы 10-6 мг делают заключение о высокой вирулентности микобактерий; при развитии генерализованного туберкулеза через 120 дней после введения дозы 10-4 мг - о средней вирулентности микобактерий; при развитии прогрессивного туберкулеза через 150-240 дней после введения дозы более или равно 10-1 мг делают заключение о слабой вирулентности микобактерий. Аттенуированными (невирулентными) считают те культуры М. tuberculosis, которые в любой дозе не вызывают прогрессивного туберкулеза у морских свинок (12). Недостатком известного способа является длительность его осуществления (6-8 месяцев), а также высокая стоимость, обусловленная стоимостью животных и продолжительностью их содержания в ходе осуществления способа.
Наиболее близким к заявляемому является способ оценки вирулентности микобактерий М. tuberculosis, включающий выделение образца тканей легкого больного туберкулезом путем биопсии или из операционного материала, получение гомогената тканей легкого, высев их на специальные твердые питательные среды для культивирования микобактерий, культивирование последних в течение 1-3 месяцев; окраску клеток по методу Циля-Нильсена, подсчет колоний размножающихся микобактерий (1). Недостатком данного способа является то, что он дает косвенную оценку вирулентности. Это обусловлено тем, что микобактерий после посева на питательные среды в течение длительного времени размножаются в благоприятной среде, что не позволяет объективно оценить способность микобактерий размножаться в клетках человека и млекопитающих и вызывать заболевание туберкулезом. Между тем, в организме человека М. tuberculosis находятся преимущественно внутри клеток-хозяев либо они располагаются в воспаленной и некротизированной ткани легкого, то есть в условиях, существенно отличающихся от хорошо аэрируемых твердых питательных сред, на которых размножаются при посеве исследуемые на вирулентность микобактерии. Кроме того, при учете количества микобактерий в полном клеточном пуле ткани легкого, включающем альвеоциты, фибробласты, дендритные клетки, макрофаги, нейтрофилы и др., не учитывается то, что основная часть микобактерий находится внутри альвеолярных макрофагов, где, прежде всего, они и размножаются, вызывая в дальнейшем развитие туберкулезного заболевания у человека. При лечении туберкулеза противотуберкулезными препаратами последние оказывают влияние на те микобактерий, которые уже высвободились из альвеолярных макрофагов. В связи с этим, важно оценивать вирулентность микобактерий, которые продолжают оставаться в альвеолярных макрофагах. Кроме того, размножение микобактерий в макрофагах определяется состоянием иммунной системы пациента. Длительность культивирования альвеолярных макрофагов искажает картину размножения в них микобактерий в сравнении с размножением в альвеолярных макрофагах в организме пациента, т.к. при длительном культивировании на специальных питательных твердых средах, т.е. в благоприятной среде, микобактерии размножаются интенсивнее, чем в организме пациента. Это не позволяет приблизить оценку вирулентности микобактерий к той, которая проявляется у конкретного пациента. Другим недостатком данного способа является длительность его осуществления (1-3 месяца).
Задачей, на решение которой направлено изобретение, является определение вирулентности микобактерий туберкулезного комплекса М. tuberculosis применительно к конкретному пациенту, страдающему туберкулезом легких, сокращение длительности осуществления способа.
Решение поставленной задачи достигается тем, что получают ex vivo культуру альвеолярных макрофагов согласно заявленному способу, перед окраской фиксируют клетки на покровных стеклах через 12-20 часов после начала культивирования, оценивают долю альвеолярных макрофагов, содержащих микобактерии, от общего числа альвеолярных макрофагов, наличие альвеолярных макрофагов, содержащих колонии размножающихся микобактерий без корд-морфологии роста, и долю альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста, от общего числа альвеолярных макрофагов, содержащих микобактерии; при доле альвеолярных макрофагов, содержащих микобактерии, менее 1% от общего числа альвеолярных макрофагов и отсутствии в них колоний размножающихся микобактерий делают заключение о невирулентности микобактерий у данных больных; при доле альвеолярных макрофагов, содержащих микобактерии, менее 1% от общего числа альвеолярных макрофагов и присутствии в них колоний размножающихся микобактерий, не содержащих корд-морфологии роста, делают заключение о слабой вирулентности микобактерий у данных больных; при доле альвеолярных макрофагов, содержащих микобактерии, 1-10% от общего числа альвеолярных макрофагов и доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста, менее 10% от общего числа альвеолярных макрофагов, содержащих микобактерии, делают заключение о средней вирулентности микобактерий у данных больных; при доле альвеолярных макрофагов, содержащих микобактерии, более 10% от общего числа альвеолярных макрофагов и доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста, более или равной 10% от общего числа альвеолярных макрофагов, содержащих микобактерии, делают заключение о высокой вирулентности микобактерий у данных больных.
Раскрытие изобретения
Раскрытие способа получения ex vivo культур альвеолярных макрофагов из операционного материала больных туберкулезом легких
Способ получения ex vivo культур альвеолярных макрофагов из операционного материала больных туберкулезом легких для оценки вирулентности Mycobacterium tuberculosis включает получение образцов ткани легкого из операционного материала, измельчение образца ткани легкого, проведение последующей гомогенизации измельченной ткани легкого путем протирки через сито диаметром пор 0.5-2.0 мм с добавлением физиологически приемлемого раствора. Клеточную взвесь получают из гомогената путем пассивного осаждения негомогенизированных остатков ткани легкого. Затем осаждают клетки из клеточной взвеси путем центрифугирования при скорости 800-1200 об/мин в течение 4-5 мин при комнатной температуре +20-25°С. Культивирование клеток осуществляют на покровных стеклах в полной ростовой среде в емкостях для культивирования клеток в течение 12-20 часов. Затем удаляют неприкрепившиеся к покровным стеклам клетки путем замены полной ростовой среды с неприкрепившимися клетками на физиологически приемлемый раствор, после чего заменяют его на свежую полную ростовую среду.
Все процедуры по заявляемому способу выполняют с соблюдением норм стерильности в соответствии с санитарными правилами работы с патогенными биологическими объектами (13).
Для получения образцов ткани легкого из операционного материала больных туберкулезом отбирают фрагменты ткани, характеризующиеся отсутствием казеозных масс и признаков некротического повреждения (Фиг. 1).
Измельчение образца ткани легкого осуществляют, например, с помощью стерильных ножниц в стерильном боксе (Фиг. 2).
На фиг. 3 показаны инкапсулированные образования (туберкулы) на поверхности сита, в сосуде - гомогенат, содержащий клетки и негомогенизированные остатки ткани легкого.
В качестве физиологически приемлемого раствора для разведения гомогената ткани легкого и удаления из емкости для культивирования клеток неприкрепившихся к покровным стеклам клеток используют фосфатно-солевой буфер рН 7.4 или раствор 0.1М NaCl или любую ростовую среду для культивирования клеток без добавления сыворотки, например RPMI 1640, DMEM/F12 или DMEM.
Для культивирования альвеолярных макрофагов используют полную ростовую среду, например DMEM/F12, содержащую 10% сыворотки крови плодов коров, 2 мМ глутамина и 50 мкг/мл гентамицина; RPMI 1640 с 10% сыворотки плодов коров, 2 мМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина.
В качестве емкости для культивирования клеток могут быть использованы 24-луночные планшеты или их аналоги (Фиг. 4). Отмывание клеток из лунок планшета от клеточной взвеси показано на фиг. 5.
Культивирование клеток осуществляют стандартно при температуре +37°С в атмосфере 5% СО2. Пример культуры клеток, полученной из операционного материала больного туберкулезом, представлен на фиг. 6, 7.
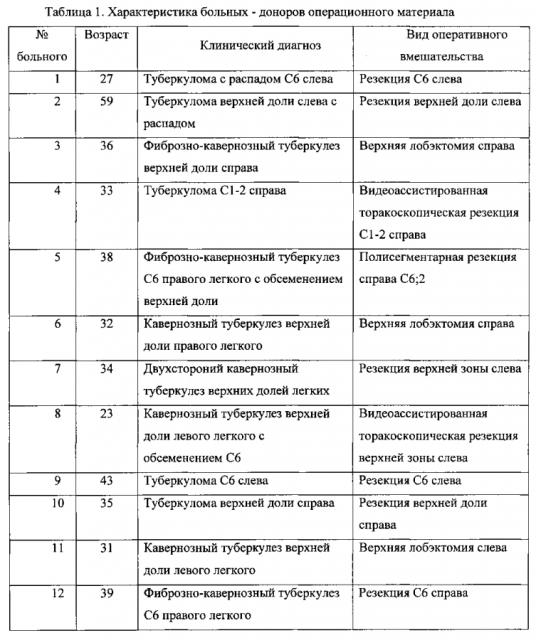
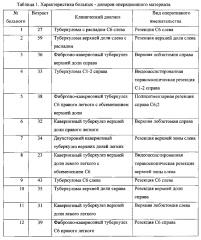
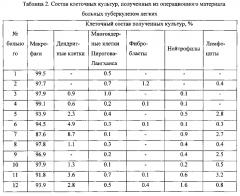
Заявляемым способом получают культуры жизнеспособных альвеолярных макрофагов из операционного материала больных различными формами туберкулеза легких, диагноз которых и вид оперативного вмешательства представлены в таблице 1. Жизнеспособность клеток составляет 100% и обеспечивается щадящим режимом центрифугирования: более низкой скоростью (800-1200 об/мин) при комнатной температуре (+20-25°С), сокращением длительности центрифугирования до 4-5 мин. Жизнеспособность клеток подтверждается фотографиями окрашенных клеток на покровных стеклах (Фиг. 6, 7). Анализ под микроскопом культуры клеток на покровных стеклах показывает, что до 99.5% клеток составляют альвеолярные макрофаги (таблица 2). Это достигают путем использования покровных стекол для культивирования клеток, на которые в течение 12-20 часов прикрепляются преимущественно альвеолярные макрофаги, остальные клетки остаются в клеточной взвеси либо прикрепляются к стенкам лунки для культивирования клеток и удаляются путем отмывания буферным раствором и последующей заменой буферного раствора на свежую полную ростовую среду после указанного срока. При культивировании клеток согласно прототипу без использования покровных стекол в лунках пластиковых планшетов происходит налипание всех видов клеток (эритроциты, лимфоциты, дендритные клетки, альвеоциты и др.) на пластиковые стенки лунок, что не позволяет получить культуру, содержащую преимущественно альвеолярные макрофаги. Нежизнеспособные клетки не способны прикрепиться к покровным стеклам и вымываются из лунки физиологически приемлемым раствором. Идентификация альвеолярных макрофагов на покровных стеклах подтверждается также окраской клеток, прикрепившихся к покровным стеклам, с использованием 50 nМ лизосомотропного красителя LysoTracker Red DND-99 (Invitrogen, USA, L7528), который позволяет выявить присутствие значительного количества лизосом в цитоплазме клеток, что характерно для альвеолярных макрофагов как клеток-фагоцитов (Фиг. 8).
Использование длительности культивирования 12-20 часов обусловлено тем, что именно это время необходимо для прикрепления альвеолярных макрофагов и их распластывания на покровных стеклах, что позволяет в последующем при оценке вирулентности М. tuberculosis получить четкое изображение микобактерий в составе альвеолярных макрофагов и повысить точность оценки их количества. Ограничение длительности культивирования макрофагов указанным сроком позволяет получить оценку вирулентности микобактерий в культуре ex vivo, приближенную к той вирулентности, которую они проявляют в организме пациента, т.к. за указанный ограниченный срок культивирования происходит только прикрепление макрофагов к покровным стеклам, а последующее повышенное размножение в них микобактерий как показатель вирулентности микобактерий внутри альвеолярных макрофагов, обусловленное более благоприятной для этого полной ростовой средой в лунках для культивирования клеток, начинается в более поздние сроки культивирования.
Раскрытие способа оценки вирулентности Mycobacterium tuberculosis с использованием полученных по заявленному способу ex vivo культур альвеолярных макрофагов
Способ оценки вирулентности Mycobacterium tuberculosis включает получение ex vivo культур клеток альвеолярных макрофагов из операционного материала больных туберкулезом легких по описанному выше заявленному способу, фиксацию клеток на покровных стеклах через 12-20 часов после начала культивирования, окраску клеток на покровных стеклах по методу Циля-Нильсена. Затем оценивают долю альвеолярных макрофагов, содержащих микобактерии, от общего числа альвеолярных макрофагов, наличие альвеолярных макрофагов, содержащих колонии размножающихся микобактерий без корд-морфологии роста, и долю альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста, от общего числа альвеолярных макрофагов, содержащих микобактерии. При доле альвеолярных макрофагов, содержащих микобактерии, менее 1% от общего числа альвеолярных макрофагов и отсутствии в них колоний размножающихся микобактерий делают заключение о невирулентности микобактерий у данных больных. При доле альвеолярных макрофагов, содержащих микобактерии, менее 1% от общего числа альвеолярных макрофагов и присутствии в них колоний размножающихся микобактерий, не содержащих корд-морфологии роста, делают заключение о слабой вирулентности микобактерий у данных больных. При доле альвеолярных макрофагов, содержащих микобактерий, 1-10% от общего числа альвеолярных макрофагов и доле альвеолярных макрофагов, содержащих колоний размножающихся микобактерий с корд-морфологией роста, менее 10% от общего числа альвеолярных макрофагов, содержащих микобактерии, делают заключение о средней вирулентности микобактерий у данных больных. При доле альвеолярных макрофагов, содержащих микобактерий, более 10% от общего числа альвеолярных макрофагов и доле альвеолярных макрофагов, содержащих колонии микобактерий с корд-морфологией роста, более или равной 10% от общего числа альвеолярных макрофагов, содержащих микобактерии, делают заключение о высокой вирулентности микобактерий у данных больных.
Корд-морфология роста колоний микобактерий туберкулеза представляет собой выстраивание микобактерий внутри клетки (альвеолярного макрофага) в форме кос или жгутов в линию вдоль своих длинных осей.
Для фиксации клеток на покровных стеклах используют 4%-й раствор формалина, приготовленного на фосфатно-солевом буфере (рН 7.4).
Для окраски клеток покровные стекла отмывают от фиксатора в фосфатно-солевом буферном растворе (рН 7.4) при комнатной температуре. Затем их окрашивают методом Циля-Нильсена (14), специфичного для окраски М. tuberculosis. Используют набор реагентов для окраски по методу Циля-Нильсена, например, производства ООО «Первая Лабораторная Компания» (Санкт-Петербург, Россия). В результате микобактерий М. tuberculosis с неповрежденной клеточной стенкой в альвеолярных макрофагах человека с туберкулезной инфекцией окрашиваются в красный цвет, ядра клеток-носителей возбудителя - в синий цвет, а их цитоплазма - в светло-голубой цвет (черно-белый вариант изображения с соответствующими обозначениями представлен на Фиг. 7, 9-11).
Подсчет макрофагов, содержащих микобактерии, колонии микобактерий с наличием или отсутствием корд-морфологии роста производят под микроскопом.
Заявляемый способ позволяет получить в течение 12-20 часов ex vivo культуры альвеолярных макрофагов из операционного материала больных разными формами туберкулеза легких и в течение 2-3 дней оценить степень вирулентности М. tuberculosis применительно к конкретному пациенту. Таким образом, заявленный способ оценки вирулентности М. tuberculosis у конкретного больного позволяет сократить срок осуществления до 3-4 дней вместо 3-4 месяцев по прототипу.
Оценка вирулентности микобактерий в клетках больных туберкулезом легких имеет большое значение как для корректировки схем лечения с целью повышения его эффективности, так и для контроля за эпидемиологически опасными формами туберкулезного заболевания (1). Заявляемый способ может быть использован как один из составляющих в принятии решений по проведению и корректировке дальнейших профилактических и лечебных мероприятий, направленных на излечение больных туберкулезом легких.
Перечень фигур, чертежей и иных материалов
Фиг. 1. Вырезание кусочка ткани из удаленного в ходе операции сегмента легкого больного №7.
Фиг. 2. Измельчение кусочка ткани легкого.
Фиг. 3. Инкапсулированные образования (туберкулы) на поверхности сита, в сосуде - гомогенат, содержащий клетки и негомогенизированные остатки ткани легкого больного №5.
Фиг. 4. Культуральные планшеты с клеточной суспензией в лунках.
Фиг. 5. Отмывание монослоя прикрепившихся к покровным стеклам клеток от клеточной взвеси (дебриса), содержащей неприкрепившиеся к покровным стеклам клетки в лунках планшетов для культивирования клеток.
Фиг. 6. Пример культуры клеток, полученной из легкого больного №7. Окраска клеток гематоксилином Майера. Масштабная черта 10 мкм.
Фиг. 7. Примеры культур клеток, полученных из легких больных №5 и №6. Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги и многоядерную клетку Пирогова-Лангханса с микобактериями М. tuberculosis указывают черные стрелки и пропеллер, соответственно. Дендритная клетка отмечена черной звездочкой, нейтрофил и лимфоцит - черной и светлой снежинками, соответственно. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Фиг. 8. Конфокальные флуоресцентные изображения альвеолярных макрофагов из легкого больного №2. Лизосомы визуализированы красителем LysoTracker Red DND-99 (в черно-белом варианте цвет лизосом - светло-серый). Масштабная черта 20 мкм.
Фиг. 9. Альвеолярные макрофаги из легкого больного №7 с микобактериями М. tuberculosis. Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. Макрофаги с микобактериями отмечены черными стрелками.
Фиг. 10. Альвеолярные макрофаги из легкого больного №5 с колониями микобактерий М. tuberculosis (отмечены черными стрелками), содержащими корд-морфологию роста. Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм.
Фиг. 11. Альвеолярные макрофаги из легкого больного №6 с колониями микобактерий М. tuberculosis (отмечены черными стрелками), содержащими корд-морфологию роста. Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм.
Фиг. 12. Альвеолярные макрофаги из легкого больного №9, содержащие микобактерии М. tuberculosis.
Таблица 1. Характеристика больных - доноров операционного материала.
Таблица 2. Состав ex vivo клеточных культур, полученных из операционного материала больных туберкулезом легких по заявленному способу.
Таблица 3. Доли альвеолярных макрофагов, содержащих микобактерии М. tuberculosis, колонии размножающихся микобактерий в ex vivo клеточных культурах альвеолярных макрофагов, полученных из операционного материала больных туберкулезом легких, и заключение о вирулентности микобактерий у данных больных.
Осуществление изобретения
Осуществление способа получения ex vivo культур альвеолярных макрофагов из операционного материала больных туберкулезом легких
Пример 1. Больной №5. Диагноз: фиброзно-кавернозный туберкулез С6 правого легкого с обсеменением верхней доли (таблица 1). Ex vivo культуру альвеолярных макрофагов из операционного материала больного №6 получают согласно описанному выше способу. Отбирают фрагменты ткани, характеризующиеся отсутствием казеозных масс и признаков некротического повреждения. Измельчение образца ткани легкого осуществляют в стерильных чашках Петри с помощью стерильных ножниц в стерильном боксе до небольших размеров на кусочки примерно 4×4 мм (Фиг. 2). Гомогенизацию ткани легкого в буферном растворе осуществляют с помощью протирки через сито диаметром 0.5 мм. В качестве физиологически приемлемого раствора для разведения гомогената ткани легкого использовали фосфатно-солевой буфер рН 7.4. Для получения гомогената измельченную ткань легкого переносят в сито с вышеуказанным диаметром пор, располагающееся на сосуде для сбора гомогената, и с помощью керамического пестика протирают через поры сита, смывая полученный гомогенат последовательным добавлением 12 мл фосфатно-солевого буфера (рН 7.4). На поверхности сита могут оставаться твердые инкапсулированные образования диаметром 40-60 мм, являющиеся фиброзированными очагами инфекции или туберкулами, которые невозможно гомогенизировать (Фиг. 3), их утилизируют согласно требованиям к обращению с медицинскими отходами (15). Полученный гомогенат содержит клеточную взвесь и негомогенизированные остатки ткани легкого. Собранный гомогенат ткани легкого в 14 мл фосфатно-солевого буфера переносят в первую пробирку объемом 15 мл и оставляют на 5 мин для оседания кусочков ткани (пассивное осаждение). Затем надосадочную жидкость, представляющую собой клеточную взвесь, переносят во вторую чистую пробирку объемом 15 мл. Клетки из клеточной взвеси осаждают путем центрифугирования при скорости 800 об/мин в течение 5 мин при комнатной температуре +20-25°С. После окончания центрифугирования надосадочную жидкость из второй пробирки сливают в отходы, а к оставшемуся осадку, содержащему осажденные клетки, добавляют полную ростовую среду для культивирования клеток DMEM/F12, содержащую 10% сыворотки крови плодов коров, 2 мМ глутамина и 50 мкг/мл гентамицина. Полученную суспензию клеток разливают по 0.5 мл в емкости для культивирования клеток с покровными стеклами на дне. В качестве емкости для культивирования клеток используют 24-луночные планшеты (Фиг. 4). Культивирование клеток осуществляют при температуре +37°С в атмосфере 5% СО2 в течение 12 часов.
По истечении указанного срока покровные стекла с прикрепившимися клетками отмывают от клеточной взвеси, состоящей из эритроцитов, лимфоцитов и др. клеток, и погибших клеток. Для этого из лунок планшета удаляют старую среду и добавляют по 1 мл фосфатно-солевого буфера (рН 7.4), который мягко суспендируют по краю каждой лунки, осторожно промывая покровное стекло с прикрепившимися клетками (Фиг. 5). Затем жидкость сливают, в лунки добавляют свежую полную ростовую среду для культивирования клеток.
На фиг. 10 представлена полученная культура клеток больного №5. По результатам цитологического анализа методом световой микроскопии установлено, что 93.9% клеток данной культуры составляют альвеолярные макрофаги (таблица 2). Жизнеспособность клеток равна 100%.
Пример 2. Больной №7. Диагноз: двухсторонний кавернозный туберкулез верхних долей легких (таблица 1). Ex vivo культуру альвеолярных макрофагов из операционного материала больного №7 получают согласно описанному выше способу в разделе «Раскрытие изобретения» и в примере 1 в части, касающейся отбора фрагментов ткани, емкостей для культивирования клеток и режимов культивирования (температура, концентрация СО2). Гомогенизацию ткани легкого осуществляют в растворе 0.1 М NaCl с помощью протирки через сито диаметром пор 2.0 мм. Осаждение клеток из клеточной взвеси путем центрифугирования осуществляют при скорости 1200 об/мин в течение 4 мин. Культивирование клеток осуществляют в полной ростовой среде RPMI 1640 с 10% сыворотки плодов коров, 2 мМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина в течение 20 час. Удаление из емкости для культивирования клеток, неприкрепившихся к покровным стеклам, полную ростовую среду заменяют на физиологически приемлемый раствор 0.1 М NaCl, затем его заменяют на полную ростовую среду, указанную выше.
На фиг. 9 представлена полученная ex vivo культура альвеолярных макрофагов больного №7. По результатам цитологического анализа методом световой микроскопии установлено, что 87.6% клеток данной культуры составляют альвеолярные макрофаги (таблица 2). Жизнеспособность клеток равна 100%.
Пример 3. Больной №9 с туберкуломой в сегменте С6 левого легкого (таблица 1). Ex vivo культуру альвеолярных макрофагов из операционного материала больного №9 получают согласно описанному выше способу в разделе «Раскрытие изобретения» и в примере 1 в части, касающейся отбора фрагментов ткани, емкостей для культивирования клеток и режимов культивирования (температура, концентрация СО2). Гомогенизацию ткани легкого осуществляют в растворе безсывороточной ростовой среды RPMI 1640 с помощью протирки через сито диаметром пор 1.5 мм. Осаждение клеток из клеточной взвеси путем центрифугирования осуществляют при скорости 1000 об/мин в течение 4 мин. Культивирование клеток осуществляют в полной ростовой среде DMEM/F12, содержащей 10% сыворотки крови плодов коров, 2 мМ глутамина и 50 мкг/мл гентамицина в течение 16 час. Удаление из емкости для культивирования клеток, не прикрепившихся к покровным стеклам, используют безсывороточную ростовую среду DMEM, затем ее заменяют на указанную выше полную ростовую среду.
На фиг. 12 представлена полученная ex vivo культура альвеолярных макрофагов больного №9. По результатам цитологического анализа методом световой микроскопии установлено, что 96.9% клеток данной культуры составляют альвеолярные макрофаги (таблица 2). Жизнеспособность клеток равна 100%.
Осуществление способа оценки вирулентности Mycobacterium tuberculosis с использованием полученных ex vivo культур альвеолярных макрофагов
Результаты анализа ex vivo культуры альвеолярных макрофагов, полученной из послеоперационного материала восьми пациентов, больных туберкулезом, представлены в таблице 3. Она содержит данные о доле альвеолярных макрофагов, содержащих микобактерии, от общего числа альвеолярных макрофагов, доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий без корд-морфологии роста, от общего числа альвеолярных макрофагов, содержащих микобактерии, и доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста от общего числа альвеолярных макрофагов, содержащих микобактерий, а также заключение о вирулентности М. tuberculosis у конкретного пациента.
Пример 1. Больной №1 (27 лет) с туберкуломой с распадом в сегменте 6 левого легкого, который был удален в результате операции. Оценку вирулентности М. tuberculosis с использованием полученных ex vivo культур альвеолярных макрофагов осуществляют согласно способу, описанному выше. Ex vivo культуру альвеолярных макрофагов, полученную из операционного материала больного №1 согласно заявленному способу, фиксируют на покровных стеклах через 12 часов после начала культивирования. Для фиксации клеток на покровных стеклах в лунки планшета для культивирования клеток на 10 мин приливают по 1 мл 4% раствора формалина, приготовленного на фосфатно-солевом буфере (рН 7.4). Затем раствор формалина удаляют из каждой лунки.
Для окраски клеток покровные стекла отмывают от фиксатора в 4 мл фосфатно-солевого буфера (рН 7.4) в течение 10 мин при комнатной температуре. Затем их окрашивают методом Циля-Нильсена (14), специфичного для окраски М. tuberculosis. Используют набор реагентов для окраски по методу Циля-Нильсена производства ООО «Первая Лабораторная Компания» (Санкт-Петербург, Россия).
По результатам цитологического анализа установлено, что доля альвеолярных макрофагов, содержащих микобактерии, от общего числа альвеолярных макрофагов для больного №1 составила 0.5%, при этом не обнаружено альвеолярных макрофагов, содержащих колонии размножающихся микобактерий без корд-морфологии роста и с корд-морфологией роста. Сделано заключение о невирулентности микобактерий М. tuberculosis у данного пациента. Это позволяет прогнозировать благоп