Соединения, пригодные для синтеза бензамидных соединений
Иллюстрации
Показать всеНастоящее изобретение относится к новым соединениям Формулы I, которые пригодны для синтеза бензамидных соединений. В Формуле I: R1 выбран из Br и CN; R2 выбран из Н и Br; R3 выбран из Н и ; где R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и X выбран из О и S; при условии, что: если R1 представляет собой Br и R2 представляет собой Н, то R не представляет собой СН3; если R1 представляет собой CN, то R2 представляет собой Н; и если R1 представляет собой Br, то R3 представляет собой , где R не представляет собой Н. 5 н. и 10 з.п. ф-лы, 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[001] Настоящее изобретение относится к новым соединениям, пригодным для синтеза бензамидных соединений.
УРОВЕНЬ ТЕХНИКИ
[002] Бензамидные соединения применяют в качестве промежуточных соединений для синтеза многих фармацевтических терапевтических лекарств. Например, 2-амино-4,6-диметоксибензамид был описан в патенте США №3966965 в качестве промежуточного соединения для синтеза производных оксаминовой кислоты для предупреждения гиперчувствительности при аллергических реакциях. В более поздних патентных заявках это соединение описано как ценное промежуточное соединение для получения новых сердечно-сосудистых агентов (US2008/0188467 и WO2008/92231 на имя компании Resverlogix Corp).
[003] 2-Амино-4,6-диметоксибензамид может быть получен из 4,6-диметоксиизатового ангидрида. 4,6-Диметоксиизатовый ангидрид может быть получен по реакции 4,6-диметоксиантраниловой кислоты с фосгеном (патент США №4191840 и Org. Synth. 1947, 27, 45). Альтернативно, для получения 2-амино-4,6-диметоксибензамида можно преобразовать 3,5-диметоксианилин в его гидрохлоридную соль, после чего эта соль взаимодействует с оксалилхлоридом с образованием 4,6-диметоксиизатина. Затем изатин может быть превращен в целевое соединение через нестабильное карбоксильное промежуточное соединение по реакции с
гидроксидом натрия и перекисью водорода с последующим EDCI/HOBt - опосредованным связыванием с образованием 2-амино-4,6-диметоксибензамида (WO 2008/92231).
[004] В известных ранее способах синтеза бензамидных соединений и производных зачастую используют нестабильные промежуточные соединения, неэффективные процессы и, в некоторых случаях, большое количество стадий, что приводит к более низкому выходу и увеличению стоимости производства. Следовательно, сохраняется необходимость в способах получения бензамидных соединений и производных, которые являются эффективными, не требуют применения редких или нестабильных реагентов, могут быть выполнены с применением недорогих реагентов и обеспечивают экологически более безопасные процессы.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[005] В настоящем изобретении предложены новые соединения, которые подходят для способа синтеза бензамидных соединений. В одном аспекте настоящего изобретения предложен способ получения бензамидных соединений с применением недорогих реагентов. Более конкретно, соединения согласно настоящему изобретению могут быть использованы в способах синтеза бензамидных соединений, включающих меньшее количество стадий и/или более эффективные стадии реакции, меньшее количество стадий выделения, более высокие выходы и улучшенную чистоту. Эти и другие особенности настоящего изобретения становятся понятными из следующего описания, графических материалов и приложенной формулы изобретения.
[006] В некоторых вариантах реализации соединения настоящего изобретения выбраны из соединений Формулы I:
где:
R1 выбран из Br и CN;
R2 выбран из Н и Br;
R3 выбран из Н и ; где
R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X выбран из О и S;
при условии, что:
если R1 представляет собой Br, и R2 представляет собой Н, то R не представляет собой СН3;
если R1 представляет собой CN, то R2 представляет собой Н; и
если R1 представляет собой Br, то R3 представляет собой
[007] В некоторых вариантах реализации соединения настоящего изобретения выбраны из соединений Формулы I-A:
где:
R выбран из Н, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X выбран из О и S.
[008] В другом варианте реализации соединения настоящего изобретения выбраны из соединений Формулы I-В
где:
R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X выбран из О и S.
[009] В других вариантах реализации соединения настоящего изобретения выбраны из соединений Формулы I-С:
где:
R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X выбран из О и S.
[0010] В конкретном варианте реализации соединение настоящего изобретения представляет собой
(2-Амино-4,6-диметоксибензонитрил).
[0011] В некоторых вариантах реализации соединения настоящего изобретения выбраны из соединений Формулы I-А, в которых X представляет собой кислород.
[0012] В других вариантах реализации соединения настоящего изобретения выбраны из соединений Формулы I-В, в которых X представляет собой кислород.
[0013] В других вариантах реализации соединения настоящего изобретения выбраны из соединений Формулы I-С, в которых X представляет собой кислород.
[0014] В некоторых вариантах реализации соединения настоящего изобретения выбраны из соединений формулы I-А, в которых R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2.
[0015] В некоторых вариантах реализации соединения настоящего изобретения выбраны из соединений формулы I-В, в которых R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2.
[0016] В некоторых вариантах реализации соединения настоящего изобретения выбраны из соединений формулы I-С, в которых R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2.
ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0017] В настоящем изобретении предложены соединения, пригодные для синтеза 2-амино-4,6-диметоксибензамида и других бензамидных соединений.
[0018] В некоторых вариантах реализации соединения настоящего изобретения получают следующими способами:
(i) защитой 3,5-диметоксианилина защитным агентом с образованием защищенного 3,5-диметоксианилина,
(ii) галогенированием защищенного 3,5-диметоксианилина галогенирующим агентом с образованием галогенированного защищенного 3,5-диметоксианилина,
(iii) цианированием галогенированного защищенного 3,5-диметоксианилина цианирующим агентом с образованием цианированного защищенного 3,5-диметоксианилина,
(iv) снятием защиты с цианированного защищенного 3,5-диметоксианилина с образованием цианированного 3,5-диметоксианилина.
(v) кристаллизацией цианированного 3,5-диметоксианилина и
(vi) гидратированием цианированного 3,5-диметоксианилина с образованием 2-амино-4,6-диметоксибензамида.
[0019] В зависимости от исходного соединения и заданного бензамидного соединения, которое нужно синтезировать, может потребоваться защита некоторых функциональных групп. Специалисты в данной области техники могут использовать любые известные способы для защиты определенной функциональной группы (групп) от нежелательной реакции на стадиях галогенирования, цианирования и/или гидратации.
[0020] В некоторых вариантах реализации соединения настоящего изобретения выбраны из:
2-бром-3,5-диметокситрифторацетанилида [А],
2,4-дибром-3,5-диметокситрифторацетанилида [В],
2-циано-3,5-диметокситрифторацетанилида [С] и
2-амино-4,6-диметоксибензонитрила [D].
[0021] В одном примере синтез 2-амино-4,6-диметоксибензамида включает защиту 3,5-диметоксианилина по меньшей мере одним защитным агентом с образованием защищенного анилинового соединения. Стадия защиты включает взаимодействие 3,5-диметоксианилина с защитным агентом, таким как трифторуксусный ангидрид, с применением триэтиламина в толуоле с образованием защищенного анилинового соединения или, в этом примере, 3,5-диметоксианилин образует 3,5-диметокситрифторацетанилид. В одном из вариантов реализации изобретения раствор, содержащий толуол, используют непосредственно на следующей стадии, на стадии галогенирования, после промывания водой. В другом варианте реализации изобретения раствор, содержащий толуол, используют непосредственно на следующей стадии, на стадии галогенирования, без промывания водой.
[0022] Альтернативно, специалисты в данной области техники могут удалить, уменьшить или увеличить количество толуола и/или промежуточных соединений, и/или удалить воду перед галогенированием
соединения, как, например, удаление воды азеотропной перегонкой толуола и воды. Хотя один из вариантов реализации защитной группы в данном примере представляет собой трифторацетил, для защиты функциональной группы NH2 в анилиновом соединении можно использовать также другие защитные группы, такие как ацетильные, различные моногалогенацетильные, дигалогенацетильные и тригалогенацетильные группы. Обнаружено, что трифторацетильная защитная группа обусловливает улучшенную селективность на стадии галогенирования, по сравнению с ацетильной защитной группой.
[0023] В некоторых вариантах реализации настоящего изобретения предложено соединение Формулы I-А:
где:
R выбран из Н, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X выбран из О и S.
[0024] В некоторых вариантах реализации настоящего изобретения предложено соединение Формулы I-В:
где:
R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X выбран из О и S.
[0025] В некоторых вариантах реализации настоящего изобретения предложено соединение Формулы I-C:
где:
R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X выбран из О и S.
[0026] В некоторых вариантах реализации соединение настоящего изобретения выбраны из:
2-бром-3,5-диметокситрифторацетанилида,
2,4-дибром-3,5-диметокситрифторацетанилида,
2-циано-3,5-диметокситрифторацетанилида и
2-амино-4,6-диметоксибензонитрила.
[0027] В некоторых вариантах реализации настоящего изобретения предложено соединение в соответствии с Формулой I-A:
где:
R выбран из Н, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X представляет собой О.
[0028] В некоторых вариантах реализации настоящего изобретения предложено соединение в соответствии с Формулой I-B:
где:
R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X представляет собой О.
[0029] В некоторых вариантах реализации настоящего изобретения предложено соединение в соответствии с Формулой I-C:
где:
R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; и
X представляет собой О.
[0030] В некоторых вариантах реализации настоящего изобретения предложено соединение в соответствии с Формулой I-A:
где:
R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2; и X выбран из О и S.
[0031] В некоторых вариантах реализации настоящего изобретения предложено соединение в соответствии с Формулой I-B:
где:
R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2; и
X выбран из О и S.
[0032] В некоторых вариантах реализации настоящего изобретения предложено соединение в соответствии с Формулой I-C:
где:
R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2; и
X выбран из О и S.
[0033] Следующие примеры представлены для иллюстрации, и они не предназначены для какого-либо ограничения объема границ настоящего изобретения.
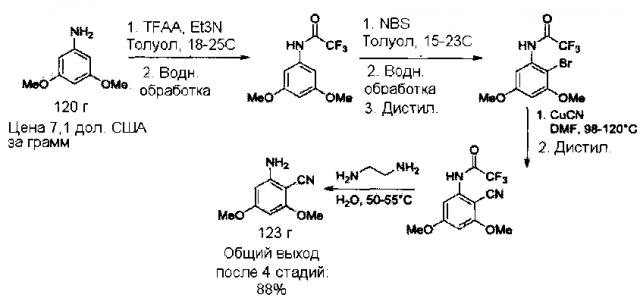
[0034] На схеме ниже показан процесс получения амино-4,6-диметоксибензонитрила, начиная с синтеза 3,5-диметокситрифторацетанилида, согласно приведенным далее примерам 1-4.
ПРИМЕР 1
3,5-диметокситрифторацетанилид
[0035] В 2 л колбу, оснащенную рубашкой, загрузили 3,5-диметоксианилин (120 г), толуол (1335 г) и триэтиламин (87 г). Смесь перемешивали при 18-20°С до полного растворения твердых веществ. Трифторуксусный ангидрид (185 г) добавляли в течение по меньшей мере 1 часа, поддерживая температуру реакции в диапазоне 18-25°С. Реакционную смесь перемешивали в течение по меньшей мере 1 часа, а затем проверили полноту протекания реакции по ВЭЖХ. В смесь добавили воду (250 г) и нагревали реакционную смесь до 40-45°С, и перемешивали в течение по меньшей мере 10 минут. Прекратили перемешивание и разделили фазы. Нижнюю водную фазу удалили и добавили воду (250 г) в толуольный слой с продуктом. Смесь перемешивали при 40-45°С в течение по меньшей мере 10 минут и разделили фазы, удалив нижнюю водную фазу. Затем толуольный раствор продукта, 3,5-диметокситрифторацетанилида, охладили до температуры ниже 0°С, подготовив его к стадии получения бром-3,5-диметокситрифторацетанилида. 1Н-ЯМР (Ацетон-d6): δ 10,10 (ш с, 1Н), 6,97 (д, J=2,1 Гц, 2 Н), 6,38 (м, 1Н), 3,77 (с, 6Н). ГХ-МС: 249,15.
ПРИМЕР 2
2-Бром-3,5-диметокситрифторацетанилид [А]
[0036] Толуольный раствор 3,5-диметокситрифторацетанилида, содержащийся в 2 л колбе, оснащенной рубашкой, охладили до температуры -5-0°С. К холодной суспензии 3,5-диметокситрифторацетанилида добавляли твердый N-бромсукцинимид (145 г) порциями по 5-10 г в течение по меньшей мере 1 часа. Во время добавления поддерживали температуру ниже 0°С.После завершения добавления смесь оставили нагреваться до 15-23°С и перемешивали в течение по меньшей мере 1 часа. Завершение реакции контролировали по ВЭЖХ. После завершения реакции в смесь добавили воду (235 г) и нагрели реакционную смесь до 35-45°С, и выдерживали в течение по меньшей мере 10 минут. Перемешивание прекратили и оставили фазы разделяться. Нижнюю водную фазу удалили и добавили воду (235 г) в толуольный раствор бром-3,5-диметокситрифторацетанилида. Смесь перемешивали при 35-45°С в течение по меньшей мере 10 минут и разделили фазы, удалив нижнюю водную фазу. Толуольный раствор 2-бром-3,5-диметокситрифторацетанилида перенесли в 2 л четырехгорлую круглодонную колбу, оснащенную дистиллятором и колбонагревателем. Раствор нагревали до кипения и перегоняли толуол до достижения температуры смеси 125-140°С.Смесь охладили до температуры менее 80°С под азотом и добавили к ней N,N′-диметилформамид (ДМФ; 1215 г). Смесь перемешали и охладили до температуры менее 80°С. Раствор использовали на стадии получения 2-амино-4,6-диметоксибензонитрила. 1Н ЯМР (ацетон-d6) δ 9,69 (ш с, 1Н), 7,05 (д, J=2,7 Гц, 1Н), 6,66 (д, J=2,6 Гц, 1Н), 3,93 (с, 3Н), 3,85 (с, 3Н); 13С ЯМР (ацетон-d6) δ 161,2, 158,2, 156,0 (к, J=37,3 Гц), 138,2, 117,0 (к, J=288 Гц), 104,1, 99,2, 98,6, 57,0, 56,2.
2,4-Дибром-3,5-диметокситрифторацетанилид [В]
[0037] Соединение В можно выделить в качестве подходящего побочного продукта синтеза соединения А, например, хроматографией. ГХ-МС m/z 407,00 (м), 328 (м-Br).
ПРИМЕР 3
2-циано-3,5-диметокситрифторацетанилид [С]
[0038] К раствору 2-бром-3,5-диметокситрифторацетанилида в ДМФ в 2 л круглодонной колбе добавили 89 г цианида меди (CuCN). Смесь нагревали на бане до 98-120°С и выдерживали в течение по меньшей мере 6 часов. Завершение реакции проверили при помощи анализа ВЭЖХ. После завершения реакционную смесь охладили до температуры менее 60°С и вакуумировали сосуд, и выполнили перегонку ДМФ. Дистилляцию продолжали до объема смеси приблизительно 570 мл. Остаток охладили до температуры менее 40°С. 1Н ЯМР (ДМСО-d6) δ 11,63 (ш с, 1Н), 6,69 (с, 2Н), 3,91 (с, 3Н), 3,85 (с, 3Н). ГХ-МС: 274,15 (м).
ПРИМЕР 4
2-амино-4,6-диметоксибензонитрил [D]
[0039] В отдельную 2 л колбу, оснащенную рубашкой, загрузили воду (1065 г) и этилендиамин (390 г). Водный раствор нагрели до 50-55°С и выдерживали при этой температуре. К остатку, содержащему 2-циано-3,5-диметокситрифторацетанилид и ДМФ, полученному на предыдущей стадии, добавляли полученную водную смесь в течение по меньшей мере 15 минут. Реакционный раствор перемешивали при 50-55°С в течение по меньшей мере 2 часов. Анализ проверки завершения реакции выполнили при помощи ВЭЖХ. После завершения реакции смесь довели до 35-37°С и выдерживали при этой температуре для образования суспензии. Полученную суспензию медленно охлаждали до 5-15°С в течение по меньшей мере 2 часов. Смесь выдерживали при 5-15°С в течение 2 часов, а затем фильтрованием выделили продукт, 2-амино-4,6-диметоксибензонитрил. Осадок на фильтре, 2-амино-4,6-диметоксибензонитрил, промыли водой для удаления маточного раствора. Полученный влажный осадок на фильтре высушили и анализировали при помощи ВЭЖХ. В этом процессе получили 123 грамма продукта, 2-амино-4,6-диметоксибензонитрила [D], с выходом 88% от исходного 3,5-диметоксианилина. 1Н ЯМР (ацетон-d6) δ 6,03 (д, J=1,9 Гц, 1Н), 5,89 (д, J=1,9, 1Н), 5,44 (ш с, 2Н), 3,83 (с, 3Н), 3,77 (с, 3Н); 13С ЯМР (ацетон-d6) δ 166,0, 164,1, 154,5, 116,3, 92,3, 88,8, 79,8, 26,2, 55,8. ГХ-МС: 178,15 (м).
Перекристаллизация 2-амино-4,6-диметоксибензонитрила [D]
[0040] В 1 л четырехгорлую круглодонную колбу загрузили 2-амино-4,6-диметоксибензонитрил (90 г) и изопропиловый спирт (720 мл). К колбе присоединили холодильник и колбонагреватель. К перемешиваемой смеси добавили уголь (1,8 г) и нагревали смесь с обратным холодильником до кипения (82-83°С). Смесь выдерживали при кипении в течение 1 часа, а затем охладили до 75-77°С и выдерживали по меньшей мере в течение 6 часов. Затем отфильтровали уголь, а фильтрат собрали в чистую 1 л четырехгорлую круглодонную колбу. Фильтрат медленно охладили до 60-62°С и выдерживали до начала кристаллизации. Полученную суспензию медленно охлаждали до 0-5°С в течение по меньшей мере 2 часов. Смесь выдерживали при 0-5°С в течение по меньшей мере 0,5 часа и отфильтровали, чтобы собрать продукт. Осадок на фильтре, 2-амино-4,6-диметоксибензонитрил, промыли изопропиловым спиртом и высушили в вакуумной печи при 50°С и под вакуумом в 22 дюйма ртутного столба. В процессе получили 83,8 г очищенного 2-амино-4,6-диметоксибензонитрила (выход 84%) [D].
[0041] За исключением тех случаев, в которых явно указано иное, использование терминов в единственном числе не является ограничением, и это не следует толковать как ограничение настоящего описания или пункта формулы изобретения до одного элемента, использованного в единственном числе. Скорее, применение единственного числа в настоящем документе предназначено для охвата одного или нескольких таких элементов, если в тексте явно не указано иное.
[0042] Любой и каждый патент или патентная заявка, или опубликованный документ, упомянутый в любой части настоящего описания,
in toto включен в настоящее описание посредством ссылки, как если бы он был полностью изложен в настоящем документе.
[0043] В отношении настоящего изобретения могут быть выполнены многочисленные изменения, входящие в общую идею и объем границ приложенной формулы изобретения.
1. Соединение Формулы I: где:R1 выбран из Br и CN;R2 выбран из Н и Br;R3 выбран из Н и ; гдеR выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; иX выбран из О и S;при условии, что:если R1 представляет собой Br и R2 представляет собой Н, то R не представляет собой СН3;если R1 представляет собой CN, то R2 представляет собой Н; иесли R1 представляет собой Br, то R3 представляет собой , гдеR не представляет собой Н.
2. Соединение в соответствии с Формулой I-А: где:R выбран из CF3, CF2H, CFH2, CCl3, ССl2Н, CClH2, CBr3, CBr2H и CBrH2; иX выбран из О и S.
3. Соединение в соответствии с Формулой I-В: где:R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; иX выбран из О и S.
4. Соединение в соответствии с Формулой I-С: где:R выбран из Н, СН3, CF3, CF2H, CFH2, CCl3, CCl2H, CClH2, CBr3, CBr2H и CBrH2; иX выбран из О и S.
5. Соединение, выбранное из:2-бром-3,5-диметокситрифторацетанилида,2,4-дибром-3,5-диметокситрифторацетанилида,2-циано-3,5-диметокситрифторацетанилида и2-амино-4,6-диметоксибензонитрила.
6. Соединение по п. 2, отличающееся тем, что X представляет собой кислород.
7. Соединение по п. 3, отличающееся тем, что X представляет собой кислород.
8. Соединение по п. 4, отличающееся тем, что X представляет собой кислород.
9. Соединение по п. 2, отличающееся тем, что R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2.
10. Соединение по п. 3, отличающееся тем, что R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2.
11. Соединение по п. 4, отличающееся тем, что R выбран из CF3, CF2H, CFH2, CCl3, CCl2H и CClH2.
12. Соединение по п. 5, отличающееся тем, что соединение представляет собой 2-бром-3,5-диметокситрифторацетанилид.
13. Соединение по п. 5, отличающееся тем, что соединение представляет собой 2,4-дибром-3,5-диметокситрифторацетанилид.
14. Соединение по п. 5, отличающееся тем, что соединение представляет собой 2-циано-3,5-диметокситрифторацетанилид.
15. Соединение по п. 5, отличающееся тем, что соединение представляет собой 2-амино-4,6-диметоксибензонитрил.