Иммуногенная композиция
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к иммунологии, и описывает иммуногенную композицию, содержащую в качестве активных веществ: иммуногенную микрочастицу, состоящую из микрочастицы комплекса адъювант-антиген, где антиген(ы), инкапсулирован(ы) в адъювантную микрочастицу, состоящую из амфифильного полимера(ов), у которого(ых) гидрофобный(е) сегмент(ы) представляет(ют) собой поли(гидроксикислоту); и молекулы поверхностно-активного вещества, включающие структуру эфира жирной кислоты, инкапсулированные в иммуногенную микрочастицу. Иммуногенные микрочастицы обеспечивают высокую иммуноактивирующую способность в отношении живого организма, даже при небольшом количестве антигена и/или небольшом количестве доз и могут быть использованы в качестве вакцины для терапии и/или профилактики инфекционных заболеваний, раковых образований. 11 н.п. ф-лы, 6 ил., 6 табл., 13 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к иммуногенной композиции, содержащей в качестве активного ингредиента иммуногенную микрочастицу, при этом иммуногенная микрочастица включает: микрочастицы комплексов адъювант-антиген, где антиген(ы) инкапсулирован(ы) в адъювантной микрочастице, состоящей из амфифильного полимера(ов); и поверхностно-активное вещество.
Уровень техники
Для повышения иммуноактивирующей способности антигена, вместе с антигеном используют адъювант. Хотя полный адъювант Фрейнда (CFA), как известно, имеет превосходный эффект в качестве адъюванта, CFA готовят из убитых бактерий и эмульсии масла, и, следовательно, он имеет сильные побочные эффекты, такие как сильная воспалительная реакция и образование язвенной опухоли (гранулемы) в области введения. Поэтому использование CFA для человека не разрешено по причине безопасности. Соответственно, адъюванты, которые разрешены для введения человеку, ограничены.
Примеры адъювантов, которые разрешены для введения человеку, включают адъюванты на основе гидроксида алюминия, но их иммуноактивизирующая способность необязательно является достаточной, и, следовательно, их нужно неоднократно вводить, для достижения приобретения иммунитета. Поэтому разработка иммуногенной композиции, в которой используется эффективный и сильный адъювант, и где такая композиция может быть использована для людей, остается востребованной.
Для разработки нового адъюванта, предназначенного для достижения высокой иммуноактивирующей способности, был реализован способ, где антиген инкапсулирован в микрочастицу. Сообщалось, что введение антигена в виде микрочастиц увеличивает иммунологические реакции, такие как продукция антител, по сравнению со случаем введения только одного антигена, но эффект от его введения не являлся достаточно высоким, поскольку было сообщено только об эффекте с почти таким же уровнем, как в случае вышеуказанного адъюванта на основе гидроксида алюминия. Это, как полагают, происходит из-за трудности в эффективном инкапсулировании гидрофильных антигенных молекул, таких как белки, в микрочастицы, которые известны как микрочастицы, состоящие из гидрофобных сополимеров полимолочных кислот и полигликолевых кислот, с поддержанием структуры молекул антигена (непатентный документ 1).
В последние годы сообщалось о новой технологии микрочастиц (патентные документы 1 и 2), где в такой технологии используют амфифильный полимер, который позволяет с высокой эффективностью инкапсулировать белок с высокой молекулярной массой. Хотя эта новая микрочастица была изучена для ее работы при замедленном высвобождении лекарственных средств, ее адъювантная функция в случаях инкапсуляции антигена в целом не была изучена. Кроме того, на основе механизма, по которому микрочастица, содержащая антиген, функционирует в качестве адъюванта, считается, что функция замедленного высвобождения молекулы антигена, так же как и механизма, по которому микрочастица, содержащая антиген, полностью включается в иммуноцит и высвобождает антиген в клетке, являются важными, и что функция высвобождения лекарственного средства из частицы и работы в качестве адъюванта необязательно коррелированы друг с другом. Поэтому трудно вывести адъювантную функцию, основанную на замедленном высвобождении частицы, и невозможно предложить эффективный адъювант, имеющий намного лучшее действие, чем алюминиевые адъюванты, на основе обычных технологий с использованием микрочастиц, несмотря на необходимость его создания.
Документы уровня техники
Патентные документы
Патентный документ 1 - WO2006/095668
Патентный документ 2 - JP 2008-088158 A
Непатентные документы
Непатентный документ 1 - Advanced drug delivery reviews, 2005, vol. 57, pp. 391-410.
Сущность изобретения
Проблемы, решаемые изобретением
Настоящее изобретение обеспечивает иммуногенную композицию, которая проявляет высокую иммуноактивирующую способность даже с небольшим количеством антигена и/или при небольшом количестве доз.
Средства для решения проблемы
Для решения вышеуказанных проблем, авторы настоящего изобретения изучили способ, которым может быть индуцирован высокий уровень иммунной активации при использовании небольшого количества антигена и небольшого количества его доз, и в результате обнаружили, что иммуногенная композиция, содержащая в качестве активных ингредиентов: иммуногенную микрочастицу, состоящую из микрочастицы комплекса адъювант-антиген, где антиген(ы) инкапсулирован(ы) в адъювантную микрочастицу; и поверхностно-активное вещество; имеет высокую иммуноактивирующую способность в условиях in vivo. Таким образом, настоящее изобретение включает следующее.
(1) Иммуногенная композиция, содержащая в качестве активного ингредиента: иммуногенную микрочастицу, состоящую из микрочастицы комплекса адъювант-антиген, где антиген(ы) инкапсулирован(ы) в адъювантную микрочастицу, состоящую из амфифильного полимера(ов), у которого(ых) гидрофобный(е) сегмент(ы) представляет(ют) собой поли(гидроксикислоту); и поверхностно-активное вещество, где поверхностно-активное вещество инкапсулировано в иммуногенную микрочастицу.
(2) Иммуногенная композиция по (1), где иммуногенная микрочастица представляет собой частицу, состоящую из микрочастиц комплекса адъювант-антиген, ассоциированных друг с другом.
(3) Иммуногенная композиция по (1) или (2), где поверхностно-активное вещество включает структуру эфира жирной кислоты.
(4) Иммуногенная композиция по любому из (1)-(3), где адъювантная микрочастица имеет в своей внутренней части гидрофильную часть(и), состоящую(ие) из гидрофильного сегмента(ов) амфифильного полимера(ов), и имеет внешний слой, состоящий из гидрофобной части(ей), состоящий(их) из гидрофобного сегмента(ов) амфифильного полимера(ов).
(5) Иммуногенная композиция по любому из (1)-(4), где гидрофильный сегмент амфифильного полимера представляет собой полисахарид.
(6) Иммуногенная композиция по любому из (1)-(5), где амфифильный полимер представляет собой привитый амфифильный полимер, состоящий из полисахаридного каркаса и присоединенной(ых) цепи(ей) поли(гидроксикислоты).
(7) Иммуногенная композиция по (5) или (6), где полисахарид представляет собой декстран.
(8) Иммуногенная композиция по любому из (1)-(7), где поли(гидроксикислота) представляет собой сополимер молочной и гликолевой кислот.
(9) Иммуногенная композиция по любому из (1)-(8), где поверхностно-активное вещество дополнительно включает моносахарид и/или структуру(ы) полиэтиленгликоля.
(10) Иммуногенная композиция по любому из (1)-(8), где поверхностно-активное вещество представляет собой одно или более соединений, выбранных от группы, состоящей из полисорбата 80, полисорбата 20, моноолеата сорбитана, триолеата сорбитана и полиоксиэтилена гидрогенизированного касторового масла.
(11) Иммуногенная композиция, содержащая в качестве активного ингредиента иммуногенную микрочастицу, полученную стадиями:
растворения поверхностно-активного вещества в водном растворителе A, в котором растворен(ы) антиген(ы), или в органическом растворителе B, не смешивающемся с водой, в котором растворен(ы) амфифильный полимер(ы), у которого(ых) гидрофобный сегмент(ы) представляет(ют) собой поли(гидроксикислоту), и смешивания полученной смеси с получением обратнофазной эмульсии; и
удаления растворителя из обратнофазной эмульсии.
(12) Иммуногенная композиция, содержащая в качестве активного ингредиента иммуногенную микрочастицу, полученную способом получения частицы, состоящей из микрочастиц комплекса адъювант-антиген, связанных друг с другом, включающим стадии:
смешивания водного растворителя A, в котором растворен(ы) антиген(ы), и органического растворителя B, не смешивающегося с водой, в котором растворен амфифильный полимер(ы), гидрофобный сегмент(ы) которого представляет(ют) собой поли(гидроксикислоту), с получением обратнофазной эмульсии;
удаления растворителя из обратнофазной эмульсии с получением микрочастиц комплекса адъювант-антиген; и
введения дисперсии C микрочастиц комплекса адъювант-антиген в жидкую фазу D, где растворен поверхностный модификатор, с последующим удалением дисперсионной среды;
где поверхностно-активное вещество(а) растворено(ы) в водном растворителе A, в органическом растворителе B, не смешивающемся с водой, и/или в дисперсии C.
Эффект изобретения
Настоящим изобретением предоставлена иммуногенная композиция с сильной иммунной активацией in vivo, которая ранее была невозможна.
Краткое описание фигур
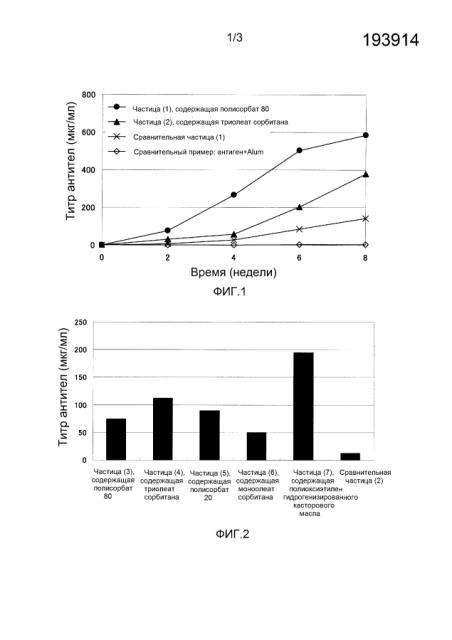
На фиг.1 показана иммунологическая оценка 1 иммуногенных микрочастиц, содержащих CEA.
На фиг.2 показана иммунологическая оценка 2 иммуногенных микрочастиц, содержащих CEA.
На фиг.3 показана иммунологическая оценка 3 иммуногенных микрочастиц, содержащих CEA.
На фиг.4 показана иммунологическая оценка 4 иммуногенных микрочастиц, содержащих CEA.
На фиг.5 показана иммунологическая оценка 5 иммуногенных микрочастиц, содержащих CEA.
На фиг.6 показана иммунологическая оценка иммуногенных микрочастиц, содержащих OVA.
Лучший вариант осуществления изобретения
Настоящее изобретение относится к иммуногенным композициям, содержащим в качестве активного ингредиента иммуногенную микрочастицу, состоящую из микрочастицы комплекса адъювант-антиген, где антиген(ы), инкапсулирован(ы) в адъювантную микрочастицу, состоящую из амфифильного полимера(ов), гидрофобный(е) сегмент(ы) которого(ых) представляет(ют) собой поли(гидроксикислоту); и поверхностно-активное вещество.
В первую очередь дается описание амфифильного полимера, составляющего адъювантную микрочастицу. Понятие "амфифильный" означает, что сохранены свойства как гидрофильности, так и гидрофобности. Когда растворимость в воде определенной части выше, чем растворимость других частей, эта часть называется гидрофильной. Гидрофильная часть является предпочтительно растворимой в воде, но даже в случаях, когда эта часть имеет плохую растворимость в воде, это является достаточном, если ее растворимость в воде выше, чем растворимость других частей. Когда растворимость в воде определенной части ниже, чем растворимость других частей, эта часть называется гидрофобной. Гидрофобная часть является предпочтительно нерастворимой в воде, но даже в случаях, когда эта часть имеет плохую растворимость в воде, это является достаточном, если ее растворимость в воде ниже, чем растворимость других частей.
Амфифильный полимер означает полимер, имеющий вышеуказанную амфифильность для всей молекулы. Понятие полимер означает, что молекула имеет молекулярную структуру, в которой гидрофильный сегмент(ы) или гидрофобный сегмент(ы) амфифильного полимера, или оба вместе, образует(ют) структуру, в которой повторяются минимальные единицы (мономеры). Амфифильный полимер настоящего изобретения не является ограниченным, если он имеет структуру, включающую гидрофильный сегмент(ы) и гидрофобный сегмент(ы), и он может быть линейным блок-полимером, имеющим гидрофильный сегмент(ы) и гидрофобный сегмент(ы), связанные друг с другом; разветвленным полимером, имеющим разветвления, в котором присутствует множество гидрофильных или гидрофобных сегментов, или оба из них; или привитый полимер, в котором множество гидрофобных сегментов присоединены к гидрофильному сегменту или множество гидрофильных сегментов присоединены к гидрофобному сегменту. Амфифильный полимер настоящего изобретения предпочтительно является полимером, имеющим один гидрофильный сегмент, при этом наиболее предпочтителен линейный блок-сополимер, имеющий как гидрофильный сегмент, и так гидрофобный сегмент, или привитый полимер, имеющий множество гидрофобных сегментов, присоединенных к основной цепи гидрофильной сегмента.
Амфифильные полимеры, составляющие иммуногенную композицию, могут быть набором из множества типов амфифильных полимеров, состоящих из полимерных составляющих, имеющих разные гидрофильные части, и/или из гидрофильных частей, или набор амфифильных полимеров, имеющих такой же полимерный состав, но имеющих множество типов соединений, если такие амфифильные полимеры обладают свойствами адъювантной микрочастицы. Для достижения воспроизводимости и увеличения продуктивности, амфифильные полимеры предпочтительно являются набором небольшого количества типов амфифильных полимеров, более предпочтительно набор преимущественно состоит не более чем из 2 типов амфифильных полимеров, и еще более предпочтительно, он состоит преимущественно из одного типа амфифильного полимера.
В настоящем изобретении гидрофобный сегмент амфифильного полимера представляет собой поли(гидроксикислоту). Поли(гидроксикислота) не является ограниченной и предпочтительно представляет собой биологически совместимый полимер, который не имеет существенного отрицательного воздействия при введении в живой организм. Биологическая совместимость, как используется в данном описании, означает, что в случае орального введения полимера крысам, LD50 составляет не менее 2000 мг/кг. Кроме того, полимер может быть сополимером из множества типов гидроксикислот, и он предпочтительно является полимером, состоящим не более чем из 2 типов гидроксикислот. Конкретные предпочтительные примеры поли(гидроксикислот) включают полигликолевую кислоту, полимолочную кислоту, поли(2-гидроксимасляную кислоту), поли(2-гидроксивалериановую кислоту), поли(2-гидроксикапроновую кислоту), поли(2-гидроксикаприновую кислоту) и поли(яблочную кислоту); производные и сополимеры этих макромолекулярных соединений; среди которых более предпочтительны сополимеры полимолочной кислоты, сополимеры полигликолевой кислоты и сополимеры полимолочной и полигликолевой кислот. Кроме того, в случаях, когда поли(гидроксикислота) представляет собой сополимер полимолочной и полигликолевой кислот, соотношение молочной и гликолевой кислот (мольные %) в составе сополимера полимолочной и полигликолевой кислот не является ограниченным, если достигается цель настоящего изобретения, как описано выше, и предпочтительное соотношение составляет от 100:0 до 30:70, более предпочтительно от 60:40 до 40:60.
Гидрофильный сегмент амфифильного полимера не является ограниченным и предпочтительно представляет собой биологически совместимый полимер, как в случае гидрофобного сегмента. Кроме того, с целью придания персистентной адъювантной способности для адъювантной микрочастицы, состоящей из амфифильного полимера(ов), сегмент предпочтительно представляет собой устойчивый полимер, который не поддается легкой деструкции в живом организме или в клетке млекопитающего или птицы. Конкретные примеры биологически совместимого и устойчивого полимера включают полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, полиэтиленимин, полиакриловую кислоту, полиметакриловую кислоту, поли-1,3-диоксан, полимер 2-метакрилоилоксиэтилена с фосфорилхолином, поли-1,3,6-триоксан, полиаминовую кислоту и устойчивые полисахариды (например, целлюлозу, хитин, хитозан, геллановую смолу, альгиновую кислоту, гиалуроновую кислоту, пуллулан и декстран). В случаях, когда гидрофильный сегмент представляет собой полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, полиэтиленимин, полиакриловую кислоту, полиметакриловую кислоту, поли-1,3-диоксан, полимер 2-метакрилоилоксиэтилена с фосфорилхолином, поли-1,3,6-триоксан или полиаминовую кислоту, амфифильный полимер предпочтительно представляет собой линейный блок-сополимер, который имеет как гидрофильный, так и гидрофобный сегменты, и в случаях, когда гидрофильный сегмент представляет собой полисахарид, амфифильный полимер предпочтительно представляет собой привитый полимер, имеющий множество гидрофобных сегментов, присоединенных с основной гидрофильной цепью сегмента. Кроме того, гидрофильный сегмент амфифильного полимера предпочтительно представляет собой полиэтиленгликоль или устойчивый полисахарид, при этом более предпочтительным полисахаридом является декстран.
Амфифильный полимер, имеющий гидрофобный сегмент(ы), состоящий(е) из поли(гидроксикислоты), и гидрофильный сегмент(ы), предпочтительно не смешивается с водой как целый полимер, из-за способности иммуногенной композиции инкапсулировать антиген и из-за персистентности при введении в живой организм.
Средняя молекулярная масса гидрофильного сегмента амфифильного полимера не ограничена, и в случае блок-сополимера, где гидрофильный сегмент(ы) и гидрофобный сегмент(ы) линейно связаны друг с другом, средняя молекулярная масса предпочтительно составляет от 1000 до 50000, более предпочтительно от 2000 до 15000. Термин "блок", используемый в данном описании, означает часть в молекуле полимера, где такая часть состоит из не менее 5 мономерных звеньев и отличается от другой смежной части(ей) по химической структуре или конфигурации. Полимер, состоящий, по меньшей мере, из двух блоков, линейно связанных друг с другом, называют блок-сополимером. Каждый блок, непосредственно составляющий блок-сополимер, может быть случайным, периодическим или градиентным полимером, состоящим из не менее 2 типов мономерных звеньев. В настоящем изобретении блок-сополимер предпочтительно является таким, в котором предпочтительно присоединены одно звено полимера, образующего гидрофильный сегмент, и одно звено поли(гидроксикислоты).
В случае привитого полимера, имеющего гидрофобный сегмент(ы), присоединенный(ые) к основной цепи гидрофильного сегмента, средняя молекулярная масса гидрофильного сегмента предпочтительно составляет от 1000 до 100 000, более предпочтительно от 2000 до 50000, еще более предпочтительно от 10000 до 40000. Число присоединенных цепей предпочтительно составляет от 2 до 50. Число присоединенных цепей может быть вычислено на основе отношения между основной цепью гидрофильного сегмента и основной цепью гидрофобного сегмента, и средней молекулярной массы гидрофобного сегмента, полученной при помощи 1H-ЯМР измерения, и средней молекулярной массы основной цепи используемого гидрофильного сегмента.
Предпочтительное соотношение средних молекулярных масс гидрофобного сегмента и гидрофильного сегмента варьирует в зависимости от амфифильного полимера и, в случае блок-сополимера, где гидрофобный сегмент(ы) и гидрофильный сегмент(ы) линейно связаны друг с другом, среднее соотношение молекулярной массы между гидрофильным сегментом и гидрофобным сегментом составляет предпочтительно 1:1 или более, более предпочтительно 1:2 или более, еще более предпочтительно 1:4 или более, особенно предпочтительно 1:4 или более; и 1:25 или менее.
В случае привитого полимера, имеющего множество гидрофобных сегментов, присоединенных к основной цепи гидрофильного сегмента, среднее соотношение молекулярной массы между основной цепью гидрофильного сегмента и всеми присоединенными гидрофобными сегментами, предпочтительно составляет 1:3 или более, и средняя молекулярная масса каждой присоединенной цепи составляет от 2500 до 40000. Более предпочтительно, когда среднее соотношение всех молекулярных масс составляет 1:5 или более, и средняя молекулярная масса каждой присоединенной цепи составляет от 5000 до 40000.
Следует отметить, что вышеуказанная средняя молекулярная масса представляет собой значение средней молекулярной массы, если не указано иное. Показатель средней молекулярной массы представляет собой значение средней молекулярной массы, вычисленной без учета молекулярного размера, и значение средней молекулярной массы амфифильного полимера и полимеров, составляющих гидрофильный сегмент(ы) амфифильного полимера, могут быть вычислены как молекулярные массы на основе значений молекулярных масс полистирола или пуллулана, путем измерения гельпроникающей хроматографией (GPC). Кроме того, средняя молекулярная масса поли(гидроксикислот) может быть вычислена с помощью ядерного магнитного резонанса (ЯМР), на основе соотношения площадей под пиками для концевых остатков и площадей под пиками для других остатков.
Амфифильный полимер, используемый в настоящем изобретении, может быть синтезирован известным способом, и примеры такого способа включают способ, где полимер поли(гидроксикислоты) добавляют к полимеру, который будет использоваться в качестве гидрофильного сегмента, и реакцию конденсации полученной смеси, для получения амфифильного полимера; способ, где активированные мономеры гидроксикислот добавляют к полимеру, который будет использоваться в качестве гидрофильного сегмента, и проводят реакцию полимеризации полученной смеси, для получения амфифильного полимера; и способ, где, наоборот, мономеры, составляющие гидрофильный сегмент, добавляют к гидрофобному сегменту, который является поли(гидроксикислотой), и проводят реакцию полимеризации полученной смеси.
Например, амфифильный полимер, состоящий из полиэтиленгликоля и поли(гидроксикислоты), может быть получен способом, в котором активизированные мономеры гидроксикислоты добавляют к полиэтиленгликолю в присутствии оловянного катализатора, чтобы осуществить реакцию полимеризации для введения поли(гидроксикислоты), с получением, таким образом, амфифильного блок-сополимера (Journal of Controlled Release, 71, p. 203-211 (2001)).
Кроме того, амфифильный полимер привитого типа, состоящий из полисахарида и присоединенной цепи(ей) поли(гидроксикислоты), может быть получен, например, как описано в (1), (2) или (3) ниже:
(1) способом, в котором активизированные мономеры гидроксикислоты добавляют к полисахариду в присутствии оловянного катализатора, чтобы осуществить реакцию полимеризации для введения поли(гидроксикислоты), с получением, таким образом, амфифильного полимера привитого типа (Macromolecules, 31, p. 1032-1039 (1998));
(2) способом, в котором незащищенные гидроксильные группы в части полисахарида, у которого большинство его гидроксильных групп защищены заместителями, активируют основанием, и добавляют активированные мономеры гидроксикислоты для включения присоединяемой цепи(ей), состоящих из поли(гидроксикислоты), с последующим удалением защитных групп, получая, таким образом, амфифильный полимер привитого типа (Polymer, 44, p. 3927-3933, (2003)); и
(3) способом, в котором реакцию конденсации сополимера поли(гидроксикислоты) с полисахаридом осуществляют, используя дегидрирующий агент и/или агент, формирующий функциональные группы, с получением амфифильного полимера привитого типа (Macromolecules, 33, p. 3680-3685 (2000)).
Адъювантная микрочастица описана ниже. Адъювантная микрочастица представляет собой микрочастицу, имеющую адъювантную способность, и адъювантная способность означает способность, с которой может быть вызван иммунный ответ на введение антигена в живой организм на более высоком уровне, чем в случае введения только одного антигена. Кроме того, в настоящем изобретении понимается, что адъювантная микрочастица представляет собой микрочастицу, состоящую из амфифильного полимера(ов) и антигена(ов), инкапсулированного(ых) в адъювантную микрочастицу, с образованием микрочастицы комплекса адъювант-антиген, где такой комплекс содержит микрочастицу в качестве активного ингредиента иммуногенной композиции настоящего изобретения.
Структура адъювантной микрочастицы не является ограниченной, но структура, где гидрофильный сегмент(ы) амфифильного полимера(ов) включен(ы) в адъювантную микрочастицу и гидрофобный сегмент(ы) амфифильного полимера(ов) представлен(ы) в виде внешнего слоя, предпочтительна с точки зрения сохранения стабильности инкапсулированного антигена(ов).
Тип антигена, инкапсулированного в адъювантную микрочастицу, не является ограниченным, и он может быть пептидом, белком, гликопротеином, гликолипидом, липидом, углеводом, нуклеиновой кислотой или полисахаридом; или вирусом, бактериальной клеткой, аллергенным веществом, тканью или клеткой, включающих их. Конкретные примеры антигена включают антигены, полученные из пыльцы, антигены, полученные из вируса гепатита A, антигены, полученные из вируса гепатита B, антигены, полученные из вируса гепатита C, антигены, полученные из вируса гепатита D, антигены, полученные из вируса гепатита C, антигены, полученные из вируса гепатита E, антигены, полученные из вируса гепатита F, антигены, полученные из вируса ВИЧ, антигены, полученные из вируса гриппа, антигены, полученные из вируса герпеса (HSV-1, HSV-2), антигены, полученные из возбудителя сибирской язвы, антигены, полученные из хламидий, антигены, полученные из пневмококков, антигены, полученные из вируса японского энцефалита, антигены, полученные из вируса кори, краснухи, антигены, полученные из Clostridium tetani, антигены, полученные из вируса ветрянки, антигены, полученные из вируса атипичной пневмонии (SARS), антигены, полученные из вируса Эпштейна-Барра (EB), антигены, полученные из вируса папилломы, антигены, полученные из Helicobacter pylori, антигены, полученные из вируса бешенства, антигены, полученные из вируса Западного Нила, антигены, полученные из хантавируса, антигены, полученные из Streptococcus, антигены, полученные из Staphylococcus, антигены, полученные из Bordetella pertussis, антигены, полученные из Mycobacterium tuberculosis, антигены, полученные из Plasmodium, антигены, полученные из полиовируса, антигены, полученные из различных зоонозных инфекций, антигены рака и антигены, полученные из различных пищевых аллергенов.
Для инкапсулированного антигена нет требования быть единственным антигеном. В свете применения настоящего изобретения, иммунные ответы могут быть индуцированы против раковых клеток, бактерий, вирусов или подобных, которые состоят из множества элементов. В таких случаях антиген может быть множеством типов белков или подобного, которые могут вызвать иммунные ответы, или может быть смесью веществ, типы которых не могут быть идентифицированы. Кроме того, включение множества типов антигенов для успешной индукции иммунных ответов против множества типов антигенов, является одной из форм использования иммуногенной композиции настоящего изобретения. В адъювантную микрочастицу может быть инкапсулировано предпочтительно более 3 типов антигенов, более предпочтительно один тип антигена.
Микрочастицы комплекса адъювант-антиген настоящего изобретения могут изменять способность удерживания включенного антигена в зависимости от типа(ов) и способа(ов) получения полимера(ов), составляющего(их) адъювантную микрочастицу. Возможные примеры механизма, за счет которого придается иммуногенность микрочастице комплекса адъювант-антиген по настоящему изобретению, включают множество процессов, таких как процесс, где антиген, высвобожденный из адъювантной микрочастицы, распознается иммунокомпетентными клетками, и процесс, где сама адъювантная микрочастица распознается иммунокомпетентными клетками. Также может быть получен превосходный эффект за счет синергического действия этих процессов.
Тип иммунного ответа, индуцируемого процессом, в котором микрочастицы комплекса адъювант-антиген заставляют иммунокомпетентные клетки распознавать антиген, варьирует в зависимости от типа такого процесса, и предпочтительный процесс может быть выбран в зависимости от типа иммунного ответа, который будет индуцирован и от участка введения. Таким образом, в предпочтительном режиме использования, антиген необязательно должен быть высвобожден из микрочастицы комплекса адъювант-антиген, и оптимальный режим, в котором достигается оптимальная целевая иммуногенность, зависит от антигена и типа иммунного ответа, который будет активирован. Однако в случаях, когда антиген чрезвычайно быстро высвобождается из микрочастицы комплекса адъювант-антиген, долгосрочное непрерывное иммуностимулирующее действие, которое является превосходной особенностью настоящего изобретения, не может быть получено, и поэтому предпочтительно, когда через одну неделю после введения не менее 10% антигена в микрочастице комплекса адъювант-антиген сохраняется в живом организме в виде комплекса, и более предпочтительно, когда не менее 50% антигена остается инкапсулированным через одну неделю после введения. Эти режимы высвобождения могут быть подтверждены оценкой in vitro, имитирующей условия окружения in vivo.
Микрочастица комплекса адъювант-антиген обеспечивает хороший эффект даже при таком состоянии частиц, где комплексы ассоциированы друг с другом. Термин "ассоциация", как используется в данном описании, означает, что две или более частиц связаны друг с другом за счет силы взаимодействия между частицами или за счет другого вещества, образуя агрегат. Сила взаимодействия между частицами не является ограниченной, и примеры включают гидрофобное взаимодействие, водородную связь и силу Ван-дер-Ваальса. Ассоциация не ограничена состоянием, когда микрочастицы находятся в контакте друг с другом, и вещество, обладающее аффинностью в отношении микрочастиц, может находиться между микрочастицами, или микрочастицы могут быть диспергированы в матрице. В качестве вещества, обладающего аффинностью в отношении микрочастиц или матрицы, предпочтительным является полимер, и наиболее предпочтительным является амфифильный полимер, гидрофобная часть которого представляет собой поли(гидроксикислоту), и который имеет такую же структуру, как и адъювантная микрочастица. Конкретные примеры включают амфифильные полимеры, где каждый состоит из основной полисахаридной цепи и присоединенной цепи(ей) поли(гидроксикислоты), блок-сополимеры, где каждый состоит из полиэтиленгликоля и поли(гидроксикислоты), и поли(гидроксикислоту).
Ассоциация микрочастиц комплекса адъювант-антиген может быть представлена состоянием, когда высвобождение происходит после применения ассоциата, или состоянием, когда высвобождение не происходит сразу после применения. Следует отметить, что даже в случаях, когда структура частиц, состоящих из связанных вместе микрочастиц комплекса адъювант-антиген, соответствует состоянию, у которого не может быть известно присутствие ассоциации комплекса, частица расценивается как имеющая сформированный ассоциат комплексов, если способ получения частиц включает стадию ассоциации комплексов.
Средний размер микрочастиц комплекса адъювант-антиген или частиц, образованных ассоциацией комплексов, составляет предпочтительно от 0,1 до 50 мкм, более предпочтительно от 0,1 до 10 мкм. В частности, средний размер микрочастиц комплекса адъювант-антиген составляет предпочтительно от 0,1 до 1 мкм, более предпочтительно от 0,1 до 0,5 мкм, и средний размер ассоциатов микрочастиц комплекса адъювант-антиген составляет предпочтительно от 0,1 до 50 мкм, более предпочтительно от 0,1 до 10 мкм, еще более предпочтительно от 1 до 10 мкм. Средний размер микрочастиц комплекса адъювант-антиген или частиц, образованных ассоциацией комплексов, может быть непосредственно измерен путем анализа изображения, с использованием сканирующего электронного микроскопа (SEM, например, модель S-4800, выпускаемая Hitachi, Ltd).
Микрочастицы комплекса адъювант-антиген или частицы, образованные ассоциацией комплексов, имеют эффект усиления иммуногенности инкапсулированного антигена. Авторы настоящего изобретения обнаружили, что иммуногенность инкапсулированного антигена может быть дополнительно увеличена за счет инкапсулирования поверхностно-активного вещества, в качестве активного ингредиента, в иммуногенную микрочастицу, состоящую из микрочастиц комплекса адъювант-антиген или частиц, образованных ассоциацией комплексов (далее называемой “иммуногенной микрочастицей”). Таким образом, иммуногенная микрочастица, в качестве активного ингредиента иммуногенной композиции настоящего изобретения, включает поверхностно-активное вещество, инкапсулированное в нее, в качестве составляющего.
Поверхностно-активное вещество, используемое в настоящем изобретении, не является ограниченным, и конкретные примеры поверхностно-активных веществ включают полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 65, полисорбат 80, полисорбат 85, моноолеат глицерина, моноолеат сорбитана, моноолеат полиэтиленгликоля, моностеарат этиленгликоля, моностеарат глицерина, моностеарат сорбитана, моностеарат пропиленгликоля, моностеарат полиэтиленгликоля, монопальмитат сорбитана, мономиристат глицерина, монолаурат сорбитана, монолаурат полиэтиленгликоля, триолеат сорбитана, тристеарат сорбитана, полиоксиэтилен гидрогенизированного касторового масла, сополимеры пропиленгликоля и полиоксиэтилена, полиэтиленгликоль, поливиниловый спирт, алкиловый эфир полиоксиэтилена, диэтаноламид жирной кислоты (например, диэтаноламид стеариновый кислоты, диэтаноламид олеиновой кислоты и диэтаноламид лауриновой кислоты), лецитин, натриевую соль жирной кислоты (например, стеарат натрия, олеат натрия и лаурат натрия), алкилсульфат натрия, октилфениловый эфир полиоксиэтилена и алкилгликозид. Поверхностно-активное вещество, используемое в настоящем изобретении, может быть или одного типа, или двух и более типов.
Поверхностно-активное вещество, используемое в настоящем изобретении, предпочтительно является одобренным для использования в качестве фармацевтической добавки. Конкретные примеры поверхностно-активных веществ, одобренных в качестве фармацевтических добавок, включают полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 65, полисорбат 80, полисорбат 85, моноолеат глицерина, моноолеат сорбитана, моноолеат полиэтиленгликоля, моностеарат этиленгликоля, моностеарат глицерина, моностеарат сорбитана, моностеарат пропиленгликоля, моностеарат полиэтиленгликоля, монопальмитат сорбитана, мономиристат глицерина, монолаурат сорбитана, монолаурат полиэтиленгликоля, триолеат сорбитана, тристеарат сорбитана, полиоксиэтилен гидрогенизированного касторового масла, сополимеры пропиленгликоля и полиоксиэтилена, полиэтиленгликоль, поливиниловый спирт, алкиловый эфир полиоксиэтилена, диэтаноламид жирной кислоты (например, диэтаноламид стеариновый кислоты, диэтаноламид олеиновой кислоты и диэтаноламид лауриновой кислоты), лецитин, натриевую соль жирной кислоты (например, стеарат натрия, олеат натрия и лаурат натрия) и алкилсульфат натрия.
Поверхностно-активное вещество, используемое в настоящем изобретении, является предпочтительно неионогенным поверхностно-активным веществом. Конкретные примеры неионогенного поверхностно-активного вещества включают полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 65, полисорбат 80, полисорбат 85, моноолеат глицерина, моноолеат сорбитана, моноолеат полиэтиленгликоля, моностеарат этиленгликоля, моностеарат глицерина, моностеарат сорбитана, моностеарат пропиленгликоля, моностеарат полиэтиленгликоля, монопальмитат сорбитана, мономиристат глицерина, монолаурат сорбитана, монолаурат полиэтиленгликоля, триолеат сорбитана, тристеарат сорбитана, полиоксиэтилен гидрогенизированного касторового масла, сополимеры пропиленгликоля и полиоксиэтилена, полиэтиленгликоль, поливиниловый спирт, алкиловый эфир полиоксиэтилена и диэтаноламид жирной кислоты (например, диэтаноламид стеариновый кислоты, диэтаноламид олеиновой кислоты и диэтаноламид лауриновой кислоты).
Среди поверхностно-активных веществ предпочтительно используются поверхностно-активные вещества, включающие структуру эфира жирной кислоты. Конкретные примеры структуры эфира жирной кислоты включают эфир лауриновой кислоты, эфир пальмитиновой кислоты, эфир стеариновой кислоты, эфир олеиновой кислоты и гидрогенизированное касторовое масло, и предпочтительные примеры структуры эфира жирной кислоты включают эфир лауриновой кислоты, эфир олеиновой кислоты и гидрогенизированное касторовое масло. Конкретные примеры поверхностно-активных веществ, включающих структуру эфира жирной кислоты, включают полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 65, полисорбат 80, полисорбат 85, моноолеат глицерина, моноолеат сорбитана, моноолеат полиэтиленгликоля, моностеарат этиленгликоля, моностеарат глицерина, моностеарат сорбитана, моностеарат пропиленгликоля, моностеарат полиэтиленгликоля, монопальмитат сорбитана, мономиристат глицерина, монолаурат сорбитана, монолаурат полиэтиленгликоля, триолеат сорбитана, тристеарат сорбитана и гидрогени