Противосудорожное и транквилизирующее средство
Иллюстрации
Показать всеИзобретение относится к фармацевтике. Описано противосудорожное и транквилизированное средство с общей формулой:
где R=CH2CH2NH2 HBr (производное 1);
R=CH2CH2CH2NH2 HBr (производное 2);
R=CH2(CH2)4NH2 HBr (производное 3);
R=p-CH2NEt2 HCl (производное 4);
R=m-CH2NEt2 HCl (производное 5).
Изобретение обеспечивает значительное сокращение времени наступления фармакологического эффекта, а также снижение отрицательных побочных явлений. 7 табл., 9 пр.
Реферат
Изобретение относится к области медицины и может быть использовано для лечения судорожных состояний различной этиологии, а также состояний психомоторного возбуждения.
Известно использование феназепама в качестве транквилизирующего и противосудорожного средства (Машковский М.Д. Лекарственные средства. 16 изд. - М.: Новая Волна, 2012, с. 79-80). Феназепам используется, в основном, перорально в виде таблеток для лечения вегетативных дисфункций, алкоголизма, навязчивых состояний и психозов.
Недостатком пероральной формы феназепама является весьма медленное наступление фармакологического эффекта, что ограничивает возможность ее использования для терапий острых состояний. Кроме того, пероральное использование препарата невозможно при судорогах, спазмах, бессознательном состоянии и т.п.
Низкая растворимость феназепама в воде не позволяет изготовить инъекционную лекарственную форму в виде водного раствора. Известен раствор феназепама 0,05-0,15% для инъекций, в состав которого входит глицерин (5-15%), ТВИН-80 (2-10%), поливинилпирролидон (0,5-1,2%, натрий пиросернистый (0,1-0,3%), щелочь до рН 6.0-7.5 и вода до 100% (RU 2224522, опубл. 27.02.2004). В медицинской практике для инъекций обычно используется 0,1%-ный раствор феназепама, но также выпускается 0,3% и 3%-ный раствор феназепама для инъекций.
Недостатками лекарственного средства RU 2224522, выбранного в качестве прототипа настоящего изобретения, являются местные реакции при внутримышечном введении: флебит или венозный тромбоз, краснота, припухлость или боль в месте введения (www.vidal.ru/drugs/phenazepam_23774), а также недостаточно быстрое наступление фармакологического эффекта.
Задачей настоящего изобретения является сокращение времени достижения фармакологического эффекта, а также снижение отрицательных побочных эффектов в условиях использования внутримышечного пути введения.
Согласно изобретению заявляемое вещество представляет собой производное 3-гидроксифеназепама с общей формулой:
где R=CH2CH2NH2 HBr (производное 1);
CH2CH2CH2NH2 HBr (производное 2);
CH2(CH2)4NH2 HBr (производное 3);
(производное 4);
(производное 5).
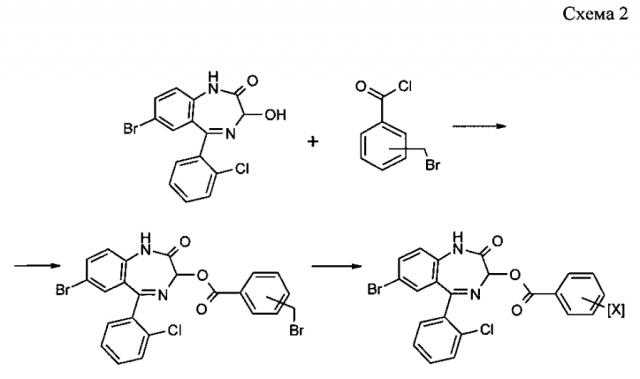
Производные 1-3 получают по схеме 1, а производные 4 и 5 - по схеме 2.
Схема 1
Для производного 1 n=2; для производного 2 n=3; для производного 3 n=5.
Для получения производного 1 в трехгорлой колбе растворили 1.46 г (4 ммоль) 3-гидроксифеназепама в 40 мл дихлорметана, охладили до 0°С и затем добавили 0.98 г (4 ммоль) N-бензилоксикарбонил-аланина и 0.91 г (0.0044 моль) дициклогексилкарбодиимида в 10 мл дихлорметана, а также 0,06 г (0,4 ммоль) 4-пирролидинопиридина. Реакционную смесь оставляли на ночь, после чего осадок отфильтровали и промыли горячим дихлорметаном. Объединенный фильтрат промыли последовательно водным раствором NaHCO3, водной уксусной кислотой 5% и водой, органический слой отделили и растворитель упарили. К сырому продукту добавили 12 мл 24% раствора HBr в уксусной кислоте и перемешивали до полного растворения. После этого к раствору добавили 40 мл абсолютного эфира, перемешивали и декантировали эфир, а осадок промывали 2 раза эфиром и выдерживали под слоем эфира 12 ч. После кристаллизации осадок отфильтровали, сушили и перекристаллизовали из смеси спирт-эфир. Получили 1,05 г заявленного вещества в виде практически бесцветных кристаллов с Тпл. 217-219°С.
Производное 2 получали аналогично из 3-гидроксифеназепама и N-бензилоксикарбонил-γ-аминомасляной кислоты, а производное 3 - из 3-гидроксифеназепама и N-бензилоксикарбонил-ε-аминокапроновой кислоты. Характеристики заявляемых веществ представлены в таблице 1.
Для производного 4 X=p-CH2NEt2 HCl; для производного 5 Х=m-CH2NEt2 HCl.
Для получения производного 4 к раствору 7.3 г (0.02 моль) 3-гидроксифеназепама и 2.95 г (0.024 моль) 4-диметиламинопиридина в 100 мл сухого тетрагидрофурана (ТГФ) при комнатной температуре добавили раствор 5.6 г (0.024 моль) хлорангидрида 4-бромметилбензойной кислоты в 15 мл ТГФ. Смесь перемешивали 5 часов и оставляли на ночь. Затем осадок отфильтровали, промыли 20 мл ТГФ, фильтрат упарили в вакууме и оставили на сутки при комнатной температуре. К полученному веществу добавили 30 мл сухого эфира, осадок отфильтровали и промыли сухим эфиром.
Полученный продукт растворили в 110 мл ТГФ и к этому раствору прибавили 9.0 мл (0.088 моль) диэтиламина. Перемешивали реакционную массу 20 ч при 50°С, после чего охладили смесь, отфильтровали и промыли 10 мл ТГФ. Объединенный фильтрат упарили в вакууме, а остаток растворили в этилацетате, раствор промыли водой и экстрагировали дважды 0.7%-ной HCl. Кислый водный раствор промыли этилацетатом и подщелочили водным аммиаком 25%. Выделившийся продукт экстрагировали эфиром, осушили над безводным поташом и перевели в гидрохлорид путем насыщения эфирного раствора безводным HCl. Полученный продукт отфильтровали и перекристаллизовали из водного спирта. Получили 2,6 г производного 4 в виде белого кристаллического вещества с Тпл 253-255°С.
Производное 5 получали аналогично из 3-гидроксифеназепама и хлорангидрида 3-бромметилбензойной кислоты.
Характеристики заявляемых веществ представлены в таблице 1.
Производные 1-5 обладают хорошей растворимостью в воде (свыше 1%), в отличие от феназепама, растворимость которого в воде при комнатной температуре составляет 0,0016%.
Структуру заявляемых соединений подтверждают их спектры протонного магнитного резонанса:
Спектр ЯМР 1Н соединения 1, δ, м.д.: 2.95 т (2Н, СН2СО), 3.15 м (2Н, CH2N), 5.84 с (1Н, Н3), 7.10 с (1H, Н6), 7.30 д (1H, Н9), 7.45-7.57 м (4Н, Н3′+Н4′+Н5′+Н6′), 7.68 д (1Н, Н8), 7.98 шир. с (3Н, NH3 +), 11.25 уш. с (1H, NH1).
Спектр ЯМР 1H соединения 2, δ, м.д.: 1.94 м (2Н, СН2), 2.66 т (2Н, СН2СО), 2.93 м (2Н, CH2N), 5.82 с (1Н, Н3), 7.10 с (1Н, Н6), 7.28 д (1Н, Н9), 7.49-7.68 м (4Н, Н3′+Н4′+Н5′+Н6′), 7.72 д (1Н, Н8), 7.81 шир. с (3Н, NH3 +), 11.22 уш. с (1Н, NH1).
Спектр ЯМР 1Н соединения 3, δ, м.д.: 1.46 м (2Н, СН2), 1.65 м (2Н, СН2), 1.71 м (2Н. СН2), 2.54 т (2Н, СН2СО), 2.80 м (2Н, CH2N), 5.77 с (1H, Н3), 7.08 с (1Н, Н6), 7.28 д (1Н, Н9), 7.45-7.57 м (4Н, Н3′+Н4′+Н5′+Н6′), 7.67 д (1Н, Н8), 7.81 шир. с (3Н, NH3 +), 11.15 уш. с (1H, NH1).
Спектр ЯМР 1Н соединения 4, δ, м.д.: 1.31 т (6Н, 2СН3), 3.08 м (4Н, 2СН2), 4.40 с (2Н, СН2-Ar), 6.06 с (1Н, Н3), 7.13 с (1H, Н6), 7.33 д (1H, Н9), 7.45-7.65 м (4Н, Н3′+Н4′+Н5′+Н6′), 7.73 д (1Н, Н8), 7.93 д (2Н, Нм,м′), 8.19 д (2Н, Но,о′), 11.33 уш. с (1Н, NH1), 11.40 уш. с (1Н, NH+).
Спектр ЯМР 1Н соединения 5, δ, м.д.: 1.30 т (6Н, 2СН3), 3.08 м (4Н, 2СН2), 4.43 с (2Н, СН2-Ar), 6.08 с (1H, Н3), 7.14 с (1H, Н6), 7.34 д (1Н, Н9), 7.46-7.66 м (5Н, Н3′+Н4′+Н5′+Н6′+Нм), 7.74 д (1H, Н8), 8.20 т (2Н, Но,п), 8.32 с (1Н, Но), 11.12 уш. c (1H, NH1), 11.36 c (1H, NH+).
Заявителю не известны какие-либо источники информации, в которых бы содержались сведения об идентичных технических решениях, что позволяет сделать вывод о соответствии заявленного изобретения условию патентоспособности «Новизна».
Как показывают приведенные ниже примеры, заявленное вещество обеспечивает важный технический результат, состоящий в значительном сокращении времени наступления фармакологического эффекта, а также существенном снижении побочных явлений.
Заявителем не выявлены какие-либо источники информации, содержащие сведения о влиянии признаков изобретения на достигаемый вследствие их реализации технический результат. Это, по мнению заявителя, свидетельствует о соответствии данного технического решения условию патентоспособности «Изобретательский уровень».
Реализация изобретения поясняется примерами.
Пример 1. Исследование противосудорожного действия заявляемого вещества на моделях судорог осуществлялось на белых нелинейных крысах массой 180-200 г, возраста 13-14 недель, с применением общепринятых в фармакологической практике агентов, вызывающих судороги (коразол, тиосемикарбазид, стрихнин), а также при максимальном электрошоке (МЭШ). Каждая экспериментальная группа включала по 10 животных.
Прототип и заявляемое вещество вводили внутримышечно за 10 мин перед введением конвульсантов, в водном растворе объемом 0,2 мл. Для сравнительной оценки противосудорожной активности веществ были определены эффективные дозы (ЕД50), вызывающие двукратное снижение продолжительности судорог на данных моделях.
Лечебное действие веществ при отравлении судорожным ядом - стрихнином - оценивали по выживаемости крыс. Животным подкожно вводили летальную дозу стрихнина, а через 1 мин внутримышечно вводили препарат (феназепам или заявляемое вещество в дозе, соответствующей 4 ЕД50, на модели стрихниновых судорог, см. таблицу 2). Подсчет выживших животных осуществляли через 4 ч после введения стрихнина. Результаты сравнивали с группой контрольных крыс, не получавших лечения.
Результаты исследования противосудорожной активности веществ приведены в таблице 2, а по защитному действию при отравлении стрихнином - в таблице 3.
Таким образом, наиболее активным является производное №2 заявляемого вещества, которое по уровню противосудорожной активности превосходит прототип в 3.5-5.5 раз.
Таким образом, по уровню выживаемости животных можно сделать вывод, что при остром отравлении стрихнином заявленное вещество, особенно производное 2, более эффективно, чем прототип.
Пример 2. Определение сроков наступления эффекта и продолжительности противосудорожного действия веществ
В эксперименте использовали 5 групп крыс, по 10 животных в каждой группе. В первую группу входили контрольные животные, не получавшие препаратов. Группам 2-5 вводили вещества внутримышечно в дозе, соответствующей 4 ЕД50, на модели МЭШ (см. таблицу 2). Начало действия препаратов фиксировали по снижению частоты и длительности судорожных корчей по сравнению с контрольной группой, завершение эффекта - по отсутствию разницы с контролем. Латентный период определяли как разницу во времени между моментом введения препарата и началом его действия, общую продолжительность действия - как разницу между началом и окончанием действия препарата. Результаты представлены в таблице 4.
Как видно из таблицы 4, заявляемое вещество оказывает значительно более быстрое действие, чем прототип. Таким образом, заявляемое вещество за счет быстродействия имеет преимущество перед прототипом в случае оказания экстренной помощи при судорожных состояниях и состояниях возбуждения.
Другое преимущество заявляемого вещества состоит в большей продолжительности его противосудорожного действия (особенно у производного №2) по сравнению с прототипом, что обеспечивает более долговременный терапевтический эффект при однократной инъекции.
Пример 3. Изучение транквилизирующего действия веществ
Исследование проводили на нелинейных белых крысах по методике «Открытое поле» - оценка поведения крыс в условиях свободного перемещения в стандартной клетке. В эксперименте использовано 7 групп по 10 животных, отобранных по принципу рандомизации:
группа 1 - сиднокарб 1 мг/кг;
группа 2 - сиднокарб+феназепам, 1 мг/кг;
группа 3 - сиднокарб+производное №1,1 мг/кг;
группа 4 - сиднокарб+производное №3, 1 мг/кг;
группа 5 - сиднокарб+производное №4, 1 мг/кг;
группа 6 - сиднокарб+производное №5, 1 мг/кг;
группа 7 - контроль (интактные животные).
Первым 6 группам вводили перорально препарат, возбуждающий психомоторику (сиднокарб). Через 15 мин соответствующим группам животных внутримышечно вводили исследуемые препараты (феназепам и заявляемые вещества), а группе контроля - дистиллированную воду. Через 10 мин после введения препаратов крыс помещали в камеру «Открытое поле» и фиксировали число актов двигательной активности животных с помощью автоматического регистратора, период регистрации охватывал 2 мин. Результаты представлены в таблице 5.
Таким образом, заявляемое вещество достоверно снижает психомоторную двигательную активность, вызванную сиднокарбом. Наиболее выраженным транквилизирующим действием обладает производное №5, которое значительно превосходит прототип в условиях данной модели исследования. Помимо снижения числа двигательных актов производное №5 заметно сильнее, чем прототип, уменьшает относительное время пребывания животных на периферии поля, что свидетельствует о снижении чувства страха и тревожности (анксиолитическое действие).
Пример 8. Изучение острой токсичности и терапевтической широты заявленного вещества в сравнении с прототипом при внутримышечном введении крысам-самцам
Для этого исследуемые вещества в дозах, кратных 50 мг, вводили соответствующим группам животных. Число животных в каждой группе составляло 5 особей. Заявляемые вещества и феназепам вводили крысам в виде водных суспензий с добавкой 5% ТВИН-80. Количество павших животных оценивали на третьи сутки после введения веществ. На основе этих данных рассчитывали среднесмертельную дозу ЛД-50, вызывающую гибель 50% животных. С учетом результатов по противосудорожной активности (таблица 2) рассчитывали терапевтический индекс вещества (К) по формуле:
К=ЛД50/ЕД50,
где ЕД50 - эффективная доза, вызывающая двукратное снижение частоты и продолжительности судорог, вызванных стрихнином (см. таблицу 2).
Результаты исследования приведены в таблице 6.
Полученные результаты свидетельствуют, что острая токсичность заявляемого вещества сопоставима с прототипом, при этом по терапевтической широте противосудорожного действия производные №2, 3 и 5 превосходят прототип.
Пример 9. Исследование местного эффекта при внутримышечном введении
Исследование проводили на нелинейных белых крысах в составе 5 групп по 3 животных. Исследуемые препараты вводили животным внутримышечно в дозе 1 мг/кг в объеме 0,1 мл раствора. Растворы вводимых веществ были подкрашены добавкой метиленового синего.
Через 1 ч после введения препаратов крыс умерщвляли декапитацией. Окрашенные участки ткани объемом 0.2 см вырезали, экстрагировали хлороформом и исследовали методом высокоэффективной жидкостной хроматографии, определяя локальное массовое содержание препарата в зоне введения. Параллельно определяли массовое содержание препарата в мышечной ткани животного вне зоны введения. Полученные результаты представлены в таблице 7.
Таким образом, концентрация феназепама в зоне внутримышечного введения прототипа многократно выше, чем в других участках мышечной ткани. Это связано с низкой растворимостью феназепама, который высаживается из инъекционной смеси в момент введения и сорбируется на тканевых волокнах и других структурах мышечной ткани. Очевидно, этим обусловлено местное раздражающее действие прототипа. Напротив, заявляемое вещество за счет хорошей водорастворимости быстро распределяется из места введения, что обусловливает отсутствие местных раздражающих эффектов.
Противосудорожное и транквилизирующее средство с общей формулой: где R=CH2CH2NH2 HBr (производное 1);CH2CH2CH2NH2 HBr (производное 2);CH2(CH2)4NH2 HBr (производное 3); , при этом у фенильного кольца группа CH2NEt2 находится в пара-положении (производное 4); , при этом у фенильного кольца группа CH2NEt2 находится в мета-положении (производное 5).