Способ оценки терапевтического воздействия эндометриальных стволовых клеток человека на поврежденный эндометрий в эксперименте.
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и может быть использовано для оценки терапевтического воздействия клеточного продукта (КП) на основе эндометриальных стволовых клеток (ЭСК) на поврежденный эндометрий. Для этого используют модельных животных, полученных путем эстрогенизации самок кроликов с последующей имплантацией на париетальную брюшину передней брюшной стенки фрагментов аутологичного эндометрия. При этом проводят послеоперационную профилактическую антибактериальную терапию путем внутримышечного введения цефтриаксона в дозе 50 мг/кг/сут в течение 5 суток. На 7 день после имплантации вводят суспензию КП на основе ЭСК или внутривенно - в ушную вену, или локально - непосредственно в толщу импланта. На 10 день после введения суспензии удаляют все образцы имплантов для гистологического и иммуногистохимического исследования. Способ позволяет оценить эффективность воздействия ЭСК в динамике, в т.ч. при различном пути их введения, при создании адекватных условий модели хронического эндометрита. 6 табл.
Реферат
Изобретение относится к области медицины, а именно к экспериментальной медицине, и может быть использовано для оценки терапевтического воздействия ЭСК человека на поврежденный эндометрий в эксперименте.
В последние годы появились публикации о новом источнике стволовых клеток человека - ЭСК, полученных из менструальной крови. Считается, что ежемесячная регенерация эндометрия в организме женщины обусловлена именно этими клетками.
Показано, что ЭСК менструальной крови обладают всеми свойствами стволовых клеток: могут дифференцироваться в разные ткани, то есть плюрипотентны; экспрессируют специфические маркеры, имеют высокую пролиферативную активность - выше, чем у мезенхимальных клеток пуповинной крови, рассматриваемых как наиболее перспективный источник взрослых стволовых клеток; способны к длительному поддержанию в культуре. При этом получение образца ЭСК технически просто, неинвазивно, существует возможность использовать аутологичные клетки; этические препятствия отсутствуют. Такие клетки уникальны, поскольку в отличие от других типов стволовых клеток не имеют аналогов у животных. Риск развития у реципиентов патологии генетической природы, онкологических осложнений трансплантации, аутоиммунных заболеваний отсутствует.
В настоящее время ЭСК очень востребованы как в работах по изучению биологических свойств мезенхимальных стволовых клеток, так и в качестве терапевтического агента на экспериментальных моделях таких заболеваний, как инфаркт миокарда, болезнь Паркинсона, сахарный диабет, инсульт. Их результаты подтверждают, что ЭСК, выделенные из менструальной крови, являются ценным материалом для клеточной терапии.
Несмотря на активную исследовательскую работу, направленную на изучение терапевтического потенциала клеточных технологий во многих смежных областях, имеются лишь единичные сообщения об использовании стволовых клеток в репродуктивной сфере. Так, доказано, что ЭСК могут использоваться для профилактики невынашивания беременности, связанного с несостоятельностью эндометрия, при этом в эксперименте ЭСК трансплантировались в один из рогов матки псевдобеременной крысы и при одновременной стимуляции прогестероном формировалась децидуальная ткань (патент RU 2515475).
Однако данный способ не позволяет оценить терапевтическое воздействие ЭСК и на сегодняшний день для терапии патологических состояний органов репродуктивной системы ЭСК не использовались ни в клинической практике, ни на экспериментальных животных моделях.
Техническим результатом изобретения является создание способа оценки терапевтического воздействия ЭСК человека на поврежденный эндометрий в эксперименте, позволяющем оценить эффективность введения ЭСК в динамике при различном пути их введения в организм модельных животных, повысить точность способа за счет создания адекватных условий для проведения сравнительной оценки.
Указанный технический результат достигается тем, что в способе оценки терапевтического воздействия эндометриальных стволовых клеток человека на поврежденный эндометрий в эксперименте, заключающемся в том, что модельным животным, полученным путем эстрогенизации самок кроликов с последующей имплантацией на париетальную брюшину передней брюшной стенки фрагментов аутологичного эндометрия, поврежденного согласно заданным параметрам, и послеоперационной профилактической антибактериальной терапией путем внутримышечного введения цефтриаксона в дозе 50 мг/кг/сут в течение 5 суток, на 7 день после имплантации вводят суспензию клеточного продукта на основе ЭСК, внутривенно - в ушную вену или локально - непосредственно в толщу импланта, и на 10 день после введения суспензии клеточного продукта на основе ЭСК удаляют все образцы имплантов для гистологического и иммуногистохимического исследований.
Модель поврежденного эндометрия (патент RU 2 533 739) в данном исследовании формируется на 7 день после аутоимплантации эндометрия и может использоваться как мишень для терапевтического воздействия КП на основе ЭСК при наличии следующих признаков: наличие воспалительных инфильтратов, мононуклеарной инфильтрации, склеротических изменений в сосудах, очагового фиброза стромы, повышение экспрессии факторов CD16 и CD56 в строме и железах эндометрия, признаки деструкции железистого и стромального компонентов эндометрия.
Терапевтическое действие КП на основе ЭСК эндометрия изучалось на экспериментальной модели хронического эндометрита по приведенному ниже протоколу.
Самки кроликов породы Шиншилла (п=36) после предварительной эстрогенизации, имплантации аутологичного эндометрия на брюшину передней брюшной стенки и подтверждения состоятельности модели на 7 день после имплантации были разделены на две группы. Первая группа (группа исследования) (n=20) состояла из модельных животных, которым осуществляли трансплантацию КП на основе ЭСК (подгруппа 1а; n=10) или плацебо (фосфатно-солевой буфер, ФСБ) (подгруппа 1б; n=10) локально в имплант. Во второй группе (группа сравнения) (n=16) трансплантация КП на основе ЭСК (подгруппа 2а; n=8) или плацебо (ФСБ) (подгруппа 2б; n=8) производилось внутривенно.
Трансплантация КП на основе ЭСК или ФСБ производилась животным на 7-й день после имплантации эндометрия сразу после макроскопической оценки состояния имплантов, а также после эксцизионной биопсии одного из фрагментов имплантированного эндометрия (с целью морфологической и иммуногистохимической верификации адекватности модели заболевания эндометрия). Животным 1а подгруппы КП на основе ЭСК (20-40 мкл клеточной суспензии) вводили локально в толщу импланта с использованием гамильтоновского шприца объемом 50 мкл. Животным 1б подгруппы в толщу импланта вводили равный объем ФСБ.
В группе сравнения соответствующие объемы КП на основе ЭСК (подгруппа 2а) и ФСБ (подгруппа 2б) вводились системно - путем инъекции в ушную вену. В послеоперационном периоде всем животным с целью профилактики послеоперационных осложнений назначали антибиотики (цефтриаксон в дозе 50 мг/кг/сут) в течение 5 суток.
Оценка состояния имплантов, забор ткани имплантов для микроскопического и иммуногистохимического исследований производились на 17 день моделирования (10 день после введения КП на основе ЭСК или ФСБ) путем релапаротомии с последующим выведением животного.
С целью оценки терапевтических возможностей КП на основе ЭСК было изучено 152 импланта эндометрия от 36 модельных животных: 82 импланта от 20 модельных животных группы 1 (основной) - которым выполнялось локальное введение КП на основе ЭСК или ФСБ и 70 имплантов от 16 модельных животных группы 2 (группа сравнения), которым введение КП на основе ЭСК или ФСБ производилось внутривенно.
Подготовку препаратов ткани эндометрия для морфологического исследования проводили на основании фиксации в 10% нейтральном формалине не менее 10 суток с последующей проводкой по стандартной схеме с повышением концентрации спиртов. Окраску препаратов осуществляли гематоксилин-эозином и по Ван-Гизон по стандартной методике (Меркулов Г.А. Основы патогистологической техники / М.: Медицина. - 1961. - 187 с.).
Подготовку препаратов ткани эндометрия для иммуногистохимического исследования с окраской на маркеры CD90, CD105, CD16, CD56 проводили с использованием стандартного одноэтапного протокола с демаскировкой антигена высокотемпературной обработкой ткани в 0,01 М цитратном буфере (рН 6,0). Визуализация результатов исследования проводилась при помощи флюоресцентной микроскопии. Для количественной оценки результатов иммуногистохимической реакции получали микрофотографии образцов ткани с помощью системы фиксации микроскопических изображений, состоящей из микроскопа NikonEclipse Е400, цифровой камеры Nikon DXM1200, персонального компьютера на базе IntelPentium 4, программного обеспечения «АСТ-1», версия 2.12. Получили по 5 микрофотографий соответственно 5 случайно выбранным полям зрения на увеличении ×400 для каждого образца. В дальнейшем с помощью программы компьютерного анализа изображений «Морфология 5.0» (ВидеоТест, Россия) оценивали площадь, занятую иммунопозитивными структурами, относили ее к общей площади кадра и рассчитывали показатель относительной площади (%), в котором и выразили экспрессию исследуемых маркеров.
Комплексная характеристика имплантов проводилась на основании визуальной оценки состояния имплантов, данных световой микроскопии и иммуногистохимического исследования.
При интраоперационной макроскопической оценке состояния имплантов модельных животных обеих групп использовались следующие характеристики: форма имплантированного аутологичного эндометрия и его отношение к поверхности париетальной брюшины, наличие, степень выраженности и распространенность гиперемии в зоне имплантации, наличие, характер и локализация спаечного процесса между органами брюшной полости.
У всех модельных животных до введения клеточного продукта на основе ЭСК или ФСБ импланты эндометрия характеризовались умеренно выраженной степенью гиперемии, равномерно распространенной по всей зоне имплантации.
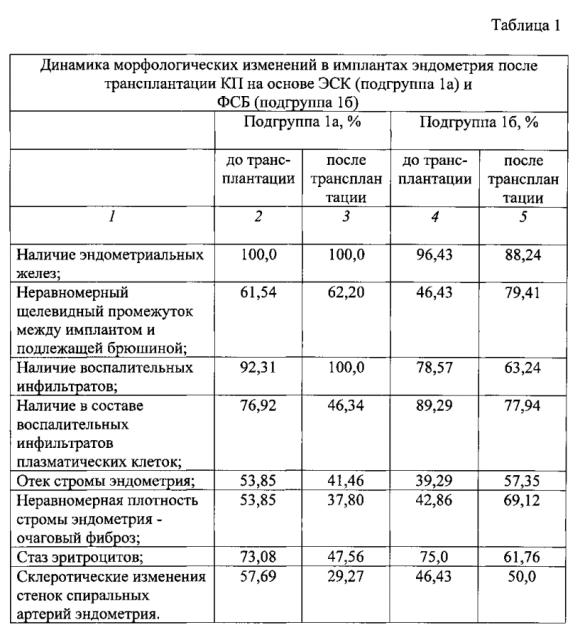
В качестве морфологических признаков, характеризующих наличие и динамику структурных изменений в ткани эндометрия, использовались следующие: наличие эндометриальных желез с частично слущенным в просвет эпителием; неравномерный щелевидный промежуток между имплантом и подлежащей брюшиной; наличие воспалительных инфильтратов; инфильтрация стромы плазматическими клетками; отек стромы эндометрия; наличие очагового фиброза; стаз эритроцитов; склеротические изменения стенок спиральных артерий.
Сравнительная оценка макроскопических критериев состояния имплантов эндометрия у модельных животных основной группы показала, что на фоне локального введения КП на основе ЭСК по сравнению с аналогичными показателями, полученными у модельных животных-реципиентов плацебо, в зоне имплантированного эндометрия местная воспалительная реакция проявляется слабо и не имеет тенденции к распространению, снижается способность к образованию спаечного процесса в зоне имплантации эндометрия и в брюшной полости, исход воспалительной реакции в зоне имплантации эндометрия в рубцово-спаечный процесс ограничен.
Сравнительная оценка микроскопических признаков активности воспалительных процессов в области имплантов при локальном введении КП на основе ЭСК и ФСБ показала, что среди образцов имплантов эндометрия, полученных после введения КП основе ЭСК выявлялись признаки активации процессов восстановления гистоархитектоники ткани имплантированного эндометрия (Табл. 1). Проводимое морфологическое исследование позволило констатировать, что в образцах имплантов модельных животных после локального введения КП прослеживается отчетливая тенденция к сохранению железистой структуры - в отличие от образцов модельных животных после локального введения плацебо. При этом большая частота выявления воспалительных инфильтратов в тканях имплантов после введения КП может рассматриваться как проявление активации компенсаторно-восстановительных процессов.
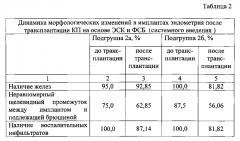
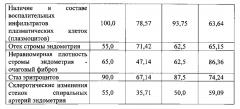
Сравнительная оценка макроскопических критериев состояния имплантов эндометрия у модельных животных группы сравнения показала, что на фоне системного введения КП на основе ЭСК (подгруппа 2а) по сравнению с аналогичными показателями у модельных животных - реципиентов плацебо (подгруппа 2б), реакция воспаления протекает менее агрессивно, не имеет тенденции к развитию инфильтративных и грубых рубцово-спаечных процессов.
Сравнительная оценка морфологических показателей признаков воспаления в имплантах эндометрия при системном введении КП на основе ЭСК и ФСБ показала, что введение клеточного продукта на основе ЭСК (подгруппа 2а) коррелирует со снижением активности процессов организации соединительной ткани в имплантах эндометрия (Табл. 2): в частности, с меньшей частотой выявлены воспалительные инфильтраты в сочетании с высоким содержанием плазмоцитов в их составе, тогда как при оценке образцов имплантов от модельных животных после системного введения ФСБ (подгруппа 2б) выявлены с повышенной частотой признаки очагового фиброза, стаза эритроцитов и склеротических изменений в стенках спиральных артерий.
В последующем проведена сравнительная оценка морфологическихх показателей состояния имплантированного эндометрия при локальном и системном введении КП на основе ЭСК.
Сравнительная оценка макроскопических критериев состояния имплантов эндометрия показала, что при сравнении показателей модельных животных, получивших КП на основе ЭСК локально и системно, отмечено, что при локальном введении КП на основе ЭСК воспалительная реакция имеет стабильные проявления, ограничена преимущественно зоной имплантации эндометрия и не сопровождается развитием грубого рубцово-спаечного процесса в брюшной полости.
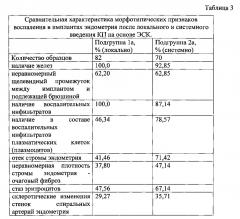
Сравнительная оценка морфологических характеристик процессов воспаления в имплантах эндометрия после локального и системного введения КП на основе ЭСК показала, что в образцах имплантов эндометрия, полученных после локального ведения КП на основе ЭСК (подгруппа 1а), с большой частотой выявляются воспалительные инфильтраты, а такие проявления воспалительной реакции, как отек стромы, очаговый фиброз, стаз эритроцитов и склеротические изменения стенок спиральных артерий встречаются гораздо реже, чем при системном введении КП на основе ЭСК (подгруппа 2а) (Табл. 3).
В качестве иммуногистохимических признаков, характеризующих наличие деструктивного процесса в ткани эндометрия, использовались маркеры цитотоксичных NK-клеток CD16 и CD56. Иммуногистохимическое подтверждение экспрессии факторов CD90 и CD105 (маркеров мезенхимальных стволовых клеток) использовалось для верификации присутствия КП на основе ЭСК в ткани имплантов эндометрия, в то же время, было показано, что в исследуемых образцах не экспрессировались маркеры кроветворных клеток CD34 и CD45.
Образцы имплантов эндометрия модельных животных были использованы для проведения сравнительного иммуногистохимического анализа. В результате показано, что в образцах имплантов эндометрия модельных животных после локального введения КП на основе ЭСК (подгруппа 1а) и ФСБ (подгруппа 1б) имеются достоверные отличия экспрессии маркера CD16 - более высокая площадь его экспрессии в образцах, полученных после локального введения КП на основе ЭСК по сравнению с аналогичным показателем от модельных животных-реципиентов плацебо свидетельствует о тенденции к активации местной воспалительной реакции под воздействием КП на основе ЭСК. Отсутствие экспрессии факторов CD90 и CD105 в подгруппе 1б связано с введением плацебо (табл. 4).
При оценке результатов системного введения КП на основе ЭСК и ФСБ выявлено, что в группе модельных животных после системного введения КП на основе ЭСК (подгруппа 2а) в имплантах определяется достоверно более высокая экспрессия CD16 по сравнению с образцами от модельных животных после системного введения ФСБ (подгруппа 2б). Более высокая площадь его экспрессии в образцах, полученных после системного введения КП на основе ЭСК по сравнению с ФСБ, свидетельствует о тенденции к активации местной воспалительной реакции под воздействием КП на основе ЭСК. Стимуляция факторов местного иммунитета в совокупности с изменениями, выявленными при морфологическом анализе ткани имплантов, свидетельствует о стимуляции механизмов, запускающих процессы восстановления гистоархитектоники ткани. Отсутствие экспрессии факторов CD90 и CD105 в подгруппе 2б связано с введением плацебо (Табл. 5).
Проведена сравнительная оценка иммуногистохимических показателей состояния имплантированного эндометрия при локальном и системном введении КП на основе ЭСК (Табл. 6).
При локальном введении КП на основе ЭСК (подгруппа 1а) показатели относительной плотности CD16 и CD56 в имплантах достоверно превышали эти показатели в группе с системным введением КП на основе ЭСК (подгруппа 2а) (при использовании непараметрического метода Манна-Уитни) (Таблица 6). Уровни экспрессии CD90 и CD105 не имели достоверных отличий между образцами, полученными от животных групп 1а и 2а. Таким образом, показано, что в условиях локального введения КП на основе ЭСК по сравнению с системным введением реактивность тканей имплантоваутологичного эндометрия более выражена.
Метод иммуногистохимического исследования образцов имплантированного эндометрия, в условиях предложенной экспериментальной модели заболевания эндометрия является информативным для оценки терапевтического действия КП на основе ЭСК. Определение маркеров КП на основе ЭСК иммуногистохимическим методом позволяет верифицировать экспансию КП на основе ЭСК в условиях экспериментальной модели заболевания эндометрия как при локальном, так и при системном введении. Иммуногистохимическим методом выявляется тенденция к усилению активности NK-клеток, активизации репаративных процессов в имплантах эндометрия после введения КП продукта на основе ЭСК, что свидетельствует о стимуляции факторов, запускающих процессы восстановления гистоархитектоники ткани.
Таким образом, представленный способ позволяет оценить эффективность терапевтического воздействия ЭСК на поврежденный эндометрий в условиях эксперимента и оценить эффективность введения стволовых клеток в динамике.
Способ оценки терапевтического воздействия эндометриальных стволовых клеток человека на поврежденный эндометрий в эксперименте, заключающийся в том, что модельным животным, полученным путем эстрогенизации самок кроликов с последующей имплантацией на париетальную брюшину передней брюшной стенки фрагментов поврежденного аутологичного эндометрия и послеоперационной профилактической антибактериальной терапией путем внутримышечного введения цефтриаксона в дозе 50 мг/кг/сут в течение 5 суток, на 7 день после имплантации вводят суспензию клеточного продукта на основе ЭСК, внутривенно - в ушную вену или локально - непосредственно в толщу импланта, и на 10 день после введения суспензии клеточного продукта на основе ЭСК удаляют все образцы имплантов для гистологического и иммуногистохимического исследований.