Способ выделения липополисахарида chlamydia trachomatis
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен способ выделения липополисахарида Chlamydia trachomatis. Способ включает экстрагирование липополисахарида из бактериальных клеток 90%-ным водным раствором фенола при 50°С. Далее супернатант отделяют от нерастворенных компонентов центрифугированием, разводят 0,1 М трис-HCl буфером в соотношении 1:9. Выделение липополисахарида Chlamydia trachomatis проводят методом аффинной хроматографии на конканавалин-А-сефарозе 4В. После выделения промывают 1 М раствором NaCl, забуференным трис-HCl буфером, и элюируют 0,4-0,45 М раствором N-ацетил-D-глюкозамина в трис-HCl буфере с дальнейшей диализацией и лиофилизацией. Изобретение обеспечивает повышение степени чистоты выделенного липополисахарида. 4 ил., 1 табл.
Реферат
Изобретение относится к области медицины, а именно биохимии, в частности к способам извлечения липополисахаридов, и может быть использовано для выделения липополисахарида из микробной массы Chlamydia trachomatis.
Chlamydia trachomatis считается наиболее распространенным возбудителем бактериальных инфекций, передаваемых половым путем [Калинина С.Н., Тиктинский О.Л. Лечение хронического простатита, обусловленного хламидийной и уреаплазменной инфекцией и осложненного мужским бесплодием. Урология. 2010; 3: 52-57]. Одним из факторов патогенности Chlamydia trachomatis, влияющим на физиологию репродуктивных процессов, как у мужчин, так и у женщин и приводящим к развитию бесплодия, связанного с инфекционно-воспалительными процессами урогенитального тракта, являются липополисахариды (ЛПС) - сложные макромолекулы, обнаруженные в клеточной оболочке грамотрицательных бактерий.
Хорошо известно, что ЛПС Chlamydia trachomatis даже в минимальных дозах являются мощными эндотоксинами, способными оказывать цитотоксическое действие на половые клетки, угнетать их функции и индуцировать гибель [Бухарин О.В., Кузьмин М.Д., Иванов Ю.Б. Роль микробного фактора в патогенезе мужского бесплодия. Журн. микробиол. 2000; 2: 106-110; Hosseinzadeh S., Pacey А.А., Eley A. Chlamydia trachomatis induced death of human spermatozoa is caused primarily by lipopolysaccharide // J. Med. Microbiol. - 2003. - V. 52. - №3. - p. 193-200].
Изучение таких бактериальных факторов, как ЛПС, представляется принципиально важным в свете поиска новых подходов к лечению и профилактике хронических инфекций. Правильный подбор метода выделения и хорошей очистки ЛПС гарантирует успешное определение его структурных центров, которые определяют биологическую активность макромолекул как специфических антигенов, эндотоксинов, фармакологических препаратов.
Для успешного определения биологических функций, химического состава и структуры, серологической активности липополисахарида (ЛПС) имеется ряд способов его выделения и очистки, однако все они не лишены недостатков.
В практике хорошо известен водно-фенольный способ выделения ЛПС из клеток грамотрицательных бактерий [Westphal О., Luderitz О., Bister F. Uber die Extraktion von Bakterien mit Phenol / Wasser // Z. Naturforsch., 1952. - №3. - P. 148-155; Westphal O., Jann K. Bacterial lipopolysaccharides. Extraktion with phenol-water and further applications of the procedure. - Methods Carbohydr. Chem., 1965, №5, p. 83-91], включающий обработку микробной массы водно-фенольной смесью при 65°С в течение 45 мин. После охлаждения смесь разделяют центрифугированием. Водную фазу отсасывают и диализуют в течение 3-4 сут против дистиллированной воды для удаления фенола и примесей низкой молекулярной массы. ЛПС осаждают ультрацентрифугированием при 100000 g и 15°С в течение 3 ч.
Недостатками этого способа являются:
- недостаточная чистота препарата ЛПС;
- длительность проведения: необходимость длительного диализа и последующей дополнительной очистки препарата ультрацентрифугированием;
- использование дорогостоящего оборудования (ультрацентрифуга);
- невысокий выход продукта из-за потери ЛПС на этапе ультрацентрифугирования.
Существует другой способ выделения ЛПС из R-форм грамотрицательных бактерий с использованием метода экстракции смесью фенол-хлороформ-петролейный эфир [Galanos С., Luderitz О., Westphal О.A. New method for the extraction of R lipopolysaccharide // Eur. J. Biochem. - 1969. - V. 9, №2. - P. 245-249], при котором сухие бактериальные клетки трижды суспензируют в смеси 90%-ного фенола : хлороформа : петролейного эфира (т. кип. 40-60°С) в соотношении 2:5:8 соответственно, встряхивают 2 мин с охлаждением (не выше 20°С) и центрифугируют 15 мин при 5000 об/мин. Супернатанты объединяют, хлороформ и петролейный эфир удаляют отгонкой при 30-40°С. К фенольной фазе добавляют дистиллированную воду по каплям до тех пор, пока ЛПС не выпадет в осадок, который отделяют центрифугированием при 3000 об/мин в течение 10 мин, а затем осадок промывают 2-3 раза небольшими порциями 80% фенола, трижды промывают эфиром для удаления фенола и высушивают в вакууме. ЛПС растворяют в 50 мл воды, нагревают до 45°С, вязкость раствора уменьшают путем помещения его на 5 мин в ультравибратор, после чего ЛПС осаждают ультрацентрифугированием при 100000 g в течение 4 ч. Осадок отделяют и растворяют в небольшом количестве воды и лиофилизируют.
Для выделения ЛПС Chlamydia trachomatis используют описанный выше способ Galanos С., а также способ в модификации Nurminen М. [Nurminen М., Rietschel Е.Т., Brade Н. Chemical characterization of Chlamydia trachomatis lipopolysaccharide // Infect Immun. - 1985. - V. 48. - p. 573-575], заключающийся в том, что сухие клетки Chlamydia trachomatis (элементарные тельца) суспензируют в 2,5 мл 90%-ного водного раствора фенола и гомогенизируют в течение 5 мин с последующим перемешиванием на магнитной мешалке при 50°С в течение 30 мин. К смеси добавляют 4 мл петролейного эфира (т. кип. 90-100°С) и 2,5 мл хлороформа и перемешивают в течение 1 ч при комнатной температуре. После центрифугирования супернатант освобождают от органических растворителей при пониженном давлении и оставшуюся фенольную фазу осаждают 10 объемами охлажденного ацетона (-20°С). Осадок трижды отмывают холодным ацетоном, растворяют в воде и лиофилизируют. Сухой материал повторно экстрагируют смесью фенол-хлороформ-петролейный эфир по способу Galanos С. (см. выше), осаждают водой, отмывают ацетоном, растворяют в воде и сушат под вакуумом.
Недостатками способов Galanos С. и Nurminen М. являются:
- системы органических веществ, используемые для выделения ЛПС, влияют на его структуру, конформацию, приводят к частичной деградации полимера, которая крайне нежелательна при проведении молекулярно-биологических исследований, так как эти изменения отражаются на биологической активности эндотоксина;
- органические вещества, используемые для выделения ЛПС, являются летучими, агрессивными, ядовитыми для человека и экологически вредными веществами.
- многоэтапность и длительность процедур выделения, что затрудняет процесс получения чистого ЛПС.
- невысокая степень очистки получаемых препаратов ЛПС от примесей бактериальных компонентов;
- использование специального и дорогостоящего оборудования;
- невысокий выход продукта из-за потери ЛПС на этапах ультрацентрифугирования или на нескольких процедурах лиофильной сушки, что к тому же может значительно нарушать нативные свойства ЛПС (в первую очередь ухудшается растворимость целевого продукта).
Наиболее близким к заявляемому способу является прототип - способ выделения ЛПС Chlamydia trachomatis (серовар Е и LGV) [Hosseinzadeh S., Pacey АА., Eley A. Chlamydia trachomatis induced death of human spermatozoa is caused primarily by lipopolysaccharide // J. Med. Microbiol. - 2003. - V. 52. - №3. - p. 193-200] путем суспензирования сухих бактериальных клеток в 2,5 мл 90%-ного водного раствора фенола, гомогенизирования в течение 5 мин с последующим перемешиванием на магнитной мешалке при 50°С в течение 30 мин. К смеси добавляют 4 мл петролейного эфира (т. кип. 90-100°С) и 2,5 мл хлороформа и перемешивают в течение 1 ч при комнатной температуре. После центрифугирования при 10000 g в течение 30 мин супернатант освобождают от органических растворителей на роторном испарителе при 40°С, а оставшуюся фенольную фазу осаждают 10 объемами охлажденного ацетона (-20°С). Осадок промывают холодным ацетоном и сушат под вакуумом.
Однако данный способ выделения ЛПС Chlamydia trachomatis имеет следующие недостатки:
- относится к жестким химическим методам выделения эндотоксина, что приводит к изменению исходной молекулярной организации биополимера, нарушая его нативную структуру и биологические свойства;
- использование летучих, агрессивных, ядовитых для человека и экологически вредных веществ;
- неудовлетворительное качество получаемого препарата ЛПС из-за невысокой степени его очистки за счет присутствия в препарате примесей других бактериальных компонентов, в частности большого количества белка и нуклеиновых кислот, что может затруднить его дальнейшее использование;
Изобретение направлено на повышение степени чистоты, т.е. улучшение качества ЛПС Chlamydia trachomatis.
Указанный технический результат достигается тем, что после фенольной экстракции липополисахарида из бактериальных клеток на следующем этапе супернатант отделяют от нерастворенных компонентов центрифугированием в течение 15 мин при 5000 об/мин и разводят его 0,1 М трис-HCl буфером (рН 7,5) в соотношении 1:9, а на заключительной стадии выделения проводят аффинную хроматографию липополисахарида Chlamydia trachomatis на конканавалин-А-сефарозе 4 В, после чего промывают 1 М раствором NaCl, забуференным трис-HCl буфером, и элюируют связанный на колонке липополисахарид 0,4-0,45 М раствором N-ацетил-D-глюкозамина в трис-HCl буфере с рН=8,0, с дальнейшей диализацией и лиофилизацией.
Выделение ЛПС Chlamydia trachomatis проводили следующим способом. В качестве источника ЛПС использовали сухие бактерии Chlamydia trachomatis, которые суспензировали в 2,5 мл 90%-ного водного раствора фенола, гомогенизировали в течение 5 мин и перемешивали на магнитной мешалке при 50°С в течение 30 мин. Не растворенные компоненты удаляли центрифугированием в течение 15 мин при 5000 об/мин, супернатант разводили 0,1 М трис-HCl буфером (рН 7,5) в соотношении 1:9.
Заключительная стадия выделения ЛПС Chlamydia trachomatis представляла собой аффинную хроматографию на конканавалин-А-сефарозе 4В. Через колонку конканавалин-А-сефарозы, уравновешенную трис-HCl буфером (рН 7,5), пропускали весь объем, полученный на предшествующей стадии фракционирования. От неспецифически связанных белков колонку промывали 1 М хлоридом натрия, забуференного трис-HCl буфером. Связанный на колонке ЛПС элюировали ступенчатым градиентом концентрации N-ацетил-D-глюкозамина от 0,1 до 0,5 М в трис-HCl буфере (рН=8,0). Собирали фракции, в каждой из которых определяли ЛПС по реакции с фенолом и серной кислотой, РНК - по поглощению при 260 нм, белок - по Лоури. Максимальная концентрация ЛПС выделялась при элюировании 0,4-0,45 М раствором N-ацетил-D-глюкозамина в трис-HCl буфере (рН=8,0). Фракции, содержащие ЛПС, собирали, диализировали против дистиллированной воды, лиофилизировали и хранили при -20°С.
Для подтверждения успешного выделения ЛПС Chlamydia trachomatis 20 мкл образца ЛПС, полученного предлагаемым способом, вносили в 14%-ный полиакриламидный гель (ПААГ) и проводили электрофорез при комнатной температуре в трис-глициновом буфере (рН 8,3) при напряжении 100-150 В. В качестве положительного контроля был использован ЛПС E. coli (серотип 055:В5, «Sigma»). Для выявления ЛПС гели обрабатывали азотнокислым серебром (рис. 1.).
На рис. 1 (электрофорез в ПААГ), где дорожка 1 - ЛПС, выделенный из Chlamydia trachomatis (серовар Е) патентуемым способом; дорожка 2 - ЛПС E. coli (серотип 055:В5, «Sigma»), видно, что после аффинной хроматографии препарат ЛПС Chlamydia trachomatis гомогенен при электрофоретическом контроле чистоты.
Предлагаемый способ был успешно апробирован на кафедре химии ГБОУ ВПО Астраханского ГМУ Минздрава России в течение 2014 года.
Очищенные элементарные тельца (ЭТ) Chlamydia trachomatis были получены из клеток McCoy по методике [Caldwell Н.D., Kromhout J., Schachter J. Purification and partial characterization of the major outer membrane protein of Chlamydia trachomatis // Infect Immun. - 1981. - V. 31. - p. 1161-1176]. ЛПС выделяли из лиофилизированных клеток (ЭТ) Chlamydia trachomatis (серовар Е).
Ниже приводится результат апробации.
50 мг сухих клеток ЭТ Chlamydia trachomatis суспензировали в 2,5 мл 90%-ного водного раствора фенола, гомогенизировали в течение 5 мин и перемешивали на магнитной мешалке при 50°С в течение 30 мин. Не растворенные компоненты удаляли центрифугированием в течение 15 мин при 5000 об/мин, супернатант разводили 0,1 М трис-HCl буфером (рН 7,5) в соотношении 1:9.
Заключительная стадия выделения ЛПС Chlamydia trachomatis представляла собой аффинную хроматографию на конканавалин-А-сефарозе 4В. Через колонку конканавалин-А-сефарозы, уравновешенную трис-HCl буфером (рН 7,5), пропускали весь объем, полученный на предшествующей стадии фракционирования. От неспецифически связанных белков колонку промывали 1 М хлоридом натрия, забуференного трис-HCl буфером. Связанный на колонке ЛПС элюировали 0,4-0,45 М раствором N-ацетил-D-глюкозамина в трис-HCl буфере с рН=8,0. Фракции, содержащие ЛПС, собирали, диализировали против дистиллированной воды, лиофилизировали и хранили при -20°С.
В результате был получен и охарактеризован препарат ЛПС Chlamydia trachomatis, выделенный патентуемым способом (ЛПС1), а для сравнения был взят препарат ЛПС Chlamydia trachomatis, полученный способом-прототипом (ЛПС2).
Препараты ЛПС, выделенные разными способами, представляют собой хлопья белого цвета, хорошо растворимые в воде, сахарозо-фосфатном буферном растворе или в 0,9%-ном растворе NaCl.
Определение химического состава проводили общепринятыми методами: суммарные углеводы по Дюбуа с тимолом и серной кислотой, белки по Лоури, нуклеиновые кислоты - по Спирину.
Сравнительный анализ препаратов, выделенных патентуемым способом (ЛПС1) и способом-прототипом (ЛПС2), показал сходные характеристики по проценту выхода образцов от сухого веса клеток (2-3%), однако по другим параметрам имелось значительное различие (табл. 1). Так, образец ЛПС2 содержал повышенное количество белка 6,2% и нуклеиновых кислот 3,5%, т.е. был недостаточной степени очистки.
В таблице 1 приведена сравнительная характеристика чистоты ЛПС Chlamydia trachomatis, полученного предлагаемым способом выделения (ЛПС1) и способом-прототипом (ЛПС2).
Для подтверждения выделения и чистоты ЛПС Chlamydia trachomatis, полученного предлагаемым способом, проводили обращенно-фазовую высокоэффективную жидкостную хроматографию (ОФ ВЭЖХ) на хроматографическом комплексе Gilson.
ОФ ВЭЖХ проводили на сорбенте силосорб С-18 (Чехия), который представляет собой частицы силикагеля, покрытые мономолекулярным слоем октадецилтрихлорсилана. Подвижной фазой служил линейный градиент ацетонитрила в 0,1% растворе трифторуксусной кислоты.
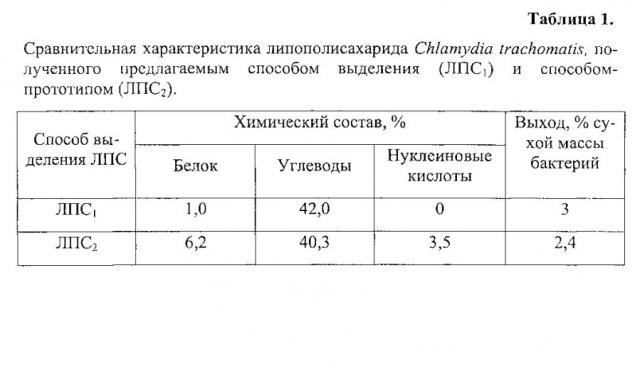
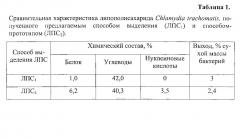
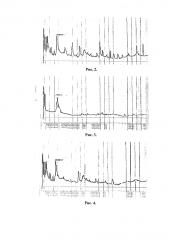
Для анализа использовали: образец исходного препарата ЛПС Chlamydia trachomatis, выделенный после фенольной экстракции из бактериальных клеток (ЛПС0) (рис. 2); образец препарата ЛПС Chlamydia trachomatis, выделенный патентуемым способом (ЛПС1) (рис. 3); образец препарата ЛПС Chlamydia trachomatis, выделенный способом-прототипом (ЛПС2) (рис. 4).
Анализ хроматограмм образцов ЛПС0, ЛПС1 и ЛПС2 методом ОФ ВЭЖХ (рис. 2, 3, 4 соответственно) показал основной пик, в котором содержится полисахарид. При сравнительном анализе хроматограмм образцов ЛПС Chlamydia trachomatis видно, что препарат ЛПС0 не очищен; в препарате ЛПС1, полученным патентуемым способом, отмечается только один основной пик, что доказывает чистоту препарата. В отличие от ЛПС1 в препарате ЛПС2, полученном способом-прототипом, отмечается 3-4 дополнительных значимых пика на 15,4; 17,8; 23,3 и 31 мин.
При расчете чистоты ЛПС Chlamydia trachomatis планиметрическим методом в препарате ЛПС0 доля ЛПС по данным ОФ ВЭЖХ составляла примерно 8%; в препарате ЛПС1, выделенном патентуемым способом, 94,7%; а в препарате ЛПС2 - 77,6%.
Главное преимущество предлагаемого нами способа выделения ЛПС Chlamydia trachomatis заключается в применении аффинной хроматографии на конканавалин-А-сефарозе. Аффинная хроматография - наиболее целесообразный и рациональный метод получения чистых препаратов, достоинствами которого также является небольшое количество операций и высокий выход продукта. Широко известно эффективное использование углеводсвязывающих белков - лектинов в качестве лигандов в аффинной хроматографии. Так, например, применение лектинов в основном для очистки самых различных гликопротеидов значительно упрощает и ускоряет процесс очистки последних.
Важнейшей характеристикой лектинов является их свойство обратимо и избирательно связывать углеводы, не вызывая их химического превращения, специфичность их взаимодействия с углеводами. Лектины взаимодействуют как со свободными моно- и олигосахаридами, так и с остатками углеводов в составе гликопротеидов, полисахаридов и гликолипидов. Учитывая углеводную специфичность лектина конканавалин-А и присутствие в составе ЛПС Chlamydia trachomatis Д-глюкозамина, наблюдается их эффективное связывание. Это позволяет однократно повысить степень очистки ЛПС (по сравнению со способом-прототипом).
Преимущества патентуемого способа выделения ЛПС Chlamydia trachomatis с использованием аффинной хроматографии на конканавалин-А-сефарозе, в том, что способ позволяет улучшить качество препарата ЛПС Chlamydia trachomatis по сравнению со способом-прототипом и получить более химически чистый и гомогенный ЛПС, что одновременно дает возможность сократить применение ядовитых для человека и экологически вредных веществ.
Более высокое качество препарата ЛПС, выделенного описанным способом, позволит использовать препарат в широком наборе микробиологических, биохимических и иммунологических исследований.
Способ выделения липополисахарида Chlamydia trachomatis путем экстрагирования его из бактериальных клеток 90%-ным водным раствором фенола при 50°С, отличающийся тем, что на следующем этапе супернатант отделяют от нерастворенных компонентов центрифугированием в течение 15 мин при 5000 об/мин и разводят его 0,1 М трис-HCl буфером (рН 7,5) в соотношении 1:9, а на заключительной стадии выделения проводят аффинную хроматографию липополисахарида Chlamydia trachomatis на конканавалин-А-сефарозе 4В, после чего промывают 1 М раствором NaCl, забуференным трис-HCl буфером, и элюируют связанный на колонке липополисахарид 0,4-0,45 М раствором N-ацетил-D-глюкозамина в трис-HCl буфере с рН=8,0 с дальнейшей диализацией и лиофилизацией.