Способ ингибирования репликации вич в клетках млекопитающих и у людей
Иллюстрации
Показать всеИзобретение относится к области биохимии. Представлен способ ингибирования репликации вируса иммунодефицита человека (ВИЧ), включающий обработку клеток млекопитающего агентом, выбранным из группы пептидов, интерферирующей РНК или антисмыслового олигонуклеотида, разрушающим структуру белков виментина и/или кератина-10 цитоскелетных промежуточных филаментов (IF) в клетке млекопитающего. Также изобретение относится к применению указанного агента для получения лекарственного средства для лечения ВИЧ-инфекции. Кроме того, представлены фармацевтические композиции для лечения ВИЧ-инфекции, содержащие указанный агент. Изобретение позволяет повысить уровень ингибирования репликации ВИЧ. 4 н. и 6 з.п. ф-лы, 11 ил., 2 табл., 12 пр.
Реферат
Область техники
Это изобретение относится к области биомедицины, а точнее к терапиям инфекционных заболеваний и, в частности, инфекционного заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ). В настоящем изобретении описывается способ ингибирования репликации ВИЧ посредством изменения цитоскелета, особенно тех белков, которые образуют цитоскелетные промежуточные филаменты (IF). Настоящее изобретение также относится к применению агентов, которые негативно модулируют или модифицируют цитоскелет, с целью производства лекарственных средств для предупреждения и лечения ВИЧ-инфекции.
Предпосылки создания изобретения
Возникновение ВИЧ/СПИД (синдром приобретенного иммунного дефицита)-пандемии принадлежит к числу наиболее значительных проблем со здоровьем, возникающих во всем мире в последние тридцать лет. Оно привело к разработке антиретровирусных терапий, способных остановить прогрессирование инфекции и снизить смертность (De Cock K, Crowley SP, Lo YR, Granich RM, Williams BG. Boletin de la Organizacion Mundial de la Salud 2009; 87: 488-488).
В соответствии с оценкой по UNAIDS (Объединенной программе ООН по ВИЧ/СПИДу), приведенной в отчете за 2008 год, было 33 миллиона ВИЧ-инфицированных людей, 2,7 миллиона из которых были новыми случаями, выявленными в 2008 году. В соответствии с оценкой 67% охватывающих весь мир инфекций возникают в странах Африки, расположенных южнее Сахары (Report on global AIDS epidemic 2008. Geneva, UNAIDS). В соответствии с бюллетенем, опубликованным Всемирной организацией здравоохранения в 2009 году, существуют две основные тенденции во всем мире: общее поражение популяции стран Африки, расположенных южнее Сахары, и концентрация инфекции в специфических группах риска в остальном мире, соответственно (De Cock K, Crowley SP, Lo YR, Granich RM, Williams BG 2009. Boletin de la Organizacion Mundial de la Salud 2009; 87: 488-488).
Ежегодная частота возникновения ВИЧ-инфекции достигла максимума в середине 1990-ых годов (Bongaarts J, Buettner T, Heiling G, Pelletier F. Popul. Dev. Rev. 2008; 34: 199-224). Однако общее число ВИЧ-инфицированных людей продолжает увеличиваться в Африке вследствие устойчиво высокого коэффициента заболеваемости, вызываемой вирусом, и устойчиво высокой скорости роста популяции (De Cock K, Crowley SP, Lo YR, Granich RM, Williams BG 2009. Boletin de la Organizacion Mundial de la Salud 2009; 87: 488-488).
Появление вариантов ВИЧ, которые являются резистентными к имеющимся в настоящее время лекарственным средствам против ВИЧ, и плохое соблюдение лечения пациентами остаются основными причинами неблагоприятного исхода лечения. Резистентность вируса отмечали с начала антиретровирусной монотерапии, что привело к появлению комбинированной терапии против ВИЧ с использованием двух или более средств против ВИЧ, каждое из которых с отличным механизмом действия. Коэффициенты заболеваемости и смертности значительно снизились среди подвергнутых лечению пациентов с внедрением высокоэффективной антиретровирусной терапии (HAART). В этой терапии объединены нуклеозидные и ненуклеозидные ингибиторы обратной транскриптазы и ингибиторы протеазы (PR). Тем не менее, терапия с использованием множества лекарственных средств не устраняет ВИЧ полностью, при этом длительное лечение, как правило, приводит к резистентности к нескольким лекарственным средствам. Половина пациентов, получающих комбинированную терапию против ВИЧ, не полностью поддается лечению, в основном вследствие резистентности вируса к одному или нескольким используемым лекарственным средствам. Кроме того, резистентность вируса была выявлена у недавно инфицированных пациентов, что значительно ограничивает возможные варианты лечения этих пациентов.
Успех комбинированной терапии против ВИЧ дал прогноз в отношении возможного уничтожения вируса. Однако в латентно инфицированных клетках, а также в тканях было описано существование вирусных резервуаров, в которых вирус сохраняется независимо от терапии. В соответствии с оценкой требуется более 70 лет непрерывного лечения для уничтожения вирусных резервуаров, событие, считающееся невероятным, поскольку терапия предполагает вторичные эффекты и порой смертельные метаболические осложнения, такие как лактоцитоз, сахарный диабет, липодистрофия, панкреатит и другие (Iglesias E 2009. Biotecnologia Aplicada 26: 189-194).
Соблюдение антиретровирусной терапии против ВИЧ является одной из самых обсуждаемых проблем, касающихся HAART, и особенно ингибиторов PR (протеазы), вследствие быстрого появления резистентности вируса в случае нерегулярного приема лекарственных средств или прерывания лечения. Существует несколько причин несоблюдения лечения, включающих непереносимость лекарственных средств, сложные схемы введения, неблагоприятный исход лечения, взаимодействия лекарственных средств, социально-экономические проблемы и другие.
Комбинированная терапия замедляет прогрессирование СПИДа, но не излечивает инфицированных пациентов (Marsden MD, Zack JA 2009. J. Antimicrob. Chemoth. 63: 7-10). Даже когда терапия преобразовывало эту инфекцию в хроническое заболевание, а не смертельную болезнь, а также увеличивала среднюю вероятность продолжительности жизни среди пациентов до уровней, подобных таковым для общей популяции, она, тем не менее, представляет нерешенные серьезные проблемы, которые требуют поиска новых стратегий для уменьшения используемых антиретровирусных средств. Это является целью поиска новых вариантов лечения.
Все недостатки имеющихся терапий против ВИЧ подкрепляют необходимость в новых лекарственных средствах против ВИЧ, различающихся, главным образом, своими механизмами и/или мишенями действия. Целью настоящего изобретения является обеспечение способа ингибирования репликации и/или инфицирования ВИЧ. Дальнейшей целью настоящего изобретения является обеспечение способа ингибирования репликации и/или инфицирования ВИЧ, который характеризуется механизмом, отличным от ингибирования полимеразы ВИЧ или протеазы ВИЧ. Другой целью настоящего изобретения является обеспечение способа ингибирования репликации и/или инфицирования ВИЧ посредством нацеливания на клетку-хозяина, а не вирус. В частности, целью настоящего изобретения является нацеливание на цитоскелет, а конкретнее на промежуточные филаменты (IF) клетки-хозяина. В частности, другой целью настоящего изобретения является нацеливание на белки хозяина виментин и кератин-10. Полагают, что при нацеливании на клетку-хозяина ВИЧ будет, вероятно, труднее продуцировать «ускользнувшие» мутанты. Виментин и кератин-10 важны для структуры IF, и настоящее изобретение показало, что они являются мишенью, подходящей для ингибирования ВИЧ. Другой целью настоящего изобретения является обеспечение агентов и фармацевтических композиций, которые разрушают IF клетки или уменьшают количество белков хозяина виментина и/или кератина-10.
С помощью настоящего изобретения достигается по крайней мере одна из вышеупомянутых целей.
Краткое изложение сущности настоящего изобретения
Настоящее изобретение относится к изменению цитоскелета клетки млекопитающего в качестве способа ингибирования репликации и/или инфицирования ВИЧ. Цитоскелет представляет собой трехмерную каркасную структуру, которая способствует сохранности клетки и играет несколько ролей в клетке. Его образуют три основные структуры: микротрубочки, микрофиламенты и промежуточные филаменты (IF). IF включают совокупность белков, специфических для каждого типа клетки, среди них находятся виментин и кератин-10.
Виментин является белком с молекулярной массой (М.м.), составляющей 58 кДа, образующим IF и обычно экспрессируемым в эндотелиальных клетках кровеносных сосудов, в некоторых эпителиальных клетках и в мезенхимных клетках (Alberts B, Johnson A, Lewis J., Raff M, Roberts K., Walter P. 2002. Molecular Biology of the Cell, 4th ed., Garland Publishing, New York). Известно, что виментин является субстратом протеазы (PR) ВИЧ, и предполагают, что действие PR затрагивает виментин, следовательно, возможно, затрагивает структуру цитоскелета (Blanco R, Carrasco L, Ventoso I 2003. J. Biol. Chem. 278: 1086-1093). Было также установлено, что лечение N-концевыми пептидами виментина, получаемыми в результате протеолитического процессирования, способно к изменению архитектуры клеточного ядра. Это изменение архитектуры ядра также отмечено в ВИЧ-инфицированных клетках (Shoeman RL, Huttermann C, Hartig R, Traub P 2001. Mol. Biol. Cell 12: 143-154). Полученные ранее данные наводят на мысль о том, что жизненный цикл ВИЧ зависит от разрезания виментина.
Кератины включают совокупность белков IF (приблизительно 30 членов) в диапазоне молекулярной массы от 10 до 68 кДа. Их классификация и нумерация были осуществлены в соответствии с их М.м. и их электрофоретическим поведением в кислой (pKi=4-6; тип I) и нейтральной - основной среде (pKi=6-8; тип II). Кератин-10 представляет собой кератин типа I с М.м., составляющей приблизительно 60 кДа, обнаруженный в основном в IF полностью дифференцированных эпидермальных клеток (Zhou XM 1988. J. Biol. Chem. 263: 15584-15589). Настоящее изобретение направлено на способ ингибирования репликации и/или инфицирования ВИЧ в клетке млекопитающего, включающий разрушение (структуры) цитоскелетных IF в указанной клетке млекопитающего. Кроме того, настоящее изобретение также направлено на агенты, которые разрушают цитоскелетные IF, для предупреждения или лечения ВИЧ-инфекции.
В первом аспекте настоящим изобретением обеспечивается способ ингибирования репликации ВИЧ в клетке млекопитающего, при этом указанный способ включает разрушение или негативное модулирование (структуры) цитоскелетных IF в клетке млекопитающего. В частности, указанной клеткой млекопитающего является клетка, являющаяся мишенью инфицирования вирусом ВИЧ.
В предпочтительном варианте осуществления указанного способа IF включают белки виментин и/или кератин-10.
В другом предпочтительном варианте осуществления указанного способа способ включает уменьшение количества виментина и/или кератина-10 в указанных IF с целью разрушения или негативного модулирования (структуры) цитоскелетных промежуточных филаментов и/или уменьшение количества свободного виментина и/или кератина-10, доступного для создания новых IF.
Тем не менее, в другом предпочтительном варианте осуществления указанного способа способ включает уменьшение экспрессии генов, кодирующих белки виментин и/или кератин-10, с целью разрушения или негативного модулирования (структуры) цитоскелетных промежуточных филаментов.
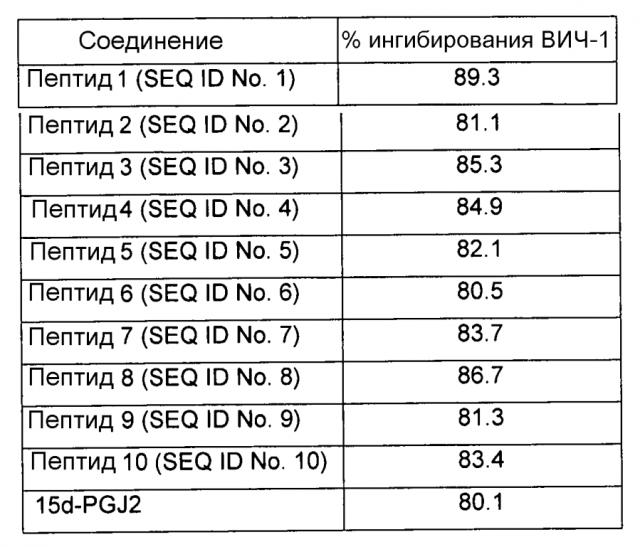
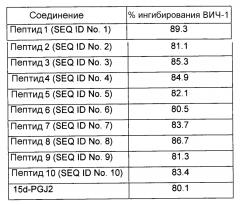
Тем не менее, в другом предпочтительном варианте осуществления указанного способа разрушения указанных IF достигают посредством введения в указанную клетку млекопитающего терапевтически эффективной дозы агента, выбираемого из группы, состоящей из полипептидов, пептидов, нуклеиновых кислот и химических соединений. В одном предпочтительном варианте осуществления указанным агентом является пептид, выбираемый из группы пептидов, идентифицированных как SEQ ID NO: 1-10, и их гомологов. В другом предпочтительном варианте осуществления указанным агентом является интерферирующая РНК или антисмысловой олигонуклеотид, мишенью которой(ого) являются гены виментина и/или кератина-10 или их транскрипты. Тем не менее, в другом предпочтительном варианте осуществления указанным агентом является химическое соединение или липидное производное.
В другом аспекте настоящим изобретением обеспечивается агент, который разрушает или негативно модулирует цитоскелетные IF, для предупреждения или лечения ВИЧ-инфекции.
В предпочтительном варианте осуществления этого аспекта указанные IF включают виментин и/или кератин-10.
В другом предпочтительном варианте агента в соответствии с настоящим изобретением указанный агент вызывает/успешно осуществляет уменьшение количества виментина и/или кератина-10 в указанных IF.
В другом предпочтительном варианте такого агента агент уменьшает экспрессию генов, кодирующих виментин и/или кератин-10.
В другом предпочтительном варианте агента в соответствии с настоящим изобретением указанный агент выбирают из группы, состоящей из полипептидов, пептидов, нуклеиновых кислот и химических соединений.
В другом предпочтительном варианте агента в соответствии с настоящим изобретением указанный агент включает пептид, выбираемый из группы пептидов, идентифицированных как SEQ ID NO: 1-10, и их гомологов.
В другом предпочтительном варианте агента в соответствии с настоящим изобретением указанным агентом является интерферирующая РНК или антисмысловой олигонуклеотид, мишенью которой(ого) являются гены виментина и/или кератина-10 или их транскрипты.
В другом предпочтительном варианте агента в соответствии с настоящим изобретением указанным агентом является интерферирующая РНК, выбираемая из группы, состоящей из короткой интерферирующей РНК, короткой шпилечной РНК и микроРНК. Предпочтительно указанная интерферирующая РНК включает последовательность из 15-50 нуклеотидов, комплементарную району информационной РНК белков виментина и/или кератина-10, предпочтительно 18-25 нуклеотидов.
В другом предпочтительном варианте агента в соответствии с настоящим изобретением указанным агентом является химическое соединение, и указанным соединением является липидное соединение или липидное производное. Предпочтительно указанным липидным соединением является циклопентеноновый простагландин 15-дезокси-∆-12,14-PGJ2 (15d-PGJ2).
В другом аспекте настоящим изобретением обеспечивается фармацевтическая композиция для лечения или предупреждения ВИЧ-инфекции, при этом указанная композиция включает агент в соответствии с настоящим изобретением, описанный выше, который разрушает или негативно модулирует цитоскелетные IF в соответствии с настоящим изобретением, как описано выше, и фармацевтически приемлемый носитель или наполнитель.
В предпочтительном варианте композиции в соответствии с настоящим изобретением указанный агент выбирают из группы, состоящей из полипептидов, пептидов, нуклеиновых кислот и химических соединений, которые разрушают IF, которые включают виментин и/или кератин-10.
В предпочтительном варианте композиции в соответствии с настоящим изобретением указанным агентом является пептид, выбираемый из группы, состоящей из пептидов, идентифицированных как SEQ ID NO: 1-10, и их гомологов.
Предпочтительно указанным агентом является интерферирующая РНК или антисмысловой олигонуклеотид, мишенью которой(ого) являются гены виментина и/или кератина-10 или их транскрипты.
В предпочтительном в высокой степени варианте агента в соответствии с настоящим изобретением указанный агент применяется для лечения или предупреждения ВИЧ-инфекции, или применяется для производства лекарственного средства для лечения или предупреждения ВИЧ-инфекции. Лечение или предупреждение ВИЧ-инфекции включает привязку к ингибированию или блокировке репликации вируса.
В предпочтительном варианте указанной фармацевтической композиции интерферирующую РНК выбирают из группы, состоящей из короткой интерферирующей РНК, короткой шпилечной РНК и микроРНК.
В предпочтительном варианте указанной фармацевтической композиции химическим соединением является липидное соединение или липидное производное. Предпочтительно указанным липидным соединением является циклопентеноновый простагландин 15-дезокси-∆-12,14-PGJ2.
В другом аспекте настоящим изобретением обеспечивается фармацевтическая комбинация, включающая агент, который разрушает цитоскелетные IF в соответствии с настоящим изобретением, как описано здесь выше, и по крайней мере одно лекарственное средство против ВИЧ. Примеры лекарственных средств против ВИЧ, подходящие для применения в аспектах настоящего изобретения, включают ингибиторы протеазы ВИЧ, наиболее предпочтительно ингибитор протеазы, который выбирают из группы, состоящей из атазанавира (ReyatazTM), ампренавира (AgeneraseTM), дарунавира (PrezistaTM), нелфинавира (ViraceptTM), саквинавира (InviraseTM или FortovaseTM), индинавира (CrixivanTM), фосампренавира (LexivaTM или TelzirTM), лопинавира (AluviaTM), ритонавира (NorvirTM), типранавира (AptivirTM), функциональных производных этих лекарственных средств и их комбинаций, таких как лопинавир+ритонавир (KaletraTM). Другими антиретровирусными средствами, которые могут применяться в аспектах настоящего изобретения, являются ненуклеозидные ингибиторы обратной транскриптазы (nNRTI), такие как эфавиренз (StocrinTM) и невирапин (ViramuneTM), этравирин (IntelenceTM), рилпивирин (TMC-278), ловирид (R89439), делавирдин (Rescriptor), функциональные производные этих лекарственных средств и их комбинации. Другими антиретровирусными средствами, которые могут применяться в аспектах настоящего изобретения, являются нуклеозидные ингибиторы обратной транскриптазы (NRTI) или являющиеся аналогами нуклеозидов ингибиторы обратной транскриптазы (NARTI), такие как ламивудин (3TC или EpivirTM), абакавир (ZiagenTM), зидовудин (AZT или Retrovir AZTTM), ставудин (d4T или ZeritTM), залцитабин (ddC или HividTM), диданозин (ddI или VidexTM), эмтрицитабин (FTC или EmtrivaTM), тенофовир (VireadTM), априцитабин (AVX754), стампидин, элвуцитабин (L-Fd4C), рацивир, амдоксовир, функциональные производные этих лекарственных средств и их комбинации, такие как эмтрицитабин+тенофовир (TruvadaTM), зидовудин+ламивудин (CombivirTM) и абакавир+ламивудин+зидовудин (TrizivirTM).
Помимо вышеупомянутых антиретровирусных средств фармацевтическая комбинация настоящего изобретения может включать комбинации различных классов антиретровирусных средств, перечисленных выше, такие как комбинации эфавиренз+зидовудин+ ламивудин, эфавиренз+тенофовир+эмтрицитабин, лопинавир, усиленный с помощью ритонавира+зидовудина+ламивудина, и лопинавир, усиленный с помощью ритонавира+тенофовира+эмтрицитабина.
В предпочтительном варианте фармацевтической комбинации в соответствии с настоящим изобретением агенты и лекарственные средства вводят одновременно, по отдельности или последовательно, в качестве части схемы введения доз.
В другом аспекте настоящим изобретением обеспечивается способ лечения или предупреждения ВИЧ-инфекции у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективной дозы фармацевтической композиции в соответствии с любым из пунктов 20-26 формулы изобретения или фармацевтической комбинации в соответствии с любым из пунктов 27-28.
Краткое описание чертежей
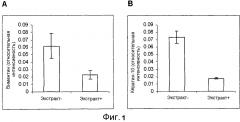
Фиг. 1. Относительная интенсивность зон белков человека виментина и кератина-10, идентифицированных с помощью сравнительного протеомного анализа. На панели А демонстрируется уменьшение белка виментина в культурах, подвергнутых обработке экстрактом с анти-ВИЧ активностью. На панели В демонстрируется уменьшение белка кератина-10 в культурах, подвергнутых обработке экстрактом с анти-ВИЧ активностью. «Усы» означают среднеквадратические отклонения.
Фиг. 2. Выявление белков виментина и кератина-10 в культурах с устойчивым сайленсингом каждого из обоих белков. Виментин (А) и кератин-10 (В) оценивали с помощью Вестерн-блоттинга в линии клеток МТ4, подвергнутой сайленсингу каждого белка, MT4vim(s) и MT4K-10(s), соответственно. Культуры MT4vim(s) и MT4K-10(s) продемонстрировали уменьшенную экспрессию соответствующего белка по сравнению с культурой клеток МТ4. Белок β-актин использовали в качестве контроля для нормализации результатов анализа с помощью Вестерн-блоттинга. Каждый вариант был проанализирован на дублирующих дорожках. На этой фигуре К-10 означает кератин-10.
Фиг. 3. Ингибирование репликации ВИЧ в культурах клеток MT4vim(s) и MT4K-10(s), оцененное с помощью оценки антигена р24. Культуры клеток МТ4, MT4vim(s) и MT4K-10(s) заражали штаммом Bru ВИЧ-1 с множественностью заражения, составляющей 0,01. Репликация вируса была ингибирована на более чем 90% в культурах клеток MT4vim(s) и MT4K-10(s). «Усы» означают среднеквадратические отклонения.
Фиг. 4. Анализ заражения лентивирусным вектором pLGW в культурах клеток МТ4, MT4vim(s) и MT4K-10(s). Культивируемые клетки трансдуцировали лентивирусным вектором, что напоминает первые стадии цикла репликации вируса ВИЧ-1 после вхождения, также несущим ген-репортер GFP. А) Культуры клеток MT4vim(s) и MT4K-10(s) продемонстрировали уменьшенный процент флуоресцентных клеток после трансдукции лентивирусом по сравнению с клетками МТ4 без сайленсинга. Усы» означают среднеквадратические отклонения. В) Полученные при проточной цитометрии гистограммы для каждой культуры.
Фиг. 5. Структурный анализ IF в культурах клеток МТ4. Культуры клеток МТ4, MT4vim(s) и MT4K-10(s) были исследованы с помощью трансмиссионной электронной микроскопии. Культуры с сайленсингом (В, С) продемонстрировали укороченные IF вместо длинных филаментов, отмечаемых в культурах клеток МТ4 без сайленсинга, используемых в качестве контроля (А). Панель D демонстрирует фрагментированные IF в результате действия пептида, идентифицированного как SEQ ID NO: 1, на клетки МТ4.
Фиг. 6. Ингибирование репликации ВИЧ-1 в клетках МТ4 с помощью пептидов. А) Клетки инкубировали с пептидом в течение 24 ч и далее заражали штаммом HXB1 ВИЧ-1 с множественностью заражения, составляющей 0,05. Репликация вируса была ингибирована на высокий процент, который также увеличивался вместе с увеличением концентрации пептида. «Усы» означают среднеквадратические отклонения. В) Клетки инкубировали с пептидами в течение 24 ч и далее заражали штаммом Bru ВИЧ с множественностью заражения, составляющей 0,01. Половина ингибирующей концентрации (IC50) находилась на наномолярном уровне в случае всех пептидов.
Фиг. 7. Ингибирование репликации ВИЧ-1 с помощью различных пептидов в мононуклеарных клетках периферической крови (PBMC). Эти клетки подвергали предварительной стимуляции, обработке различными концентрациями пептидов и далее инфицированию штаммом Bru ВИЧ-1. Пептиды ингибировали репликацию ВИЧ дозозависимым образом.
Фиг. 8. Ингибирование репликации ВИЧ-2 с помощью пептидов, идентифицированных как SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10. PBMC подвергали предварительной стимуляции, обработке различными концентрациями пептидов и далее инфицированию штаммом CBL-20 ВИЧ-2. Пептиды ингибировали репликацию ВИЧ-2 дозозависимым образом.
Фиг. 9. Уменьшение виментина в присутствии пептидов, идентифицированных как SEQ ID NO: 1, 4, 5, 7, 8 и 9. Линию клеток МТ4 инкубировали с указанными пептидами в концентрации каждого = 50 мкМ в течение 24 ч. Виментин выявляли методом с использованием Вестерн-блоттинга. Соответствующие виментину полосы продемонстрировали уменьшенную интенсивность в культурах, обработанных пептидами.
Фиг. 10. Оценка интернализации пептидов, идентифицированных как SEQ ID NO: 1 (А) и SEQ ID NO:3 (В), в линию клеток МТ4. На диаграмме представлен процент флуоресцентных клеток, соответствующий проникновению пептидов в концентрациях, составляющих 5, 10, 20 и 40 мкМ, и в различные моменты времени в линию клеток МТ4. Сс: не подвергнутые обработке клетки. «Усы» означают среднеквадратические отклонения.
Фиг. 11. Ингибирование репликации ВИЧ-1 липидным производным. Клетки МТ4 инкубировали с различными концентрациями циклопентенонового простагландина 15-дезокси-∆-12,14-PGJ2 (15d-PGJ2) и далее заражали ВИЧ-1 (штаммом Bru) с множественностью заражения, составляющей 0,01. Простагландин 15d-PGJ2 ингибировал репликацию ВИЧ-1. «Усы» означают среднеквадратические отклонения.
Подробное описание настоящего изобретения
Настоящее изобретение решает вышеупомянутую задачу и описывает способ ингибирования репликации ВИЧ посредством разрушения цитоскелета, точнее белков, образующих цитоскелетные IF.
В рамках настоящего изобретения в состав указанных IF могут входить кислый кератин, основный кератин, виментин, десмин, глиальный фибриллярный кислый белок, периферин, нейрофиламентный (NF) белок, интернексин, филенсин, факинин и ламин.
В варианте осуществления настоящего изобретения в состав указанных IF могут входить белки виментин и кератин. Конкретнее, виментин и кератин-10 могут образовывать указанные IF. Измененный цитоскелет ингибирует репликацию вируса ВИЧ в клетках человека.
Под разрушением цитоскелетных IF подразумевается, что структура IF модифицируется или изменяется так, что снижается количество белков, образующих цитоскелетные IF, и/или структурный разрыв цитоскелетных IF на более короткие субъединицы и/или изменение структурной формы сети цитоскелета и/или разборка IF. Описываемый здесь цитоскелет относится к каркасной структуре клетки или «скелету», содержащейся в цитоплазме, и составлен из белка. Цитоскелет присутствует во всех клетках, он играет важные роли как во внутриклеточном переносе, так и в клеточном делении. Его образуют три основные структуры: микротрубочки, микрофиламенты и промежуточные филаменты (IF). Цитоскелет обеспечивает структуру и форму клетки. Цитоскелетные элементы взаимодействуют активно и непосредственно с клеточными мембранами.
Определяемые здесь IF представляют собой семейство родственных белков, которые имеют общие структурные признаки и особенности последовательностей. Промежуточные филаменты имеют средний диаметр, составляющий 10 нанометров, который находится между таковым актина (микрофиламентов) и микротрубочек. Большинство типов промежуточных филаментов является цитоплазматическим, но один тип, ламины, являются ядерным. Существует приблизительно 70 различных генов, кодирующих различные белки промежуточных филаментов, специфические для каждого тира клетки, среди которых находятся белки виментин и кератин-10.
Используемый здесь термин «виментин» относится к члену семейства белков промежуточных филаментов, идентифицируемому по справочной последовательности в NCBI: NP_003371.2, имеющему последовательность, приведенную в SEQ ID NO: 11. Белки виментины образуют нитеобразные полимеры в ряде стадий сборки, начинающемся с антипараллелей, полусовмещенных парных димеров (или тетрамеров) с образованием филаментов длиной, равной единице, (ULF), которые собираются в продольном направлении с образованием полного филамента.
Используемый здесь термин «кератин» относится к семейству фиброзных структурных белков промежуточных филаментов. Белки кератины образуют нитеобразные полимеры в ряде стадий сборки, начинающемся с димеризации, димеры собираются в тетрамеры и октамеры и, в конечном счете, в ULF, способные к отжигу конец-в-конец в длинные филаменты. Каждый кератин типа I коэкспрессируется со специфическим партнером - кератином типа II, и каждая пара кератинов, которая образуется по мере совместной сборки специфических предпочтительных и предопределенных пар, является характеристической и указывающей на дифференциацию и специализацию конкретного типа эпителиальной клетки.
Используемый здесь термин «кератин-10» относится к кератину, цитоскелетному типа I, 10, члену семейства белков промежуточных филаментов, идентифицируемому по номеру доступа в Swiss-Prot: Q6EIZ0.1, имеющему последовательность, приведенную в SEQ ID NO: 12.
Используемый здесь термин «ген» относится к последовательности ДНК, включающей, но без ограничения, последовательность ДНК, которая может транскрибироваться в мРНК, которая может транслироваться в полипептидные цепи, транскрибироваться в рРНК или тРНК или служить в качестве сайтов распознавания ферментами и другими белками, вовлеченными в репликацию, транскрипцию и регуляцию ДНК. Этот термин относится к любой последовательности ДНК, включающей несколько функционально связанных фрагментов ДНК, таких как район промотора, 5' нетранслируемый район (5' UTR), кодирующая область (которая может кодировать или может не кодировать белок) и 3' нетранслируемый район (3' UTR), включающий сайт полиаденилирования. Обычно 5' UTR, кодирующая область и 3' UTR транскрибируются в РНК, кодирующая область которой, в случае кодирующего белок гена, транслируется в белок. Ген обычно включает интроны и экзоны.
Используемый здесь термин «ген виментина» относится к гену, кодирующему белок виментин или его гомолог.
Используемый здесь термин «ген кератина-10» относится к гену, кодирующему белок кератин-10 или его гомолог.
Термин «разрушение», как здесь используется применительно к разрушению промежуточных филаментов, как здесь указано, относится к нарушению функции или структурной организации. В частности, разрушение может включать разрыв структуры, ингибирование полимеризации, ингибирование образования и биосинтеза, в том числе ингибирование образования первичных, вторичных и третичных структур белков и т.д.
Термин «негативное модулирование», как здесь используется применительно к негативному модулированию промежуточных филаментов, как здесь указано, относится к такому изменению функции или структурной организации, которое приводит к потере или уменьшению биологической функции указанных филаментов.
Используемый здесь термин «цитоскелетные промежуточные филаменты (IF)» относится к промежуточным филаментам в качестве типа цитоскелетных элементов, и их размер является промежуточным по сравнению с таковым актина и микротрубочек. Вместе эти три структуры благоприятствуют сохранности структуры, форме клетки и подвижности клетки и органелл. Цитоскелетные промежуточные филаменты постоянно подразделяют на пять типов: типы I и II: кислый кератин и основный кератин. Кератины также имеют подтипы, которые являются уникальными для различных эпителиальных клеток; тип III: виментин в фибробластах, эндотелиальных клетках и лейкоцитах; десмин в мышце; глиальный фибриллярный кислый белок в астроцитах и других типах глии и периферин в волокнах периферических нервов; тип IV: нейрофиламентные (NF) белки H (тяжелый), M (средний) и L (низкомолекулярный), интернексин, филенсин и факинин; и тип V: ламины.
Используемый здесь термин «структура цитоскелетных промежуточных филаментов (IF)» относится к спиральной организации тетрамеров филаментов. Каждый мономер промежуточных филаментов состоит из альфа-спирального палочковидного домена, который соединяет амино-конец (головку) с карбоксильным концом (хвостом). Палочковидные домены свертываются вокруг другого филамента с образованием димера. N- и C-концы каждого филамента являются совмещенными. Некоторые промежуточные филаменты образуют гомодимеры, другие образуют гетеродимеры. Затем димеры образуют размещенные в шахматном порядке тетрамеры, которые выстроены в ориентации головка-хвост. Этот тетрамер считается основной субъединицей промежуточного филамента. Конечный промежуточный филамент представляет собой спиральный ряд этих тетрамеров.
В контексте описания этого изобретения термин «лечение» относится к любым и всяким применениям, которые вылечивают состояние или заболевание или его симптомы, предотвращают установление состояния или заболевания или его симптомов, или по-другому предотвращают или препятствуют или реверсируют прогрессирование состояния или заболевания или других нежелательных симптомов абсолютно любым способом.
Используемый здесь термин «терапевтически эффективная доза» относится к нетоксичному количеству терапевтического средства, достаточному для обеспечения желаемого терапевтического эффекта, например, лечения, уменьшения интенсивности или предупреждения желаемого заболевания или состояния или для проявления выявляемого терапевтического или профилактического эффекта. Эффект можно выявить, например, по химическим маркерам или уровням антигенов. Терапевтические эффекты также включают ослабление физических симптомов. Точное эффективное количество для субъекта будет зависеть от размера и состояния здоровья субъекта, природы и степени заболевания, и терапевтических средств или комбинации терапевтических средств, выбранных для введения. Поэтому бесполезно устанавливать точное эффективное количество заранее. Однако эффективное количество для конкретной ситуации можно определить с помощью обычного экспериментирования и решается практикующим врачом.
В рамках настоящего изобретения эффективная доза будет составлять от приблизительно 0,01 мг/кг до 50 мг/кг или от 0,05 мг/кг до приблизительно 10 мг/кг композиций полинуклеотидов или полипептидов у индивидуума, которому ее вводят.
Используемый здесь термин «фармацевтически приемлемый носитель или наполнитель» относится к носителю для введения терапевтического средства, такого как полипептид, полинуклеотид и другие терапевтические средства. Этот термин относится к любому фармацевтическому носителю, который сам не вызывает продукцию антител, вредных для индивидуума, получающего композицию, и который можно вводить без чрезмерной токсичности. Подходящими носителями могут быть большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. Такие носители хорошо известны специалистам со средним уровнем компетентности в данной области техники. Фармацевтически приемлемые носители в терапевтических композициях могут содержать жидкости, такие как вода, солевой раствор, глицерин и этанол. Кроме того, в таких носителях могут присутствовать вспомогательные вещества, такие как смачивающие реагенты или эмульгаторы, рН-буферные вещества и т.п. Всестороннее обсуждение фармацевтически приемлемых наполнителей имеется в Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991). Обычно терапевтические композиции готовят в виде инъецируемых препаратов, в виде либо жидких растворов, либо суспензий, или в твердых формах, подходящих либо для приготовления раствора или суспензии в жидких носителях, либо для прямого приема. В определение фармацевтически приемлемого носителя включены липосомы, как и аэрозоли.
Термин «гомолог», как здесь используется и применительно к пептиду, относится к пептиду, включающему аминокислотную последовательность, идентичную, как установлено с помощью совмещения последовательности, например, с Blast и т.д., последовательностям SEQ ID NO: 1-10 на по крайней мере 70%, предпочтительно на по крайней мере 75%, более предпочтительно на по крайней мере 85%, 90% или даже 90%, и способному разрушать, негативно модулировать или модифицировать цитоскелет, особенно белки, образующие цитоскелетные IF, а точнее белки виментин и кератин-10. Подходящими гомологами являются пептиды с консервативными аминокислотными заменами. Соответственно, когда заменено менее 10% аминокислот, более соответственно - менее 5%, менее 3%, и наиболее предпочтительно, когда заменено менее 1% аминокислот. Соответственно, когда заменено менее 10 аминокислотных остатков, более соответственно - менее 5, и наиболее соответственно, когда заменено менее 2 аминокислот. Консервативной заменой является замена, при которой аминокислоту заменяют другой очень схожей аминокислотой, которая оказывает незначительный эффект на активность белка или не оказывает такой эффект. «Консервативной заменой» является замена аминокислоты другой аминокислотой, имеющей такой же результирующий электронный заряд и приблизительно такой же размер и форму. Аминокислоты с алифатическими или замещенными алифатическими боковыми цепями аминокислот имеют приблизительно одинаковый размер, когда общее число атомов углерода и гетероатомов в их боковых цепях отличается на не более чем приблизительно четыре атома. Они имеют приблизительно одинаковую форму, когда число ветвей в их боковых цепях отличается на не более чем одну ветвь. Считают, что аминокислоты с фенильными или замещенными фенильными группами в их боковых цепях имеют приблизительно одинаковый размер и форму. Ниже перечислены пять групп аминокислот. Замена аминокислоты в полипептиде другой аминокислотой из той же самой группы приводит к консервативной замене. Группа I: глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин и не встречающиеся в природе аминокислоты с С1-С4 алифатическими или гидроксил-замещенными, С1-С4 алифатическими боковыми цепями (неразветвленными или моноразветвленными). Группа II: глютаминовая кислота, аспарагиновая кислота и не встречающиеся в природе аминокислоты с замещенными карбоксильными группами, С1-С4 алифатическими боковыми цепями (неразветвленными или с одной точкой разветвления). Группа III: лизин, орнитин, аргинин и не встречающиеся в природе аминокислоты с замещенными аминогруппами или гуанидинами, С1-С4 алифатическими боковыми цепями (неразветвленным