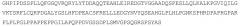Фармацевтическая композиция для лечения метаболического синдрома
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается фармацевтической композиции для снижения уровней глюкозы, содержащей по меньшей мере одно соединение FGF-21 и по меньшей мере один агонист GLP-1R. Группа изобретений также касается применения указанной фармацевтической композиции для получения лекарственного средства для лечения метаболического синдрома, диабета, ожирения или избыточной массы у пациента. Группа изобретений обеспечивает синергический эффект в снижении уровней глюкозы в плазме. 7 н. и 12 з.п. ф-лы, 2 пр., 6 ил.
Реферат
Настоящее изобретение относится к фармацевтической композиции, содержащей, по меньшей мере, одно соединение FGF-21 (фактора роста фибробластов 21), по меньшей мере, один агонист GLP-1R (рецептора глюкагонподобного пептида-1) и, необязательно, по меньшей мере, одно противодиабетическое лекарственное средство и/или, по меньшей мере, один ингибитор DPP-4 (дипептил-пептидазы-4) для лечения, по меньшей мере, одного метаболического синдрома и/или атеросклероза, в частности, диабета, дислипидемии, ожирения и/или избыточной массы тела.
Сахарный диабет характеризуется его клиническими проявлениями, а именно, инсулиннезависимая или начинающаяся в зрелом возрасте форма, также известная как диабет 2 типа, и инсулинозависимая или ювенильная форма, также известная как диабет 1 типа. Проявления клинических симптомов диабета 2 типа и лежащее в его основе ожирение обычно появляются в возрасте более 40 лет. Напротив, диабет 1-го типа обычно проявляет быстрое начало заболевания часто в возрасте до 30 лет. Заболевание представляет собой метаболическое расстройство у людей с распространенностью приблизительно 1% в общей популяции, причем одна четвертая часть из них относится к 1-му типу и три четверти из них относятся к диабету 2-го типа. Диабет 2-го типа представляет собой заболевание, характеризуемое высоким уровнем глюкозы, инсулина и кортикостероидов в циркулирующей крови.
В настоящее время, существуют различные фармакологические подходы к лечению диабета 2-го типа, которые могут использоваться индивидуально или в комбинации, и которые действуют через различные типы действии:
1) сульфонилмочевина стимулирует секрецию инсулина;
2) бигуаниды (метформин) действуют путем стимуляции утилизации глюкозы, снижения продукции глюкозы печенью и уменьшения кишечного выброса глюкозы;
3) ингибиторы oc-глюкозидазы (акарбоза, миглитол) замедляют переваривание углеводородов и, следовательно, всасывание из желудочно-кишечного тракта и снижают гипергликемию после приема пищи;
4) тиазолидиндионы (троглитазон) усиливают действие инсулина, таким образом, содействуя утилизации глюкозы в периферических тканях; и
5) инсулин стимулирует утилизацию глюкозы в тканях и ингибирует выброс глюкозы из печени.
Однако большинство лекарственных средств имеют ограниченную эффективность и не решают наиболее важные проблемы, снижающуюся функцию β-клеток и связанное с ней ожирение.
Ожирение представляет собой хроническое заболевание, которое очень распространено в современном обществе и связано с многочисленными медицинскими проблемами, включая сахарный диабет, резистентность к инсулину, гипертонию, гиперхолестеринемию и коронарную болезнь сердца. Кроме того, имеется высокая корреляция между ожирением и диабетом и резистентностью к инсулину, последняя из которых в целом сопровождается гиперинсулинемией или гипергликемией или ими обоими. Кроме того, диабет 2-го типа связан с риском заболевания коронарных артерий от двукратного до четырехкратного.
Для диабета 1-го типа характерно проявление в виде очень низкого или не измеряемого уровня инсулина в плазме при повышенном уровне глюкагона. Иммунный ответ, специфически направленный против β-клеток, приводит к диабету 1-го типа, потому что β-клетки секретируют инсулин. Современные терапевтические схемы по поводу диабета 1-го типа направлены на попытки минимизации гипергликемии, возникающей в результате отсутствия натурального инсулина.
Фактор роста фибробластов 21 (FGF21) представляет собой новый метаболический регулятор, продуцируемый в первую очередь печенью, которая оказывает мощные противодиабетические и снижающие уровень липидов эффекты на экспериментальных моделях ожирения и сахарного диабета 2-го типа. Этот гормон вносит вклад в регуляцию массы тела и участвует в реакции на дефицит питания и кетогенное состояние у мышей. Основными участками видов метаболического действия FGF21 являются жировая ткань, печень и поджелудочная железа. Экспериментальные исследования показали улучшения компенсации диабета и дислипидемии после введения FGF21 у мышей и приматов с диабетом (Dostalova et al. 2009). Было показано, что FGF21 стимулирует захват глюкозы в мышиных адипоцитах 3T3-L1 в присутствии и в отсутствие инсулина и снижает уровни глюкозы, триглицеридов и глюкагона в крови после еды и натощак у мышей ob/ob и db/db и 8-недельных крыс ZDF дозозависимым образом, таким образом, обеспечивая основу для применения FGF-21 в качестве средства для лечения диабета и ожирения (см., например, Международную патентную публикацию WO 03/011213).
Факторы роста фибробластов (FGF) представляют собой полипептиды, широко экспрессированные в развивающихся и взрослых тканях. Семейство FGF в настоящее время состоит из 22 членов, с FGF-1 по FGF-23. Члены семейства FGF высоко сохранны и по генной структуре, и по аминокислотной последовательности между видами позвоночных. Существуют 18 факторов роста фибробластов млекопитающих (FGF1-FGF10 и FGF16-FGF23), которые группируются в 6 подсемейств на основании различий гомологии последовательностей и филогенеза. Пронумерованные FGF, которые не отнесены к подсемействам - гомологичные факторы FGF (ранее известные как FGF11-FGF14) - имеют высокую идентичность последовательностей с семейством FGF, но не активируют рецепторы FGF (FGFR) и поэтому в целом не считаются членами семейства FGF.
Хотя большинство FGF действуют в качестве местных регуляторов роста и дифференциации клеток, недавно проведенные исследования указывают на то, что члены подсемейства FGF19, включая FGF15/19, FGF21 и FGF23 оказывают важные метаболические эффекты эндокринным видом. Члены подсемейства FGF19 регулируют разнообразные физиологические процессы, на которые не воздействуют классические FGF. Широкое разнообразие видов метаболической активности этих эндокринных факторов включает регуляцию метаболизма желчных кислот, углеводородов и липидов, а также гомеостаза фосфатов, кальция и витамина D (Tomlinson et al. 2002, Holt et al. 2003, Shimada et al. 2004, Kharitonenkov et al. 2005, Inagaki et al. 2005, Lundasen et al. 2006).
FGF21 был первоначально выделен из мышиных эмбрионов. мРНК FGF21 была наиболее обильно экспрессирована в печени и в меньшей степени в тимусе (Nishimura et al. 2000). Человеческий FGF21 высоко идентичен (аминокислотная идентичность приблизительно 75%) мышиному FGF21. Среди членов семейства человеческих FGF, FGF21 наиболее подобен (аминокислотная идентичность приблизительно 35%) FGF19 (Nishimura et al. 2000). FGF21 не оказывает пролиферативные и канцерогенные эффекты (Kharitonenkov et al. 2005, Huang et al. 2006, Wente et al. 2006), которые типичны для большинства членов семейства FGF (Ornitz and Itoh 2001, Nicholes et al. 2002, Eswarakumar et al. 2005).
Введение FGF21 страдающим ожирением мышам ob/ob с дефицитом лептина и мышам ob/ob с дефицитом рецепторов лептина и страдающим ожирением крысам ZDF значительно снижало содержание глюкозы и триглицеридов в крови, уменьшало уровни инсулина натощак и улучшало выведение глюкозы во время перорального теста на переносимость глюкозы. FGF21 не воздействовал на потребление пищи или массу/композицию тела страдающих диабетом или худых мышей и крыс в течение курса 2-недельного введения. Важно, что FGF21 не вызывал митогенность, гипогликемию или прибавку веса при любой тестированной дозе у страдающих диабетом или здоровых животных или при избыточной экспрессии у трансгенных мышей (Kharitonenkov et al. 2005). Трансгенные мыши с избыточной экспрессией FGF21 были устойчивы к вызванному рационом ожирению.
Введение FGF21 страдающим диабетом макакам резус в течение 6 недель снижало уровни глюкозы, фруктозамина, триглицеридов, инсулина и глюкагона плазмы натощак. Важно, что гипогликемия не наблюдалась во время исследования, несмотря на значительные эффекты снижения уровня глюкозы. Введение FGF21 также значительно снижало содержание LDL-холестерина (холестерина липопротеина низкой плотности) и увеличивало содержание HDL-холестерина (холестерина липопротеина высокой плотности) и, в отличие от мышей (Kharitonenkov et al. 2005), немного, но значимо уменьшало массу тела (Kharitonenkov et al. 2007).
Дополнительную информацию можно получить из следующих ссылок:
1. DOSTALOVA I. et al.: Fibroblast Growth Factor 21: A Novel Metabolic Regulator With Potential Therapeutic Properties in Obesity/Type 2 Diabetes Mellitus. Physiol Res 58: 1-7, 2009.
2. ESWARAKUMAR V.P. et al.: Cellular signaling by fibroblast growth factor receptors. Cytokine Growth Factor Rev 16: 139-149, 2005.
3. HOLT J.A. et al.: Definition of a novel growth factor-dependent signal cascade for the suppression of bile acid biosynthesis. Genes Dev 17: 1581 -1591, 2003.
4. HUANG X. et al.: Forced expression of hepatocytespecific fibroblast growth factor 21 delays initiation of chemically induced hepatocarcinogenesis. Mol Carcinog 45: 934-942, 2006.
5. INAGAKI T. et al.: Endocrine regulation of the fasting response by PPARa-mediated induction of fibroblast growth factor 21. Cell Metab 5: 415-425, 2007.
6. KHARITONENKOV A. et al.: FGF-21 as a novel metabolic regulator. J Clin Invest 1 15: 1627-1635, 2005.
7. KHARITONENKOV A. et al.: The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21. Endocrinology 148: 774-781, 2007.
8. LUNDASEN T. et al.: Circulating intestinal fibroblast growth factor 19 has a pronounced diurnal variation and modulates hepatic bile acid synthesis in man. J Intern Med 260: 530-536, 2006.
9. NICHOLES K. et al.: A mouse model of hepatocellular carcinoma: ectopic expression of fibroblast growth factor 19 in skeletal muscle of transgenic mice. Am J Pathol 160: 2295-2307, 2002.
10. NISHIMURA T. et al.: Identification of a novel FGF, FGF-21, preferentially expressed in the liver. Biochim Biophys Acta 1492: 203-206, 2000.
11. ORNITZ D.M. et al.: Fibroblast growth factors. Genome Biol 2: REVIEWS3005, 2001.
12. SHIMADA T. et al.: FGF-23 is a potent regulator of vitamin D metabolism and phosphate homeostasis. J Bone Miner Res 19: 429-435, 2004.
13. TOMLINSON E. et al.: Transgenic mice expressing human fibroblast growth factor-19 display increased metabolic rate and decreased adiposity. Endocrinology 143: 1741 -1747, 2002.
14. WENTE W. et al.: Fibroblast growth factor-21 improves pancreatic beta-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and Akt signaling pathways. Diabetes 55: 2470-2478, 2006.
Кишечный пептид, глюкагонподобный пептид-1 (GLP-1) представляет собой гормон с инкретиновой активностью и секретируется зависимым от питательных веществ образом. Он стимулирует глюкозозависимую секрецию инсулина. GLP-1 также содействует пролиферации β-клеток и регулирует гликемию посредством дополнительных действий на сенсоры глюкозы, ингибирования опорожнения желудка, потребление пищи и секрецию глюкагонов. Кроме того, GLP-1 стимулирует секрецию инсулина и снижает уровень глюкозы в крови у людей с диабетом 2-го типа. Экзогенное введение биологически активного GLP-1, GLP-1 (7-27) или GLP-1 (7-36 амида) в дозах, повышающих концентрации в плазме приблизительно в 3-4 раза относительно физиологических уровней после приема пищи, полностью нормализует гипергликемию натощак у пациентов с диабетом 2-го типа (Nauck, M.A. et al. (1997) Exp Clin Endocrinol Diabetes, 105, 187-197). Человеческий рецептор GLP-1 (GLP-1R) представляет собой состоящий из 463 аминокислот гептаспиральный связанный с белком G рецептор, широко экспрессированный в островках поджелудочной железы, почках, легких, сердце и множественных областях периферической и центральной нервной системы. Внутри островков, GLP-1R преимущественно локализуется в островковых β-клетках. Активация передачи сигналов GLP-1R инициирует программу дифференциации в направлении фенотипа, более подобного эндокринному, в частности, дифференциацию предшественников, происходящих из человеческих островков, в функционирующие β-клетки (Drucker, D.J. (2006) Cell Metabolism, 3, 153-165).
К сожалению, и FGF-21, и биоактивный GLP-1, а также дрруе известные лекарственные средства сами по себе имеют ограниченную эффективность в отношении сложных и многофакторных метаболических дисфункций, которые могут наблюдаться при диабете 2-го типа или других метаболических расстройствах. Это также относится к эффективности при снижении уровней глюкозы крови самими указанными соединениями.
В соответствии с настоящим изобретением, к удивлению было обнаружено, что комбинация FGF-21 и агониста GLP-1R значительно снижала уровни глюкозы в крови синергическим образом до нормогликемических уровней.
Поэтому, один вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей, по меньшей мере, одно соединение FGF-21 (фактора роста фибробластов 21) и, по меньшей мере, один агонист GLP-1R (рецептора глюкагонподобного пептида-1).
«Соединение FGF-21» определяется как соединение, проявляющее активность FGF-21, в частности, содержащее (i) нативный FGF-21, особенно, человеческий FGF-21, в частности, человеческий FGF-21, как показано в SEQ ID NO:1, или (ii) миметик FGF-21 с активностью FGF-21.
«Активность FGF-21» обычно измеряется в анализе активности FGF-21, в целом известном специалисту в данной области. Анализ активности FGF-21 представляет собой, например, «анализ захвата глюкозы», как описано в публикации Kharitonenkov, A. et al. (2005), 1 15; 1627, No. 6. В качестве примера анализа захвата глюкозы, адипоциты, хранившиеся в течение 3 часов в DMEM (модифицированной по Дульбекко среде Игла)/0,1% BSA (бычьем сывороточном альбумине), стимулировали FGF-21 в течение 24 часов и дважды промывали буфером KRP (15 мМ HEPES, pH 7,4, 118 мМ NaCl, 4,8 мМ KCl, 1,2 мМ MgSO4, 1,3 мМ CaCl2, 1,2 мМ KH2PO4, 0,1% BSA) и 100 мкл буфера KRP, содержащего 2-деокси-D-[14C]глюкозу (2-DOG) (0,1 мкКи, 100 мкМ), добавляется в каждую лунку. Контрольные лунки содержат 100 мкл буфера KRP с 2-DOG (0,1 мкКи, 10 мМ) для мониторинга неспецифичности. Реакция захвата проводится в течение 1 часа при 37°C, прекращается добавлением цитохалазина B (20 мкМ), и измеряется счетчиком излучения Wallac 1450 MicroBeta (PerkinElmer, USA).
Примерами миметиков FGF-21 являются (a) белки, имеющие, по меньшей мере, 96%, в частности, аминокислотную идентичность 99% аминокислотной последовательности, показанной в SEQ ID NO:1, и имеющие активность FGF-21, (b) слитый белок FGF-21 или (c) конъюгат FGF-21, например, мутеин FGF-21, слитый белок FGF-21-Fc, слитый белок FGF-21-HSA или пэгилированный FGF-21.
Примеры мутеинов FGF-21 описаны, например, в Международных патентных публикациях WO 2005/061712, WO 2006/028595, WO 2006/028714, WO 2006/065582 или WO 2008/121563. Иллюстративными мутеинами являются мутеины, которые имеют сниженную способность O-гликозилирования при экспрессировании, например, в дрожжах, по сравнению, с человеческим FGF-21 дикого типа, например, человеческий FGF-21 с замещением в положении 167 (серин), например, человеческий n FGF-21 с одним из следующих замещений: Ser167Ala, Ser167Glu, Ser167Asp, Ser167Asn, Ser167Gln, Ser167Gly, Ser167Val, Ser167His, Ser167Lys или Ser167Tyr. Другим примером является мутеин, который проявляет сниженное деамидирование, по сравнению с человеческим FGF-21 дикого типа, например, мутеин с замещением в положении 121 (аспарагин) человеческого FGF-21, например, Asn121Ala, Asn121Val, Asn121Ser, Asn121Asp или Asn121Glu. Альтернативным мутеином является человеческий FGF-21, имеющий одну или более не натурально кодированных аминокислот, например, как описано общей формулой в п.29 формулы изобретения Международной патентной публикации WO2008/121563. Другие мутеины включают замещение заряженных (например, аспартата, глутамата) или полярных, но незаряженных аминокислот (например, серина, треонина, аспарагина, глутамина) например, полярные, но незаряженные или заряженные аминокислоты, соответственно. Примерами являются Leu139Glu, Ala145Glu, Leu146Glu, lle152Glu, Gln156Glu, Ser163Glu, lle152Glu, Ser163Glu или Gln54Glu. Другим мутеином является мутеин, проявляющий сниженную восприимчивость к протеолитическому разрушению пи экспрессии, например, в дрожжах, по сравнению с человеческим FGF-21, в частности, человеческим FGF-21 с замещением Leu153 аминокислотой, выбранной из Gly, Ala, Val, Pro, Phe, Tyr, Trp, Ser, Thr, Asn, Asp, Gin, Glu, Cys или Met. Предпочтительным мутеином FGF-21 является мутированный FGF-21 в соответствии с SEQ ID NO:2, которая несет делецию аминокислот 1-28 человеческого FGF-21 (SEQ ID NO:1) и содержит дополнительный глицин на N конце.
Примеры слитых белков FGF-21 описаны, например, в Международных патентных публикациях WO 2004/110472 или WO 2005/113606, например, слитый белок FGF-21-Fc или слитый белок FGF-21-HSA. «Fc» означает часть Fc иммуноглобулина, например, часть Fc lgG4. «HSA» означает человеческий сывороточный альбумин.
Примеры конъюгатов FGF-21 описаны, например, в Международных патентных публикациях WO 2005/091944, WO 2006/050247 или WO 2009/089396, например, связанные с гликолем соединения FGF-21. Такие связанные с гликолем соединения FGF21 обычно несут полиэтиленгликоль (PEG), например, у аминокислотного остатка цистеина или лизина или у введенного N-связанного или O-связанного участка гликозилирования (именуемого в настоящем описании «пэгилированный FGF-21»). Такие пэгилированные соединения FGF-21 в целом проявляют продолжительное время действия, по сравнению с человеческим FGF-21. Подходящие ПЭГ имеют молекулярную массу примерно от 20000 до 40000 дальтон.
«Агонист GLP-1R» определяется как соединение, которое связывается с рецептором GLP-1 и активирует его, подобно GLP-1 (глюкагонподобному пептиду 1). Физиологические действия GLP-1 и/или агониста GLP-1R описаны, например, в публикации Nauck, M.A. et al. (1997) Exp. Clin. Endocrinol. Diabetes, 105, 187-195. Эти физиологические действия у здоровых индивидов, в частности людей, включают, например, глюкозозависимую стимуляцию секреции инсулина, подавление секреции глюкагона, стимуляцию биосинтеза (про)инсулина, снижение потребления пищи, замедление желудочного опорожнения и/или однозначную чувствительность к инсулину.
Подходящие анализы для выявления аонистов GLP-1R описаны, например, в публикациях Thorkildsen, Chr. et al. (2003), Journal of Pharmacology and Experimental Therapeutics, 307, 490-496; Knudsen, L.B. et al. (2007), PNAS, 104, 937-942, No. 3; Chen, D. et al. (2007), PNAS, 104, 943-948, No. 3; или в заявке на патент США US 2006/0003417 A1 (см., например, пример 8). Вкратце, в «анализе связывания с рецептором» очищенная мембранная фракция эукариотических клеток, содержащих, например, человеческий рекомбинантный рецептор GLP-1, например, клеток CHO, BHK или HEK293, инкубируют с тестируемым соединении или соединениями в присутствии, например, человеческого GLP-1, например, амида GLP-1 (7-36), который продается, например, с 125I (например, 80 кБк/пкмоль). Обычно используют различные концентрации тестируемого соединения или соединений, и величины IC50 определяют как концентрации, уменьшающиеся специфическое связывание человеческого GLP-1. В «функциональном анализе рецепторов» получали изолированные плазматические мембраны из эукариотических клеток, как, например, описано выше, экспрессирующих, например, человеческий рецептор GLP-1, и инкубировали с тестируемым соединением. Функциональный анализ проводят измерением цАМФ как реакцию на стимуляцию тестируемым соединением. В «анализе репортерного гена» эукариотические клетки, такие как, например, описаны выше, экспрессирующие, например, человеческий рецептор GLP-1 и содержащие, например, запускаемую элементом множественной реакции/элементом реакции цАМФ репортерную плазмиду, экспрессирующую ген люциферазы, культивируют в присутствии тестируемого соединения. Активности запускаемой элементом реакции цАМФ репортерной плазмиды, экспрессирующей ген люциферазы, измеряют как реакцию на стимуляцию тестируемым соединением.
Подходящие агонисты GLP-1R выбираются из биоактивного GLP-1, аналога GLP-1 или заместителя GLP-1, как, например, описано в публикациях Drucker, D.J. (2006) Cell Metabolism, 3, 153-165; Thorkildsen, Chr. (2003; см. выше); Chen, D. et al. (2007; см. выше); Knudsen, L.B. et al. (2007; см. выше); Liu, J. et al. (2007) Neurochem Int., 51, 361 -369, No. 6-7; Christensen, M. et al. (2009), Drugs, 12, 503-513; Maida, A. et al. (2008) Endocrinology, 149, 5670-5678, No. 11 и в заявке на патент США US 2006/0003417. Иллюстративные соединения представляют собой GLP-1 (7-37), GLP-1(7-36)амид, экстендин-4, лираглутид, CJC-1131, албугон, албиглутид, эксенатид, эксенатид-LAR, оксинтомодулин, ликсисенатид, генипрозид, AVE-0010, короткий пептид с агонистической активностью в отношении GLP-1R и/или низкомолекулярное органическое соединение с агонистической активностью в отношении GLP-1R.
Подробнее, человеческий GLP-1 (7-37) имеет аминокислотную последовательностью SEQ ID NO:3. Амид человеческого GLP-1 (7-36) имеет аминокислотную последовательность SEQ ID NO:4. Экстендин-4 имеет аминокислотную последовательность SEQ ID NO:5. Эксенатид имеет аминокислотную последовательность SEQ ID NO:6 и оксинтомодулин - аминокислотную последовательность SEQ ID NO:7. Аминокислотная последовательность ликсизенатида показана в SEQ ID NO:8. Структура ликсизенатида основана на эксендине-4(1-39), модифицированном на C-конце шестью дополнительными остатками лизина для противодействия немедленному физиологическому разрушению DPP-4 (дипептидил-пептидазой-4). Аминокислотная последовательность AVE0010 показана в SEQ ID NO:9.
Химическая структура лираглутида показана на фиг.1. Лирагутид получают замещением Liraglutide Lys 34 GLP-1 (7-37) на Arg, и добавлением C16 жирной кислоты в положении 26 с использованием спейсера в виде γ-глутаминовой кислоты. Химическим названием является [N-эпсилон(гамма-L-глутамоил(N-альфа-гексадеканоил)-Lys26,Arg34-GLP-1 (7-37)].
Химическая структура CJC-1131 показана на фиг.2. Альбумин прикреплен к C-концу GLP-1 с замещением d-аланина в положении 8. CJC-1131 проявляет очень хорошую комбинацию устойчивости и биологической активности.
Другие пептиды с агонистической активностью в отношении GLP-1R раскрыты, например, в заявке на патент США US 2006/0003417, а низкомолекулярные органические соединения с агонистической активностью в отношении GLP-1R раскрыты, например, в публикациях Chen et al. 2007, PNAS, 104, 943-948, No. 3 или Knudsen et al., 2007, PNAS, 104, 937-942.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция дополнительно содержит, по меньшей мере, одно противодиабетическое лекарственное средство и, по меньшей мере, один ингибитор DPP-4.
Иллюстративными противодиабетическими лекарственными средствами являются
a) инсулин,
b) тиазолидиндион, например, росиглитизон или пиоглитазон (см., например, Международную патентную публикацию, WO 2005/072769), метформин (N,N-диметилимидодикарбонимидовый диамид), или
c) сульфонилмочевина, такая как хлорпропамид (4-хлор-N-(пропилкарбамоил)бензолсульфонамид), толазамид (N-[(азепан-1-иламино)карбонил]-4-метилбензолсульфонамид), гликлазид (N-(гексагидроциклопента[c]пиррол-2(1H)-илкарбамоил)-4-метилбензолсульфонамид) или глимепирид (3-этил-4-метил-N-(4-[N-((1r,4r)-4-метилциклогексилкарбамоил)-сульфамоил]фенэтил)-2-оксо-2,5-дигидро-1H-пиррол-1-карбоксамид).
В соответствии с настоящим изобретением, «инсулин» означает естественно встречающийся инсулин, модифицированный инсулин или аналог инсулина, включая их соли и комбинации, например, комбинации модифицированного инсулина и аналога инсулина, например, инсулины, которые имеют аминокислотные обмены/делеции/добавления, а также другие модификации, такие как ацилирование или другая химическая модификация. Одним примером данного типа соединения является инсулин детемир, т.е., LysB29-тетрадеканоил/дес(B30) человеческий инсулин. Другим примером могут быть инсулины, в которые были включены ненатуральные аминокислоты или аминокислоты, которые являются в норме не кодирующими в эукариотах, такие как D-аминокислоты (Geiger, R. et al., Hoppe Seylers Z. Physiol. Chem. (1976) 357, 1267-1270; Geiger, R. et al., Hoppe Seylers Z. Physiol. Chem. (1975) 356, 1635-1649, No. 10; Krail, G. et al., Hoppe Seylers Z. Physiol. Chem. (1971) 352, 1595-1598, No. 1 1). Еще одними примерами являются аналоги инсулина, в которых C-концевая карбоновая кислота или A-цепи, или B-цепи, или обеих цепей замещены амидом.
«Модифицированный инсулин» предпочтительно выбран из ацилированного инсулина с инсулиновой активностью, в частности, в котором одна или более аминокислот в A и/или B цепи инсулина ацилированы, предпочтительно, человеческий инсулин, ацилированный в положении B29 (Tsai, Y.J. et al. (1997) Journal of Pharmaceutical Sciences, 86, 1264-1268, No. 11). Другие ацилированные инсулины представляют собой человеческий инсулин desB30 или бычий инсулин B01 (Tsai, Y.J. et al., см. выше). Другими примерами ацилированного инсулина являются, например, те, которые раскрыты в патентах США №№ 5750497 и 6011007. Обзор связей структуры и активности для модифицированных инсулинов представлен в публикации Mayer, J.P. et al. (2007) Biopolymers, 88, 687-713, No. 5. Модифицированные инсулины обычно получают химической и/или ферментной манипуляцией с инсулином или подходящим предшественником инсулина, таким как препроинсулин, проинсулин или их усеченные аналоги.
«Аналог инсулина» предпочтительно выбран из инсулина с инсулиновой активностью, имеющего одну или более мутаций, замещений, делеций и/или добавлений, в частности, инсулин с C- и/или N-концевым усечением в A и/или B цепи, предпочтительно, инсулин des(B30), инсулин PheB1, инсулин B1-4, человеческий инсулин AspB28 (инсулин аспарт), человеческий инсулин LysB28/ProB29 (инсулин лизпро), человеческий инсулин LysB03/GluB29 (инсулин глулизин) или человеческий инсулин GlyA21/ArgB31/ArgB32 (инсулин гларгин). Единственным условием аналога инсулина является то, что они имеет достаточную инсулиновую активность. Обзор связи структуры-активности для аналогов инсулина с обсуждением того, какие аминокислотные обмены, делеции и/или добавления допустимы, представлен в публикации Mayer, J.P. et al. (2007; см. выше). Аналоги инсулина представляют собой предпочтительно такие, где один или более из естественно встречающихся аминокислотных остатков, предпочтительно, один, два или три из них, были замещены другим аминокислотным остатком. Другими примерами аналогов инсулина являются C-концевые усеченные производные, такие как человеческий инсулин des(B30); аналгии инсулина с N-концевым усечением B-цепи, такие как инсулин des PheB1 или инсулин des B1-4; аналоги инсулина, в которых A-цепь и/или B-цепь имеет N-концевое удлинение, включая так называемые «преинсулины», где B-цепь имеет N-концевое удлинение; и аналоги инсулина, в которых A-цепь и/или B-цепь имеет C-концевое удлинение. Например, один или два Arg могут быть добавлены в положение B1. Примеры аналогов инсулина описаны в следующих патентах и их эквивалентах: в патенте США № 5618913, Европейских патентах EP 0254516A2 и EP 0280534A2. Обзор аналогов инсулина в клиническом применении представлен в публикации Mayer J.P. et al. (2007, см. выше). Аналоги инсулина или их предшественников обычно получают с использованием методик генной технологии, хорошо известных специалистам в данной области, обычно в бактериях или дрожжах, при необходимости, с последующей ферментной или синтетической манипуляцией. Альтернативно, аналоги инсулина могут быть получены химически (Cao, Q.P. et al. (1986) Biol. Chem. Hoppe Seyler, 367, 135-140, No. 2). Примерами определенных аналогов инсулина являются аспарт (т.е., человеческий инсулин AspB28); инсулин лизпро (т.е., человеческий инсулин LysB28, ProB29); инсулин глулизин (т.е., человеческий инсулин LysB03, GluB29); и инсулин гларгин (т.е., человеческий инсулин GlyA21, ArgB31, ArgB32).
Иллюстративными ингибиторами DPP-4 являются
ситаглиптин: (R)-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазол[4,3-a]-пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амин,
вилдаглиптин: (S)-1-[N-(3-гидрокси-1-адамантил)глицил]пирролидин-2-карбонитрил,
саксаглиптин: (1S,3S,5S)-2-[(2S)-2-амино-2-(3-гидрокси-1-адамантил)ацетил]-2-азабицикло[3.1.0]гексан-3-карбонитрил,
линаглиптин: 8-[(3R)-3-аминопиперидин-1-ил]-7-(бут-2-ин-1-ил)-3-метил-1-[(4-метилхиназолин-2-ил)метил]-3,7-дигидро-1H-пурин-2,6-дион),
адоглиптин: (2-({6-[(3R)-3-аминопиперидин-1-ил]-3-метил-2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил}метил)бензонитрил и
берберин, которой представляет собой соль четвертичного аммония из группы изохинолиновых алкалоидов, обнаруживаемых в корнях, корневищах, стволах и коре растений, таких как барбарис, желтокорник канадский (Hydrastis canadensis) и китайский коптис.
Отдельные соединения фармацевтической композиции по настоящему изобретению могут комбинироваться в одной препаративной форме или содержаться в нескольких препаративных формах, например, для одновременного или последующего, т.е., последовательного введения, или их комбинаций.
В соответствии с настоящим изобретением, комбинация, по меньшей мере, одного соединения FGF-21 и, по меньшей мере, одного агониста GLP-1R к удивлению привела к синергическому эффекту в снижении уровней глюкозы в плазме, как показано экспериментальными моделями в разделе «Примеры». Экспериментальными моделями являются мыши ob/ob или мыши с ожирением и мыши db/db. Мышь ob/ob представляет собой мутантную мышь, которая не может продуцировать гормон лептин, который регулирует аппетит. Следовательно, мышь ob/ob избыточно поедает пищу и становится очень тучной. Это стандартная экспериментальная модель гипергликемии, резистентности к инсулину и ожирения. Другой стандартной моделью диабета является мышь db/db, имеющая недостаточную активность рецепторов лептина. Эта мышь также характеризуется ожирением, гипергликемией и резистентностью к инсулину.
Фармацевтическая композиция по настоящему изобретению содержит терапевтически эффективные количества отдельных соединений и в целом фармацевтически приемлемый носитель, разбавитель или эксципиент, например, стерильную воду, физиологический солевой раствор, бактериостатический солевой раствор, т.е., солевой раствор, содержащий примерно 0,9% мг/мл бензилового спирта, забуференный фосфатом солевой раствор, раствор Хэнкса, лактат Рингера, лактозу, дектрозу, сахарозу, трегалозу, сорбит, маннит и тому подобные. Композиция представляет собой в целом раствор или суспензию. Она может вводиться перорально, подкожно, внутримышечно, внутрилегочно, путем ингаляции и/или посредством введений длительного высвобождения. Предпочтительно, композиция вводится подкожно.
Термин «терапевтически эффективное количество» в целом означает количество соединения, которое приводит к желательному терапевтическому и/или профилактическому эффекту, не вызывая неприемлемых побочных эффектов. Типичный диапазон дозировки составляет от примерно 0,01 мг в день до примерно 1000 мг в день. Предпочтительный диапазон дозировки для каждого терапевтически эффективного соединения составляет от примерно 0,1 мг в день до примерно 100 мг в день, а наиболее предпочтительный диапазон дозировки составляет от примерно 1,0 мг/день до примерно 10 мг/день, в частности, примерно 1-5 мг/день.
В случае последовательного введения (введений), отдельные соединения фармацевтической композиции вводятся в течение периода времени, когда синергический эффект соединения FGF-21 и агониста GLP-1R еще можно измерить, например, в «тесте на переносимости глюкозы», как, например, показано в разделе «Примеры». Тест на переносимость глюкозы представляет собой тест для определения того, как быстро глюкоза выводится из крови после введения глюкозы. Глюкоза чаще всего вводится перорально («пероральный тест на переносимость глюкозы» или «OGTT»). Период времени для последовательного введения отдельных соединений, в частности, соединения FGF-21 и агониста GLP-1R, обычно составляет в пределах одного часа, предпочтительно, в пределах получаса, наиболее предпочтительно, в пределах 15 минут, в частности, в пределах 5 минут.
В целом, фармацевтическая композиция вводится пациенту один или несколько раз в день или один или несколько раз в неделю, или даже при необходимости в течение более длительных периодов времени. Наиболее предпочтительным видом применения фармацевтической композиции по настоящему изобретению является подкожное введение от одного до трех раз в день в комбинированной дозе.
Фармацевтическая композиция по настоящему изобретению снижает уровни глюкозы в крови до нормогликемических уровней и увеличивает расход энергии путем более быстрой и более эффективной утилизации глюкозы и, таким образом, может применяться для лечения, по меньшей мере, одного метаболического синдрома и/или атеросклероза, в частности, диабета 1-го типа или 2-го типа, дислипидемии, ожирения и/или избыточной массы тела, в частности, диабета 2-го типа.
Следовательно, настоящее изобретение также относится к применению описанной фармацевтической композиции (композиций) для получения лекарственного препарата для лечения, по меньшей мере, одного из указанных выше заболеваний или расстройств и к способу лечения, по меньшей мере, одного из указанных выше заболеваний у пациента. Пациент, в частности, выбран из пациента с диабетом 1-го типа; пациента с диабетом 2-го типа, в частности, пациента с диабетом 2-го типа, получающего диетологическое лечение; пациента с диабетом 2-го типа, получающего лечение сульфонилмочевиной; пациента с диабетом 2-го типа в далеко запущенной стадии и/или пациента с диабетом 2-го типа, получающего длительное лечение инсулином. Лекарственный препарат может быть получен способами, известными специалисту в данной области, например, смешиванием фармацевтически эффективных количеств соединения или соединений с приемлемым фармацевтическим носителем, разбавителем или эксципиентом, как описано выше.
Следующие чертежи и примеры представлены только с целью иллюстрации и не предназначены для ограничения настоящего изобретения.
ЧЕРТЕЖИ
На фиг.1 показана химическая структура лираглутида.
На фиг.2 показана химическая структура CJC-1131.
На фиг.3 показаны результаты перорального теста переносимости глюкозы (OGTT) после 10 дней подкожной инъекции FGF-21 вместе с AVE0010 у мышей ob/ob.
На фиг.4 показаны уровни глюкозы в плазме в течение времени после подкожной инъекции FGF-21 вместе с AVE0010 у мышей ob/ob.
На фиг.5 показаны результаты OGTT после 21 дня подкожной инъекции FGF-21 вместе с AVE0010 у мышей db/db.
На фиг.6 показаны уровни глюкозы в плазме в течение времени после подкожной инъекции FGF-21 вместе с AVE0010 у мышей db/db.
ПРИМЕРЫ
1. Лечение мышей ob/ob
Самок мышей ob/ob (B6.V-LEP OB/J, в возрасте 6 недель) получали в компании Charles Rivers Laboratories (Sulzfeld, Germany). Мышей методом случайной выборки включали в группы, получавшие лечение тестируемым соединением или носителем, и рандомизацию стратифицировали по массе тела и уровням глюкозы в крови после приема пищи. Животных содержали группами по 6 мышей при 23°C и при 12-часовом цикле света-темноты. Все экспериментальные процедуры проводили в соответствии с Законом Германии о защите животных.
Мышей ob/ob лечили носителем (PBS, солевым раствором, забуференным фосфатом), 0,05 мг/кг/день AVE0010 (SEQ ID NO:9), 0,75 мг/кг/день рекомбинантного человеческого FGF-21 (SEQ ID NO:2) или комбинированной дозой FGF-21 (SEQ ID NO:2) и AVE0010 (SEQ ID NO:9), (0,75+0,05 мг/кг/день) подкожно, один раз в день. Мыши имели неограниченный доступ к стандартному сухому корму для грызунов в течение периодов медикаментозного лечения. Массу тела регистрировали через день, и потребление пищи измеряли один раз в неделю в течение всего исследования. За один день до первого лечения и через 10 дней исследования измеряли уровень глюкозы в крови кровопусканием из кончика хвоста в условиях сытости. Как показано на фиг.4, уровни глюкозы в крови получавших лечение мышей стали нормальными (нормогликемическими). На 8-ой день исследования, выполняли тест на переносимость глюкозы (OGTT). У мышей натощак проводили пероральную провокационную пробу введением глюкозы в количестве 2 г/кг. Содержание глюкозы в крови измеряли в указанные точки времени кровопусканием из кончика хвоста без анестезии. Результаты OGTT показаны на фиг.3. По сравнению с введением только FGF-21 или только AVE0010, устойчивость к глюкозе была заметно сильнее улучшена лечением комбинацией. Страдающие ожирением животные, получавшие лечение комбинацией, были даже более устойчивы к глюкозе, чем худые контрольные животные.
2. Лечение мышей db/db
Самок мышей db/db (BKS.Cg-m +/+ Leprdb /J, возраст 6 недель) лечили носителем (PBS); 0,05 мг/кг/день AVE0010, 0,75 мг/кг/день рекомбинантного человеческого FGF-21 (SEQ ID NO:2) или комбинированной дозой FGF-21 (SEQ ID NO:2) и AVE0010 (SEQ ID NO:9), (0,75+0,05 мг/кг/день) подкожно один раз в день. Мыши имели неограниченный доступ к корму. Перед первым лечением, через одну неделю и через 4 недели содержание в крови глюкозы и HbA1c измеряли в условиях сытости. После 21 дней лечения, начинали тест на переносимость глюкозы (OGTT). У мышей натощак проводили пероральную провокационную пробу введением раствора глюкозы в количестве 2 г/кг, и содержание глюкозы в крови измеряли в указанные точки времени. Результаты показаны на фиг.5 и 6. Введение комбинации FGF-21 плюс AVE0010 приводит к нормализации содержания глюкозы в крови и резко улучшало устойчивость к глюкозе, по сравнению с контрольными животными с ожирением, получавшими носитель. С другой стороны, по сравнению с лечением комбинацией, лечение отдельно FGF21 или AVE0010 ведет только к ингибированию увеличения содержания глюкозы в крови и небольшому улучшению устойчивости к глюкозе.
ПОСЛЕДОВАТЕЛЬНОСТИ
Человеческий FGF-21 (SEQ ID NO:1):
Мутированный FGF-21 (G+FGF21 H29-S209; SEQ ID NO:2):
Человеческий GLP-1 (7-37) (SEQ ID NO:3):
Человеческий GLP-1 (7-36)NH2 (SEQ ID NO:4):
Экстендин-4 (SEQ ID NO:5):
Эксенатид (SEQ ID NO:6):
Оксинтомодулин (SEQ ID NO:7):
Ликсисенатид (SEQ ID NO:8)
AVE0010 (SEQ ID NO:9):
1. Фармацевтическая композиция для снижения уровней глюкозы, содержащая по меньшей мере одно соединение FGF-21 (фактор роста фибробластов 21), имеющее аминокислотную последовательность согласно SEQ ID NO: 2 и по меньшей мере один агонист GLP-1R