Композиции пептидных радиоактивных индикаторов
Иллюстрации
Показать всеИзобретение относится к композициям визуализирующего агента, содержащим меченные радиоактивным изотопом 18F cMet-связывающие пептиды, подходящие для визуализации in vivo с использованием позитронно-эмиссионной томографии (PET). Также описаны фармацевтические композиции, способы получения композиций, а также способы визуализации in vivo с использованием данных композиций для применения в терапии рака. 4 н. и 8 з.п. ф-лы, 1 ил., 14 пр.
Реферат
Область изобретения
Настоящее изобретение относится к композициям визуализирующего агента, содержащим меченные радиоактивной меткой cMet-связывающие пептиды (сМВР), подходящие для визуализации in vivo с использованием позитронно-эмиссионной томографии (PET). Эти cMet-связывающие пептиды мечены радиоактивным изотопом 18F. Также описаны фармацевтические композиции, способы получения агентов и приготовления композиций, а также способы визуализации in vivo с использованием данных композиций, особенно для применения в диагностике рака.
Предшествующий уровень техники
Фактор роста гепатоцитов (HGF), также известный как рассеивающий фактор (SF), представляет собой фактор роста, который вовлечен в различные физиологические процессы, такие как заживление ран и ангиогенез. Взаимодействие HGF с его высокоаффинным рецептором (c-Met) вовлечено в рост, инвазию и метастазирование опухолей.
В работе Knudsen и др. рассмотрена роль HGF и c-Met в раке предстательной железы с возможными применениями для визуализации и терапии (Adv. Cancer Res., 91, 31-67 (2004)). Меченые антитела против met для диагностики и терапии описаны в WO 03/057155.
Показано, что c-Met вовлечен в рост, инвазию и метастазирование опухолей при многих видах рака эпителиального происхождения у человека. c-Met экспрессируется большинством карцином, и его повышенная относительно нормальной ткани экспрессия зарегистрирована при раке легкого, молочной железы, колоректальном раке, раке поджелудочной железы, головы и шеи, желудка, гепатоцеллюлярном раке, раке яичника, почки, глиоме, меланоме и многих саркомах. В случае колоректальной карциномы (CRC) сверхэкспрессия c-Met зарегистрирована в диспластических очагах аберрантных крипт, участках самых ранних предопухолевых поражений данного заболевания. При плоскоклеточном раке головы и шеи c-Met, по имеющимся данным, экспрессируется или сверхэкспрессируется приблизительно в 80% случаев первичных опухолей. При метастазах рака предстательной железы в кости сообщалось, что c-Met сверхэкспрессируется более чем в 80% случаев костного метастаза.
В нормальных условиях c-Met экспрессируется на эпителиальных клетках и активируется по паракринному механизму под действием HGF мезенхимального происхождения. Активация c-Met в нормальных клетках является кратковременным и строго регулируемым событием. Однако, в опухолевых клетках c-Met может быть конститутивно активным. При раке аберрантная стимуляция c-Met может достигаться посредством амплификации/сверхэкспрессии c-Met, активации мутаций c-Met (например, структурных изменений) и приобретения автономного контроля роста в результате образования аутокринных сигнальных петель. Помимо этого, дефектная понижающая регуляция c-Met-рецептора также будет вносить вклад в аберрантную экспрессию c-Met в клеточной мембране. В то время как сверхэкспрессия c-Met является зависимой от HGF (по аутокринному/паракринному механизму), структурные изменения, вызываемые мутациями, не зависят от HGF (например, потеря внеклеточного домена).
В WO 2004/078778 описаны полипептиды или мультимерные пептидные конструкции, которые связываются с c-Met или комплексом, содержащим c-Met и HGF. Описано приблизительно 10 различных структурных классов пептидов. В WO 2004/078778 описано, что эти пептиды могут быть мечены детектируемой меткой для применений in vitro и in vivo или лекарственным средством для терапевтических применений. Детектируемая метка может представлять собой: фермент, флуоресцентное соединение, оптический краситель, ион парамагнитного металла, контрастный агент для ультразвукового исследования или радионуклид. В WO 2004/078778 установлено, что предпочтительные метки являются радиоактивными или парамагнитными и наиболее предпочтительно включают металл, который хелатирован металлохелатирующим агентом. В WO 2004/078778 установлено, что радионуклиды могут быть выбраны из: 18F, 124I, 125I, 131I, 123I, 77Br, 76Br, 99mTc, 51Cr, 67Ga, 68Ga, 47Sc, 167Tm, 141Ce, 111In, 168Yb, 175Yb, 140La, 90Y, 88Y, 153Sm, 166Ho, 165Dy, 166Dy, 62Cu, 64Cu, 67Cu, 97Ru, 103Ru, 186Re, 203Pb, 211Bi, 212Bi, 213Bi, 214Bi, 105Rh, 109Pd, 117mSn, 149Pm, 161Tb, 177Lu, 198Au и 199Au. В WO 2004/078778 (страница 62) установлено, что предпочтительными радионуклидами для диагностических целей являются: 64Cu, 67Ga, 68Ga, 99mTc и 111In, при этом особенно предпочтительным является 99mTc.
В WO 2008/139207 описаны cMet-связывающие циклические пептиды из 17-30 аминокислот, меченные оптической репортерной визуализируемой группировкой, подходящей для визуализации организма млекопитающего in vivo с использованием света в диапазоне длин волн от зеленой до ближней инфракрасной области спектра 600-1200 нм. Такие cMet-связывающие пептиды содержат аминокислотную последовательность:
Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6;
где X1 представляет собой Asn, His или Tyr;
X2 представляет собой Gly, Ser, Thr или Asn;
X3 представляет собой Thr или Arg;
X4 представляет собой Ala, Asp, Glu, Gly или Ser;
X5 представляет собой Ser или Thr;
X6 представляет собой Asp или Glu;
и все Cysa-d представляют собой остатки цистеина, так что остатки а и b, а также c и d циклизованы с образованием двух отдельных дисульфидных связей. Оптическим репортером согласно WO 2008/139207 предпочтительно является цианиновый краситель.
В WO 2009/016180 описаны cMet-связывающие циклические пептиды, аналогичные таковым из WO 2008/139207, где оптическим репортером является бензопирилиевый краситель. В WO 2008/139207 и WO 2009/016180 установлено, что такие агенты полезны для оптического применения in vitro и in vivo, в особенности для оптической визуализации in vivo организма человека. Оптическая визуализация колоректального рака является предпочтительным применением.
Настоящее изобретение
Настоящее изобретение относится к композициям визуализирующего агента, содержащим меченные радиоактивным 18F cMet-связывающие пептиды, подходящие для визуализации in vivo с использованием позитронно-эмиссионной томографии (PET). Такие cMet-связывающие пептиды мечены через остаток лизина (Lys).
Предпочтительно, такие композиции визуализирующего агента подавляют уровень присутствующего немеченого cMet-связывающего циклического пептида. В этом и заключается преимущество, поскольку 18F-меченый сМВР представляет собой радиоактивный индикатор, присутствующий и вводимый в экстремально низкой концентрации из расчета на химическое вещество, таким образом, немеченый сМВР, если его не удалить, в противном случае будет присутствовать в большом химическом избытке. Установлено, что это важно при применениях РЕТ-визуализации in vivo, поскольку иначе немеченый сМВР эффективно конкурирует с 18F-меченым сМВР за сайты связывания с c-Met in vivo. Ввиду этого наблюдается отрицательное воздействие на "захват" и таким образом на соотношение сигнал/фон in vivo. Этот вопрос не был описан в предшествующем уровне техники, поскольку, например, если cMet-связывающие пептиды мечены оптическими репортерными красителями, то количества рассматриваемого химического вещества - меченого пептида, существенно превышают таковые для PET, и ввиду этого вопрос о конкуренции не поднимается.
Путем использования композиций визуализирующего агента по настоящему изобретению также решают ранее непризнанную проблему адгезии меченных радиоактивной меткой сМВР-пептидов к различным материалам, включая фильтры. Предложены солюбилизированные композиции, что подразумевает возможность получения радиоактивных индикаторов на основе 18F-меченых сМВР и проведения стерилизующей фильтрации без значительной потери радиоактивного индикатора, обусловленной адсорбцией на фильтре.
Краткое описание графических материалов
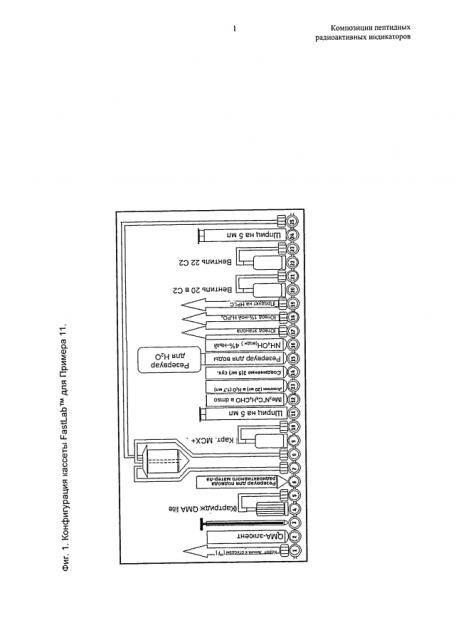
На Фиг.1 представлена конфигурация кассеты FastLab™, где:
QMA обозначает SPE-картридж (четвертичный метиламмоний; обработка воды);
МСХ+ обозначает SPE-картридж (катионообменник смешанного действия);
С2 обозначает SPE-картридж (низкая гидрофобность; на основе диоксида кремния).
Подробное описание изобретения
В первом аспекте настоящего изобретения предложен визуализирующий агент, содержащий меченный радиоактивным 18F cMet-связывающий циклический пептид, где указанный cMet-связывающий циклический пептид представляет собой 18-30-мерный циклический пептид формулы I:
Z 1 − [ c M B P ] − Z 2 ( I ) ,
где:
cMBP (cMet-связывающий циклический пептид) имеет формулу II:
− ( A ) x − Q − ( A ' ) y − ( I I ) ,
где Q представляет собой аминокислотную последовательность (SEQ-1):
-Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6-,
где X1 представляет собой Asn, His или Tyr;
X2 представляет собой Gly, Ser, Thr или Asn;
X3 представляет собой Thr или Arg;
X4 представляет собой Ala, Asp, Glu, Gly или Ser;
X5 представляет собой Ser или Thr;
X6 представляет собой Asp или Glu;
и все Cysa-d представляют собой остатки цистеина, так что остатки a и b, а также c и d циклизованы с образованием двух отдельных дисульфидных связей;
A и A' независимо представляют собой любую аминокислоту, отличную от Cys, при условии, что по меньшей мере один из A и A' присутствует и представляет собой Lys;
x и y независимо представляют собой целые числа величиной от 0 до 13 и выбраны так, что сумма x и y равна от 1 до 13;
Z1 присоединен к N-концу сМВР и представляет собой Н или MIG;
Z2 присоединен к С-концу сМВР и представляет собой OH, OBc или MIG,
где Bc представляет собой биосовместимый катион;
каждый MIG независимо представляет собой группу, ингибирующую метаболизм, которая представляет собой биосовместимую группу, ингибирующую или подавляющую метаболизм сМВР-пептида in vivo;
где сМВР мечен посредством 18F по остатку Lys групп A или A'.
Под термином "визуализирующий агент" понимают соединение, подходящее для визуализации организма млекопитающего. Предпочтительно, млекопитающее представляет собой интактный организм млекопитающего in vivo и более предпочтительно представляет собой человека. Предпочтительно, чтобы при введении профессиональным медицинским специалистом визуализирующий агент можно было ввести в организм млекопитающего минимально инвазивным образом, т.е. без существенного риска для здоровья млекопитающего. Таким минимально инвазивным введением предпочтительно является внутривенное введение в периферическую вену указанного субъекта, без необходимости местной или общей анестезии.
Термин "визуализация in vivo", как он использован в данном описании, относится к тем методам, с помощью которых можно неинвазивно получать изображения всего или части внутреннего содержимого млекопитающего.
Под термином "cMet-связывающий циклический пептид" понимают пептид, который связывается с рецептором фактора роста гепатоцитов, также известным как c-Met (или просто MET). Такими подходящими пептидами по настоящему изобретению являются циклические пептиды формулы I из 18-30 аминокислот. Такие пептиды имеют кажущуюся KD (константу диссоциации) для c-Met менее чем примерно 20 нМ. Последовательность указанных сМВР-пептидов содержит остатки пролина, и известно, что такие остатки могут проявлять цис/транс-изомеризацию амидной связи остова. сМВР-Пептиды по настоящему изобретению включают все такие изомеры.
Группа Z1 замещает аминогруппу последнего аминокислотного остатка в сМВР, т.е. на амино-конце. Таким образом, когда Z1 представляет собой Н, амино-конец сМВР оканчивается свободной группой NH2 последнего аминокислотного остатка. Группа Z2 замещает карбонильную группу последнего аминокислотного остатка сМВР, т.е. на карбокси-конце. Таким образом, когда Z2 представляет собой ОН, карбокси-конец сМВР оканчивается свободной группой CO2H последнего аминокислотного остатка, и когда Z2 представляет собой OBc, эта концевая карбоксильная группа ионизирована в виде группы CO2Bc.
Под термином "биосовместимый катион" (Bc) понимают положительно заряженный противоион, который образует соль с ионизированной отрицательно заряженной группой, где указанный положительно заряженный противоион является также нетоксичным и поэтому подходящим для введения в организм млекопитающего, особенно организм человека. Примеры подходящих биосовместимых катионов включают ионы щелочных металлов натрия или калия; щелочноземельных металлов кальция и магния, и ион аммония. Предпочтительными биосовместимыми катионами являются катионы натрия и калия, наиболее предпочтительно натрия.
Под термином "ингибирующая метаболизм группа" (MIG) понимают биосовместимую группу, которая ингибирует или подавляет метаболизм пептида сМВР in vivo либо по амино-концу (Z1), либо по карбокси-концу (Z2). Такие группы хорошо известны специалистам в данной области техники, и их подходящим образом выбирают для амино-конца пептида из: N-ацилированных групп -NH(C=O)RG, где ацильная группа -(C=O)RG имеет RG, выбранный из C1-6алкильных или С3-10арильных групп, или содержит полиэтиленгликолевую (ПЭГ) структурную единицу; для карбокси-конца пептида из: карбоксамида, сложного трет-бутилового эфира, сложного бензилового эфира, сложного циклогексилового эфира, аминоспирта или полиэтиленгликолевой (ПЭГ) структурной единицы. Такие предпочтительные ПЭГ-группы представляют собой биомодификаторы формулы IA или IB:
17-Амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановая кислота формулы IA,
где p равно целому числу от 1 до 10. Альтернативно, можно использовать ПЭГ-подобную структуру на основе производного пропионовой кислоты формулы IB:
,
где p является таким, как определено для формулы IA, а q равно целому числу от 3 до 15.
В формуле IB p предпочтительно равен 1 или 2, а q предпочтительно равно 5-12.
Такими предпочтительными аминоконцевыми группами MIG являются ацетил, бензилоксикарбонил или трифторацетил, наиболее предпочтительно ацетил.
Под термином "меченный радиоактивным 18F" понимают, что cMet-связывающий циклический пептид ковалентно конъюгирован с радиоактивным изотопом 18F. 18F подходящим образом присоединен посредством связи C-F по типу фторалкила или фторарила, поскольку такие связи относительно стабильны in vivo и таким образом придают устойчивость к метаболическому отщеплению радиоактивной метки 18F от сМВР-пептида. Предпочтительно 18F присоединен посредством связи C-F по типу фторарила. 18F может быть присоединен непосредственно к одной из аминокислот сМВР, но предпочтительно конъюгирован с сМВР как часть радиоактивного фторированного заместителя. Указанные заместители предпочтительно представлены формулой:
,
где:
L представляет собой синтетическую линкерную группу формулы -(A)m-, где каждый А независимо представляет собой -CR2-, -CR=CR-, -С≡С-, -CR2CO2-, -CO2CR2-, -NR(C=O)-, -(C=O)NR-, -NR(C=O)NR-, -NR(C=S)NR-, -SO2NR-, -NRSO2-, -CR2OCR2-, -CR2SCR2-, -CR2NRCR2-, -CR2-O-N=, -CR2-O-NR-, -CR2-O-NH(CO)-, С4-8циклогетероалкиленовую группу, С4-8циклоалкиленовую группу, C5-12ариленовую группу или C3-12 гетероариленовую группу, аминокислоту, сахар или монодисперсную полиэтиленгликолевую (ПЭГ) структурную единицу;
каждый R независимо выбран из Н, С1-4алкила, C2-4алкенила, C2-4алкинила, C1-4алкоксиалкила или C1-4гидроксиалкила;
m равно целому числу величиной от 1 до 20;
n равно целому числу величиной 0 или 1.
Под термином "аминокислота" понимают L- или D-аминокислоту, аминокислотный аналог (например, нафтилаланин) или аминокислотный миметик, которые могут иметь природное происхождение или исключительно синтетическое происхождение и могут быть оптически чистыми, т.е. представлять собой единичный энантиомер и, следовательно, быть хиральными, или смесь энантиомеров. В данном описании используют традиционные 3-буквенные или однобуквенные сокращения для аминокислот. Предпочтительно, аминокислоты по настоящему изобретению являются оптически чистыми. Под термином "аминокислотный миметик" понимают синтетические аналоги существующих в природе аминокислот, которые представляют собой изостеры, т.е. разработаны с целью имитации пространственной и электронной структуры природного соединения. Такие изостеры общеизвестны среди специалистов в данной области техники и включают, но этим не ограничиваются, депсипептиды, ретроинверсопептиды, тиоамиды, циклоалканы или 1,5-дизамещенные тетразолы (см. М. Goodman, Biopolymers, 24, 137 (1985)).
Под термином "пептид" понимают соединение, содержащее две или более чем две аминокислоты, определенные ниже, соединенные посредством пептидной связи (то есть амидной связью, соединяющей амин одной аминокислоты с карбоксилом другой).
Под термином "сахар" понимают моно-, ди- или трисахарид. Подходящие сахара включают: глюкозу, галактозу, мальтозу, маннозу и лактозу. В сахар возможно могут быть введены функциональные группы для обеспечения легкого сочетания с аминокислотами. Так, например, глюкозаминное производное аминокислоты можно конъюгировать с другими аминокислотами посредством пептидных связей. Одним из примеров этого является глюкозаминное производное аспарагина (имеющееся в продаже от NovaBiochem):
В том случае, когда A и A' представляют собой "любую аминокислоту, отличную от Cys", это означает, что дополнительная аминокислота из групп A и A' не содержит свободных тиоловых групп, в частности остатков Cys. Это так потому, что наличие дополнительного остатка Cys повышало бы риск скремблирования дисульфидных мостиков, а именно дисульфидных мостиков Cysa-Cysb и Cysc-Cysd, в последовательности Q с последующей потерей или уменьшением cMet-связывающей аффинности.
Предпочтительные признаки
Предпочтительные cMBP-пептиды по настоящему изобретению имеют KD для связывания c-Met с комплексом c-Met/HGF менее чем примерно 10 нМ (на основании измерений поляризации флуоресценции в анализе), наиболее предпочтительно в диапазоне 1-5 нМ, в идеальном случае менее 3 нМ.
сМВР-Пептид формул I и II предпочтительно имеет формулу IIA:
− ( A ) x − Q − ( A ' ) z − L y s − ( I I A ) ,
где A является таким, как определено для формулы II,
z равно целому числу величиной от 0 до 12, и сумма x и z равна от 0 до 12,
и сМВР содержит только один остаток Lys.
Так, в формуле IIA единственный остаток Lys локализован конкретно на С-конце сМВР. Это в свою очередь означает, что радиоактивная метка 18F предпочтительно локализована на С-конце.
Q предпочтительно содержит аминокислотную последовательность SEQ-2 или SEQ-3:
Ser-Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6 (SEQ-2);
Ala-Gly-Ser-Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6-Gly-Thr (SEQ-3).
В SEQ-1, SEQ-2 и SEQ-3 X3 предпочтительно представляет собой Arg. В формуле I и формуле II группа -(A)x- или -(A')y- предпочтительно содержит линкерный пептид, который выбран из:
-Gly-Gly-Gly-Lys- (SEQ-4),
-Gly-Ser-Gly-Lys- (SEQ-5) или
-Gly-Ser-Gly-Ser-Lys- (SEQ-6).
сМВР-Пептид согласно первому аспекту предпочтительно имеет аминокислотную последовательность (SEQ-7):
Ala-Gly-Ser-Cysa-Tyr-Cysc-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cysd-Trp-Cysb-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys.
Предпочтительные визуализирующие агенты по настоящему изобретению содержат пептид сМВР, защищенный по обоим концам группами MIG, т.е. предпочтительно оба Z1 и Z2 представляют собой MIG, которые обычно будут разными. Наличие обоих концов пептида, защищенных таким способом, важно для применений при визуализации in vivo, поскольку иначе можно ожидать быстрого метаболизма пептида с последующей потерей аффинности селективного связывания для c-Met. В том случае, когда оба Z1 и Z2 представляют собой MIG, предпочтительно, чтобы Z1 представлял собой ацетил, a Z2 представлял собой первичный амид. Наиболее предпочтительно, чтобы Z1 представлял собой ацетил, a Z2 представлял собой первичный амид, и группировка 18F была присоединена к эпсилон-аминогруппе боковой цепи остатка лизина в сМВР.
Радиоактивный фторированный заместитель -(L)n-18F может быть присоединен к альфа-аминогруппе N-конца cMet-связывающего пептида или альтернативно к аминогруппе боковой цепи каких-либо амино-замещенных аминокислот (например, остатков Lys). Предпочтительно, он присоединен к эпсилон (s) аминогруппе остатка Lys в сМВР.
В предпочтительных радиоактивных фторированных заместителях -(L)n-18F n равно 1, т.е. присутствует синтетическая линкерная группа, которая определена выше. Такие более предпочтительные заместители содержат радиоактивную метку 18F, связанную с фенильной группой, т.е. данный заместитель имеет формулу:
− ( A ) x C 6 H 4 − 18 F ,
где: A такой, как определено выше,
x равно целому числу величиной от 0 до 5.
Такие наиболее предпочтительные заместители являются результатом либо N-ацилирования аминогруппы остатка Lys активированным фторированным сложным эфиром, либо конденсации аминооксипроизводного по аминогруппе остатка Lys с фторированным бензальдегидом, и имеют формулу:
Визуализирующие агенты по первому аспекту могут быть получены, как описано в пятом аспекте (ниже).
Во втором аспекте настоящего изобретения предложена композиция визуализирующего агента, содержащая:
(1) меченный радиоактивным 18F cMet-связывающий циклический пептид по первому аспекту;
(2) немеченый cMet-связывающий циклический пептид;
где указанный cMet-связывающий циклический пептид имеет одну и ту же аминокислотную последовательность в (1) и (2),
и где немеченый сМВР-пептид присутствует в указанной композиции не более чем в 50-кратном молярном количестве по отношению к 18F-меченому сМВР-пептиду.
Предпочтительными воплощениями меченного радиоактивным 18F cMet-связывающего циклического пептида во втором аспекте являются такие, которые описаны в первом аспекте (выше).
Термин "композиция" имеет свое общепринятое значение, то есть это смесь определенных компонентов. Композиция может быть в твердой форме или в форме жидкости/раствора.
Под термином "немеченый" понимают, что cMet-связывающий циклический пептид не является радиоактивным, т.е. не мечен радиоактивным 18F или любым другим радиоактивным изотопом. В композиции могут присутствовать один или более таких пептидов, и такие немеченые пептиды главным образом включают нерадиоактивные предшественники по четвертому аспекту (ниже). Термин "немеченый" включает в себя cMet-связывающий циклический пептид, меченный 19F, где указанный 19F присутствует в составе 18F- фторида, использованного для введения радиоактивной метки в указанный cMet-связывающий циклический пептид, и ввиду этого является продуктом этой же реакции радиоактивного мечения. Как известно в данной области техники, если два фтор-замещенных соединения отличаются только изотопами атома фтора, их поведение с точки зрения химии практически одинаково, и поэтому разделить их будет крайне трудно. Немеченый cMet-связывающий циклический пептид или предшественник предпочтительно имеет уже присоединенные группы Z1 и/или Z2. Авторы настоящего изобретения обнаружили, что когда для конъюгирования с предшественником сМВР-пептида, функционализированным группой аминоокси, используют 18F-меченый альдегид, то главным источником побочных продуктов являются нерадиоактивные альдегидные примеси. Такой важной альдегидной примесью в 18F-бензальдегиде является DMAP (т.е. 4-диметиламино)-бензальдегид. Следовательно, продукты конъюгирования нерадиоактивных альдегидов (таких как DMAP) с сМВР-пептидом, функционализированным группой аминоокси, также находятся в пределах объема термина "немеченый cMet-связывающий циклический пептид".
Предпочтительно, немеченый cMet-связывающий циклический пептид присутствует в указанной композиции не более чем в 30-кратном, более предпочтительно не более чем в 20-кратном, наиболее предпочтительно менее чем в 10-кратном молярном количестве по отношению к соответствующему 18F-меченому пептиду.
Композиция по второму аспекту предпочтительно существует в форме раствора, причем в растворе находятся оба компонента (1) и (2). Более предпочтительно, данный раствор представляет собой биосовместимый растворитель или смесь двух либо более таких растворителей. Такие предпочтительные биосовместимые растворители описаны в третьем аспекте (ниже), и предпочтительно содержат водный растворитель.
Авторы настоящего изобретения обнаружили, что при концентрациях радиоактивного индикатора приблизительно в диапазоне концентраций 1-50 мкг/мл 18F-меченые сМВР-пептиды по изобретению демонстрируют нежелательное связывание с рядом материалов. Поскольку радиоактивный индикатор присутствует в такой очень низкой концентрации, то даже небольшое количество химически адсорбированного вещества может составлять значительный процент от количества имеющегося радиоактивного изотопа. Такую концентрацию радиоактивного индикатора следует сравнить, например, с концентрацией соответствующих меченных цианиновым красителем cMet-связывающих пептидов, для которых концентрация будет составлять приблизительно 2-10 мг/мл, т.е. выше почти в тысячу раз. В таких случаях потеря микрограммовых количеств вещества вследствие адсорбции будет составлять незначительный процент от количества меченных красителем пептидов, по-прежнему остающихся в растворе. Материалы, к которым наблюдается адгезия радиоактивного индикатора, включают пластики, стекло и диоксид кремния. В случае фильтров это может означать высокий процент потерь радиоактивности при использовании стерилизующей фильтрации.
Авторы настоящего изобретения обнаружили, что вышеупомянутое явление адгезии связано с тем, что сМВР-пептид выпадает в осадок в кислотных условиях (особенно при пониженных температурах). Поэтому предпочтительно поддерживать pH композиции при 7,5 или выше, более предпочтительно при pH 8,0 или выше, чтобы удерживать желаемый 18F-меченый cMet-связывающий пептид в растворе и таким образом избегать потери вещества. В качестве альтернативы или в дополнение к использованию контролируемого значения pH, может быть введен солюбилизатор.
Под термином "солюбилизатор" понимают присутствующую в композиции добавку, которая повышает растворимость визуализирующего агента в растворителе. Таким предпочтительным растворителем является водная среда, и поэтому солюбилизатор предпочтительно улучшает растворимость в воде. Такие подходящие солюбилизаторы включают: С1-4 спирты; глицерин; полиэтиленгликоль (ПЭГ); пропиленгликоль; полиоксиэтиленсорбитана моноолеат; сорбитана моноолеат; полисорбаты; блок-сополимеры поли(оксиэтилен)-поли(оксипропилен)-поли(оксиэтилен)а (Pluronics™); циклодекстрины (например, альфа-, бета- или гамма-циклодекстрин, гидроксипропил-β-циклодекстрин или гидроксипропил-γ-циклодекстрин) и лецитин.
Предпочтительными солюбилизаторами являются циклодекстрины, C1-4спирты и Pluronics™, более предпочтительно циклодекстрины и С2-4спирты. Когда солюбилизатором является спирт, он предпочтительно представляет собой этанол или пропанол, более предпочтительно этанол. Этанол может играть двойную роль, поскольку он также может действовать как радиопротектор. Когда солюбилизатором является циклодекстрин, он предпочтительно представляет собой β-циклодекстрин, более предпочтительно гидроксипропил-β-циклодекстрин (HPCD). Концентрация циклодекстрина может составлять от примерно 0,1 до примерно 40 мг/мл, предпочтительно от примерно 5 до примерно 35 мг/мл, более предпочтительно 20-30 мг/мл, наиболее предпочтительно около 25 мг/мл. Когда используют единственный солюбилизатор, предпочтительно он представляет собой этанол или гидроксипропил-β-циклодекстрин, более предпочтительно этанол. Когда используют комбинацию солюбилизаторов, она предпочтительно состоит из этанола и гидроксипропил-β-циклодекстрина.
Предпочтительно, композицию по второму аспекту поддерживают при pH 7,5 или выше, возможно в присутствии 5-10% (об./об.) этанола в качестве солюбилизатора.
Композиция визуализирующего агента по второму аспекту предпочтительно дополнительно содержит один или более радиопротекторов. Под термином "радиопротектор" понимают соединение, которое ингибирует реакции разложения, например, окислительно-восстановительные процессы, путем захвата очень реакционноспособных свободных радикалов, таких как кислородсодержащие свободные радикалы, возникающие в результате радиолиза воды. Возможно использование комбинации двух или более разных радиопротекторов. Удобно, когда радиопротекторы по настоящему изобретению выбраны из: этанола; аскорбиновой кислоты; пара-аминобензойной кислоты (т.е. 4-амино-бензойной кислоты или рАВА); гентизиновой кислоты (т.е. 2,5-дигидроксибензойной кислоты) и, где это применимо, из солей таких кислот с биосовместимым катионом, как определено выше. Радиопротектор по настоящему изобретению предпочтительно содержит пара-аминобензойную кислоту или пара-аминобензоат натрия.
Наиболее предпочтительная композиция визуализирующего агента по настоящему изобретению содержит сМВР-пептид с SEQ-7, где оба присоединенные Z1 и Z2 представляют собой MIG, и комбинацию радиопротектора пара-аминобензойной кислоты и радиопротектора/солюбилизатора этанола в водном буфере. Предпочтительным пептидом с SEQ-7 в таких предпочтительных композициях является пептид 1, а предпочтительным 18F-меченым сМВР-пептидом является соединение 3. Концентрация радиоактивного соединения предпочтительно составляет менее 350 МБк/мл, причем концентрация рАВА составляет 2 мг/мл, а этанола примерно 5-10% об./об., предпочтительно 6,5-7,5% об./об.
В третьем аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая визуализирующий агент по первому аспекту или композицию визуализирующего агента по второму аспекту вместе с биосовместимым носителем, в стерильной форме, подходящей для введения млекопитающему.
Предпочтительными аспектами визуализирующего агента и композиции в третьем аспекте являются такие, которые определены в первом и втором аспектах соответственно.
"Биосовместимый носитель" представляет собой текучую среду, в частности жидкость, в которой можно суспендировать или предпочтительно растворить визуализирующий агент, с тем, чтобы композиция стала физиологически переносимой, т.е. могла быть введена в организм млекопитающего без проявления токсичности или без вызывания чрезмерного дискомфорта. Биосовместимым носителем является соответственно инъецируемый жидкий носитель, такой как стерильная, апирогенная вода для инъекций; водный раствор, такой как физиологический раствор (который предпочтительно может быть сбалансирован таким образом, чтобы конечный продукт для инъекции был изотоническим); водный буферный раствор, содержащий биосовместимый буферный агент (например, фосфатный буфер); водный раствор одного или более регулирующих тоничность веществ (например, солей катионов плазмы с биосовместимыми противоионами), Сахаров (например, глюкозы или сахарозы), спиртов сахаров (например, сорбита или маннита), гликолей (например, глицерина) или других неионных полиолов (например, полиэтиленгликолей, пропиленгликолей и тому подобного). Предпочтительно, биосовместимым носителем является апирогенная вода для инъекций, изотонический физиологический раствор или фосфатный буфер. Использование буфера предпочтительно для регулирования pH.
Все визуализирующие агенты и биосовместимый носитель поставляются в подходящих флаконах или сосудах, которые содержат герметично закрытый контейнер, позволяющий поддерживать стерильную чистоту и/или радиоактивную безопасность, а также возможно инертный заполняющий свободное пространство газ (например, азот или аргон), в то же время допускающий добавление и отбор растворов посредством шприца или канюли. Таким предпочтительным контейнером является флакон с герметизирующей прокладкой, где газонепроницаемая пробка обжата дополнительным упаковочным средством (обычно из алюминия). Пробка подходит для однократного или многократного прокалывания иглой для подкожных инъекций (например, обжатая пробка с герметизирующей прокладкой) с поддержанием при этом стерильной чистоты. Такие контейнеры имеют дополнительное преимущество в том, что при желании пробка может выдерживать вакуум (например, чтобы заменить заполняющий свободное пространство газ или дегазировать растворы) и выдерживать изменения давления, например, уменьшение давления без допускания проникновения газов из внешней атмосферы, таких как кислород или водяной пар.
Предпочтительные контейнеры для лекарственных средств для многократного приема представляют собой один большой флакон (например, объемом от 10 до 30 см3), который содержит многократные дозы лекарственного средства для приема пациентом, в силу чего однократные дозы для приема пациентом могут быть отобраны таким образом в шприцы марки "для клинического использования" с различными интервалами времени в течение приемлемого срока годности препарата в зависимости от данной клинической ситуации. Предварительно заполненные шприцы сконструированы для включения разовой дозы для человека или "стандартной дозы" и поэтому предпочтительно представляют собой шприц одноразового применения или другой шприц, подходящий для клинического применения. Фармацевтические композиции по настоящему изобретению предпочтительно имеют дозировку, подходящую для одного пациента, и предложены в подходящем шприце или контейнере, как описано выше.
Возможно, что фармацевтическая композиция может содержать дополнительные эксципиенты, такие как антимикробный консервант, pH-регулирующий агент, наполнитель, радиопротектор, солюбилизатор или регулирующий осмоляльность агент. Термины "радиопротектор" и "солюбилизатор" и их предпочтительные воплощения имеют те же значения, которые описаны во втором аспекте (выше). Под термином "антимикробный консервант" понимают агент, который ингибирует рост потенциально вредных микроорганизмов, таких как бактерии, дрожжи или плесневые грибы. Антимикробный консервант также может демонстрировать некоторые бактерицидные свойства в зависимости от применяемой дозировки. Главная роль антимикробного консерванта(ов) по настоящему изобретению состоит в ингибировании роста любого такого микроорганизма в фармацевтической композиции. Однако антимикробный консервант также возможно может быть использован для ингибирования роста потенциально вредных микроорганизмов в одном или боле