Способ эндоскопического лечения рубцовых стенозов пищевода у больных с эрозивно-язвенным эзофагитом
Иллюстрации
Показать всеИзобретение относится к медицине, хирургии, эндоскопическим методам лечения рубцовых стенозов пищевода, осложненных эрозивно-язвенным эзофагитом. Проводят бужирование эластичными конусными бужами путем последовательного использования бужей возрастающего номера и соответственно диаметра. При этом после каждой операции бужирования в пищевод через эндоскоп дозированно в течение 1 мин инсуфлируют оксид азота, вырабатываемого аппаратом «Плазон», с малой концентрацией в газовом потоке 300 ppm. Причем осуществляют прицельное воздействие оксидом азота на области разрывов слизистой оболочки, образовавшиеся в результате бужирования, и эрозивно-язвенных дефектов. Курс лечения включает 6 сеансов через день. Способ позволяет предупредить разрывы пищевода, остановить кровотечение из разрывов слизистой с последующей быстрой их эпителизацией, без образования грубых рубцов, за счет повышения под действием оксида азота в малой концентрации активности клеток эндотелия сосудов и тромбоцитов, с образованием пласта из тромбоцитов на эрозивной поверхности, исключается травма кардиального отдела пищевода, обеспечивается выраженный стойкий результат, отсутствие гастро-эзофагеального рефлюкса, исключение рецидивов. 1 з.п. ф-лы, 4 ил., 2 пр., 1 табл.
Реферат
Изобретение относится к области медицины, а именно к хирургии: способам эндоскопического лечения рубцовых стенозов пищевода, осложненных эрозивно-язвенным эзофагитом.
Проблема лечения больных с Рубцовыми стенозами пищевода, осложненными эрозивно-язвенным эзофагитом, весьма актуальна для современной хирургии. Эрозивно-язвенный эзофагит является заболеванием, на фоне которого усугубляется процесс стенозирования пищевода. Кроме того, длительно текущее эрозивно-язвенное поражение пищевода является фоном для развития инфильтративного рака пищевода.
Одним из наиболее эффективных методов лечения рубцовых стенозов пищевода является эндоскопический, что обусловлено бурным развитием эндоскопической техники и появлением новых технологий.
Известны различные способы эндоскопического лечения рубцовых стенозов пищевода.
Известен способ лечения стеноза пищевода (Вагнер Е.А., Субботин В.М., Мехоношин В.Н. и соавт. Пневмогидравлическая дилатация рубцовых сужений пищевода. - Тез. Докл. Конф. «Хирургия пищевода и трахеи». -Кемерово. - 1987 г. - С 18-19), заключающийся в дилатации зоны сужения расширяющимся баллоном, в который под давлением нагнетают воздух или жидкость.
Однако данный способ имеет ряд недостатков. Для осуществления расширения необходимо провести баллон непосредственно в зону сужения, что сопряжено с высоким риском перфорации пищевода, особенно при наличии протяженного стеноза с узким и извитым ходом, а также при выраженном престенотическом расширении. При этом установка баллона в пищевод выполняется либо под рентгенологическим контролем, что сопровождается значительной лучевой нагрузкой, либо она требует проведения эндоскопического исследования.
Сам процесс дилатации лишен объективного контроля, что повышает риск разрыва пищевода из-за перерастяжения его стенки, особенно в области стеноза.
Известен также способ лечения рубцовых стенозов пищевода (Левин С.И., Расулов Х.Х., Ахматов Д.А. и соавт. Непрерывное бужирование послеожоговых рубцовых стриктур пищевода. - М.: Хирургия. - 1984 г. - №10 - С. 74-76), включающий проведение через зону сужения бужей - бусинок продолговатой формы (олив) с помощью назогастральной нити. Диаметр бужей последовательно увеличивают.
Недостатком способа является то, что первые сеансы бужирования сопровождаются высоким риском разрыва пищевода, т.к. олива имеет торцовую часть тупой закругленной формы, которая упирается в узкое отверстие стеноза, а не раздвигает его. Вышерасположенные стенки пищевода при этом смещаются за оливой и растягиваются. Перерастяжение пищевода приводит к его разрыву.
В качестве ближайшего аналога принят способ лечения рубцовых стенозов пищевода путем бужирования эластичными бужами (Терновский С.Д. Лечение химических ожогов и рубцовых сужений пищевода у детей. М., 1963 г., с. 73-87).
Устранение стеноза осуществляют посредством постепенного последовательного использования бужей возрастающего номера и соответствующего ему диаметра: от номера бужа, незначительно превышающего диаметр стеноза, до номера бужа, соответствующего диаметру пищевода здорового человека определенного возраста.
Однако известный способ имеет существенные недостатки. Использование возрастных размеров бужей не позволяет получить выраженный и стойкий клинический эффект.
Способ не приводит к получению устойчивого восстановления проходимости пищевода. По данным разных авторов, повторное рубцевание происходит в 6,8%-35% случаев (Г.А. Ратнер, В.И. Белоконев с соавт. М.: Хирургия №8, 1998 г. «Двадцатилетний опыт форсированного бужирования Рубцовых стриктур пищевода» С. 5, А.Ф. Черноусов, П.М. Богопольский, «Бужирование пищевода при рубцовых ожоговых стриктурах» М.: Хирургия №10, 1998 г. С. 28).
Авторами предлагаемого изобретения установлено и доказано, что при проведении бужа через кардиальный отдел пищевода известным способом происходит его дилатация, вследствие чего возникает агрессивный гастроэзофагеальный рефлюкс, приводящий к появлению у больного респираторных осложнений, обострению воспалительных процессов в зоне травмированного бужом стеноза.
Основой любого бужирования является механическое растяжение зоны стеноза за счет передачи давления с проксимального конца на дистальный (Сотников В.Н., Дубинская Т.К., Сотников А.В. и др. Эндоскопическая диагностика и лечение послеоперационных сужений пищеводно-кишечных и пищеводно-желудочных анастомозов. Учебное пособие. М.: РМАПО. 1997. С. 12.). При этом превалирует продольное направление силы, растягивающей пищевод в длину, и скарификация слизистой оболочки. Кроме того, бывает сложно рассчитать величину давления на буж, так как при плотных стриктурах ткани часто не растягиваются, а при рыхлых возникают глубокие разрывы слизистой и подслизистой оболочек пищевода.
Задачей изобретения является создание способа эндоскопического лечения рубцовых стенозов пищевода у больных с эрозивно-язвенным эзофагитом, позволяющего получить выраженный и стойкий клинический эффект, уменьшить травматизацию тканей пищевода, исключить возможность его разрыва, возникновение гастроэзофагиального рефлюкса и связанных с ним осложнений.
Сущность изобретения состоит в том, что в способе эндоскопического лечения рубцовых стенозов пищевода, осложненных эрозивно-язвенным эзофагитом, включающий проведение бужирования эластичными конусными бужами путем последовательного использования бужей возрастающего номера и соответственно диаметра с последующим поддерживающим бужированием, после выполнения процедуры бужирования в пищевод инсуфлируют оксид азота с помощью аппарата «Плазон» при его концентрации в газовом потоке 300 ppm,и воздействуют им на всю поверхность зоны стеноза, при этом осуществляют прицельное воздействие на области разрывов слизистой оболочки, образовавшихся в результате бужирования, включая слизистый и подслизистый слои, и эрозивно-язвенных дефектов, время воздействия составляет 1 минуту, курс лечения включает 6 сеансов, проводимых через день.
Использование изобретения позволяет получить следующий технический результат.
Предлагаемый способ позволяет получить выраженный клинический эффект: диаметр сформированного в зоне рубцового сужения просвета пищевода имеет «физиологический запас». Даже незначительное его сужение не сказывается на полноценном для пациента приеме пищи. Достигнутый результат надежно закрепляется за счет проведения поддерживающего бужирования конусовидными бужами.
Способ позволяет предупредить разрыв пищевода, остановить кровотечение из разрывов слизистой с последующей быстрой их эпителизацией, без образования грубых рубцов, что обеспечивает выраженный стойкий результат, исключает рецидивы и определяет тактику лечения без частых повторных инвазивных вмешательств.
За счет исключения травмы кардиального отдела пищевода, осложнения, которые могли бы сказаться на результате, не возникают. Профилактика гастроэзофагеального рефлюкса создает благоприятные условия для течения восстановительных процессов.
Выполнение процедур не требует дорогостоящих расходных материалов, так как проводится с помощью конусовидных бужей и инсуфляции в пищевод оксида азота, который вырабатывает из воздуха аппарат «Плазон».
Технический результат изобретения заключается в обеспечении эффективного эндоскопического лечения рубцовых стенозов пищевода, осложненных эрозивно-язвенным эзофагитом, за счет комплексного применения бужирования пищевода и инсуфляции оксида азота от аппарата «Плазон» через биопсийный канал эндоскопа с содержанием оксида азота в газовом потоке 300 ppm в течение 1 мин на протяжении 6 сеансов (Регистрационное удостоверение № ФСР 2007/00583 от 09 августа 2007 г., Федеральная Служба надзора в сфере здравоохранения и социального развития).
Аппарат «Плазон» предназначен для лечения ран и воспалительных процессов. Во время работы аппарат производит из окружающего воздуха оксид азота, который содержится в потоке газа, образованного путем охлаждения воздушной плазмы.
Положительный результат достигается за счет использования установленных авторами новых свойств оксида азота и механизма его действия, за счет которых на участках эрозированной поверхности образуется пласт из тромбоцитов с последующей остановкой кровотечения. В короткое время эпителизируются разрывы слизистой без образования грубых рубцов, что надежно закрепляет полученный результат и предупреждает рецидивы.
За счет применения оксида азота, устраняющего последствия бужирования, стало возможным использование конусовидных бужей без оливы, которые не повреждают кардиальный отдел пищевода, что в совокупности позволяет избежать развития осложнений и получить стойкий терапевтический эффект.
У больных, отягощенных эрозивно-язвенным эзофагитом, создаются условия для эффективного безопасного проведения лечения и протекания восстановительного периода.
Оксид азота (NO) - восстановленная форма моноокиси азота - является свободным радикалом, имеющим неспаренный электрон на внешней орбитали. Открыт в 1980 г. как эндотелиальный релаксирующий фактор. Синтезируется из L-аргинина при встраивании в молекулу последнего двух атомов кислорода с образованием двух новых соединений - NO и цитруллина. Процесс происходит под влиянием ферментов NO-синтаз (NOS). NO, будучи низкомолекулярным соединением с высокой липофильностью, обладает высокой диффузионной способностью и легко преодолевает тканевые барьеры, проникая из клеток в межклеточную среду и обратно и влияя не только на клетки, его продуцирующие, но и на их микроокружение. NO регулирует многие физиологические функции и патологические процессы.
Многие авторы считают, что NO - один из древних и универсальных регуляторов систем внутриклеточной и межклеточной сигнализации (Северин Е.С., Муйжнек Е.Л., Северин С.Е. Концепция вторичных мессенджеров: от фундаментальных основ к клинической практике. М.: Димитреа График Групп. 2005. 336 с).
Чрезвычайно важный физиологический аспект действия NO - его бактерицидное действие как собственное, так и пероксинитритом, образующимся в тканях при взаимодействии NO с супероксиданионом.
Оксид азота индуцирует фагоцитоз бактерий нейтрофилами и макрофагами, активирует антиоксидантную защиту, регулирует специфический и неспецифический иммунитет, непосредственно индуцирует пролиферацию фибробластов, рост сосудов, синтез коллагена, образование и формирование грануляционной ткани, пролиферацию эндотелия.
В процессе длительного использования прибора «Плазон» авторами предлагаемого изобретения было обнаружено, что при инсуфляции оксида азота на поверхности кровоточащих сосудов образуются тромбы. В связи с тем, что это явление закономерно повторялось, авторы предположили, что именно оксид азота оказывает влияние на остановку кровотечения, что подтвердилось в процессе электронно-микроскопических исследований биопсийного материала, взятого во время эндоскопического исследования до и после NO-терапии.
Проведены специальные исследования структуры эндотелия. Влияние оксида азота на эндотелий осуществляется через специфические рецепторы, расположенные на апикальной поверхности клетки. В результате гипоксии происходит резкое снижение эндогенного оксида азота, что приводит к истощению и извращению компенсаторной способности эндотелия. Подача экзогенного оксида азота через эндоскоп восстанавливает функциональную активность эндотелиального пласта, способствует неоваскулогенезу.
Одним из факторов наползания эндотелиального пласта с краев язвенного дефекта является создание матрицы из тромбоцитов, которые мигрируют из сосудистого русла и составляют вместе с моноцитами (макрофагами) популяцию пришлых клеток.
Для выявления сосудистой патологии авторы использовали метод сканирующей электронной микроскопии коррозионных препаратов по методике Я.Л. Караганова и соавт. (1982). Для приготовления препаратов использовали инъекционные массы (Метилметакрилат), после чего препараты подвергали коррозии, слепки микрососудов напыляли золотом. Слепки сосудов слизистой оболочки пищевода в исследуемом материале изучали в сканирующем электронном микроскопе фирмы «Philips-PSEM, 500-х» со съемкой на широкоформатную фотопленку.
В ходе анализа биопсийных препаратов с помощью световой электронной микроскопии (СЭМ) в зоне язвы наблюдали повышенную активность тромбоцитов, в отдельных участках плотно закрывающих язвенную поверхность. Тромбоцитарная активность сопряжена с воздействием оксида азота, и если в сосудах оксид азота блокирует агрегацию тромбоцитов, то на эрозивной поверхности он создает условия для формирования пласта тромбоцитов, что приводит к остановке кровотечения.
Иммуногистохимическое исследование эндотелия кровеносных микрососудов с целью определения их пролиферативной активности проводили следующим образом: фиксированные в метакарне образцы тканей отмывают в метаноле, хлороформе и заливают в парапласт («Polyscienc Inc., США). Срезы с парапластовых блоков получают на микротоме «Autocut» («Reichert-Jung,» Австрия), депарафинируют в толуоле и регидратируют в метаноле нисходящей концентрации и воде. Затем препараты обрабатывают 3% перекисью водорода (30 мин) для инактивации эндогенной пероксидазной активности. После этого срезы промывают фосфатно-солевым буфером (0,1 М рН 7,4) с 0,05% Tween-20. На приготовленные срезы наносят раствор первых моноклональных антител ковалентных ядерному антигену пролиферирующих клеток (PCNA), полученных от мышей.
Анализ биоптатов показал, что до обработки оксидом азота митотическая активность эпителия в краевых отделах язвы составила 6,17±0,4%, а в МЭЛ - 9,11±0,79%. После комплексного лечения с включением оксида азота этот показатель увеличился и составил соответственно 48,2±0,32% и 21,34±0,21%.
Авторами сделан вывод: резкий подъем пролиферативной активности эпителиоцитов зоны язвы обусловлен воздействием на язву оксида азота, что играет существенную роль в процессе репаративной регенерации (фиг. 1, 2).
Авторы изучали способность эндотелия к пролиферации и восстановлению функций массопереноса до и после сеансов NO-терапии.
Для изучения трансэндотелиального массопереноса кровеносных микрососудов применили метод криофрактографии. Стандартная процедура подготовки образца для криоскалывания состоит из трех этапов: химической криофиксации образца, его пропитывания криопротектантом и быстрого замораживания в охлажденном фреоне. Затем проводят непосредственное скалывание образца, находящегося в стеклообразном состоянии методом срезывания.
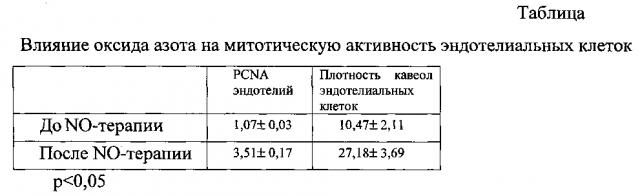
С помощью метода криофрактографии определяли пространственное распределение плазмолеммальных пузырьков, которые представляют собой одну из важнейших структур эндотелиоцитов (фиг. 3). Их функцию связывают с транспортом белковых молекул. В биоптатах, взятых из краев язвы в момент остановки кровотечения, пролиферативная активность эндотелия кровеносных микрососудов была низкая и составила не более 1 маркированной клетки в поле зрения эндотелиального пласта. После 3 сеансов NO-терапии мы наблюдали увеличение количества маркированных моноклональными антителами (МКА) клеток PCNA более чем в 3 раза (с 1,07±0,03 абс. ед. до 3,51±0,17 абс. ед.). После сеансов NO-терапии количество кавеол увеличилось более чем в 2,5 раза - с 10,47±2,11 до 27,18±3,69 ((табл.) (фиг. 4 а, б).
Таким образом, функциональная активность эндотелиальных клеток под влиянием экзогенного оксида азота заметно возрастает, что благоприятно сказывается на трофике окружающих тканей и способствует ускорению процесса репаративной регенерации.
Таким образом, авторами установлены и использованы новые свойства оксида азота. Одно из них - кровоостанавливающее свойство, обусловленное повышением активности тромбоцитов.
Оксид азота также обладает свойством улучшать трофику тканей и ускорять репаративно-регенераторные процессы за счет улучшения микроциркуляции.
Подача экзогенного оксида азота через эндоскоп восстанавливает функциональную активность истощенной в результате гипоксии компенсаторной способности эндотелиального пласта и способствует неоваскулогенезу.
Авторами отработан режим подачи оксида азота, оптимальный и достаточный для получения требуемого результата - тромбирования сосудов на поверхности эрозий и язв и ускорения процесса эпителизации.
Из имеющихся доступных источников информации авторам не известно использование оксида азота по новому назначению и в лечении больных с рубцовыми стенозами пищевода, в том числе осложненными эрозивно-язвенным кровотечением.
Способ осуществляется следующим образом.
Пациенту с диагнозом рубцовый стеноз пищевода выполняют общеклинические и клинико-лабораторные обследования: осмотр, сбор жалоб и анамнеза по основной и сопутствующей патологии, лабораторные исследования: клинический анализ крови, анализ биохимических показателей углеводного, липидного, белкового обмена, мочевины, креатинина, электролитов, трансаминаз, коагулограммы, а также клинический анализ мочи. Забор крови на все исследования осуществляют из кубитальной вены строго натощак.
Проводят эзофагогастроскопию, во время которой определяют диаметр просвета пищевода в зоне стенозирования, протяженность стеноза, изменения слизистой оболочки пищевода вокруг зоны стенозирования - наличие эрозий, язв, их количество, размеры, глубина.
Устранение стеноза осуществляют посредством проведения бужирования эластичными конусными бужами путем последовательного использования бужей возрастающего номера и соответственно диаметра.
После выполнения процедуры бужирования лечебный сеанс продолжают с использованием прибора «Плазон». К прибору «Плазон» подключают специальную насадку, ее дистальный конец вводят в биопсийный канал эзофагогастроскопа. Через насадку в просвет пищевода пациента инсуфлируют оксид азота при его содержании в газовом потоке 300 ppm.
Путем манипулирования дистальным концом эндоскопа воздействуют оксидом азота на всю поверхность слизистой оболочки зоны стеноза пищевода, при этом осуществляют прицельное воздействие на области ее разрывов, образовавшихся в результате бужирования, включая слизистый и подслизистый слои, а также эрозивно-язвенные дефекты. Время инсуфляции составляет 1 минуту.
После этого поверхность разрывов исследуют. Путем визуальной оценки определяют тромбированные сосуды и выявляют отсутствие подтекания крови.
Курс лечения составляет 6 сеансов, проводимых через день и включающих выполнение процедуры бужирования с последующей инсуфляцией в конце каждого сеанса оксида азота с помощью аппарата «Плазон» на область воздействия.
Способ может быть воспроизведен с одинаковой степенью достоверности в разных эндоскопических отделениях.
Клинические испытания предлагаемого способа проведены на кафедре ГБОУ ДПО РМАПО на базе ГКБ им. С.П. Боткина на 80 пациентах (добровольцах) в возрасте от 35 до 63 лет, из них - 50 мужчин, 30 женщин с диагнозом: рубцовый стеноз пищевода, эрозивно-язвенный эзофагит.
Всем пациентам проведено лечение по предлагаемому способу.
Сроки лечения составили 12 дней - 6 сеансов бужирования через день с инсуфляцией в конце каждого сеанса оксида азота от аппарата «Плазон».
Процедура лечения у всех больных проходила гладко, без осложнений и разрывов пищевода. У 23 пациентов с эрозивно-язвенным эзофагитом не возникло гастроэзофагиального рефлюкса и связанных с ним осложнений. У всех пациентов достигнут выраженный и стойкий клинический эффект: отмечена хорошая проходимость пищи, отсутствие болей за грудиной, удалось уменьшить травматизацию тканей пищевода, не отмечено разрывов пищевода, возникновения гастроэзофагеального рефлюкса, образования эрозий и язв и связанных с ними осложнений (кровотечения).
Пример 1. Больная Б., 72 л. Клинический диагноз: рубцовый стеноз верхней трети пищевода III степени, осложненный эрозивно-язвенным эзофагитом. Протяженность рубцового сужения около 3 см. На базе больницы им. СП. Боткина было проведено 10 курсов эндоскопического бужирования с периодичностью 1 раз в 6 месяцев. При этом курс лечения состоял из 6 сеансов, каждый из которых включал процедуру бужирования с последующим воздействием оксидом азота. Последний раз поступила в апреле 2014 г. С терапевтической целью после каждого сеанса бужирования для остановки кровотечения и ускорения эпителизации эрозий и язв проведена обработка всей поверхности зоны стеноза и прицельно - области разрывов, включая слизистый и подслизистый слои, а также эрозивно-язвенные дефекты оксидом азота от аппарата «Плазон» в течение 1 мин при его содержании в газовом потоке 300 ppm. Кровотечение остановлено. Эпителизация эрозивно-язвенных дефектов, а также разрывов слизистой и подслизистой пищевода наступила после 5 сеансов лечения, всего проведено 6 сеансов. Выполнено электронно-микроскопическое исследование биопсийного материала, полученного до и после лечения с использованием терапии оксидом азота (Фиг. 1, 2, 3). Через 6 мес. пациентка жалоб не предъявляет, пища проходит хорошо, болей за грудиной нет. При повторном эндоскопическом исследовании в зоне стеноза определяются нежные рубцы. Прибор диаметром 9,6 мм свободно низведен за зону стеноза. Эрозий и язв нет. В дальнейшем проведении курсов бужирования необходимости нет. Достигнуто клиническое излечение. Больная продолжает наблюдаться. Пример 2. Больная Г., 90 лет. Клинический диагноз - рубцовый стеноз верхней трети пищевода II степени. Протяженность стеноза 2 см. Ежегодно проводятся 1-2 курса бужирования в течение 10 лет. При последнем обращении в ноябре 2013 г. проведено лечение по предлагаемому способу, включающее выполнение процедуры бужирования с последующей инсуфляцией в конце каждого сеанса оксида азота с помощью аппарата «Плазон» и воздействием на зоны разрывов в течение 1 мин при его содержании в газовом потоке 300 ppm. Эпителизация разрывов слизистой и подслизистой наступила после 4 сеансов лечения. Проведено электронно-микроскопическое исследование биопсийного материала, полученного до и после лечения (Фиг. 4 а, б). Через 1 год пациентка жалоб не предъявляет, пища проходит хорошо, болей за грудиной нет. При повторном эндоскопическом исследовании в зоне стеноза определяются нежные рубцы. Просвет пищевода широкий, прибор диаметром 9,6 мм свободно низведен за зону стеноза. Эрозий и язв нет. В проведении курса бужирования необходимости нет. Достигнуто клиническое излечение. Больная продолжает наблюдаться.
Таким образом, использование предлагаемого способа эндоскопического лечения рубцовых стенозов пищевода у больных с эрозивно-язвенным эзофагитом позволил получить выраженный и стойкий клинический эффект, уменьшить травматизацию тканей пищевода, исключить возможность его разрыва, возникновение гастроэзофагеального рефлюкса и связанных с ним осложнений.
1. Способ эндоскопического лечения рубцовых стенозов пищевода, осложненных эрозивно-язвенным эзофагитом, включающий проведение бужирования эластичными конусными бужами путем последовательного использования бужей возрастающего номера и соответственно диаметра, отличающийся тем, что после каждой операции бужирования в пищевод через эндоскоп дозированно в течение 1 минуты инсуфлируют оксид азота с концентрацией в газовом потоке 300 ppm и осуществляют прицельное воздействие на области разрывов слизистой оболочки, образовавшиеся в результате бужирования, и эрозивно-язвенных дефектов, при этом курс лечения включает 6 сеансов, проводимых через день.
2. Способ по п. 1, отличающийся тем, что оксид азота вырабатывают аппаратом «Плазон» из воздуха.