Набор для выявления днк провируса иммунодефицита крупного рогатого скота, содержащий пару специфичных праймеров и зонд, и способ диагностики вирусного иммунодефицита крупного рогатого скота методом полимеразной цепной реакции в режиме реального времени
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан набор для выявления ДНК провируса иммунодефицита крупного рогатого скота (BIV (bovine immunodeficiency virus)), содержащий пару специфичных праймеров и ДНК-зонд, методом ПЦР в режиме реального времени. Праймеры и зонд имеют следующий нуклеотидный состав (5′-3′-): pf - TAGGGTAGTGGGATCTCAGAAATC, pr - ACATCCGTAACATCTCCTACCATC, z - GAGGATGGTAGGAGATGTTACGGAT. В качестве источника флуоресценции на 5′ конце зонда применяют краситель ROX, а для тушения флуоресценции на 3′ конце BHQ2. Также описан способ диагностики BIV методом ПЦР в режиме реального времени с использованием набора по п. 1. Реакционную смесь готовят путем смешения буфера 10-кратного для ПЦР - 2.5 мкл, дНТФ (25 мМ) - 0,2 мкл, праймеров pf и pr (10 пмоль/мкл) по 1 мкл, зонда z (10 пмоль/мкл) - 0,5 мкл, Taq полимеразы (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 2 мкл, бидистиллированной воды - 7,6 мкл, а амплификацию проводят в следующем режиме: денатурация 95°С - 5 мин, циклирование: денатурация (95°С - 20 с) - отжиг (55°С - 20 с) - элонгация (72°С - 20 с), причем цикл денатурация - отжиг - элонгация повторяется 10 раз, циклирование 2 с детекцией: денатурация (95°С - 20 с) - отжиг (55°С - 20 с) - элонгация (72°С - 20 с), причем цикл денатурация - отжиг - элонгация повторяется 25 или 30 раз. Флуоресценцию измеряют по каналу Orange при температуре 55°С. Пересечение кривой флуоресценции линии threshold, установленной на уровне 30% от максимального уровня флуоресценции в последнем цикле амплификации, свидетельствует о наличии в образце провируса BIV, причем, чем меньше значение показателя «Ct», тем выше количество провируса BIV в исследуемом образце, в то время как отсутствие пересечения кривой флуоресценции линии threshold свидетельствует об отсутствии провируса BIV в образце. Изобретение может быть использовано в научных исследованиях для обнаружения генетического материала BIV в лимфоцитах крови животных методом ПЦР в режиме реального времени. 2 н.п. ф-лы, 6 ил., 3 табл., 2 пр.
Реферат
Изобретение относится к области биотехнологии, молекулярной биологии, молекулярно-генетической диагностики вирусных болезней животных и может быть использовано в научных исследованиях для обнаружения генетического материала провируса иммунодефицита крупного рогатого скота - BIV (bovine immunodeficiency virus) в лимфоцитах крови животных методом полимеразной цепной реакции в режиме реального времени (Real-time PCR).
Вирусный иммунодефицит крупного рогатого скота (ВИ КРС) - инфекционное заболевание, характеризующееся латентным течением и неизбежно приводящее к летальному исходу. В настоящее время не существует средств специфической терапии и профилактики этой инфекции. Следовательно, своевременная диагностика является единственным способом контроля над распространением данного заболевания.
Возбудитель инфекции принадлежит к семейству Retroviridae, подсемейству Orthoretrovirinae, роду Lentivirus (http://www.ictvonline.org/virusTaxonomy.asp).
Вирус является лимфонейротропным и повреждает, в первую очередь, иммунную систему: тканевый и гуморальный иммунитет (Bhatia S, Patil SS, Sood R Bovine immunodeficiency virus: a lentiviral infection // Indian J Virol. 2013 Dec; 24(3):332-41. doi: 10.1007/s13337-013-0165-9. Epub 2013 Sep 27). У животных, больных иммунодефицитом, часто возникают поражение центральной нервной и лимфоидной системы (лимфоидная фолликулярная гиперплазия и дисплазия лимфатических узлов), различные вторичные инфекции и опухолевые процессы - развивается синдром приобретенного иммунодефицита (СПИД), что ведет к снижение массы тела, потере продуктивности и получению некачественной продукции животноводства (Snider TG, Hoyt PG, Coats KS, Graves KF, Cooper CR, Storts RW, Luther DG, Jenny BF Natural bovine lentiviral type 1 infection in Holstein dairy cattle. Clinical, serological, and pathological observations // Comp Immunol Microbiol Infect Dis. 2003 Mar; 26(2):89-101).
Молодняк, полученный от больных коров, также может быть инфицирован, так как вирус передается внутриутробно или заражение происходит алиментарно, при выпаивании молоком от больных коров и контактно при совместном содержании (Meas S, Usui Τ, Ohashi Κ, Sugimoto С, Onuma M. Vertical transmission of bovine leukemia virus and bovine immunodeficiency virus in dairy cattle herds // Vet Microbiol. 2002 Jan 23; 84(3):275-82). Вакцинация BIV-инфицированных телят с целью профилактики других инфекционных заболеваний малоэффективна, поскольку вирус иммунодефицита избирательно поражает и разрушает центральное звено иммунной системы (СD4-лимфоциты), что приводит к снижению иммунного ответа. BIV-инфицированные телята в большей степени подвержены заболеваниям различной этиологии, а именно респираторным, кишечным и другим вирусным и бактериальным инфекциям, грибковым и инвазионным заболеваниям (Carpenter S, Vaughn ЕМ, Yang J, Baccam Ρ, Roth JA, Wannemuehler Y Antigenic and genetic stability of bovine immunodeficiency virus during long-term persistence in cattle experimentally infected with the BIV(R29) isolate // J Gen Virol. 2000 Jun; 81(Pt 6):1463-72).
Зарубежные исследователи сообщают о широкой распространенности BIV в мире (Bhatia S, Patil SS, Sood R Bovine immunodeficiency virus: a lentiviral infection // Indian J Virol. 2013 Dec; 24(3):332-41. doi: 10.1007/s 13337-013-0165-9. Epub 2013 Sep 27).
По некоторым данным распространение BIV в Московской области составляет от 11 до 67%, а в Ставропольском крае 11-33% (Колотвин В.В. Выявление вируса иммунодефицита крупного рогатого скота в Московской области / В.В. Колотвин, А.В. Капитонов, Н.Ф. Гриненко, Л.М. Пискарева, Г.В. Пашвыкина, С.С. Абакин, Г.О. Шайхаев, А.Д. Альтштейн, А.Ф. Валихов // Российский ветеринарный журнал (сельскохозяйственные животные). - М., - 2006. - №2. - С. 18-20).
Геном BIV имеет размер 8,48 kb и содержит три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5'-gag-pol-env-3': ген gag кодирует белки, формирующие «сердцевину» вируса; ген pol-ферментную систему вируса (обратную транскриптазу; интегразу и рибонуклеазу); ген env определяет способность вируса выходить за пределы клетки и инфицировать другие. Жизненный цикл BIV включает несколько последовательных фаз: связывание вириона с рецептором клетки хозяина: слияние вирусной оболочки и клеточной мембраны; эндоцитоз; обратное транскрибирование; интеграция с геномом хозяина. На этом этапе, провирусной ДНК, вирус может задержаться на несколько лет, делая зараженный организм латентным источником инфекции. При этом вирусная популяция увеличивается за счет клонирования инфицированных клеток. Затем наступает этап репликации: интегрированный провирус транскрибируется клеточной РНК полимеразой и, после сборки капсида, вирионы высвобождаются из клетки почкованием (Супотницкий М.В. Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. - Москва: Вузовская книга, 2009. - 400 с).
В настоящее время, для диагностики ВИ КРС в Российской Федерации не существует сертифицированных тест-систем и официально утвержденных инструкций. В мировой практике имеется ряд тестов для выявления как самого BIV, так и вирус специфичных антител.
Известен способ диагностики вирусного иммунодефицита КРС вирусологическим методом, основанный на культивирование BIV на фетальных культурах клеток селезенки и легкого КРС или кролика с последующей индикацией и идентификацией вируса (Van Der Maaten MJ, Boothe AD, Seger CL. Isolation of a virus from cattle with persistent lymphocytosis. J Natl Cancer Inst. 1972; 49:1649-1657; Guo HY, Ma YG, Gai YM, Liang ZB, Ma J, Su Y, Zhang QC, Chen QM, Tan J. Bovine HEXIM1 inhibits bovine immunodeficiency virus replication through regulating BTat-mediated transactivation. Vet Res. 2013; 44(1):21. doi: 10.1186/1297-9716-44-21; Suarez DL, Van Der Maaten MJ, Wood C. Isolation and characterization of new wild type isolates of bovine lentivirus. J Virol. 1993; 67:5051-5055).
Недостатками данного метода являются длительность, трудоемкость и необходимость использования биологических моделей.
Известен способ выявления антител к BIV в крови животных методом твердофазного иммуноферментного анализа, основанный на обнаружении специфического комплекса антиген-антитело с помощью цветной реакции вследствие ферментации субстрата энзимом, связанным с конъюгатом (Abed Y, Archambault D. A viral transmembrane recombinant protein-based enzyme-linked immunosorbent assay for the detection of bovine immunodeficiency virus infection. J Virol Methods. 2000; 85:109-116. doi: 10.1016/S0166-0934(99)00161-5; Bhatia S, Gangil R, Gupta DS, Sood R, Pradhan HK, Dubey SC. Single chain fragment variable antibody against the capsid protein of bovine immunodeficiency virus and its use in ELISA. J Virol Methods. 2010; 167:68-73. doi: 10.1016/j.jviromet.2010.03.012).
Недостатком метода является невысокая информативность на ранних этапах заражения, когда в крови недостаточно высокий уровень антител и ложноположительные результаты в случае обследования молодняка вследствие наличия в крови клостральных антител.
Известен способ выявления провирусной ДНК BIV методами классической полимеразной цепной реакции (ПНР) и гнездной ПЦР (Suarez DL, Whetstone СА. PCR diagnosis of the bovine immunodeficiency-like virus. Methods Mol Biol. 1998; 92:67-79; Колотвин B.B. Вирус иммунодефицита крупного рогатого скота: индикация инфекции и распространенность в хозяйствах Российской Федерации: Автореферат диссертации канд. биол. наук. М., 2007. - 18; Suarez DL, Van der Maaten MJ, Whetstone CA. Improved early and long-term detection of bovine lentivirus by a nested polymerase chain reaction test in experimentally infected calves. Am J Vet Res. 1995; 56(5):579-586). Данные методы основаны на прямом обнаружении генома провируса BIV в лимфоцитах крови КРС.
Недостатками данных способов являются:
- повышенный риск контаминации образцов, реактивов, помещения и оборудования лаборатории в момент манипуляции с ампликами при проведении дополнительного цикла амплификации и детекции результатов методом электрофореза в агарозном геле;
- не полное использование возможностей ПЦР, таких как максимальная специфичность и скорость проведения реакции;
- субъективность в интерпретации результатов;
- невозможность количественной оценки при учете результатов.
Наиболее близким к заявленному изобретению является способ, описанный в патенте RU №2499054 от 11.10.2012 г., опубликован 20.11.2013 г., бюл. №32. В данном изобретении выбор специфических праймеров и зондов проводили с помощью компьютерных программ на основании анализа нуклеотидных последовательностей референтных штаммов и изолятов, опубликованных в GenBank, а обнаружение генома вируса осуществляли путем проведения ПЦР в реальном времени с применеием олигонуклеотидных праймеров и гибридизационного TaqMan ДНК-зонда, несущего флуорофор и тушитель, и комплементарного части амплифицируемого со специфическими праймерами фрагмента. При этом праймеры и зонд имели следующий нуклеотидный состав (5'-3'-):14/2/qf GCT GTC GGG TAT AGG TAG GA; 14/2/z FAM - GTG AAC GTG GGG TCA TCT TCA С - BHQ1; 14/2/qr ACG TGT CCG ATG CTG СТА ТС. В качестве источника флуоресценции на 5' конце зонда применяли краситель FAM, а для тушения флуоресценции на 3' конце BHQ1. Для проведения ПЦР в режиме реального времени в отдельной пробирке готовили общую реакционную смесь на необходимое количество образцов, для этого на одну пробу добавляли 8 мкл смеси для ПЦР, 7 мкл смеси праймеров и 0,2 мкл (1 ед) Taq-полимеразы, смесь перемешивали, избегая образования пены, и раскапывали по 15 мкл в пробирки объемом 0,2 см, на поверхность смеси вносили воск в объеме 15 мкл, на воск наносили по 10 мкл исследуемого образца. Реакцию осуществляли в следующем режиме:
1. Удержание температуры 95°С - 3 мин
2. Циклирование 95°С - 10 с
60°С - 20 с
72°С - 15 с
Цикл повторить 5 раз
3. Циклирование с детекцией 2
95°С - 10 с
60°С - 20 с - Детекция
72°С - 15 с
Цикл повторить 40 раз
Флуоресценцию измеряли по каналу Green при температуре 60°С.
Но данный способ не может быть использован для выявления провируса иммунодефицита КРС из-за неспецифичности праймеров и зонда для BIV, а проведение реакции обратной транскрипции (ОТ) перед постановкой ГЩР увеличивает материальные и временные затраты на постановку анализа и усиливает риск возникновения контаминации в лаборатории.
Технической задачей является разработка быстрого, высокоспецифичного и чувствительного количественного способа обнаружения ДНК провируса иммунодефицита КРС методом ПНР в реальном времени путем конструирования набора, содержащего пару специфичных олигонуклеотидных праймеров и ДНК-зонд, а также подбора условий для проведения ПНР с ними, обеспечивающего минимальный риск контаминации в лаборатории при проведении анализа, а также исключающего субъективность при оценке результатов ПЦР.
Технический результат предлагаемого изобретения заключается в конструировании специфических олигонуклеотидных праймеров и TaqMan-зонда, комплементарных консервативной области генома BIV, и разработке способа их применения в Real-time PCR, что обеспечивает максимальную чувствительность, специфичность и скорость проведения реакции, минимизацию возможности контаминации образцов, реактивов, помещения и оборудования лаборатории образующимися ампликонами, а также полную объективность и количественный анализ полученных данных за счет автоматического учета результатов.
На фигуре 1 представлена схема строения генома BIV, размещенная на web-ресурсе NCBI (http://www.ncbi.nlm.nih.gov/genome/?term=bovine+immunodeficiency+virus).
На фигуре 2 представлен отчет работы прибора Rotor-Gene 6000 (Corbett Research Pty Ltd., Австралия) и результаты проведения Real-time PCR с применением разработанных праймеров и зонда при моделировании реакционной смеси и определений условий амплификации.
На фигуре 3 представлен отчет работы прибора Rotor-Gene 6000 и результаты проведения Real-time PCR с применением разработанных праймеров и зонда при определении чувствительности способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
На фигуре 4 представлен график из отчета работы прибора Rotor-Gene 6000 при определении специфичности способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
На фигуре 5 представлен график из отчета работы прибора Rotor-Gene 6000 при использовании Real-time PCR для выявления ДНК провируса BIV в крови КРС с применением разработанных специфических олигонуклеотидных праймеров и зонда.
На фигуре 6 представлен отчет работы прибора Rotor-Gene 6000 и результаты проведения Real-time PCR при выявлении ДНК провируса BIV в лимфоцитах крови КРС с использованием разработанных специфических олигонуклеотидных праймеров и зонда.
Техническая задача решается, а технический результат достигается путем конструирования специфических праймеров и зонда с помощью компьютерных программ на основании анализа нуклеотидных последовательностей референтных штаммов и изолятов, опубликованных на ресурсе GenBank (http://vvrvm.ncbi.nlm.nih.gov/nuccore/9626219?report=genbank) и подбора условий для проведения ПЦР в реальном времени с применением разработанных праймеров и зонда, несущего флуорофор и тушитель, и комплементарного части амплифицируемого со специфическими праймерами фрагмента. При этом праймеры и зонд отличаются тем, что имеют следующий нуклеотидный состав (5'-3'-):pf - TAGGGTAGTGGGATCTCAGAAATC, pr - ACATCCGTAACATCTCCTACCATC, z - GAGGATGGTAGGAGATGTTACGGAT, в качестве источника флуоресценции на 5' конце зонда применяют краситель ROX, а для тушения флуоресценции на 3' конце BHQ2. Для проведения ПЦР в режиме реального времени в отдельной пробирке готовят общую реакционную смесь на необходимое количество образцов, которая отличается тем, что на одну пробу берут буфер 10-кратный для ПЦР - 2,5 мкл, дНТФ (25 мМ) - 0,2 мкл, праймеры pf и pr (10 пмоль/мкл) по 1 мкл, зонд z (10 пмоль/мкл) 0,5 мкл, Taq полимеразу (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 2 мкл, бидистиллированную воду - 7,6 мкл. Смесь перемешивают, избегая образования пены, раскапывают по 15 мкл в пробирки объемом 0,2 см. На поверхность смеси вносят воск в объеме 15 мкл и на воск наносят по 10 мкл исследуемого образца. Постановка реакции отличается тем, что ее осуществляют в следующем режиме (для Rotor-Gene 6000):
1. Удержание температуры 95°С - 5 мин
2. Цитирование 95°С - 20 с
55°С - 20 с
72°С - 20 с
Цикл повторить 10 раз
3. Циклирование с детекцией 2
95°С - 20 с
55°С - 20 с - Детекция
72°С - 20 с
Цикл повторить 25 или 30 раз
Флуоресценцию измеряют по каналу Orange при температуре 55°С.
При этом отсутствует необходимость проводить реакцию ОТ.
Конструирование пары синтетических олигонуклеотидных праймеров и зонда, применяемых для выделения ДНК провируса иммунодефицита КРС, и разработка способа диагностики ВИ КРС с их использованием осуществлялись в семь этапов.
1. Анализ структуры генома BIV.
2. Конструирование праймеров и зонда.
3. Подбор оптимальной пары праймеров и зонда.
4. Моделирование состава реакционной смеси способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
5. Отработка условий способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
6. Определение чувствительности способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
7. Определение специфичности способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
1. Анализ структуры генома BIV.
С помощью компьютерной программы Vector NTI 11 (Invitrogen, США) проводили анализ структуры генома референтного штамма Bovine immunodeficiency virus и фрагментов генома BIV, размещенных на web - ресурсе NCBI, с целью выявления наиболее консервативного участка, которым оказался ген gag (316…1746 п. н.) (фиг. 1).
2. Конструирование праймеров и зонда.
С помощью компьютерной программы GENERUNR 3.0, геном вируса в формате FASTA применяли для подбора специфических олигонуклеотидов на участке gag (316…1746 п. н.), как наименее вариабельного для BIV.
3. Подбор оптимальной пары праймеров и зонда.
Проверку качества и термодинамический анализ выбранных праймеров выполняли с помощью программы OLIGO DNA/RNA primer analysis software, v.5.0. (http://molbiol-tools.ca/molecular_biology_freeware.htm#Primer%20design) и BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi). При дизайне праймеров и зонда основными требованиями были: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри олигонуклеотидов и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига праймеров; выбор температуры отжига зонда на 10°С выше, чем праймеров.
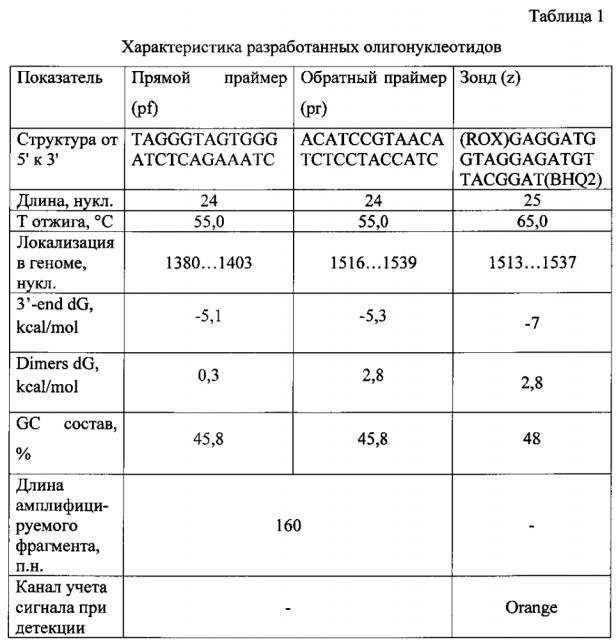
На основании проведенного компьютерного анализа была подобрана пара праймеров и зонд, характеристики которых приведены в таблице 1.
Разработанные олигонуклеотиды имеют оптимальные размер (24-25 пл.), структуру, о чем свидетельствуют показатели энергии Гиббса на 3' конце (3'-end dG): -5 и -7 kcal/mol и энергии Гиббса димерных структур (Dimers dG): 0,3 и 2,8 kcal/mol, и GC состав (45,8 и 48%), температуру отжига праймеров 55°С, температуру отжига зонда 65°С.
4. Моделирование состава реакционной смеси способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
Нуклеиновые кислоты (НК) из стабилизированных ЭДТА проб периферической крови КРС выделяли методом нуклеосорбции на силикогеле с использованием набора «ДНК-сорб-В» (ИнтерЛабСервис, Россия). ПЦР проводили в объеме реакционной смеси - 25 мкл на 1 пробу. Состав реакционной смеси представлен в таблице 2.
Состав реакционной смеси подбирали таким образом, чтобы концентрация ионов MgCl2 была в пределах 1,5- 4 мМ, что обеспечивает оптимальную скорость и точность работы фермента Taq-полимеразы, концентрация дНТФ - не более 0,4 мМ, концентрация праймеров -10 пмоль/мкл и объем пробы - 10 мкл. Перед нанесением пробы ДНК, во избежание образования неспецифических фрагментов, на поверхность смеси вносили 1-2 капли расплавленного воска для ПЦР, чтобы разделить реакционную смесь и исследуемый образец.
5. Отработка условий способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
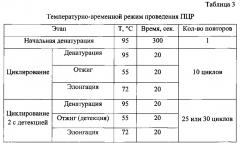
Отработку условий ПЦР с использованием разработанных олигонуклеотидов осуществляли на амплификаторе Rotor-Gene 6000 (Corbett Research Pty Ltd., Австралия). Температурно-временной режим проведения ПЦР представлен в таблице 3.
Флуоресценцию измеряют по каналу Orange (возбуждение 589 нм, излучение 605 нм) при температуре 55°С на втором циклировании. При учете результата threshold (порог) устанавливали вручную на уровне 30% от максимального уровня флуоресценции в последнем цикле амплификации. Уровень threshold составил 0,05. Значения показателя «Ct» были на уровне 24-25. В положительных образцах кривая флуоресценции пересекает линию threshold и, в зависимости от интенсивности сигнала, возвышается над линией более или менее. В отрицательных образцах и отрицательном контроле флуоресценции не наблюдается, что отражается прямой детекции на уровне или ниже линии threshold (фиг. 2).
6. Определение чувствительности способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
Положительные пробы ДНК использовали в качестве позитивного контроля при определении чувствительности метода. Учитывая высокую чувствительность метода ПЦР в реальном времени, из очищенных проб ДНК, полученной из инфицированных ВИ лимфоцитов крови КРС, готовили разведения 10-3 и 10-4. Пробы исследовали методом Real-time PCR с применением разработанных специфических олигонуклеотидов. Во всех разведениях кривая флуоресценции пересекала линию threshold и возвышалась над ней. В разведении 10-3 показатель «пороговый цикл» («Ct») составил 18, для 10-4 - 25 (фиг. 3).
7. Определение специфичности способа диагностики ВИ КРС с использованием разработанной пары праймеров и зонда.
Специфичность разрабатываемого способа проверяли на гомологичных и гетерологичных образцах: провирусная ДНК BIV, BLV (вирус энзоотического лейкоза КРС), FIV (вирус иммунодефицита кошек), FeLV (вирус лейкемии кошек), а также образцах от интактных животных. Положительный результат в ПЦР был получен только с образцом ДНК, содержащими BIV, при отсутствии кривой флуоресценции с другими пробами и в отрицательном контроле (фиг. 4).
Пример 1. Применение Real-time PCR для выявления ДНК провируса иммунодефицита КРС с использованием разработанных специфических олигонуклеотидных праймеров и зонда при исследовании периферической крови КРС.
Для анализа методом ПЦР были взяты 32 пробы периферической крови от коров (с. Озерное Саратовская обл.), признанных больных энзоотическим лейкозом на основании серологических и гематологических исследований, так как по литературным данным у таких животных наиболее часто выявляется ВИ КРС. В качестве контроля использовали очищенную ДНК крови BIV-позитивных животных. В процессе ПЦР в 10 пробах были получены кривые флуоресценции, пересекающие линию threshold, при отсутствии таковой в отрицательном контроле. Это свидетельствует о воспроизводимости результатов проведенных опытов (фиг. 5).
Пример 2. Применение реакции амплификации для выявления ДНК провируса иммунодефицита КРС в лимфоцитах крови, с использованием разработанных специфических олигонуклеотидных праймеров и зонда.
Для анализа методом ПЦР были взяты 6 проб лимфоцитов крови КРС находящегося в частном владении и подозрительного в заражении BIV, в том числе у трехнедельной телочки, полученной от BIV-позитивной коровы. В процессе ПЦР во всех 6 пробах были получены кривые флуоресценции, пересекающие линию threshold, при отсутствии таковой в отрицательном контроле. Значения показателя «Ct» составило от 18 до 24. Это свидетельствует о воспроизводимости результатов проведенных опытов (фиг. 6).
Предложенные набор и способ диагностики позволяют количественно выявлять на ранних стадиях высоко консервативную область гена gag ВИ КРС. Применение олигонуклеотидного зонда позволяет повысить чувствительность и специфичность способа, исключить субъективность при оценке результатов. Использование предлагаемой модификации ПНР позволяет значительно снизить возможность контаминации образцов, помещения, оборудования и реактивов, а также сократить сроки проведения анализа, что важно как для владельцев животных, так и для ветеринарных специалистов.
Предложенный способ диагностики и набор для его реализации апробированы с положительными результатами и регулярной воспроизводимостью этих результатов в 2015 году на 32 пробах периферической крови и 6 пробах лимфоцитов крови, полученных от КРС, подозрительного в заражении BIV.
Работу проводили на базе межкафедральной учебно-научно-исследовательской лаборатории «Геном» ФГБОУ ВПО «Саратовский ГАУ» и ФКУЗ РосНИПЧИ «Микроб» (г. Саратов).
1. Набор для выявления ДНК провируса иммунодефицита крупного рогатого скота, содержащий пару специфичных праймеров и ДНК-зонд, методом полимеразной цепной реакции в режиме реального времени, отличающийся тем, что имеют следующий нуклеотидный состав (5′-3′-):pf - TAGGGTAGTGGGATCTCAGAAATC,pr - ACATCCGTAACATCTCCTACCATC,z - GAGGATGGTAGGAGATGTTACGGAT,в качестве источника флуоресценции на 5′ конце зонда применяют краситель ROX, а для тушения флуоресценции на 3′ конце BHQ2.
2. Способ диагностики вирусного иммунодефицита крупного рогатого скота методом полимеразной цепной реакции в режиме реального времени с использованием набора для выявления ДНК провируса иммунодефицита крупного рогатого скота по п. 1, отличающийся тем, что реакционную смесь готовят путем смешения буфера 10-кратного для ПЦР - 2,5 мкл, дНТФ (25 мМ) - 0,2 мкл, праймеров pf и pr (10 пмоль/мкл) по 1 мкл, зонда z (10 пмоль/мкл) - 0,5 мкл, Taq полимеразы (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 2 мкл, бидистиллированной воды - 7.6 мкл, а амплификацию проводят в следующем режиме:денатурация 95°С - 5 мин,циклирование: денатурация (95°С - 20 с) - отжиг (55°С - 20 с) - элонгация (72°С - 20 с), причем цикл денатурация - отжиг - элонгация повторяется 10 раз,циклирование 2 с детекцией: денатурация (95°С - 20 с) - отжиг (55°С - 20 с) - элонгация (72°С - 20 с), причем цикл денатурация - отжиг - элонгация повторяется 25 или 30 раз, при этом флуоресценцию измеряют по каналу Orange при температуре 55°С, и пересечение кривой флуоресценции линии threshold, установленной на уровне 30% от максимального уровня флуоресценции в последнем цикле амплификации, свидетельствует о наличии в образце провируса BIV, причем, чем меньше значение показателя «Ct», тем выше количество провируса BIV в исследуемом образце, в то время как отсутствие пересечения кривой флуоресценции линии threshold свидетельствует об отсутствии провируса BIV в образце.