Мутантный канальный родопсин-2
Иллюстрации
Показать всеГруппа изобретений относится к мутантным канальным родопсинам и к их соответствующим применениям. Активируемый светом ионный канал содержит аминокислотную последовательность, которая по меньшей мере на 70% гомологична аминокислотной последовательности положений 1-309 SEQ ID NO: 1 (СНОР-2) и которая содержит замену в положении, соответствующем L132 в SEQ ID NO: 1. При этом замена повышает полярность канала, и проводимость кальция увеличивается по меньшей мере в два раза по сравнению с диким типом СНОР-2, как определено визуализацией Fura-2 на клетках HEK293. 7 н. и 9 з.п. ф-лы, 7 ил., 1 табл.
Реферат
Изобретение относится к мутантным канальным родопсинам, обладающим улучшенными свойствами, к конструкциям нуклеиновых кислот, кодирующим мутантные канальные родопсины, к экспрессирующим векторам, несущим конструкцию нуклеиновой кислоты, к клеткам, содержащим указанную конструкцию нуклеиновой кислоты или экспрессирующий вектор, и к их соответствующему применению.
Уровень техники
Светозависимый катионный канал внутреннего выпрямления канальный родопсин-2 (ChR2) стал предпочтительным инструментом направленной световой активации нейронов in vitro и in vivo1-4. Хотя для индуцируемой светом деполяризации можно использовать ChR2 дикого типа (WT), продолжаются исследования мутантов ChR2 с повышенной светочувствительностью для возможных будущих клинических применений (WO 03/084994 и 5-7). Большая эффективность позволила бы осуществить деполяризацию клеточных слоев, находящихся на расстоянии от применяемого источника света, несмотря на низкий оптический коэффициент пропускания, например, в тканях головного мозга. Повышение светочувствительности также позволило бы решить проблему возможных повреждений клеток при длительном облучении светом высокой интенсивности синего света, необходимых для полной активации ChR2 WT (1018-1019 фот с-1см-2 при 480 нм). Варианты с более высокой светочувствительностью также являются ключевыми для исследований, относящихся к восстановлению зрения8,9. На уровне белков более высокую эффективность света можно получать только путем повышения времени жизни в открытом состоянии и/или повышением единичной проводимости канала, т.к. светочувствительность как таковую можно улучшить лишь незначительно за счет природы ретиналя хромофоров ChR2. Ранее проведенные исследования показали, что мутации в положениях C128 и D156 спирали 3 и 4, соответственно, приводят к значительно замедленной кинетики каналов со временем жизни в открытом состоянии до 30 минут и более, обеспечивая в 500 раз выше или даже более высокую светочувствительность5 ' 6. Такие мутанты C128 и D156 можно выключать при различных периодах времени жизни в открытом состоянии красным светом. Несмотря на очень высокую светочувствительность, их медленно затухающая кинетика остается ограничивающим фактором их применимости.
Таким образом, существует необходимость в активируемых светом катионных каналах, обладающих более высокой светочувствительностью и более быстрой кинетикой ответной реакции.
Сущность изобретения
Как известно, потенциал внутренней поверхности мембраны клетки зависит от Ca++, и изменения субмембранных уровней внутриклеточного Ca++ приводят к деполяризации мембраны и к активации потенциалзависимых Na+-каналов в нейронах. Таким образом, авторы настоящего изобретения предположили, что светочувствительность нейрона можно опосредовано повышать, увеличивая потенциал внутренней поверхности их мембраны за счет притока Ca++. Неожиданно авторы изобретения обнаружили мутант ChR2 с повышенной проницаемостью для Ca++, далее обозначен как CatCh, т.е. переносящий кальций канальный родопсин. CatCh обладает в четыре раза более высокой проницаемостью для Ca++, в 70 раз более высокой светочувствительностью и более быстрой кинетикой ответной реакции при экспрессии в нейронах гиппокампа по сравнению с ChR2 WT. Показано, что повышенная светочувствительность и быстрая кинетика обусловлены относительно высоким светозависимым притоком Ca++, который повышает потенциал внутренней поверхности мембраны и активирует Ca++-активируемые калиевые каналы высокой проводимости (BK). Увеличение [Ca++]i повышает потенциал внутренней поверхности, способствуя активации потенциалзависимых Na+-каналов и опосредованно увеличивая светочувствительность. Следующая за стимуляцией светом реполяризация заметно ускорена активацией Ca++-зависимого BK канала. CatCh представляет собой пример нового принципа, на основании которого можно сконструировать светозависимые каналы для повышения светочувствительности нейрональной стимуляции. Его характеристики, такие как стимуляция с высокой точностью и быстрые потенциалы действия наряду с необходимостью низких интенсивностей света для активации, открывают возможность использования светозависимых каналов в клинической практике.
Таким образом, в первом аспекте изобретение относится к активируемому светом ионному каналу, где индуцируемый светом ионный канал содержит аминокислотную последовательность, которая обладает по меньшей мере на 70% гомологична аминокислотной последовательности, в положениях 1-309 SEQ ID NO:1 (CHOP-2), и которая содержит мутацию в положении, соответствующем L132 SEQ ID NO: 1.
В сходном втором аспекте изобретение также относится к канальному родопсину, содержащему активируемый светом ионный канал по первому аспекту и ретиналь или производное ретиналя. Кроме того, в третьем аспекте изобретение относится к конструкции нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую индуцируемый светом ионный канал по первому аспекту. В другом аспекте изобретение относится к экспрессирующему вектору, содержащему нуклеотидную последовательность, кодирующую активируемый светом ионный канал по первому аспекту или конструкцию нуклеиновой кислоты по третьему аспекту.
Кроме того, изобретение относится к клетке, содержащей канальный родопсин по второму аспекту, конструкцию нуклеиновой кислоты по третьему аспекту или экспрессирующий вектор по четвертому аспекту.
Кроме того, изобретение относится к применению активируемого светом ионного канала по первому аспекту, канального родопсина второго аспекта, конструкции нуклеиновой кислоты или экспрессирующего вектора по изобретению и клетки по изобретению в качестве лекарственного средства. В частности, изобретение относится к применению экспрессирующего вектора по изобретению в генотерапии.
Более конкретно, изобретение относится к применению активируемого светом ионного канала, канального родопсина, конструкции нуклеиновой кислоты, экспрессирующего вектора или клетки по изобретению при лечении слепоты или вызванного ослабления зрения.
В другом аспекте изобретение относится к применению активируемого светом ионного канала по первому аспекту, дополнительно содержащего треонин, серин или аланин в положении, соответствующем положению 128 SEQ ID NO: 1, и/или аланин в положении, соответствующем положению 156 SEQ ID NO: 1, при абляции злокачественных клеток.
В последнем аспекте изобретение относится к применению активируемого светом ионного канала по первому аспекту или канального родопсина по второму аспекту, или клетки по изобретению в высокопроизводительном скрининге.
Подробное описание предпочтительных вариантов осуществления
В первом аспекте изобретение относится к активируемому светом ионному каналу, где активируемый светом ионный канал содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности положений 1-309 SEQ ID NO: 1 (CHOP-2), более предпочтительно, к аминокислотной последовательности положений 1-315 SEQ ID NO: 1, или к аминокислотной последовательности положений 1-737 SEQ ID NO: 1, и которая содержит мутацию в положении, соответствующем L132 в SEQ ID NO: 1.
CHOP2 дикого типа имеет следующую аминокислотную последовательность:
MDYGGALSAV GRELLFVTNP VVVNGSVLVP EDQCYCAGWI ESRGTNGAQT ASNVLQWLAA GFSILLLMFY AYQTWKSTCG WEEIYVCAIE MVKVILEFFF EFKNPSMLYL ATGHRVQWLR YAEWLLTCPV ILIHLSNLTG LSNDYSRRTM GLLVSDIGTI VWGATSAMAT GYVKVIFFCL GLCYGANTFF HAAKAYIEGY HTVPKGRCRQ VVTGMAWLFF VSWGMFPILF ILGPEGFGVL SVYGSTVGHT IIDLMSKNCW GLLGHYLRVL IHEHILIHGD IRKTTKLNIG GTEIEVETLV EDEAEAGAVN KGTGKYASRE SFLVMRDKMK EKGIDVRASL DNSKEVEQEQ AARAAMMMMN GNGMGMGMGM NGMNGMGGMN GMAGGAKPGL ELTPQLQPGR VILAVPDISM VDFFREQFAQ LSVTYELVPA LGADNTLALV TQAQNLGGVD FVLIHPEFLR DRSSTSILSR LRGAGQRVAA FGWAQLGPMR DLIESANLDG WLEGPSFGQG ILPAHIVALV AKMQQMRKMQ QMQQIGMMTG GMNGMGGGMG GGMNGMGGGN GMNNMGNGMG GGMGNGMGGN GMNGMGGGNG MNNMGGNGMA GNGMGGGMGG NGMGGSMNGM SSGVVANVTP SAAGGMGGMM NGGMAAPQSP GMNGGRLGTN PLFNAAPSPL SSQLGAEAGM GSMGGMGGMS GMGGMGGMGG MGGAGAATTQ AAGGNAEAEM LQNLMNEINR LKRELGE (SEQ ID NO: 1)
Активируемый светом ионный канал по изобретению представляет собой мембранный белок по меньшей мере с 5 трансмембранными спиралями, который способен связывать чувствительный к свету полиен. Трансмембранные белки с 6 или 7 трансмембранными спиралями являются предпочтительными. Однако трансмембранные белки с более чем 7 спиралями, например, 8, 9 или 10 трансмембранными спиралями также включены в изобретение. Кроме того, изобретение относится к трансмембранным белкам, которые в дополнение к трансмембранной части содержат C- и/или N-концевые последовательности, где C-концевые последовательности могут простираться внутрь ограниченного мембранной просвета, например, в цитоплазму клетки или внутрь липосомы, или могут также располагаться на внешней поверхности мембраны. То же самое необязательно касается содержащейся N-концевой последовательности, которая может аналогичным образом располагаться в просвете, а также на внешней поверхности мембраны. Для длины C- и/или N-концевых последовательностей по существу не установлены ограничения, однако предпочтительными являются активируемые светом ионные каналы с не погруженными в мембрану C-концевыми последовательностями от 1 до 1000 аминокислот, предпочтительно, от 1 до 500, особенно предпочтительно, от 5 до 50 аминокислот. Независимо от длины C-концевые последовательности, N-концевые локализованные последовательности, не погруженные в мембрану, предпочтительно, содержат от 1 до 500 аминокислот, особенно предпочтительно, от 5 до 50 аминокислот. Специалистам с данной области хорошо известна концепция трансмембранной спирали. В основном они представляют собой α-спиральные белковые структуры, которые, как правило, содержат от 20 до 25 аминокислот. Однако в зависимости от природы мембраны, которая может представлять собой природную мембрану, например, клеточную или плазматическую мембрану, или также синтетическую мембрану, трансмембранные сегменты также могут быть короче или длиннее. Например, трансмембранные сегменты в искусственных мембранах могут содержать до 30 аминокислот, но, с другой стороны, также могут содержать только несколько аминокислот, например, от 12 до 16.
В предпочтительном варианте осуществления активируемый светом ионный канал содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична, предпочтительно, по меньшей мере на 75% идентична, более предпочтительно, по меньшей мере на 80% идентична, еще более предпочтительно, по меньшей мере на 85% идентична, например, по меньшей мере на 90% идентична, и наиболее предпочтительно, по меньшей мере на 95% идентична аминокислотной последовательности положений 1-309 SEQ ID NO: 1.
В другом предпочтительном варианте осуществления активируемый светом ионный канал содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична, предпочтительно, по меньшей мере на 75% идентична, более предпочтительно, по меньшей мере на 80% идентична, еще более предпочтительно, по меньшей мере на 85% идентична, например, по меньшей мере на 90% идентична, и наиболее предпочтительно, по меньшей мере на 95% идентична аминокислотной последовательности положений 1-315 SEQ ID NO: 1.
Как правило, аминокислотная последовательность "по меньшей мере на x% идентична" другой аминокислотной последовательности или указанной выше SEQ ID NO: 1, если идентичность последовательности указанной последовательностью и последовательностью сравнения составляет по меньшей мере x%. Такое выравнивание можно проводить с использованием, например, общедоступных компьютерных программ поиска гомологии, таких как программа "BLAST", предоставляемая на главной странице NCBI по ссылке http://www.ncbi.nlm.nih.gov/blast/blast.cgi, с использованием установок по умолчанию, предоставленных по указанной выше ссылке. Дополнительные способы определения процента идентичности последовательности набора последовательностей нуклеиновой кислоты известны в данной области.
Примерами таких активируемых светом ионных каналов, содержащих аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности положений 1-309 или 1-315 SEQ ID NO: 1, являются CHOP1 из C. reinhardtii (gi: 15811379), CHOP2 (gi: 167650748) и CHOP1 (gi: 167650744) из Volvox carteri, или любой другой ортолог или аллельный вариант CHOP2 или CHOP 1.
Даже в более предпочтительном варианте осуществления активируемый светом ионный канал содержит, предпочтительно состоит из аминокислотной последовательности, показанной в положениях 1-309 SEQ ID NO: 1 (CHOP-2), за исключением мутации в положении L132.
В другом даже более предпочтительном варианте осуществления активируемый светом ионный канал содержит, предпочтительно состоит из аминокислотной последовательности, показанной в положениях 1-315 SEQ ID NO: 1 (CHOP-2), за исключением мутации в положении L132.
Мутация в положении L132, или в положении, соответствующем L132 в SEQ ID NO: 1, может представлять собой замену, добавление и/или делецию. Однако предпочтительно мутация представляет собой замену, более предпочтительно выбранную из L132C, L132S, L132E, L132D и L132T, наиболее предпочтительно, где замена представляет собой L132C. Даже несмотря на то, что экспериментальные данные ограничены L132C, предполагают, что замены L132S, L132E, L132D и L132T будут проявлять аналогичные свойства, т.к. все эти замены будут увеличивать полярность канала.
Кроме того, активируемый светом канал содержит дополнительные (полу)консервативные замены. Консервативные замены представляют собой такие, которые происходят в семействе аминокислот, которые связаны с их боковыми цепями и химическими свойствами. Примерами таких семейств являются аминокислоты с основными боковыми цепями, с кислотными боковыми цепями, с неполярными алифатическими боковыми цепями, с неполярными ароматическими боковыми цепями, с незаряженными полярными боковыми цепями, с маленькими боковыми цепями, с большими боковыми цепями и т.д. Конкретные полуконсервативные и консервативные замены представляют собой:
| Аминокислота | Консервативная замена | Полуконсервативная замена |
| A | G; S; T | N; V; C |
| C | A; V; L | M; I; F; G |
| D | E; N; Q | A; S; T; K; R; H |
| E | D; Q; N | A; S; T; K; R; H |
| F | W; Y; L; M; H | I; V; A |
| G | A | S; N; T; D; E; N; Q |
| H | Y; F; K; R | L; M; A |
| I | V; L; M; A | F; Y; W; G |
| K | R; H | D; E; N; Q; S; T; A |
| L | M; I; V; A | F; Y; W; H; C |
| M | L; I; V; A | F; Y; W; C; |
| N | Q | D; E; S; T; A; G; K; R |
| P | V; I | L; A; M; W; Y; S; T; C; F |
| Q | N | D; E; A; S; T; L; M; K; R |
| R | K; H | N; Q; S; T; D; E; A |
| S | A; T; G; N | D; E; R; K |
| T | A; S; G; N; V | D; E; R; K; I |
| V | A; L; I | M; T; C; N |
| W | F; Y; H | L; M; I; V; C |
| Y | F; W; H | L; M; I; V; C |
Кроме того, специалисту в данной области будет понятно, что не следует заменять глицины в необходимых стерических положениях, и что не следует вводить пролин в участки белка, которые содержат альфа-спиральную или бета-складчатую структуру.
В другом предпочтительном варианте осуществления активируемый светом канал содержит консенсусный мотив L(I)DxxxKxxW(F,Y). Приведенные в скобках аминокислоты в каждом случае могут заменять предшествующую аминокислоту. Такой консенсусный мотив представляет собой мотив, окружающий ретиналь-связывающую аминокислоту лизин.
Возможность активировать CatCh интенсивностью света природного происхождения при поддержании высокой временной точности, делает его уникальным кандидатом, в частности в попытках поиска способов генной терапии для восстановления зрения, а также для других биомедицинских применений. Вследствие его пониженных потребностей в свете, спайки CatCh могут быть вызваны даже возбуждением, далеким от его спектрального максимума 474 нм, например, зеленым светом (532 нм - см. фиг.4d). Возможным является функционирование на внешних границах спектра активации вследствие его пониженных потребностей в свете, и она способствует проникновению в ткани.
Таким образом, светочувствительность мутантного активируемого светом ионного канала по изобретению предпочтительно повышена более чем в 5 раз, предпочтительно, более чем в 10 раз, более предпочтительно, более чем в 20 раз, например, в 30 раз, еще более предпочтительно, более чем в 40 раз, например, в 50 раз, и наиболее предпочтительно, более чем в 60 раз, или еще более чем в 70 раз, по сравнению с CHOP-2 WT в нейронах гиппокампа. Кроме того, для мутантного активируемого светом ионного канала по изобретению показана частота стимуляции, которая повышена по меньшей мере в 1,5 раза, более предпочтительно, в 2 раза, или еще более предпочтительно, в 2,5 раза по сравнению с CHOP-2 WT, как определено электрофизиологической регистрацией целой клетки в нейронах гиппокампа. Как показано в примерах, для Chop2 WT выявлена частота стимуляции в нейронах гиппокампа приблизительно от 10 Гц приблизительно до 20 Гц, где при 20 Гц сигналы уже являются неточными. Кроме того, специалисту будет понятно, что характерная частота повторения спайков также зависит от типа клеток. Например, для слуховых клеток характерная частота повторения спайков составляет до 500 Гц. Кроме того, эксперименты проводили in vitro, т.е. при температуре окружающей среды. Однако специалист может допустить, что частота стимуляции даже будет выше у теплокровных животных, таких как млекопитающие, поскольку кинетика также зависит от температуры. Таким образом, в зависимости от типа клеток и температуры можно ожидать, что мутантный активируемый светом ионный канал по изобретению может также характеризоваться частотой стимуляции, которая повышена по меньшей мере в 5 раз, предпочтительно, по меньшей мере в 10 раз, такой как по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или более предпочтительно, по меньшей мере в 40 раз, по меньшей мере в 50 раз, такой как по меньшей мере в 60 раз, или по меньшей мере в 70 раз, еще более предпочтительно, по меньшей мере в 80 раз, по меньшей мере в 90 раз, или по меньшей мере в 100 раз, наиболее предпочтительно, по меньшей мере в 125 раз, например, по меньшей мере в 150 раз, или по меньшей мере в 175 раз и, еще более предпочтительно, по меньшей мере в 200 раз по сравнению с CHOP-2 WT, что определено с помощью электрофизиологической регистрации целой клетки. Культура нейронов гиппокампа и электрофизиологическая регистрация сигналов от нейронов гиппокампа проиллюстрированы в приведенных ниже примерах.
В кратком изложении, гиппокамп выделяют у крыс Sprague-Dawley в первые сутки постнатального периода (Jackson Laboratory) и обрабатывают папаином (20 ед. мл-1) в течение 20 мин при 37ºC. Гиппокамп отмывают DMEM (Invitrogen/Gibco, с высоким содержанием глюкозы) с добавлением 10% эмбриональной телячьей сыворотки и измельчают в небольшом объеме этого раствора. ≈75000 клеток высевают на покрытые поли-D-лизином/ламинином стеклянные покровные стекла в 24-луночные планшеты. Через 3 часа среду для посева заменяют культуральной средой (Neurobasal A, содержащей 2% добавки B-27, 2 мМ Glutamax-I и 100 ед./мл пенициллина и 100 мкг/мл стрептомицина). Мутантный ChR2(L132C)-YFP и ChR2 (WT)-YFP трансфицируют через 5-10 суток после посева с использованием реагента липофектамин 2000 (Invitrogen). Альтернативно, можно добавлять 2-5×109 геномных копий/мл вируса (AAV2/7-CAG-ChR2(L132C)-2A-EGFP-WPRE-bGH) в каждую лунку через 4-9 суток после посева. Характерная конструкция конструкции аденоассоциированного вирусного вектора подробно описана в следующих ниже примерах. Экспрессия становится видимой на 5 сутки после трансдукции. Неполный транс-ретиналь добавляли в культуральную среду или регистрирующую среду для любого из экспериментов.
Для регистраций целой клетки в культивируемых нейронах гиппокампа пэтч-пипетки с сопротивлением 5-10 МОм наполняют 129 мМ глюконатом калия, 10 мМ HEPES, 10 мМ KCl, 4 мМ MgATP и 0,3 мМ Na3GTP, оттитрованными до pH 7,2. В качестве внеклеточного раствора применяют раствор Тироде (125 мМ NaCl, 2 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, 30 мМ глюкозы и 25 мМ HEPES, оттитрованными до pH 7,4). Условно не содержащий Ca++ внеклеточный раствор содержит аналогичный раствор за исключением того, что он содержит 0 мМ Ca++ и 3 мМ Mg++. Регистрации проводят в присутствии ингибиторов возбуждающей синаптической передачи сигналов 1,2,3,4-тетрагидро-6-нитро-2,3-диоксо-бензо[f]хиноксалин-7-сульфонамида (NBQX, 10 мкМ, Sigma) и D(-)-2-амино-5-фосфонопентановой кислоты (AP-5, 50 мкМ, Sigma). Для регистраций способом фиксации потенциалов к внеклеточному раствору добавляют 1 мкМ тетродотоксина. Для ингибирования активности BK каналов добавляют 1 мМ TEA. Регистрации проводят на инвертированном микроскопе Zeiss Axiovert 25, оборудованном флуоресцентной лампой. Успешную экспрессию белка подтверждают EGFP- или YFP-опосредованной флуоресценцией. Входное сопротивление нейронов составляет 15-40 МОм, и наблюдают за его стабильностью на всем протяжении эксперимента. Электрофизиологические сигналы амплифицируют с использованием амплификатора Axopatch 200A (Axon Instruments, Union City, CA), фильтруют при 10 кГц, преобразовывают в цифровую форму устройством Axon Digidata 1600 (50 Гц) и регистрируют, и анализируют с использованием программного обеспечения pClamp9 (Axon Instruments). Фототоки вызывают с использованием световых импульсов различных длин твердотельного лазера с диодной накачкой (Pusch Opto Tech GmbH, λ1=473 нм, P1=100 мВт, λ2=532 нм, P2=50 мВт) или 10 нс вспышками лазера на красителях с эксимерной накачкой (кумарин 2, λ=450 нм). Конкретные интенсивности света представляют собой интенсивности на конце кварцевого оптического волокна диаметром 400 мкм (STE-F100/400-Y-VIS/NIR, Laser 2000, Wessling, Germany) на расстоянии ≈500 мкм от клетки. Токи, измеряемые от нейронов, экспрессирующих ChR2(L132C)-YFP и ChR2(L132C)-2A-EGFP, являются идентичными.
Кроме того, в другом предпочтительном варианте осуществления проводимость кальция мутантного активируемого светом ионного канала по изобретению повышена по меньшей мере в два раза, предпочтительно, по меньшей мере в три раза, более предпочтительно, по меньшей мере в четыре раза по сравнению с CHOP-2 WT, как определено визуализацией Fura-2 на клетках HEK293. Для определения проводимости кальция проводят нагрузку Fura-2 AM (5 мМ, Invitrogen) при комнатной температуре в течение от 30 мин до 1 часа. После нагрузки клетки восстанавливают в 140 мМ растворе NaCl без Ca++ (140 мМ NaCl, 7 мМ EGTA, 2 мМ MgCl2 и 10 мМ HEPES). Желтый флуоресцентный белок возбуждают 500 мсек воздействием света с использованием фильтра 460/40 нм (Visitron Systems, Puchheim, Germany) для оценки уровня экспрессии каждой клетки от его флуоресценции YFP. Затем раствор заменяют внеклеточным раствором с Ca++, который состоит из 90 мМ CaCl2, 7 мМ EGTA, 2 мМ MgCl2 и 10 мМ HEPES. После 15 мин в темноте светозависимые каналы стимулируют в течение 10 сек синим светом (460/40 нм). Fura-2 возбуждают при 340 нм (340/20) и 380 нм (380/20), и излучаемый свет (540/80 нм) детектируют камерой CCD (все фильтры от Visitron Systems, Puchheim, Germany).
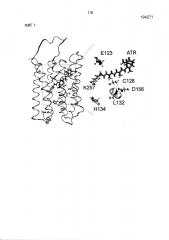
Как указано выше, мутантный активируемый светом ионный канал может дополнительно содержать дополнительные мутации, предпочтительно, замены. В одном предпочтительном варианте осуществления активируемый светом ионный канал может дополнительно содержать по меньшей мере один из следующих аминокислотных остатков: аспарагиновую кислоту в положении, соответствующем положению 253 SEQ ID NO: 1, лизин в положении, соответствующем положению 257 SEQ ID NO: 1, триптофан в положении, соответствующем положению 260 SEQ ID NO: 1, глутаминовую кислоту в положении, соответствующем положению 123 SEQ ID NO: 1, гистидин или аргинин, предпочтительно аргинин, в положении, соответствующем положению 134 SEQ ID NO: 1, треонин, серин или аланин в положении, соответствующем положению 128 SEQ ID NO: 1, и/или аланин в положении, соответствующем положению 156 SEQ ID NO: 1. Таким образом, мутантный активируемый светом ионный канал может содержать одно из следующих сочетаний аминокислотных остатков в указанных положениях, соответствующих SEQ ID NO: 1:
Cys 132 + Asp 253; Cys 132 + Lys 257; Cys 132 + Trp 260; Cys 132 + Glu 123; Cys 132 + His 134; Cys 132 + Arg 134; Cys 132 + Thr 128; Cys 132 + Ser 128; Cys 132 + Ala 128; Cys 132 + Ala 156;
Cys 132 + Asp 253 + Lys 257; Cys 132 + Asp 253 + Trp 260; Cys 132 + Asp 253 + Glu 123; Cys 132 + Asp 253 + His 134; Cys 132 + Asp 253 + Arg 134; Cys 132 + Asp 253 + Thr 128; Cys 132 + Asp 253 + Ser 128; Cys 132 + Asp 253 + Ala 128; Cys 132 + Asp 253 + Ala 156;
Cys 132 + Lys 257 + Trp 260; Cys 132 + Lys 257 + Glu 123; Cys 132 + Lys 257 + His 134; Cys 132 + Lys 257 + Arg 134; Cys 132 + Lys 257 + Thr 128; Cys 132 + Lys 257 + Ser 128; Cys 132 + Lys 257 + Ala 128; Cys 132 + Lys 257 + Ala 156;
Cys 132 + Trp 260 + Glu 123; Cys 132 + Trp 260 + His 134; Cys 132 + Trp 260 + Arg 134; Cys 132 + Trp 260 + Thr 128; Cys 132 + Trp 260 + Ser 128; Cys 132 + Trp 260 + Ala 128; Cys 132 + Trp 260 + Ala 156;
Cys 132 + Glu 123 + His 134; Cys 132 + Glu 123 + His 134; Cys 132 + Glu 123 + Arg 134; Cys 132 + Glu 123 + Thr 128; Cys 132 + Glu 123 + Ser 128; Cys 132 + Glu 123 + Ala 128; Cys 132 + Glu 123 + Ala 156;
Cys 132 + His 134 + Thr 128; Cys 132 + His 134 + Ser 128; Cys 132 + His 134 + Ala 128; Cys 132 + His 134 + Ala 156;
Cys 132 + Arg 134 + Thr 128; Cys 132 + Arg 134 + Ser 128; Cys 132 + Arg 134 + Ala 128; Cys 132 + Arg 134 + Ala 156;
Cys 132 + Thr 128 + Ala 156; Cys 132 + Ser 128 + Ala 156; Cys 132 + Ala 128 + Ala 156;
Cys 132 + Asp 253 + Lys 257 + Trp 260; Cys 132 + Asp 253 + Lys 257 + Glu 123; Cys 132 + Asp 253 + Lys 257 + His 134; Cys 132 + Asp 253 + Lys 257 + Arg 134; Cys 132 + Asp 253 + Lys 257 + Thr 128; Cys 132 + Asp 253 + Lys 257 + Ser 128; Cys 132 + Asp 253 + Lys 257 + Ala 128; Cys 132 + Asp 253 + Lys 257 + Ala 156;
Cys 132 + Lys 157 + Trp 260 + Glu 123; Cys 132 + Lys 157 + Trp 260 + His 134; Cys 132 + Lys 157 + Trp 260 + Arg 134; Cys 132 + Lys 157 + Trp 260 + Thr 128; Cys 132 + Lys 157 + Trp 260 + Ser 128; Cys 132 + Lys 157 + Trp 260 + Ala 128; Cys 132 + Lys 157 + Trp 260 + Ala 156;
Cys 132 + Trp 260 + Glu 123 + His 134; Cys 132 + Trp 260 + Glu 123 +Arg 134; Cys 132 + Trp 260 + Glu 123 + Thr 128; Cys 132 + Trp 260 + Glu 123 + Ser 128; Cys 132 + Trp 260 + Glu 123 + Ala 128; Cys 132 + Trp 260 + Glu 123 + Ala 156;
Cys 132 + Glu 123 + His 134 + Thr 128; Cys 132 + Glu 123 + His 134 + Ser 128; Cys 132 + Glu 123 + His 134 + Ala 128; Cys 132 + Glu 123 + His 134 + Ala 156;
Cys 132 + Glu 123 + Arg 134 + Thr 128; Cys 132 + Glu 123 + Arg 134 + Ser 128; Cys 132 + Glu 123 + Arg 134 + Ala 128; Cys 132 + Glu 123 + Arg 134 + Ala 156;
Cys 132 + His 134 + Thr 128 + Ala 156; Cys 132 + His 134 + Ser 128 + Ala 156; Cys 132 + His 134 + Ala 128 + Ala 156;
Cys 132 + Arg 134 + Thr 128 + Ala 156; Cys 132 + Arg 134 + Ser 128 + Ala 156; Cys 132 + Arg 134 + Ala 128 + Ala 156;
Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123; Cys 132 + Asp 253 + Lys 257 + Trp 260 + His 134; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Arg 134; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Thr 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Ser 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Ala 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Ala 156;
Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Thr 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Ser 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Ala 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Ala 156;
Cys 132 + Trp 260 + Glu 123 + His 134 + Thr 128; Cys 132 + Trp 260 + Glu 123 + His 134 + Ser 128; Cys 132 + Trp 260 + Glu 123 + His 134 + Ala 128; Cys 132 + Trp 260 + Glu 123 + His 134 + Ala 156;
Cys 132 + Trp 260 + Glu 123 + Arg 134 + Thr 128; Cys 132 + Trp 260 + Glu 123 + Arg 134 + Ser 128; Cys 132 + Trp 260 + Glu 123 + Arg 134 + Ala 128; Cys 132 + Trp 260 + Glu 123 + Arg 134 + Ala 156;
Cys 132 + Glu 123 + Arg 134 + Thr 128 + Ala 156; Cys 132 + Glu 123 + Arg 134 + Ser 128 + Ala 156; Cys 132 + Glu 123 + Arg 134 + Ala 128 + Ala 156;
Cys 132 + Glu 123 + His 134 + Thr 128 + Ala 156; Cys 132 + Glu 123 + His 134 + Ser 128 + Ala 156; Cys 132 + Glu 123 + His 134 + Ala 128 + Ala 156;
Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Thr 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Ser 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Ala 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Ala 156;
Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134 + Thr 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ser 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ala 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ala 156;
Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Thr 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ser 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ala 128; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ala 156;
Cys 132 + Trp 260 + Glu 123 + Arg 134 + Thr 128 + Ala 156; Cys 132 + Trp 260 + Glu 123 + Arg 134 + Ser 128 + Ala 156; Cys 132 + Trp 260 + Glu 123 + Arg 134 + Ala 128 + Ala 156;
Cys 132 + Trp 260 + Glu 123 + His 134 + Thr 128 + Ala 156; Cys 132 + Trp 260 + Glu 123 + His 134 + Ser 128 + Ala 156; Cys 132 + Trp 260 + Glu 123 + His 134 + Ala 128 + Ala 156;
Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134 + Thr 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ser 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ala 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ala 156;
Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Thr 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ser 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ala 128; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ala 156;
Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134 + Thr 128 + Ala 156; Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ser 128 + Ala 156; Cys 132 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ala 128 + Ala 156;
Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Thr 128 + Ala 156; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ser 128 + Ala 156; Cys 132 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ala 128 + Ala 156;
Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134 + Thr 128 + Ala 156; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ser 128 + Ala 156; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + His 134 + Ala 128 + Ala 156;
Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Thr 128 + Ala 156; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ser 128 + Ala 156; Cys 132 + Asp 253 + Lys 257 + Trp 260 + Glu 123 + Arg 134 + Ala 128 + Ala 156.
Однако в указанном выше списке Cys 132 также может быть замещен на Ser 132, Glu 132, Asp 132 или Thr 132.
В основном ретиналь или производное ретиналя, необходимое для функционирования активируемого светом ионного канала, продуцируется клеткой для трансфекции с указанным выше ионным каналом. В зависимости от своей конформации ретиналь может быть полностью транс-ретиналем, 11-цис-ретиналем, 13-цис-ретиналем или 9-цис-ретиналем. Однако также предполагают, что мутантный активируемый светом ионный канал по изобретению можно встраивать в везикулы, липосомы или другие искусственные клеточные мембраны. Таким образом, во втором аспекте изобретение относится к канальному родопсину, содержащему активируемый светом ионный канал по первую аспекту и ретиналь или производное ретиналя. Предпочтительно производное ретиналя выбрано из группу, состоящей из 3,4-дегидроретиналя, 13-этилретиналя, 9-диметил-ретиналя, 3-гидроксиретиналя, 4-гидроксиретиналя, нафтилретиналя, 3,7,11-триметил-додека-2,4,6,8,10-пентаеналя, 3,7-диметил-дека-2,4,6,8-тетраеналя, 3,7-диметил-окта-2,4,6-триеналя и ретиналей с заблокированным вращением в положении 6-7, ретиналей с заблокированным вращением в положении 8-9 и ретиналей с заблокированным вращением в положении 10-11. Кроме того, предпочтительные варианты осуществления по первому аспекту соответствуют предпочтительным вариантам осуществления по второму аспекту.
В третьем аспекте изобретение также относится к конструкции нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую активируемый светом ионный канал по первому аспекту. Для обеспечения оптимальной экспрессии кодирующую ДНК также можно соответствующим образом модифицировать, например, добавляя подходящие регуляторные последовательности и/или целевые последовательности и/или подбирая кодирующие ДНК последовательности к предпочтительной частоте использования кодона выбранного хозяина. Мишеневая последовательность может кодировать C-концевое удлинение, направляющее активируемый светом ионный канал к конкретному сайту или компартменту в клетке, такому как синапс или постсинаптический рецептор, к аксональному холмику или эндоплазматическому ретикулуму. Нуклеиновую кислоту можно комбинировать с дополнительными элементами, например, промотором и сигналом начала и остановки транскрипции, и сигналом начала и остановки трансляции, и сигналом полиаденилирования для обеспечения экспрессии последовательности белка по изобретению. Промотор может представлять собой индуцируемый или конститутивный, общий или клеткоспецифический промотор. Примером клеткоспецифического промотора является специфический для биполярных клеток промотор mGlu6. Выбор промоторов, векторов и других элементов является предметом общепринятого дизайна среднего уровня компетентности в данной области. Многие такие элементы описаны в литературе и являются доступными от коммерческих поставщиков.
Таким образом, в четвертом аспекте изобретение относится к экспрессирующему вектору, содержащему нуклеотидную последовательность, кодирующую активируемый светом ионный канал по первому аспекту или конструкцию нуклеиновой кислоты по третьему аспекту. В предпочтительном варианте осуществления вектор является подходящим для генотерапии, в частности, где вектор является подходящим для опосредованного вирусом переноса генов. Термин "подходящий для опосредованного вирусом переноса генов" в настоящем описании означает, что указанный вектор можно упаковывать в вирус и таким образом доставлять в представляющий интерес участок или клетки. Примеры подходящих для генотерапии вирусов представляют собой ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, поксвирусы, альфавирусы, вирус бешенства, вирус леса Семлики и вирусы герпеса. Эти вирусы различаются по способности переноса генов в клетки, которые они распознают и которые способны инфицировать, и возможности изменения ДНК клетки, постоянно или временно. Однако генотерапия также предусматривает не основанные на применении вирусов способы, такие как применение "голой" ДНК, липоплексов и полиплексов и дендримеров.
Как описано выше, получаемую последовательность нуклеиновой кислоты можно вводить в клетки, например, с использованием вируса в качестве носителя или посредством трансфекции, включая, например, химические трансфектанты (такие как липофектамин, Fugene и т.д.), электропорацию, кальций-фосфатную копреципитацию и прямую диффузию ДНК. Способ трансфекции клетки подробно описан в примерах, и его можно адаптировать к соответствующей клетке-реципиенту. Трансфекцией ДНК получают стабильные клетки или клеточные линии, если трансфицированная ДНК интегрирована в геном, или нестабильные (транзиентные) клетки или клеточные линии, где трансфицированная ДНК существует в экстрахромосомной форме. Кроме того, стабильные клеточные линии можно получать с использованием эписомальной реплицирующейся плазмиды, что означает, что наследование экстрахромосомной плазмиды находится под контролем контролирующих элементов, которые интегрированы в клеточный геном. В основном, выбор подходящего вектора или плазмиды зависит от клетки-хозяина.
Таким образом, в пятом аспекте изобретение относится к клетке, содержащей канальный родопсин по второму аспекту, конструкцию нуклеиновой кислоты по третьему аспекту или экспрессирующий вектор по четвертому аспекту.
Как описано ниже, одно из применений мутантного активируемого светом ионного канала по настоящему изобретению представляет собой лечение лишенных зрения индивидуумов, таких как люди или животные. Существует ряд заболеваний, при которых природные зрительные клетки больше не функционируют, но все нервные соединения способны продолжать функционировать. В настоящее время в различных исследовательских центрах предпринимают попытки имплантировать тонкие слои с искусственными керамическими фотоэлементами на сетчатку. Такие фотоэлементы предназначены для деполяризации вторичных все еще интактных клеток сетчатки и, таким образом, для инициирования нервного импульса (бионический глаз). Целенаправленная экспрессия активируемых светом ионных каналов по изобретению в таких ганглионарных клетках, амакриновых клетках или биполярных клетках была бы более чем элегантным решением и обеспечивала бы лучшую трехмерную разрешающую способность зрения.
Встраивание мутантного активируемого светом ионного канала в мембрану клеток, которые в природе не экспрессируют соответствующие каналы, например, можно просто проводить с использованием известных способов технологии рекомбинантной ДНК, где кодирующую ДНК для такого ионного канала сначала встраивают в подходящий экспрессирующий вектор, например, плазмиду, космиду или вирус, а затем трансформируют клетки-мишени такими элементами, и белок экспрессируется в хозяине. Затем клетки обрабатывают подходящим образом, например, ретиналем, для обеспечения связывания основаниями Шиффа белка и ретиналя.
В предпочтительном варианте осуществления это происходит в различных дрожжах, таких как Saccharomyces cerevisiae, Schizosaccharomyces pombe или Pichia pastoris, как уже успешно проведено для родопсинов, таких как бактериородопсин и/или бычий родопсин.
Экспрессию также можно проводить в определенных клеточных системах млекопитающих или клеточных системах насекомых. Таким образом, в предпочтительном варианте осуществления клетка представляет собой клетку млекопитающего или клетку насекомого. Экспрессию также проводят эписомальными векторами в виде транзиторной экспрессии предпочтительно в меланомных клетках (например, клеточной линии BLM), клетках COS (полученных инфицированием клеток "почек CV1 африканской зеленой мартышки") или клетках HEK ("эмбриональных клетках почек человека", например, клетках HEK293), или клетках BHK ("клетках почек детенышей хомячка"), или в виде стабильно экспрессии (интеграцией в геном) в клетках CHO ("клетках яичника китайского хомяка"), миеломных клетках или клетках MDCK ("клетках почки собаки Madine-Darby") или в клетках Sf9 насекомого, инфицированных бакуловирусами. Таким образом, в более предпочтительном варианте осуществления клетка млекопитающего представляет собой клетку COS, клетку BHK, клетку HEK293, клетку CHO, миеломную клетку или клетку MDCK.
В отношении восстановления зрения в наиболее предпочтительном варианте осуществления клетка млекопитающего представляет собой фоторецепторную клетку, палочковидную клетку сетчатки, колбочковидную клетку сетчатки, ганглиозную клетку сетчатки, биполярный нейрон, ганглиозную клетку, псевдоуниполярный нейрон, мультиполярный нейрон, пирамидальный нейрон, клетку Пуркинье или гранулярную клетку.
Нейрон представляет собой электрически возбудимую клетку, которая обрабатывает и передает информацию посредством электрической и химической передачи сигна