Ферменты жидкости икринок, получаемой при вылуплении, и их применение
Иллюстрации
Показать всеИзобретение относится к биохимии. Описаны полипептиды из жидкости икринок, получаемой при вылуплении. Представлены кодирующие их последовательности нуклеиновых кислот, фармацевтические композиции, включающие указанные полипептиды и молекулы нуклеиновых кислот. Описано применение указанных полипептидов в различных медицинских и косметических применениях на коже, особенно для увлажнения кожи и/или для отшелушивания рогового слоя кожи для лечения или профилактики расстройств или состояний кожи у животного. Изобретение расширяет арсенал средств для увлажнения кожи и лечения заболеваний, требующих увлажнения и/или отшелушивания рогового слоя кожи. 25 н. и 15 з.п. ф-лы, 3 ил., 4 пр., 1 табл.
Реферат
Настоящее изобретение относится к применению хориолизина и очень кислых белков (VAP), получаемых из жидкости икринок рыб, получаемой при вылуплении, отдельно или в комбинации в различных косметических и медицинских применениях на коже. Настоящее изобретение также относится к очень кислым белкам, которые описаны для их применения.
Кожа представляет собой один из наиболее уязвимых органов тела. Хотя они редко угрожают жизни, заболевания или патологические состояния кожи могут быть неприятными и вызывать хроническую нетрудоспособность. Кроме того, так как кожа является настолько видимой, заболевания и патологические состояния кожи могут приводить к психологическому стрессу. Следовательно, существует постоянная необходимость в эффективном лечении заболеваний и патологических состояний кожи.
Кожа является самым крупным органом тела, составляя около 12-16 процентов массы тела человека. Она осуществляет множество жизненно важных функций, как барьерное, так и регулирующее взаимодействие между внешним миром и контролируемым окружением в нашем организме.
Кожа состоит из 3 слоев, а именно эпидермиса, дермы и подкожного слоя. Эпидермис является самым верхним, эпителиальным слоем кожи. Он действует как физический барьер, предотвращающий потерю воды из организма, и предотвращающий попадание в тело веществ и организмов. Его толщина варьируется в зависимости от области тела.
Эпидермис состоит из слоистого плоского эпителия, т.е. он состоит из слоев расплющенных клеток. Кожа, волосы и ногти являются кератинизированными, что обозначает, что они имеют мертвую, твердую гидрофобную поверхность, состоящую из белка, называемого кератином. Эпидермис делается непроницаемым из-за содержания внеклеточных липидов, ассоциированных с кератиноцитами, особенно в среднем слое эпидермиса (stratum lucidum). Слизистые мембраны (например, пищевода, ротоглоточной полости, репродуктивных органов и других) преимущественно являются некератинизированными и влажными. Эпидермис имеет три основных типа клеток, а именно, кератиноциты (клетки кожи), меланоциты (пигмент-продуцирующие клетки) и клетки Лангерганса (иммунные клетки). Клетки Меркеля представляют собой четвертые, менее распространенные эпидермальные клетки.
Кератиноциты созревают и дифференцируются с накоплением кератина при движении наружу. Они в конечном счете отпадают или отслаиваются. Они формируют четыре или пять отдельных слоев, которые от наиболее поверхностного к наиболее глубокому представляют собой (i) Stratum corneum (роговой слой) с мертвыми, высушенным твердыми клетками без ядер, (ii) Stratum granulosum (гранулярный слой) с клетками, содержащими базофильные гранулы и отделенными снаружи от рогового слоя тонким блестящим слоем, (iii) Stratum spinulosum (колючий, игольчатый или шиповатый слой клеток), в котором клетки становятся все больше уплощенными при движении наружу и (iv) Stratum basale (базальный слой) с колонообразными (высокими) регенеративными клетками.
Непосредственно под эпидермисом находится базальная мембрана, специализированная структура, которая лежит между эпидермисом и дермой.
Дерма представляет собой фиброзную соединительную ткань или поддерживающий слой кожи. Основными волокнами являются волокна коллагена и эластина, которые переплетены.
Подкожный слой представляет собой жировой слой непосредственно под дермой и эпидермисом. Он также называется подкожной тканью, гиподермой или слоем. Подкожный слой преимущественно состоит из жировых клеток (адипоцитов), нервов и кровеносных сосудов.
Новые эпителиальные клетки кожи создаются в нижнем слое кожи, гранулезном слое. С течением времени клетки мигрируют к поверхности кожи и становятся более кислыми. В течение их 30-дневного путешествия они умирают и становятся насыщенными кератином. Кератин-ассоциированные липиды важны, так как они защищают кожу от внешних элементов.
Заболевания, повреждения, факторы окружающей среды, возраст, уровень гормонов, лекарственные препараты, вещества, наносимые наружно или потребляемые внутрь, генетические состояния или множество других факторов, действующих на кожу, могут приводить к отклонениям от нормы или нарушениям. Некоторые из таких отклонений от нормы или нарушений могут быть чисто косметическими по природе, например, сухость кожи, морщины или измененная пигментация, или могут быть более тяжелыми, приводя к боли или дискомфорту, например, экзема и псориаз.
Сухость кожи является одним из наиболее частых состояний или заболеваний кожи. Хотя определенные лица являются более подверженными к сухости кожи, состояние может поражать каждого, вне зависимости от возраста, пола или типа кожи.
Сухость кожи развивается, когда наружный слой кожи (роговой слой с блестящим слоем) обедняется водой. Когда этот слой хорошо увлажнен, он минимизирует потери воды через кожу и помогает не впускать раздражающие факторы, аллергены и патогенные микроорганизмы. Однако, когда роговой слой высыхает, его защитная функция снижается. Это допускает большие потери воды, оставляя кожу восприимчивой к факторам окружающей среды.
В нормальных условиях роговой слой имеет содержание воды от 10% до 30%. Вода придает коже ее мягкую, гладкую и гибкую текстуру. Вода приходит из атмосферы, подлежащих слоев кожи и пота. Жир, продуцируемый кожными железами, и жирные вещества, продуцируемые клетками кожи, действуют как натуральные увлажнители, позволяя роговому слою изолировать воду.
Организм непрерывно теряет воду через поверхность кожи путем испарения. В нормальных условиях скорость потери низка и вода адекватно замещается. Характерные признаки и симптомы сухой кожи возникают, когда потери воды превосходят замещение воды и содержание воды в роговом слое падает ниже 10%.
Крайне желательными являются увлажнители, которые улучшают или устраняют сухость кожи. Тогда как в области техники известно множество увлажнителей, сохраняется необходимость в натуральных продуктах, которые являются эффективными и мягкими.
Другим частым заболеванием или состоянием кожи является избыточное количество рогового слоя кожи. Такое состояние может возникать в результате недостаточного отслаивания рогового слоя или вследствие избыточного отложения кератина в роговом слое. Последнее может возникать, когда естественные процессы разрушения кожи становятся неравномерными, что придает коже сухой и шершавый характер. Доброкачественные гиперпролиферативные расстройства включают эпидермолитический гиперкератоз (или трещины кожи) и кератоз фолликулов кожи. Одним обычным доброкачественным гиперпролиферативным состоянием является периферическая гипертрофия вокруг шрамов и/или образование келоидов. Другими гиперпролиферативными состояниями являются омозолелости, мозоли, гиперкератозные бородавки (особенно veruca vulgaris), ихтиоз и ладонно-подошвенный кератоз.
Существующее лечение включает отшелушивание или хирургическое вмешательство в крайних случаях. Гиперкератоз обычно лечат путем увлажнения рогового слоя и удаления утолщенной кожи.
Отшелушивание также может использоваться для удаления измененных эпидермальных клеток, например, эпидермальных клеток из эпидермиса, имеющего расстройства пигментации, например, печеночные пятна.
Отшелушивание удаляет наружные слои эпидермиса, чтобы открыть под ними более новые клетки кожи. Отшелушивание может быть достигнуто физическими средствами (например, абразия кожи) или химическими средствами. Химические эксфолианты включают скрабы, содержащие салициловую кислоту, гликолевую кислоту, фруктовые ферменты, лимонную кислоту или яблочную кислоту, и могут наноситься в высоких концентрациях дерматологом, или в более низких концентрациях в продуктах для домашнего применения. Химическое отшелушивание может включать применение продуктов, которые содержат альфа гидроксикислоты (AHA) или бета гидроксикислоты (BHA), или ферменты, которые действуют, разрыхляя клееподобные вещества, которые скрепляют клетки вместе в соединения клеток, позволяя им легко удаляться. Такой тип отшелушивания рекомендуется для людей, лечащих акне.
Наибольшим недостатком отшелушивания является высокая стоимость некоторых продуктов и способов, используемых для достижения этого. Отшелушивание приводит к некоторому исходному покраснению кожи. Ближе к концу химических пилингов кожа замораживается, с цветом, варьирующимся на поверхности кожи от ярко белого до серого. Следовательно, желательны более эффективные способы, которые являются более мягкими для кожи.
Следовательно остается необходимость в методах лечения, подходящих для увлажнения кожи и/или для отшелушивания рогового слоя кожи.
Неожиданно было обнаружено, что определенные молекулы, которые обнаруживают в жидкости икринок рыб, получаемой при вылуплении, являются очень эффективными увлажнителями и эксфолиантами, а именно, хориолизин и заново идентифицированная группа очень кислых белков (VAP).
Вылупление рыбных эмбрионов достигается по меньшей мере частично посредством так называемых ферментов вылупления, хориолизинов. Хориолизин представляет собой металлопротеиназу, обнаруживаемую в жидкости икринок рыб, получаемой при вылуплении, и обычно обнаруживается в двух формах, а именно высокохориолитический фермент (хориолизин H, HCE) и низкохориолитический фермент (хориолизин L, LCE), которые являются сходными по некоторым структурным и каталитическим характеристикам и принадлежат к семейству астацина, но с существенно различными предпочтительными субстратами.
У лосося LCE является относительно необычным по сравнению с известными хориолизинами других видов рыб, и может применяться для целей, которые описаны в настоящем описании далее. Последовательность LCE лосося представлена в SEQ ID NO: 1, ниже.
Как упомянуто выше, в настоящее время была идентифицирована группа очень кислых белков (VAP) в жидкости икринок рыб, получаемой при вылуплении путем осаждения из других компонентов в 80% ацетоне и удаления ацетона выпариванием центрифугированного осадка, как описано в примерах.
Такие VAP образуются путем протеолитического расщепления полимеризованной и сшитой скорлупы или хориона во время вылупления и представляют собой фрагменты компонентов, включенных в хорион во время оогенеза, таких как хориогенин H и L, как описано в настоящем описании ниже более подробно. Указанные фрагменты хориогенных белков, которые называются VAP, высвобождаются в перивителлиновую жидкость во время вылупления, становясь компонентами икорной жидкости. VAP появляются в различных формах. При анализе изоэлектрическим фокусированием (см. примеры), VAP I, II и III (как обсуждается ниже) появляются в по меньшей мере 2, 6 и 3 изоформах, соответственно.
Авторы описывают в настоящем описании три VAP, которые были идентифицированы и которые обладают неожиданными свойствами, как описано в настоящем описании далее. Последовательности таких VAP были определены масс-спектроскопией, как описано в примерах, и представлены в SEQ ID NO: 2-4.
VAP I, II и III, как указано в настоящем описании, имеют последовательности, как указано в SEQ ID NO: 2, 3 и 4, соответственно.
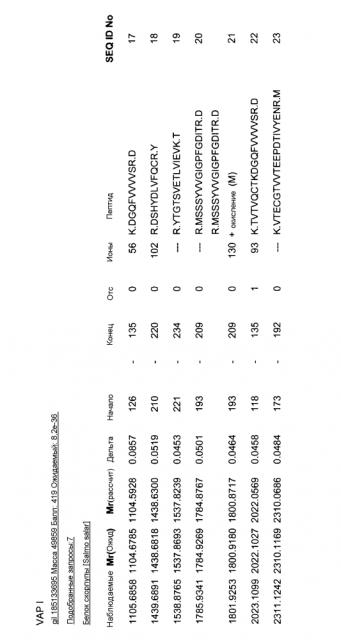
VAP I имеет 117 аминокислот в размере и молекулярную массу около 15,5 кДа и pI около 3,5. Такой VAP представляет собой фрагмент 439 аминокислотного, 57 кДа белка скорлупы (также называемого как белок zona radiata, SEQ ID NO: 5). VAP I может альтернативно быть получен из гомологичного белка zona radiata, включающего 467 остатков аминокислот (SEQ ID NO: 8).
VAP II имеет 261 аминокислоту в размере и молекулярную массу около 35 кДа и pI около 4,0. Такой VAP представляет собой фрагмент белка из 524 аминокислот, 68 кДа хориогенина H бета (SEQ ID NO: 6).
VAP III имеет 224 аминокислоты в размере и молекулярную массу около 29 кДа и pI около 5,2. Такой VAP представляет собой фрагмент белка из 438 аминокислот, 57 кДа хориогенина L (SEQ ID NO: 7).
Как показано в примерах и обсуждается выше, каждый VAP может существовать в различных изоформах.
Следовательно, в первом аспекте настоящее изобретение обеспечивает полипептид, состоящий из:
(i) последовательности аминокислот, как указано в любой из SEQ ID NO: 2-4, или последовательности, которая является по меньшей мере на 50% идентичной указанной последовательности или части любой из указанных последовательностей; и необязательно
(ii) фланкирующей последовательности аминокислот на N и/или C конце последовательности аминокислот в (i), которая имеет от 1 до 100 аминокислот в длину.
"Полипептиды", как указано в настоящем описании, представляют собой молекулы с предпочтительно более чем 50, 100, 150, 200 или 250 остатками и/или менее чем 400, 300, 200 или 100 остатками или диапазоном, выбираемым из них. Как указано в настоящем описании "часть" предпочтительно включает по меньшей мере 30, 40, 50, 60, 70, 80, 90, 100, 150, 200 или более аминокислот последовательности, из которой ее получают. Указанная часть может быть получена из центральной или N-концевой или C-концевой части последовательности. В предпочтительном аспекте указанная часть состоит из полноразмерной последовательности, из которой ее получают, из которой удалены по меньшей мере 1, 2, 3, 4 или 5 остатков аминокислот, предпочтительно с N-конца.
Как указано в настоящем описании "фланкирующая последовательность" представляет собой последовательность аминокислот, которая прикреплена к терминальному N или C концу центральной последовательности аминокислот посредством обычных пептидных связей с образованием непрерывной последовательности аминокислот (за исключением модифицированных в функциональных эквивалентах, как обсуждается в настоящем описании ниже). Фланкирующая последовательность может присутствовать на N или C терминальном конце центральной последовательности аминокислот или может присутствовать на обоих концах. Фланкирующая последовательность может быть такой короткой как 1 аминокислота, или такой длинной как 100 аминокислот, предпочтительно от 1-50 (или от 5-100 или 10-50), например, 1-25, например, 1-5 аминокислот в длину. Когда фланкирующие последовательности присутствуют и на N и на C терминальных концах, они могут быть одинаковыми или различными последовательностями и могут быть одинаковой или различной длины. Фланкирующие последовательности могут быть получены из исходной последовательности, фрагмент которой представляет собой интересующий VAP, или может иметь менее чем 80, 70, 60 или 50% идентичности нативной последовательности в сравниваемой части (см., например, нативные последовательности относительно SEQ ID NO: 2-4, представленные в SEQ ID NO: 5-7, соответственно и SEQ ID No: 8, которая обеспечивает альтернативную нативную последовательность для SEQ ID NO: 2).
Предпочтительно указанная последовательность в части (i) выше является по меньшей мере на 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичной последовательности (SEQ ID NO:2-8), с которой ее сравнивают.
Идентичность последовательности может быть определена, например, с использованием банка данных белковых последовательностей SWISS-PROT с использованием FASTA pep-cmp с вариабельным памфактором и штрафом за создание гэпа, установленным на 12,0 и штрафом за удлинение гэпа, установленным на 4,0, и окном из 2 аминокислот. Предпочтительно указанное сравнение проводят по всей длине последовательности, но может быть проведено на более маленьком окне сравнения, например, менее чем 200, 100 или 50 соседних аминокислот.
Предпочтительно такие полипептиды, связанные с идентичностью последовательностей, являются функционально эквивалентными полипептидам, которые представлены в указанных SEQ ID NO. Такие функционально эквивалентные полипептиды могут принимать форму производных, как указано ниже. Подобным образом полипептиды с последовательностями, как указано в SEQ ID NO, могут быть модифицированы, не влияя на последовательность полипептида, как описано ниже.
Более того, "части", как описано в настоящем описании, могут быть функционально эквивалентными. Предпочтительно указанные части удовлетворяют условиям идентичности (относительно сравниваемого участка), упомянутым в настоящем описании. Предпочтительные полипептиды по изобретению, включая части и полипептиды, которые включают вышеописанные фланкирующие последовательности, предпочтительно являются кислыми, например, имеют рН от 3 до 5,5, предпочтительно от 3,5 до 5,2.
Как указано в настоящем описании, чтобы достичь "функциональной эквивалентности" полипептид может иметь несколько сниженную эффективность в осуществлении медицинской или косметической функции относительно материнской молекулы (т.е. молекулы, из которой он был получен, например, путем замены аминокислот), но предпочтительно является таким же эффективным или более эффективным. Следовательно, функциональная эквивалентность относится к полипептиду, который является эффективным для лечения состояния или заболевания или для косметического улучшения состояния и/или вида кожи, как указано в настоящем описании, т.е. для уменьшения одного или более симптомов у пациента, например, вида, текстуры, толщины или содержания влаги кожи, как описано в настоящем описании далее. Это может быть оценено путем сравнения эффектов производного полипептида относительно полипептида, из которого он получен, качественным или количественным образом, например, путем проведения анализов, представленных в примерах. Где возможны количественные результаты, производное является по меньшей мере на 30, 50, 70 или 90% таким же эффективным, как материнский полипептид.
Функционально-эквивалентные белки, которые связаны с или получены из естественного белка, могут быть получены путем модификации нативной последовательности аминокислот посредством единственной или множества замен аминокислот (например, 2-20, предпочтительно 2-10), добавлений и/или делеций (обеспечивая их соответствие вышеупомянутым требованиям к идентичности последовательностей), без нарушения функции молекулы. Такие белки кодируются "функционально эквивалентными молекулами нуклеиновых кислот", которые создают путем соответствующих замен, добавления и/или делеций одного или более оснований.
Предпочтительными функциональными эквивалентами являются "аддитивные" варианты, в которых создают амино и/или карбокси концевые сшитые белки или полипептиды, включающие дополнительный белок или полипептид, сшитый с материнским полипептидом. Как описано выше, любые последовательности, которые при добавлении к центральному полипептиду, образуют непрерывную последовательность аминокислот, ограничены фланкирующими последовательностями, как описано выше.
Дополнительными предпочтительными функциональными эквивалентами являются варианты "делеции" или "усечения", в которых создаются белки или полипептиды, где с центрального полипептида удалены амино и/или карбокси концевые остатки. В определенном предпочтительном варианте осуществления изобретения остатки удаляют с аминоконца, где удаляют по меньшей мере 1, 2, 3, 4 или 5 остатков аминокислот. Такие функциональные эквиваленты представляют собой части, как описано в настоящем описании ранее.
Особенно предпочтительными функционально-эквивалентными вариантами являются натуральные биологические варианты (например, аллельные варианты или географические варианты в рамках видов или альтернативно в различных родах, например, растений, животных или бактерий, в частности рыб, особенно из семейства Salmonidae, особенно подсемейств Salmo и Oncorhynchus) и производных, полученных с использованием известных методик. Например, молекулы нуклеиновой кислоты, кодирующие функционально-эквивалентные белки, могут быть получены химическим синтезом или в рекомбинантной форме с использованием известных методик или сайт-направленного мутагенеза, включая делецию, случайный мутагенез или ферментативное отщепление и/или сшивку нуклеиновых кислот.
Настоящее изобретение также обеспечивает молекулу нуклеиновой кислоты, состоящую из последовательности нуклеотидов, которая кодирует только указанный полипептид или ее комплементарную последовательность.
В предпочтительном аспекте настоящее изобретение, таким образом, обеспечивает молекулу нуклеиновой кислоты, состоящую из:
(i) последовательности нуклеотидов, как указано в любой из SEQ ID NO: 10-12, последовательности, которая является по меньшей мере на 50% идентичной указанной последовательности или последовательности, которая гибридизуется с указанной последовательностью в нестрогих условиях связывания 6×SSC/50% формамида при комнатной температуре и промывке в условиях высокой строгости, например, 2×SSC, 65°C, где SSC=0,15 M NaCl, 0,015 M цитрат натрия, pH 7,2, или последовательности, комплементарной любой из вышеуказанных последовательностей, или их части; и необязательно
(ii) фланкирующей последовательности нуклеотидов на 5' или 3' конце последовательности нуклеотидов в (i), которая имеет от 1 до 300 нуклеотидов в длину,
или комплементарной им последовательности.
Предпочтительно указанная молекула нуклеиновой кислоты кодирует полипептид, как указано в настоящем описании выше.
"Молекулы нуклеиновой кислоты", как указано в настоящем описании, представляют собой молекулы с предпочтительно более чем 150, 300, 450, 600 или 750 оснований и/или менее чем 1200, 900, 600 или 300 оснований или диапазоном, выбранным из них. "Части", как указано выше, предпочтительно включают по меньшей мере 90, 120, 150, 180, 210, 240, 270, 300, 450 или 600 оснований нуклеотидов последовательности, из которой ее получили. Предпочтительно указанные части кодируют N-концевые, центральные или C-концевые пептиды, как описано в настоящем описании выше. В предпочтительном аспекте указанная часть состоит из полноразмерной последовательности, из которой ее получали, из которой по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 оснований были удалены, предпочтительно с 5' конца.
Как указано в настоящем описании "фланкирующая последовательность" представляет собой последовательность нуклеотидов, которая прикреплена к терминальному 5' или 3' концу центральной последовательности нуклеотидов посредством обычных фосфодиэфирных связей с образованием непрерывной последовательности нуклеотидов (за исключением модифицированных в функциональных эквивалентах, как обсуждается в настоящем описании ранее). Фланкирующая последовательность может присутствовать на 5' или 3' терминальном конце центральной последовательности нуклеотидов или может присутствовать на обоих концах. Фланкирующая последовательность может быть настолько короткой, как 1 нуклеотид, или длинной, как 300 нуклеотидов, предпочтительно от 1-150 (или от 15-300 или 30-150), например, 1-75, например, 1-15 нуклеотидов в длину. Когда фланкирующие последовательности присутствуют и на 5' и на 3' терминальных концах, они могут быть одинаковыми или различными последовательностями и могут быть одинаковой или различной длины. Фланкирующие последовательности могут быть получены из нативной последовательности, фрагментом которой является интересующая последовательность, кодирующая VAP, или могут иметь менее чем 80, 70, 60 или 50% идентичность с нативной кодирующей последовательностью в сравниваемой части (см., например, нативные последовательности относительно SEQ ID NO: 10-12, представленные в SEQ ID NO:13-15, соответственно и SEQ ID NO: 16, которая обеспечивает альтернативную нативную последовательность для SEQ ID NO: 10).
Предпочтительно указанная последовательность в части (i) выше является по меньшей мере на 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичной последовательности (SEQ ID NO:10-16), с которой ее сравнивают.
Идентичность последовательности может быть определена посредством, например, поиска FASTA с использованием пакетов GCG, со значениями по умолчанию и переменным памфактором и штрафом за создание гэпа, установленным на 12,0, и штрафом за удлинение гэпа, установленным на 4,0, с окном из 6 нуклеотидов.
Предпочтительно связанные с указанной идентичностью последовательности или гибридизованные молекулы нуклеиновой кислоты являются функционально эквивалентными молекулам нуклеиновой кислоты, которые представлены в указанных SEQ ID NO. Такие функционально эквивалентные молекулы нуклеиновой кислоты могут принимать форму производных, как указано далее, и расцениваются функционально эквивалентными, если они кодируют полипептиды, которые расцениваются функциональными эквивалентами в соответствии с тестами, описанными в настоящем описании ранее. Предпочтительными функциональными эквивалентами являются таковые, которые кодируют предпочтительные полипептиды, как указано выше, например, молекулы нуклеиновой кислоты, которые кодируют полипептиды, обнаруженные у иных родов или видов, чем специфические молекулы, упомянутые в настоящем описании.
Более того, "части", как описано в настоящем описании, могут быть функциональными эквивалентами. Предпочтительно такие части удовлетворяют условиям идентичности (относительно сравниваемого участка) или гибридизации, упомянутым в настоящем описании. Предпочтительно молекулы нуклеиновой кислоты по изобретению, включая части и последовательности нуклеотидов, включая вышеописанные фланкирующие последовательности, предпочтительно кодируют кислые полипептиды, как описано в настоящем описании ранее.
Молекулы нуклеиновой кислоты по изобретению и для применения в соответствии с изобретением могут быть одно- или двухцепочечными ДНК, кДНК или РНК, предпочтительно ДНК, и включают дегенеративные, по существу идентичные и гибридизованные последовательности, как описано выше. В идеале, однако, молекулами являются ДНК или кДНК.
Полипептиды по изобретению или для применения в соответствии с изобретением, включают таковые, которые являются модифицированными без влияния на последовательность полипептида, например, путем химической модификации, включая дегликозилирование или гликозилирование. Такие полипептиды могут быть получены путем модификации полипептида после синтеза/выделения, не влияя на функциональность, например, определенного гликозилирования, метилирования и др. определенных остатков.
Полипептиды по изобретению или для применения в соответствии с изобретением, могут также принимать форму пептидомиметиков, которые могут быть расценены производными, в которых функциональные характеристики полипептида сохраняются, но представлены в виде отличной, например, непептидной структуры. Такие пептидомиметики были успешно разработаны и используются для других определенных медицинских применений.
Пептидомиметики, в особенности непептидные молекулы могут быть созданы посредством различных процессов, включая конформационное создание лекарственных средств, скрининг, дизайн фокусированной библиотеки и классическую медицинскую химию. Могут быть использованы не только олигомеры неестественных аминокислот или другие органические связующие блоки, но также углеводы, гетероциклические или макроциклические соединения или любые органические молекулы, которые включают структурные элементы и конформацию, которая обеспечивает молекулярную электростатическую поверхность, которая имитирует такие же свойства 3-мерной конформации пептида, могут быть использованы способами, известными в области техники.
Следовательно, пептидомиметики могут нести небольшой или совершенно не нести подобия пептидного остова. Пептидомиметики могут включать полностью синтетическую непептидную форму (например, основанную на углеводородном скелете с соответствующими заместителями) или могут сохранять один или более элементов пептида, на котором они основаны, например, путем изменения одной или более аминокислот или замены одной или более аминокислот альтернативными непептидными компонентами. Пептидоподобные матрицы включают псевдопептиды и циклические пептиды. Структурные элементы, расцененные как избыточные для функции пептида, могут быть минимизированы для сохранения только функции каркаса, или удалены, когда необходимо.
Когда пептидомиметики сохраняют один или более пептидных элементов, т.е. более чем одну аминокислоту, такая аминокислота может быть заменена нестандартной или ее структурным аналогом. Аминокислоты, сохраняющиеся в последовательностях, также могут быть изменены или модифицированы (например, помечены, гликозилированы или метилированы), пока сохраняются функциональные свойства полипептидов по изобретению или для применения в соответствии с изобретением. Пептидомиметики называют как "получаемые из" определенной полипептидной последовательности. Под этим обозначают, что пептидомиметик создан со ссылкой на определенную полипептидную последовательность, так что он сохраняет структурные характеристики пептида, которые необходимы для его функции. Это могут быть определенные боковые цепи полипептида или потенциал водородных связей для его структуры. Такие характеристики могут быть обеспечены непептидными компонентами или одним или более остатками аминокислот, или связи, связывающие указанные остатки аминокислот полипептида, могут быть модифицированы, так чтобы улучшить определенные функции полипептида, такие как стабильность или устойчивость к протеазам, при сохранении структурных характеристик полипептида, которые необходимы для его функции.
Примеры нестандартных или структурных аналогов аминокислот, которые могут быть использованы, представляют собой D аминокислоты, амидные изоэфиры (такие как N-метиламид, ретро-обратный амид, тиоамид, тиоэфир, фосфонат, кетометилен, гидроксиметилен, фторвинил, (E)-винил, метиленамино, метилентио или алкан), L-N метиламинокислоты, D-α метиламинокислоты, D-N-метиламинокислоты. Примеры необычных аминокислот перечислены в таблице 1.
| Таблица 1 | |||
| Необычная аминокислота | Код | Необычнаяаминокислота | Код |
| α-аминомасляная кислота | Abu | L-N-метилаланин | Nmala |
| α-амино-α-метилбутират | Mgabu | L-N-метиларгинин | Nmarg |
| Аминоциклопропан-карбоксилат | Cpro | L-N-метиласпарагин | Nmasn |
| L-N-метиласпарагиновая кислота | Nmasp | ||
| Аминоизомасляная кислота | Aib | L-N-метилцистеин | Nmcys |
| Аминонорборнил-карбоксилат | Norb | L-N-метилглутаминин | Nmgln |
| L-N-метилглутамининовая кислота | Nmglu | ||
| Циклогексилаланин | Chexa | L-N-метилметилгистидин | Nmhis |
| Циклопентилаланин | Cpen | L-N-метилизолейцин | Nmile |
| D-аланин | Dal | L-N-метиллейцин | Nmleu |
| D-аргинин | Darg | L-N-метиллизин | Nmlys |
| D-аспарагиновая кислота | Dasp | L-N-метилметионин | Nmmet |
| D-цистеин | Dcys | L-N-метилнорлейцин | Nmnle |
| D-глутаминин | Dgln | L-N-метилнорвалин | Nmnle |
| D-глутаминоваякислота | Dglu | L-N-метилорнитин | Nmorn |
| D-гистидин | Dhis | L-N-метилфенилаланин | Nmphe |
| D-изолейцин | Dile | L-N-метилпролин | Nmpro |
| D-лейцин | Dleu | L-N-метилсерин | Nmser |
| D-лизин | Dlys | L-N-метилтреонин | Nmthr |
| D-метионин | Dmet | L-N-метилтриптофан | Nmtrp |
| D-орнитин | Dorn | L-N-метилтирозин | Nmtyr |
| D-фенилаланин | Dphe | L-N-метилвалин | Nmval |
| D-пролин | Dpro | L-N-метилэтилглицин | Nmetg |
| D-серин | Dser | L-N-метил-т-бутилглицин | Nmtbug |
| D-треонин | Dthr | L-норлейцин | Nle |
| D-триптофан | Dtrp | L-норвалин | Nva |
| D-тирозин | Dtyr | α-метиламиноизобутират | Maib |
| D-валин | Dval | α-метил-γ-аминобутират | Mgabu |
| D-α-метилаланин | Dmala | α-метилциклогексилаланин | Mchexa |
| D-α-метиларгинин | Dmarg | α-метилциклопентилаланин | Mcpen |
| D-α-метиласпарагин | Dmasn | α-метил-α-нафтилаланин | Manap |
| D-α-метиласпартат | Dmasp | α-метилпеницилламин | Mpen |
| D-α-метилцистеин | Dmcys | N-(4-аминобутил)глицин | Nglu |
| D-α-метилглутаминин | Dmgln | N-(2-аминоэтил)глицин | Naeg |
| D-α-метилгистидин | Dmhis | N-(3-аминопропил)глицин | Norn |
| D-α-метилизолейцин | Dmile | N-амино-α-метилбутират | Nmaabu |
| D-α-метиллейцин | Dmleu | α-нафтилаланин | Anap |
| D-α-метиллизин | Dmlys | N-бензилглицин | Nphe |
| D-α-метилметионин | Dmmet | N-(2-карбамилэтил)глицин | Ngln |
| D-α-метилорнитин | Dmorn | N-(карбамилметил)глицин | Nasn |
| D-α-метилфенилаланин | Dmphe | N-(2-карбоксиэтил)глицин | Nglu |
| D-α-метилпролин | Dmpro | N-(карбоксиметил)глицин | Nasp |
| D-α-метилсерин | Dmser | N-циклобутилглицин | Ncbut |
| D-α-метилтреонин | Dmthr | N-циклогептилглицин | Nchep |
| D-α-метилтриптофан | Dmtrp | N-циклогексилглицин | Nchex |
| D-α-метилтирозин | Dmty | N-циклодецилглицин | Ncdec |
| D-α-метилвалин | Dmval | N-циклододецилглицин | Ncdod |
| D-N-метилаланин | Dnmala | N-циклооктилглицин | Ncoct |
| D-N-метиларгинин | Dnmarg | N-циклопропилглицин | Ncpro |
| D-N-метиласпарагин | Dnmasn | N-циклоундецилглицин | Ncund |
| D-N-метиласпартат | Dnmasp | N-(2,2-дифенилэтил)глицин | Nbhm |
| D-N-метилцистеин | Dnmcys | N-(3,3-дифенилпропил)глицин | Nbhe |
| D-N-метилглутаминин | Dnmgln | N-(3-гуанидинопропил)глицин | Narg |
| D-N-метилглутаминат | Dnmglu | N-(1-гидроксиэтил)глицин | Nthr |
| D-N-метилгистидин | Dnmhis | N-(гидроксиэтил)глицин | Nser |
| D-N-метилизолейцин | Dnmile | N-(имидазолилэтил)глицин | Nhis |
| D-N-метиллейцин | Dnmleu | N-(3-индолилэтил)глицин | Nhtrp |
| D-N-метиллизин | Dnmlys | N-метил-γ-аминобутират | Nmgabu |
| N-метилцикло-гексилаланин | Nmchexa | D-N-метилметионин | Dnmmet |
| D-N-метилорнитин | Dnmorn | N-метилциклопентилаланин | Nmcpen |
| N-метилглицин | Nala | D-N-метилфенилаланин | Dnmphe |
| N-метиламиноизобутират | Nmaib | D-N-метилпролин | Dnmpro |
| N-(1-метилпропил)глицин | Nile | D-N-метилсерин | Dnmser |
| N-(2-метилпропил)глицин | Nleu | D-N-метилтреонин | Dnmthr |
| D-N-метилтриптофан | Dnmtrp | N-(1-метилэтил)глицин | Nval |
| D-N-метилтирозин | Dnmtyr | N-метилнафтилаланин | Nmanap |
| D-N-метилвалин | Dnmval | N-метилпеницилламин | Nmpen |
| γ-аминомасляная кислота | Gabu | N-(п-гидроксифенил)глицин | Nhtyr |
| L-т-бутилглицин | Tbug | N-(тиометил)глицин | Ncys |
| L-этилглицин | Etg | пеницилламин | Pen |
| L-гомофенилаланин | Hphe | L-α-метилаланин | Mala |
| L-α-метиларгинин | Marg | L-α-метиласпарагин | Masn |
| L-α-метиласпартат | Masp | L-α-метил-т-бутилглицин | Mtbug |
| L-α-метилцистеин | Mcys | L-метилэтилглицин | Metg |
| L-α-метилглутаминин | Mgln | L-α-метилглутаминат | Mglu |
| L-α-метилгистидин | Mhis | L-α-метилгомофенилаланин | Mhphe |
| L-α-метилизолейцин | Mile | N-(2-метилтиоэтил)глицин | Nmet |
| L-α-метиллейцин | Mleu | L-α-метиллизин | Mlys |
| L-α-метилметионин | Mmet | L-α-метилнорлейцин | Mnle |
| L-α-метилнорвалин | Mnva | L-α-метилорнитин | Morn |
| L-α-метилфенилаланин | Mphe | L-α-метилпролин | Mpro |
| L-α-метилсерин | Mser | L-α-метилтреонин | Mthr |
| L-α-метилтриптофан | Mtrp | L-α-метилтирозин | Mtyr |
| L-α-метилвалин | Mval | L-N-метилгомофенил-аланин | Nmhphe |
| N-(N-(2,2-дифенилэтил)карбамилметил)глицин | Nnbhm | N-(N-(3,3-дифенилпропил)карбамилметил)глицин | Nnbhe |
| 1-карбокси-1-(2,2-дифенилэтиламино)циклопропан | Nmbc | L-O-метилсерин | Omser |
| L-O-метилгомосерин | Omhser |
Нестандартные аминокислоты, которые могут быть использованы, включают конформационно ограниченные аналоги, например, такие как Tic (для замены F), Aib (для замены A) или пипеколовая кислота (для замены Pro).
Полипептиды и молекулы нуклеиновой кислоты, обсуждаемые выше, также включают производные, которые были модифицированы, например, для облегчения их применения в фармацевтических применениях (обсуждаемых ниже), например, путем добавления нацеливающих или функциональных групп, например, для улучшения липофильности, улучшения клето