Обогащенные фосфолипидами везикулы, несущие тканевой фактор, обладающие гемостатической активностью, и их применения
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к способу улучшения прокоагулянтных свойств тканевого фактора (TF), экспрессированного в эукариотических клетках, и может быть использовано в медицине. Полученная в соответствии с настоящим изобретением модифицированная несущая тканевый фактор микровезикула может применяться в качестве прокоагулянтного средства для лечения кровоизлияний, заживления ран и стимуляции ангиогенеза в тканях. Изобретение позволяет улучшить прокоагуляторные свойства тканевого фактора за счет того, что полученная несущая TF микровезикула формируется из липидных мембран или их фрагментов из эукариотических клеток, в которых экспрессируется тканевый фактор, а также дополнительной добавки отрицательно заряженного фосфолипида. 7 н. и 11 з.п. ф-лы, 16 ил., 2 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к лечению кровоизлияний и заживлению ран у субъекта с использованием прокоагулянта на основе тканевого фактора. Более конкретно, изобретение относится к несущей тканевой фактор (TF) микровезикуле (несущей TF микровезикуле), содержащей мембрану из эукариотической клетки в форме микровезикулы, белок тканевого фактора и отрицательно заряженный фосфолипид (NCP), а также к ее применениям в качестве прокоагулянта, полезного при лечении кровоизлияний у субъекта, а также для усиления ангиогенеза и миграции клеток. Изобретение дополнительно относится к способам получения указанных несущих TF микровезикул.
Предпосылки создания изобретения
Гемостаз представляет собой механизм, посредством которого живые организмы отвечают на кровоизлияние, и включает участие двух процессов, которые запускаются непосредственно после поражения и остаются активными в течение длительного периода времени. Первый из них известен как первичный гемостаз и характеризуется возникновением вазоконстрикции на месте поражения сосуда c образованием агрегата тромбоцитов. Второй из них известен как вторичный гемостаз, являясь фазой, в которой образуется фибриновый сгусток вследствие действия различных протеолитических ферментов коагуляционного каскада крови.
Во второй фазе процесса коагуляции крови участвуют несколько кофакторов и протеолитических ферментов, называемых факторами коагуляции, и она составляют несколько стадий, оканчивающихся образованием фибрина после гидролиза фибриногена в результате действия тромбина. Тромбин перед этим образуется в результате протеолитического гидролиза его апофермента, протромбина. Данный протеолиз осуществляется активированным фактором коагуляции Х (FXa), который связывается с поверхностью активированных тромбоцитов и только в присутствии своего кофактора, активированного фактора коагуляции V (FVa), и ионов кальция способен гидролизовать протромбин. Активация фактора коагуляции X (FX) может происходить двумя отдельными путями, внутренним и внешним.
Внутренний путь состоит из серий реакций, на которых каждый профермент гидролизуется, давая в результате свою активную форму протеазы. На каждой стадии только что активированный протеолитический фермент будет катализировать активацию следующего профермента с последовательным образованием активных форм.
Во внешнем пути коагуляции крови тканевой фактор, экспонированный на адвентициальных клетках в месте поражения, связывается с находящимся в кровотоке фактором VII/активированным фактором коагуляции VII (FVII/FVIIa), образуя комплекс TF::FVIIa и в присутствии кальция действуя в качестве субстрата, так что происходит активация FX. В настоящее время внешний путь считается наиболее значимым путем в коагуляции крови, и признано, что в случае кровоизлияния, образуемого поражением сосуда, свертывание крови запускается вследствие активации внешнего пути, включающего взаимодействие TF с его лигандом, FVII/FVIIa.
Широко признано, что TF является главным элементом, отвечающим за скорость инициации коагуляции крови, и он необходим для активации FX, который, в свою очередь, начинает гидролизовать протромбин.
Опубликована очистка TF из различных тканей, таких как: мозг человека, мозг крупного рогатого скота; плацента человека; мозг овцы; и легкие. Широко признано, что структура белка TF различается между биологическими видами, между ними не наблюдается функциональных отличий, измеряемых методами анализа коагуляции крови in vitro.
Общепризнанно, что для проявления биологической активности TF должен быть ассоциирован с фосфолипидами in vitro. Было показано, что удаление фосфолипидного компонента TF, например, с помощью фосфолипазы, приводит к потере его биологической активности in vitro.
В WO 2008080989 описаны полученные из дрожжей микровезикулы, несущие тканевой фактор, которые содержат дрожжевую мембрану и белок тканевого фактора, и их применение в качестве прокоагулянтов при лечении кровоизлияний у субъекта.
В WO 2006004675 описана экспрессия тканевого фактора в растительных клетках, неочищенные экстракты, полученные из растений, экспрессирующих TF, и искусственные везикулы, содержащие рекомбинантный TF, полученный из растительных клеток.
В EP 19359021 описана экспрессия тканевого фактора в клетках насекомых, а также релипидированный TF, который включает рекомбинантный TF (rTF), экспрессированный в клетках насекомых.
Однако в данной области необходимы дополнительные прокоагулянтные средства на основе TF.
Краткое изложение сущности изобретения
В первом аспекте изобретение относится к способу получения несущей TF микровезикулы, обладающей прокоагулянтной активностью, включающему:
(i) экспрессию TF или его варианта, обладающего прокоагулянтной активностью в эукариотической клетке,
(ii) выделение несущих TF микровезикул из клеток со стадии (i), и
(iii) приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом в условиях, подходящих для включения указанного фосфолипида в указанные везикулы.
Во втором аспекте изобретение относится к способу получения несущей TF микровезикулы, обладающей прокоагулянтной активностью, включающему:
(i) предоставление липидных микровезикул, полученных из эукариотической клетки,
(ii) приведение в контакт TF или его варианта, обладающего прокоагулянтной активностью, с липидными микровезикулами, как определено в (i), в условиях, подходящих для включения указанного белка TF или его варианта в указанные микровезикулы, и
(iii) приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом в условиях, подходящих для включения указанных фосфолипидов в указанную везикулу,
где стадии (ii) и (iii) можно проводить в любом порядке.
В другом аспекте изобретение относится к несущей TF микровезикуле, полученной с использованием способа настоящего изобретения.
В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей несущую TF микровезикулу настоящего изобретения и фармацевтически приемлемый наполнитель.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей:
(i) микровезикулу, полученную способом, включающим стадии:
а) экспрессии TF или его функционально эквивалентного варианта, обладающего прокоагулянтной активностью, в эукариотической клетке, и
b) выделения несущих TF микровезикул из клеток со стадии (а),
(ii) по меньшей мере стимулятор коагуляции, и
(iii) фармацевтически эффективный наполнитель.
В другом аспекте изобретение относится к несущей TF микровезикуле настоящего изобретения или к фармацевтической композиции настоящего изобретения для применения в качестве лекарственного средства.
В другом аспекте изобретение относится к несущей TF микровезикуле настоящего изобретения или к фармацевтической композиции настоящего изобретения для применения в лечении кровоизлияния, для стимуляции заживления ран или для лечения связанного с ангиогенезом заболевания.
В другом аспекте изобретение относится к применению несущей TF микровезикулы настоящего изобретения для определения протромбинового времени в образце.
В другом аспекте изобретение относится к набору для определения фактора антикоагулянтной терапии, содержащему микровезикулу настоящего изобретения.
Краткое описание фигур
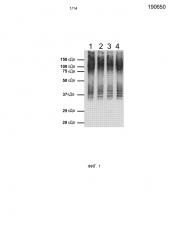
Фиг.1. Экспрессия rTF с использованием экстрактов TT-173. Вестерн-блот анализ экстрактов из очищенных TT-173 (ретентат при фильтрации через мембрану с размером пор 0,1 мкм (MFR 0,1)) после четырех независимых фильтраций в тангенциальном потоке. Блот окрашивали очищенными мышиными антителами к TF человека (BD Biosciences Pharmingen). Маркеры молекулярной массы в кДа показаны на левой стороне фигуры.
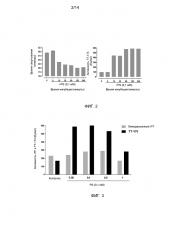
Фиг.2. Прокоагулянтная активность ТТ-173 после инкубации с фосфатидилсерином (PS). (А) для испытания эффекта PS на биологическую активность TT-173, PS (0,1 мМ) добавляли к TT-173 (1 мл) и смешанный раствор выдерживали при комнатной температуре в течение эксперимента при комнатной температуре (R/T). В различные временные точки, указанные на фигуре, одну аликвоту смеси (10 мкл) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра (Stago). Эксперимент прекращали через 300 секунд (объединенная плазма от 5 доноров). (В) Результаты, полученные, как описано в (А), также представлены в Ед/мл. Единицу определяли как количество TT-173, требуемое для свертывания нормальной объединенной плазмы за 30 секунд в стандартном коагулометрическом анализе (130 мкл плазмы, 20 мкл хлорида кальция (100 мМ) и 10 мкл продукта).
Фиг.3. Прокоагулянтная активность ТТ-173 или липидированного rTF после инкубации с различными концентрациями PS. Для испытания эффекта PS на биологическую активность либо TT-173, либо релипидированного rTF, PS (в концентрациях, указанных на фигуре) добавляли либо к TT-173 (1 мл), либо к релипидированному rTF. Оба смешанных раствора выдерживали при комнатной температуре на 2 часа. После этого времени одну аликвоту каждой смеси (10 мкл) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра (Stago). Эксперимент прекращали через 300 секунд (объединенная плазма от 5 доноров). Полученные результаты представлены в Ед/мл.
Фиг.4. Прокоагулянтная активность rTF после заключения в подходящие фосфолипидные везикулы. Коммерческий очищенный rTF релипидировали в везикулы, содержащие фосфатидилхолин/фосфатидилсерин (PC/PS), следуя стандартному способу, описанному Mimms et al. (Biochemistry 20, 833. 1981). Кратко, 100 нг rTF (American Diagnostica Inc. Stanford, CT, USA) инкубировали с: PC/PS (Sigma Aldrich Inc, Saint Louis, MO, USA) в указанных соотношениях PC:PS (100:0, 95:5, 90:10, 80:20, 70:30) (конечная концентрация - 2,6 мМ) и детергентом (N-октил-β-D-галактопиранозидом, конечная концентрация - 40 мМ). Смесь гомогенизировали и интенсивно диализовали (в течение 48 ч с несколькими сменами буфера). В результате этой процедуры происходило медленное удаление детергента и спонтанное образование липидных мицелл, содержащих rTF. После процедуры релипидации содержащие rTF мицеллы тестировали на их прокоагулянтную активность (темные столбики). Параллельно, различные содержащие rTF мицеллы инкубировали в течение 2 ч с PS с конечной концентрацией 0,1 мМ. После этого времени, мицеллы, содержащие избыток PS, также тестировали на их прокоагулянтную активность. Коагулометрические анализы проводили, как описано ниже: аликвоты (10 мкл) релипидированного rTF с везикулами PC/PS добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра (Diagnostica Stago, Inc. NJ, USA).
Фиг.5. Эффект добавления PS к различным содержащим rTF везикулам. При 4°С приготавливали по две аликвоты (2 мл каждая) либо из: i) релипидированного rTF при соотношении концентраций PC:PS-80:20; ii) релипидированного rTF при соотношении концентраций PC:PS-70:30; или iii) везикул TT-173, выделенных из рекомбинантных дрожжей, экспрессирующих TF. К одной аликвоте каждой из содержащих rTF везикул добавляли PS до концентрации 0,1 мМ и инкубировали при R/T в течение 2 ч. В течение этого времени другую аликвоту выдерживали при 4°C. После этого обе аликвоты для каждого варианта содержащих rTF везикул тестировали на прокоагулянтную активность, как описано в описании к фиг.1.
Фиг.6. Прокоагулянтная активность релипидированного rTF после инкубации с PS и различными концентрациями TT-100. Аликвоты (10 мкл) релипидированного rTF (0,3 мкг/мл), инкубированные в течение 2 ч с PS (0,1 мМ) и различными концентрациями TT-100 (0, 0,03, 0,1, 0,3 и 0,36 мг/мл), добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра.
Фиг.7. Амидолитическая активность FVIIa. Для количественной оценки ферментативной активности каталитического комплекса TF:FVIIa проводили стандартный хромогенный анализ с использованием субстрата S-2238. Активность TF:FVIIa измеряли по разнице в поглощении (оптической плотности) между субстратом S-2238 и полученным продуктом процессинга п-нитроаналином (pNA). Скорость образования pNA пропорциональна ферментативной активности, и ее удобно определять с помощью фотометра. В этом эксперименте различные концентрации TT-173, содержащие или не содержащие PS, тестировали на их способность взаимодействовать с FVIIa и в присутствии S-2238 продуцировать детектируемый pNA.
Фиг.8. Свертывающая активность ТТ-173 в цельной крови и эффект PS. Была тестирована способность ТТ-173, содержащего или не содержащего PS (0,1 мМ), коагулировать образцы здоровой плазмы и цельной крови. (А) Аликвоты (10 мкл) ТТ-173 и ТТ-173, инкубированного в течение 2 ч с PS (конечная концентрация 0,1 мМ), добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (Объединенная плазма от 5 доноров). (В) Аликвоты (200 мкл) ТТ-173 или TT-173+PS (0,1 мМ), содержащие количество rTF, указанное на фигуре, добавляли к аликвотам (800 мкл) крови, недавно полученной от здоровых доноров. Время коагуляции измеряли с помощью хронометра от начала забора крови до появления стабильного и хорошо затвердевшего сгустка крови. N=3.
Фиг.9. Предполагаемый механизм действия ТТ-173.
Фиг.10. Свертывающая активность ТТ-173 в плазме, в которой отсутствуют факторы коагуляции VIII, IX или XI. (A) Аликвоты (10 мкл) ТТ-173 или TT-173+PS (0,1 мМ) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами, сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (Объединенная плазма от 5 доноров). (В) Аналогичные аликвоты (10 мкл), как описано в (А), добавляли в нагретые кюветы, содержащие 130 мкл плазмы с удаленными факторами VIII, IX или XI. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (N=3).
Фиг.11. Свертывающая активность ТТ-173 в плазме, в которой отсутствуют факторы коагуляции V или VII. Аликвоты (10 мкл) ТТ-173 или TT-173+PS (0,1 мМ) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, с удаленными факторами V или VII. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (N=3).
Фиг.12. Свертывающая активность ТТ-173 в плазме пациентов, получающих варфарин. Аликвоты (10 мкл) ТТ-173 или TT-173+PS (0,1 мМ) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, с удаленными факторами V или VII. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (N=3).
Фиг.13. Эффект восстановления TT-173 на его прокоагулянтную активность. При разрушении везикул ТТ-173 с добавлением или без PS в результате действия детергента, который можно удалить диализом, и последующего восстановления in vitro с помощью диализа, терялось приблизительно 50% исходной активности (панель А). Однако при проведении аналогичного эксперимента с использованием везикул с релипидированным rTF не наблюдалось заметной разницы до и после диализа (панель В).
Фиг.14. Эффект добавления PS к различным содержащим rTF везикулам. При 4°С приготавливали по две аликвоты (2 мл каждая) либо из: i) релипидированного rTF при соотношении концентраций PC:PS-80:20; ii) релипидированного rTF при соотношении концентраций PC:PS-70:30; iii) везикул TT-173, выделенных из рекомбинантных дрожжей, экспрессирующих TF, или iv) везикул TT-173, выделенных из клеток насекомых, инфицированных экспрессирующими рекомбинантными бакуловирусами. К одной аликвоте каждой из содержащих rTF везикул добавляли PS до концентрации 0,1 мМ и инкубировали при R/T в течение 2 ч. В течение этого времени другую аликвоту выдерживали при 4°C. После этого обе аликвоты для каждого варианта содержащих rTF везикул тестировали на прокоагулянтную активность, как описано в описании к фиг.1.
Фиг.15. Добавление PS придает стабильность везикулам ТТ-173. В данном исследовании использовали по четыре аликвоты (по 10 мл каждая) из трех независимых партий ТТ-173. Две аликвоты из каждой партии инкубировали с PS (0,1 мМ) при R/T в течение двух часов, и остальные выдерживали при 4°C. После этого по 10 мкл для каждого из двенадцати образцов ТТ-173 использовали для определения свертывающей активности (время 0), следуя методике, описанной в описании к фиг.1. Сразу после этого, половину аликвот (3 аликвоты TT-173-PS и 3 аликвоты TT-173+PS, каждая из которых соответствовала одному из трех лотов) выдерживали при 4°C на протяжении эксперимента на стабильность, и остальные (3 аликвоты TT-173-PS и 3 аликвоты TT-173+PS) выдерживали при 20°C. В указанных на фигурах временных точках использовали по 10 мкл из каждой аликвоты для определения свертывающей активности либо в аликвотах, выдержанных при 4°C (A), либо при 20°C (B). Результаты представлены на графике со стандартным отклонением. Также показаны средние значения минимальной стабильности для различных партий при 4°C (C) и при 20°C (D).
Фиг.16. Добавление FVII, FVIIa, FX и FXa усиливает прокоагулянтный эффект ТТ-173. Различные концентрации FVII (20 нМ и 60 нМ), FVIIa (20 нМ и 60 нМ), FX (1000 нМ и 3000 нМ) и FXa (1000 нМ) добавляли к TT-173+PS 0,1 (мМ). Аликвоты смесей TT-173+PS 0,1 (мМ)/FVII, TT-173+PS 0,1 (мМ)/FVIIa, TT-173+PS 0,1 (мМ)/FX и TT-173+PS 0,1(мМ)/FXa проверяли на свертывающую активность в стандартном коагулометрическом анализе с конечной концентрацией TF в плазме, составляющей 45 нг/мл. Как показано, добавление FVII, FVIIa и FX сокращает время свертывания крови приблизительно на 2 с, и добавление FXa уменьшает время свертывания крови приблизительно на 7 с.
Подробное описание изобретения
Авторы изобретения обнаружили, что добавление дополнительного фосфатидилсерина (PS) в отсутствие детергентов к несущим TF микровезикулам, полученным из дрожжевых клеток и уже содержащим PS, неожиданно приводит к улучшению прокоагулянтных свойств указанных везикул, а также к повышению стабильности указанных везикул. Улучшение прокоагулянтных свойств можно наблюдать, например, в экспериментах, приведенных в примерах 2 и 3 настоящего изобретения, где ясно показано, что добавление фосфатидилсерина к полученным из дрожжей микровезикулам, содержащим TF, дает везикулы, имеющие улучшенные прокоагулянтные свойства (меньшее время свертывания крови) относительно везикул, которые не вступали в контакт с фосфолипидом (см., например, фиг.2 и таблицу 2). Без привязки к какой-либо теории, предполагают, что PS взаимодействует с несущими TF микровезикулами, что приводит к увеличению способности везикул захватывать плазматические факторы, вовлеченные в образование комплексов как протромбиназы, так и протеазы фактора X, что, в свою очередь, приводит к увеличению продукции тромбина. Увеличенная стабильность везикул показана, например, в примере 4 настоящего изобретения, где показано, что везикулы, предварительно обработанные PS, имеют повышенную стабильность как при 20°C, так и при 4°C.
Первый способ настоящего изобретения
В первом аспекте изобретение относится к способу (далее первому способу настоящего изобретения) получения несущей TF микровезикулы, обладающей прокоагулянтной активностью, который включает:
(i) экспрессию TF или его варианта, обладающего прокоагулянтной активностью, в эукариотической клетке,
(ii) выделение несущих TF микровезикул из клеток со стадии (i), и
(iii) приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом (NCP) в условиях, подходящих для включения указанного фосфолипида в указанные микровезикулы.
Используемый в настоящем описании термин «несущая TF микровезикула» относится к любой липидной микровезикуле, которая содержит TF, встроенный в указанную липидную микровезикулу, и которая получена из эукариотической клетки. Липидная микровезикула относится к малой и замкнутой камере, которая по существу состоит из липидных моно и бислоев. Размер несущей TF микровезикулы настоящего изобретения может варьировать в относительно широких пределах, обычно, указанный размер равен или меньше 10 мкм, обычно, равен или меньше 0,5 мкм. В конкретном варианте осуществления размер полученных из дрожжей несущих TF микровезикул настоящего изобретения варьирует в диапазоне от 10 до 0,01 мкм.
Микровезикулы образованы липидными мембранами или их фрагментами из эукариотических клеток. Мембрана относится, в основном, к организованному слою толщиной в несколько молекул (липидов и белков), образующему границу клетки (а именно, клеточной или плазматической мембране) или границы внутриклеточных органелл. Как правило, мембрана состоит из двух направленных липидных слоев (например, липидного бислоя), в которые могут быть включены белки. Липидный бислой, который представляет собой основную структуру мембран клетки, обычно образован амфипатическими молекулами (например, фосфолипидами, жирными кислотами и т.д.) в водном окружении, причем каждая молекула ориентирована гидрофильной группой в направлении внешней стороны слоя, и гидрофобной группой вовнутрь слоя.
На первой стадии первый способ настоящего изобретения включает экспрессию TF или его варианта, обладающего прокоагулянтной активностью, в эукариотической клетке.
В качестве «аукариотической клетки» в настоящем изобретении приведены любые клетки, которые содержат комплексные структуры, заключенные в мембраны, как, например, ядро. Примерами эукариотических клеток, которые можно использовать в первом способе настоящего изобретения, являются клетки грибов, дрожжевые клетки, растительные клетки и животные клетки (как, например, клетки млекопитающих, клетки рыб, клетки рептилий, клетки насекомых и т.д.).
В контексте настоящего изобретения термин «дрожжевые клетки» включает любые аскоспорогенные дрожжи (Endomycetales), базидиоспорогенные дрожжи и дрожжи, относящиеся к Fungi imperfecti (Blastomycetes). Поскольку в будущем классификация дрожжей может измениться, в целях настоящего изобретения дрожжи должны быть определены, как описано в Skinner, F. et al, (Biology and Activities of Yeast, Soc. App. Bacteriol. Symp. Series No. 9). Подходящие штаммы дрожжей включают, но без ограничения, любые виды Торула, пекарских дрожжей, пивных дрожжей, виды Saccharomyces, такие как S. cerevisiae, виды Schizosaccharomyces, виды Pichia, такие как Pichia pastoris, виды Candida, виды Hansenula, такие как Hansenula polymorpha, и виды Klyuveromyces, такие как Klyuveromyces lactis, а также различные штаммы вышеуказанных видов дрожжей, такие как штамм S. cerevisiae T73. Также можно использовать смесь любых указанных видов и штаммов.
В контексте настоящего изобретения термин «растительные клетки» включает клетки растений, включая, но без ограничения, водоросли, однодольные, двудольные и, особенно, зерновые (например, кукурузу, рис, овес и т.д.), бобовые (например, сою и т.д.), крестоцветные (например, Arabidopsis thaliana, рапс и т.д.) или пасленовые (например, картофель, томат, табак и т.д.). Клетки растений включают суспензионные культуры, зародыши, меристемные ткани, каллусные ткани, листья, корни, побеги, гаметофиты, спорофиты, пыльцу, семена и микроспоры. Специалисту в данной области будет понятно, что клетка растения может представлять собой часть растения или целое растение, на которое ссылаются как на «систему растения-хозяина». «Система растения-хозяина» или выделенные клетки растения могут находиться на различных стадиях зрелости. Система растения-хозяина также относится к любому клону такого растения, семени, потомству, полученному самоопылением, или гибридному потомству, используемому для размножения части растения, полученной либо половым путем, либо бесполым, и потомкам любого из них, таким как черенки или семена.
Используемый в настоящем описании термин «животные клетки» включает любую клетку животного. Животные клетки включают клетки млекопитающих, клетки рыб, клетки рептилий, клетки насекомых и т.д. Животные клетки могут быть получены из любой ткани животного (первичные культуры клеток) или могут представлять собой иммортализованные клетки. Иммортализованные клетки могут быть получены из опухолевых тканей или они могут быть иммортализованы с использованием методик, известных специалисту в данной области, например, заражением вирусами (например, EP1212420), или представлять собой результат слияния нормальных клеток с иммортализованной клеточной линией.
Клетки насекомых включают, но без ограничения, клетки Sf9, клетки SF21, клетки SF+, клетки Hi-Five или клетки личинок насекомых.
Млекопитающие, из которых можно получить клетки, включают крыс, мышей, обезьян, человека и т.д. Клетки млекопитающих, подходящие для настоящего изобретения, включают линии клеток эпителия, линии клеток остеосаркомы, линии клеток нейробластомы, карциномы эпителия, глиальные клетки, линии клеток печени, клетки СНО (яичника китайского хомячка), клетки COS, клетки BHK, клетки HeLa, клетки 911, клетки AT1080, клетки A549, клетки 293 или клетки PER.C6, клетки ECC NTERA-2 человека, клетки D3 линии mESC, эмбриональные стволовые клетки человека, такие как HS293 и BGV01, SHEF1, SHEF2 и HS181, клетки NIH3T3, клетки 293T, клетки REH и клетки MCF-7, а также клетки hMSC.
Термин «тканевой фактор», или «TF», также известный как «тромбопластин», «тромбоцитарный тканевой фактор», «CD 142» или «фактор свертывания III» в контексте настоящего изобретения относится к встроенному в мембрану гликопротеину, широко распространенному в животном мире, который встречается в субэндотелиальной ткани, тромбоцитах и лейкоцитах, и необходим для инициации образования тромбина из зимогена протромбина. Полипептиды TF, подходящие для применения в настоящем изобретении, включают природный TF (или дикого типа (wt)) из любого вида животных, включая человека. Примеры белков TF, которые можно использовать в настоящем изобретении, включают TF человека (номер доступа в базе данных UniProtKB P13726), TF мыши (номер доступа в базе данных UniProtKB P20352), TF крысы (номер доступа в базе данных UniProtKB P42533), TF свиньи (номер доступа в базе данных NCBI Prot NP_998950), бычий TF (номер доступа в базе данных NCBI Prot AAB20755), TF собаки (номер доступа в базе данных NCBI Prot BAD98568), TF морской свинки (номер доступа в базе данных NCBI Prot AAF36523) и белки TF из других организмов.
Поскольку природный TF содержит несколько сайтов гликозилирования, можно получить варианты TF с различной степенью гликозилирования в результате экспрессии TF в хозяевах, способных проводить реакции N-гликозилирования. Зрелый TF содержит три потенциальных сайта N-гликозилирования, имеющих консенсусную последовательность Asn-Xaa-Ser/Thr, расположенную в положениях Asn11 (последовательность Asn11-Leu12-Thr13), Asn124 (последовательность Asn124-Val125-Thr126) и Asn137 (последовательность Asn137-Asn138-Thr139). Таким образом, молекулы TF для использования в настоящем изобретении включают варианты TF, имеющие различную степень N-гликозилирования по одному или нескольким сайтам N-гликозилирования. В дрожжах гликозилирование, как правило, включает внутреннее ядро примерно из десяти остатков маннозы, соединенных с аспарагином через два остатка GlcNAc, и разветвленную внешнюю цепь примерно из 50-100 остатков маннозы. Поэтому, N-гликозилирование сможет потенциально добавлять до 300 остатков маннозы к TF, увеличивая молекулярную массу примерно на 60 кДа. Кроме того, также возможно, что несколько остатков маннозы могут быть присоединены к различным (более 25) сайтам О-гликозилирования. В конкретном варианте осуществления несущая TF микровезикула, полученная из дрожжей, содержит гликозилированный белок TF. Используемый в настоящем описании термин «гликозилированный» включает любую степень гликозилирования.
Термин «вариант TF, обладающий прокоагулянтной активностью» относится к соединениям, демонстрирующим по существу такую же биологическую активность (биологические активности), как TF, и являющимся результатом вставки, делеции или замены одного или более аминокислотных остатков. Подходящими функциональными методами анализа, которые можно использовать для оценки того, является ли данный полипептид функционально эквивалентным вариантом TF, являются методы анализа, основанные на определении способности варианта TF специфично связывать FVIIa, или основанные на in vitro определении времени коагуляции плазмы или цельной крови, или осуществляемые анализом in vivo на животной модели острого кровотечения или анализом in vivo на животной модели кровотечения с летальным исходом. Методики проведения этих анализов описаны в предшествующем уровне техники и обобщены в примерах настоящего изобретения (раздел «Способы»), а также в заявке WO 2008080989.
Варианты согласно настоящему изобретению включают аминокислотные последовательности, которые по меньшей мере на 60%, 70%, 80%, 90%, 95% или 96% аналогичны или идентичны природным молекулам TF, указанным выше. Как известно в данной области, «аналогию» между двумя белками определяют сравнением аминокислотной последовательности и ее консервативных аминокислотных замен одного белка с последовательностью второго белка. Степень идентичности между двумя белками определяют, используя компьютерные алгоритмы и способы, широко известные специалистам в данной области. Идентичность между двумя аминокислотными последовательностями предпочтительно определяют с использованием алгоритма BLASTP [BLASTManual, Altschul, S., et al., NCBI NLM NIH Bethesda, Md. 20894, Altschul, S., et al., J. Mol. Biol. 215: 403-410 (1990)].
Белок TF имеет явно выраженную доменную структуру, которая включает (1) сигнальный пептид или область с 32-аминокислотной лидерной последовательностью, которая пост-трансляционно отщепляется в ходе процессинга белка из незрелой в зрелую форму; (2) N-гликозилированный гидрофильный внеклеточный домен, содержащий примерно 219 концевых аминокислот; (3) фрагмент примерно из 23 аминокислот, в основном, гидрофобных, которые, как полагают, образуют трансмембранный домен; и (4) 21-аминокислотный карбоксильный конец, которые, как полагают, представляют собой аминокислоты, образующие часть цитоплазматического фрагмента белка. Доменная структура белка hTF дает возможность продуцирования, например, внеклеточного домена белка или его функциональных фрагментов.
В конкретном варианте осуществления фрагмент TF, обладающий прокоагулянтной активностью, содержит зрелый белок TF. Термин «зрелый TF» в контексте настоящего описания относится к белку TF, в чьей аминокислотной последовательности отсутствует сигнальный пептид. В предпочтительном варианте осуществления указанный зрелый белок TF содержит зрелый белок TF человека. Кроме того, в конкретном варианте осуществления указанный зрелый белок TF имеет аминокислотную последовательность, приведенную в SEQ ID NO:1.
Фрагмент белка TF, обладающий прокоагулянтной активностью, может быть гликозилированным, частично гликозилированным или негликозилированным. Таким образом, в конкретном варианте осуществления несущая TF липидная микровезикула настоящего изобретения содержит негликозилированный фрагмент белка TF, обладающий прокоагулянтной активностью, в то время как в другом конкретном варианте осуществления указанная полученная из дрожжей несущая TF микровезикула настоящего изобретения содержит гликозилированный фрагмент белка TF, обладающий прокоагулянтной активностью. Как указано выше, термин «гликозилированный» включает любую степень гликозилирования. В предпочтительном варианте осуществления TF или его функциональный вариант, обладающий прокоагулянтной активностью, содержит по меньшей мере один нефункциональный сайт N-гликозилирования.
В предпочтительном варианте осуществления сайтом или сайтами N-гликозилирования являются соответствующие сайтам N-гликозилирования NLT в положении 11-13, NVT в положении 124-126 или NNT в положении 137-139 в зрелом TF человека. В более предпочтительном варианте осуществления TF несет одну или более замен остатков Asn остатками, которые не являются акцепторами N-гликозилирования. В еще более предпочтительном варианте осуществления вариант TF одержит одну или более мутаций Asn→Ala по остаткам Asn в положениях, соответствующих положениям 11, 124 или 137 в зрелом TF человека.
Гликозилирование может варьировать в зависимости от системы экспрессии, используемой для получения несущих TF липидных везикул. Поэтому, изобретение относится к рекомбинантному белку тканевого фактора млекопитающих, который включает по меньшей мере один специфичный для растений гликан, специфичный для дрожжей гликан или специфичный для животных гликан.
В дополнение, как и в случае белка TF, используемый для осуществления настоящего изобретения фрагмент белка TF, обладающий прокоагулянтной активностью, может входить в слитый белок, причем указанный слитый белок включает первую область, содержащую указанный фрагмент белка TF, обладающий прокоагулянтной активностью, связанную со второй областью, содержащей другой пептид или белок. Указанная вторая область может быть связана с амино-концевой областью указанного фрагмента белка TF или, альтернативно, указанная вторая область может быть связана с карбокси-концевой областью указанного фрагмента белка TF. Как первая, так и вторая области могут быть соединены напрямую или соединены через линкерный полипептид между указанными первой и второй областями.
В конкретном варианте осуществления указанный слитый белок содержит фрагмент белка TF, обладающий прокоагулянтной активностью, и tag, соединенный с С-коцевым или N-концевым доменом указанного фрагмента белка TF. Указанный tag обычно является пептидом или аминокислотной последовательностью, которые можно использовать при выделении или очистке указанного слитого белка. Иллюстративные неограничивающие примеры tag, подходящих для получения данного слитого белка, включают указанные выше в связи со слитым белком, причем первой областью являлся белок TF. В конкретном варианте осуществления указанный tag представляет собой His-tag, соединенный с С-концевым доменом указанного белка TF или его фрагментом, обладающим прокоагулянтной активностью. В другом варианте осуществления указанный tag представляет собой His-tag, соединенный с N-концевым доменом указанного белка TF или его фрагментом, обладающим прокоагулянтной активностью. В конкретном варианте осуществления слитый белок включает зрелый белок TF, предпочтительно, зрелый белок TF человека. Данный слитый белок также обладает прокоагулянтной активностью, причем его прокоагулянтную активность можно проанализировать описанным выше методом, например, с помощью любого из анализов коагуляции крови, указанных в примере 2.
В дополнение, белок TF может быть представлен в виде части слитого белка, причем указанный слитый белок включает первую область, содержащую белок TF, соединенную со второй областью, содержащей другой пептид или белок. Указанная вторая область может быть связана с аминоконцевой областью указанного белка TF или, альтернативно, указанная вторая область может быть связана с карбокси-концевой областью указанного белка TF. Как первая, так и вторая области могут быть связаны напрямую или соединены через линкерный полипептид между указанным первой и второй областями.
В конкретном варианте осуществления указанный слитый белок включает белок TF и tag, обычно, пептидный tag, связанный с С-концевым или N-концевым доменом указанного белка TF. Указанный tag обычно представляет собой пептид или аминокислотную последовательность, которые можно использовать при выделении или очистке указанного слитого белка. Таким образом, указанный tag способен с высокой аффинностью связывать один или несколько лигандов, таких как, например, один или более лигандов аффинного матрикса, такого как хроматографическая подложка или шарики. Примером указанного tag является гистидиновый tag (His-tag или HT), такой как tag, включающий 6 остатков гистидина (His6 или H6), который может связываться с никелевой (Ni2+) или кобальтовой (Co2+) колонкой с высокой аффинностью. His-tag, как показано в примере 1 (фиг.4), обладает искомым признаком, поскольку он может связываться со своими лигандами в условиях, денатурирующих для большинства белков и разрушительных для большинства белок-белковых взаимодействий. Поэтому, его можно использовать для удаления «белка-наживки» с п