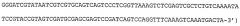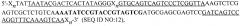Композиции и способы для обнаружения и идентификации последовательностей нуклеиновых кислот в биологических образцах
Иллюстрации
Показать всеИзобретение направлено на композиции и способы выделения, обнаружения, амплификации и количественной оценки патоген-специфичных нуклеиновых кислот в биологическом образце. Изобретение также относится к диагностическим наборам, содержащим специфичные амплификационные праймеры и меченые детекционные зонды, которые специфично связываются с продуктами амплификации, полученными в результате. Также раскрыты композиции и способы для выделения и характеристики нуклеиновых кислот, специфичных к одному или более патогенам, включая, например, вирус гриппа и Mycobacterium tuberculosis, из широкого спектра образцов, включая образцы биологического происхождения, образцы из окружающей среды, образцы клинического и/или ветеринарного происхождения. 4 н. и 23 з.п. ф-лы, 11 табл., 18 пр., 12 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение, в общем, относится к композициям и способам для обнаружения, идентификации и, необязательно, количественного определения фрагментов нуклеиновых кислот в популяции выделенных полинуклеотидов, такой как полученная из биологического образца. В частности, композиции и способы по изобретению могут сохраняться при комнатной температуре в течение длительного периода времени без ущерба для целостности компонентов или точности анализа.
Предпосылки создания изобретения
Микобактерии являются одноклеточными аэробными грамположительными бактериями. Обычно микобактерии имеют толстую гидрофобную клеточную стенку и не имеют наружной клеточной мембраны. Инфекции, вызванные микобактериями, могут быть активными в организме хозяина или могут быть скрытыми и бессимптомными. Появление штаммов с множественной лекарственной устойчивостью, необходимость длительной антибактериальной терапии и плохое соблюдение пациентами схемы лечения затрудняют лечение микобактериальных инфекций, особенно в развивающихся странах. В частности, появление штаммов M. tuberculosis с множественной лекарственной устойчивостью (MDR) сделало диагностику и лечение туберкулеза высоко приоритетными в развивающихся африканских странах.
Микобактерии обычно относят к кислотоустойчивым грамположительным бактериям из-за отсутствия у них внешней клеточной мембраны. Часто используемыми способами окрашивания кислотоустойчивых микроорганизмов являются окрашивание по Цилю-Нильсену или способом Киньона. Они обычно не сохраняют окрашивание кристаллическим фиолетовым и поэтому не считаются типичными представителями грамположительных бактерий. Однако они имеют уникальную структуру клеточной стенки, которая толще, чем у большинства других видов бактерий. Как правило, имеющая палочкообразную форму клеточная стенка состоит из гидрофобного миколятного слоя (содержащего миколовые кислоты) и пептидогликанового слоя, удерживаемых вместе полисахаридом арабиногалактаном. Эта структура клеточной стенки микобактерий помогает им выживать при резких изменениях в окружающей среде и вносит вклад в выносливость микобактерий, а также является причиной трудности лечения туберкулеза и лепры, поскольку оба эти заболевания вызываются различными видами микобактерий. Миколовые кислоты являются высокогидрофобными молекулами, которые образуют липидную оболочку вокруг организма и влияют на свойства проницаемости клеточной поверхности. Миколовые кислоты считаются существенным фактором вирулентности у некоторых видов микобактерий. Наиболее вероятно, они предупреждают атаку микобактерий катионными белками, лизоцимом и кислородными радикалами в фагоцитарных гранулах. Они также защищают микобактерии вне клетки от осаждения системой комплемента в сыворотке крови.
Кроме того, микобактерии, как правило, являются медленно растущими микроорганизмами, что усложняет культивирование различных видов микобактерий. Благодаря своей уникальной клеточной стенке они могут выживать при длительном воздействии кислот, щелочей, моющих средств, окислителей, комплемент-опосредованного лизиса и многих антибиотиков. Большинство микобактерий восприимчивы к антибиотикам кларитромицину и рифамицину, но уже появились устойчивые к этим антибиотикам штаммы.
Возбудители туберкулеза, члены комплекса Mycobacterium tuberculosis, а именно, M. tuberculosis, M. bovis, M. africanum, M. microti, M. cannetti, M. caprae и M. pinnipedi, имеют все вышеуказанные характеристики микобактерий. Главным следствием микобактериальной инфекции (в частности, инфекции одним или более видами из рода Mycobacterium) у человека является туберкулез (TB), заразная болезнь, вызванная членами «комплекса M. tuberculosis», которые включают, например, патогенные штаммы видов M. tuberculosis, M. bovis, M. africanum, M. microti, M. cannetti, M. caprae и M. pinnipedi. TB обычно поражает легкие млекопитающих-хозяев, но также может распространиться на другие органы и области тела, включая, например, кости, суставы, почки и брюшную полость, и т.д. Члены комплекса M. tuberculosis тесно связаны генетически и обладают высококонсервативными последовательностями 16S рРНК у всех представителей рода.
TB может быть приобретен в результате вдыхания капелек в воздухе, образовавшихся при кашле или чихании инфицированного человека. Соответственно, сбор биологических образцов, предположительно содержащих члены комплекса M. tuberculosis, включает сбор мокроты у пациентов с подозрением на эту инфекцию. Мокрота представляет собой откашливаемое отделяемое из дыхательных путей и в идеале содержит очень мало или практически не содержит слюны или выделений из носа, чтобы избежать загрязнения образца мокроты бактериями из полости рта. Мокрота в основном содержит слизь, вязкий коллоидный раствор, богатый гликопротеинами. Пациенты с подозрением на туберкулез обычно имеют повышенную вязкость слизи, а также увеличенное слизеобразование. В дополнение к слизи, мокрота может содержать кровь, т.е. может возникать кровохаркание, и/или гной, т.е. иметь гнойный характер. Симптомы активной туберкулезной инфекции могут включать хронический кашель (обычно с кровянистой мокротой), лихорадку, ночную потливость, хроническую усталость, бледность, потерю веса и болезненное истощение («общее истощение»). Другие симптомы могут включать затрудненное дыхание, боль в груди и хрипы ("Pulmonary Tuberculosis", PubMed Health). Если вдыхаемые туберкулезные палочки оседают в альвеолах легких, то происходит заражение с последующим расширением капилляров альвеол и набуханием эндотелиальных клеток. Альвеолит приводит к внутриклеточной репликации туберкулезных палочек и притоку полиморфноядерных лейкоцитов в альвеолы. Организмы затем распространяются через лимфатическую систему в кровеносную систему, а затем по всему телу.
Хотя в Соединенных Штатах M. tuberculosis инфицируется менее 200000 человек в год, по данным Всемирной организации здравоохранения (ВОЗ) во всем мире могут быть инфицированы около двух миллиардов человек, 90% из которых могут не иметь симптомов в течение многих лет после заражения. При отсутствии лечения туберкулез является фатальным более чем у 50% инфицированного населения, а при диссеминированных формах заболевания смертность приближается к 90%.
Вследствие хронического и изнуряющего течения туберкулезной инфекции также широко распространена коинфекция одним или более вторичными патогенами, включая, в частности, вирус иммунодефицита человека (ВИЧ). В 2007 году было зарегистрировано по меньшей мере 1370000 случаев ВИЧ-положительного TB, сосредоточенных в основном в развивающихся странах, где диагностика и лечение зачастую ограничены, неэффективны и/или непомерно дороги.
Стандартная диагностика туберкулезной инфекции, как правило, опирается на сочетание физического обследования (например, хронический кашель, увеличенные или болезненные лимфатические узлы, плеврит, необычные звуки при дыхании, и, на более поздних стадиях заболевания, характерные «барабанные» пальцы рук или ног) и диагностического обследования (например, исследование мокроты, исследование посева на микроорганизмы и исследование нуклеиновых кислот из образцов, бронхоскопия, компьютерная томография или рентген грудной клетки, биопсия легкого, торакоцентез, исследование на интерферон-γ (гамма) крови и туберкулиновый кожный тест).
«Стандарт» диагностики туберкулеза, культивирование клеток микобактерий, является трудновыполнимым, отчасти из-за их продолжительного периода удвоения, а именно, двадцать четыре часа для M. tuberculosis. Кроме того, у инфицированных людей микобактерии обычно присутствуют на низком уровне. Поэтому получение культуры из клинического образца может занять от четырех до восьми недель, в течение которых пациент может тяжело заболеть и стать заразным для других. Кроме того, культивирование клеток требует сбора, транспортировки и сохранения жизнеспособных микобактерий в образце до анализа образца в лабораторных условиях. В странах с распространенным туберкулезом и минимальным здравоохранением это может быть неосуществимым вариантом, что повышает риск распространения инфекции.
К несчастью для регионов с ограниченным доступом к медицинской помощи, цельная кровь должна быть проанализирована в течение 12 часов после получения образца, а эффективность теста не была проверена на пациентах с другими заболеваниями, такими как ВИЧ, СПИД, диабет, силикоз, хроническая почечная недостаточность, гематологические заболевания, на лицах, которые получали лечение от туберкулезной инфекции, а также не была проверена на беременных и несовершеннолетних («Clinicians Guide to QuantiFERON®-TB Gold», Cellestis). Для того чтобы подтвердить наличие микобактерий туберкулеза в биологических пробах, прочие некультуральные способы, такие как радиоиммунонализ, латекс-агглютинация и иммуноферментные методы анализа (ELISA), использовались с ограниченным успехом.
В большинстве клинических диагностических лабораторий для идентификации патогенов используется традиционное культивирование, которое обычно требует 3-7 дней для большинства вирусов и большего времени для некоторых бактериальных штаммов, в том числе, примерно до 21 дня для культивирования M. tuberculosis. Традиционная культура требует сбора образцов жизнеспособных микроорганизмов, перевозку в замороженном состоянии, а также размножение и работу с потенциально заразными и часто неизвестными микроорганизмами. Кроме того, многие инфекционные агенты, например, высокопатогенный птичий грипп, тяжелый острый респираторный синдром, комплекс M. tuberculosis, и т.д., являются патогенами 3-го уровня биологической опасности (BSL-3), которые требуют специальных служб и мер предосторожности для анализа. Существуют проблемы в получении, пересылке и сохранении высококачественных, жизнеспособных биологических образцов для культивирования. Пересылка образцов должна осуществляться с использованием холодовой цепи, наиболее часто сухого льда. Транспортировка потенциально инфекционных образцов из удаленных регионов или через международные границы с использованием коммерческих перевозчиков может быть дорогостоящей и трудоемкой, особенно когда образцы должны быть получены замороженными.
Сбор образцов является первым шагом в диагностических платформах или молекулярных протоколах, требующих обнаружения потенциально незначительных количеств нуклеиновых кислот из микроорганизмов. Вне зависимости от используемого метода исследования нуклеиновых кислот или протокола выделения РНК/ДНК, сбор образцов, особенно инактивация потенциально инфекционных агентов, а также сохранение и стабильность РНК/ДНК возбудителя, остаются критическим этапом в клинической диагностике, особенно при использовании во всем мире.
Как правило, для получения образцов мокроты пациентов с подозрением на туберкулез просят сильно покашлять, а затем выплюнуть откашливаемое в чашку для образцов. Обычно эту процедуру проводят в хорошо проветриваемом помещении, чтобы свести к минимуму возможность распространения инфекционных микобактерий. Пациентов могут попросить повторить эту процедуру для того, чтобы собрать достаточное количество мокроты для анализа, обычно в количестве от примерно 5 мл до примерно 20 мл. Как правило, собранные образцы мокроты хранят в холодильнике до проведения дальнейших аналитических процедур, таких как культивирование клеток или дезактивационные процедуры для инактивации или уничтожения любых микроорганизмов, содержащихся в образце. С целью обнаружения Mycobacterium tuberculosis в образце мокроты необходимо более 10000 бактерий на мл мокроты для визуализации палочки с использованием 100× объектива микроскопа (1000-кратное увеличение). Прямое микроскопическое исследование мазков образцов мокроты от больных туберкулезом обычно считается эффективным средством для контроля ответа пациента на лечение. Как правило, более кислотоустойчивые палочки можно найти в гнойных участках мокроты.
Область клинической молекулярной диагностики радикально изменилась с появлением полимеразной цепной реакции (ПЦР), а впоследствии, ПЦР в реальном времени. ПЦР в реальном времени (РВ-ПЦР) и обратная транскрипция с ПЦР в реальном времени (ОТ-РВ-ПЦР) могут обеспечить получение результатов с превосходной чувствительностью и специфичностью за часы. Таким образом, большинство современных диагностических лабораторий перешли от традиционного культивирования к исследованию нуклеиновых кислот (NAT), такому как ПЦР в реальном времени.
Тестирование на TB с помощью амплификации нуклеиновых кислот включает использование методики стандартной полимеразной цепной реакции (ПЦР) для обнаружения ДНК микобактерий в образцах пациента, нуклеотидных зондов для выявления микобактерий в культуре, анализ полиморфизма длины рестрикционных фрагментов (RFLP) для сравнения различных штаммов TB для эпидемиологических исследований и генетическое определение чувствительности для выявления лекарственно-устойчивых штаммов микобактерий. Полная последовательность генома M. tuberculosis была определена и опубликована; в настоящее время Управлением по контролю за продуктами и лекарственными препаратами (FDA) для использования в США были одобрены два теста на туберкулез на основе амплификации нуклеиновых кислот. Первый, известный как «Усиленный амплификацией прямой тест на Mycobacterium tuberculosis» (E-MTD, Gen-Probe, San Diego, CA, USA), предназначен для обнаружения бактерий комплекса M. tuberculosis среди кислотоустойчивых палочек в образцах из дыхательных путей пациентов с подозрением на туберкулез, как с положительными, так и с отрицательными мазками. E-MTD тест объединяет изотермическую транскрипционно-опосредованную амплификацию участка 16S рРНК со способом обнаружения, в котором используется гибридизационный зонд, специфичный к бактериям комплекса M. tuberculosis. Второй, известный как тест на Mycobacterium tuberculosis AMPLICOR® (AMPLICOR®, Roche Diagnostics, Basel, Switzerland), был одобрен для выявления бактерий комплекса M. tuberculosis в образцах из дыхательных путей пациентов с подозрением на туберкулез только с положительными мазками. В этом тесте используют ПЦР для амплификации участка гена 16S рРНК, содержащего последовательность, которая гибридизуется с олигонуклеотидным зондом, специфичным к бактериям комплекса M. tuberculosis. («Report of an Expert Consultation on the Uses of Nucleic Acid Amplification Tests for the Diagnosis of Tuberculosis», Centers for Disease Control and Prevention).
Результаты показали, что чувствительность и специфичность этих тестов имеет тенденцию меняться в зависимости от географического положения и факторов риска. Кроме того, эти методики для своего выполнения требуют сложных лабораторных условий и оборудования, тем самым снижая скорость и чувствительность теста. По этим и другим причинам в данной области существует потребность в надежных и точных способах обнаружения патогенных микобактерий в клинических образцах и, в частности, в способах быстрого выявления таких патогенов в полевых условиях, удаленных местах и в развивающихся странах, где отсутствуют стандартные лаборатории и ограничены финансовые ресурсы. В частности, весьма необходимы композиции для безопасного сбора, работы и транспортировки патогенных образцов, а также молекулярно-биологические методы быстрого обнаружения и точной идентификации TB-специфичных нуклеиновых кислот в таких образцах.
Краткое изложение сущности изобретения
Настоящее изобретение преодолевает проблемы и недостатки, связанные с текущими стратегиями и схемами, и обеспечивает новую композицию, средства и способы обнаружения и идентификации последовательностей нуклеиновых кислот.
Один вариант осуществления изобретения относится к готовым для ПЦР композициям для обнаружения микроорганизма в биологическом образце, включающим в качестве компонентов: термостабильную полимеразу, присутствующую в количестве от примерно 0,05 Ед. до примерно 1 Ед.; смесь дезоксинуклеотидтрифосфатов, содержащую примерно равные количества дАТФ, дЦТФ, дГТФ и дТТФ, совместно присутствующих в композиции в концентрации от примерно 0,1 мМ до примерно 1 мМ; хелатирующий агент, выбранный из группы, состоящей из этиленгликольтетрауксусной кислоты, гидроксиэтилэтилендиаминтриуксусной кислоты, диэтилентриаминпентауксусной кислоты, N,N-бис(карбоксиметил)глицина, этилендиаминтетрауксусной кислоты, безводного цитрата, цитрата натрия, цитрата кальция, цитрата аммония, бицитрата аммония, лимонной кислоты, цитрата диаммония, цитрата калия, цитрата магния, цитрата железистого аммония, цитрата лития и любой их комбинации, присутствующий в композиции в концентрации от примерно 0,01 мМ до примерно 1 мМ; агент для осмолярности ПЦР, выбранный из группы, состоящей из Ν,Ν,Ν-триметилглицина (бетаина), диметилсульфоксида (ДМСО), формамида, глицерина, неионных детергентов, полиэтиленгликоля, хлорида тетраметиламмония и любой их комбинации, присутствующий в композиции в концентрации от примерно 1 мМ до примерно 1 М; альбумин, выбранный из группы, состоящей из альбумина бычьей сыворотки, альбумина человеческой сыворотки, альбумина козьей сыворотки, альбумина млекопитающих и любой их комбинации, присутствующий в композиции в концентрации от примерно 5 нг/мл до примерно 100 нг/мл; по меньшей мере две соли, первая из которых представляет собой соль калия, выбранную из группы, состоящей из хлорида калия и глутамата калия, а вторая представляет собой соль магния, выбранную из группы, состоящей из хлорида магния и сульфата магния, совместно присутствующие в композиции в концентрации от примерно 50 мМ до примерно 1 М; и буфер, выбранный из группы, состоящей из трис(гидроксиметил)аминометана (Tris), цитрата, 2-(N-морфолино)этансульфоновой кислоты (MES), N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновой кислоты (BES), 1,3-бис(трис(гидроксиметил)метиламино)пропана (Bis-Tris), 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (HEPES), 3-(N-морфолино)пропансульфоновой кислоты (MOPS), N,N-бис(2-гидроксиэтил)глицина (бицина), N-[трис(гидроксиметил)метил]глицина (трицина), N-2-ацетамидо-2-иминодиуксусной кислоты (ADA), N-(2-ацетамидо)-2-аминоэтансульфоновой кислоты (ACES), пиперазин-1,4-бис(2-этансульфоновой кислоты) (PIPES), бикарбоната, фосфата и любой их комбинации, присутствующий в композиции в концентрации от примерно 1 мМ до примерно 1 М и с рН от примерно 6,5 до примерно 9,0, причем pKa буфера находится в пределах примерно одной единицы рН при выбранной температуре, причем компоненты объединены с безнуклеазной водой. Предпочтительно термостабильная полимераза представляет собой Taq-полимеразу, высокоточную полимеразу, Pfu-полимеразу и полимеразу с «горячим стартом» или полимеразу следующего поколения. Предпочтительно композиция дополнительно содержит один или более красителей, выбранных из группы, состоящей из флуоресцеина, 5-карбокси-X-родамина и ROX. Предпочтительно рН буфера или общей композиции составляет от примерно 6,5 до примерно 7,5, а pKa буфера находится в пределах 0,5 единицы от рН буфера при температуре окружающей среды, более предпочтительно pKa буфера находится в пределах 0,2 единицы от рН буфера при температуре окружающей среды. Предпочтительно композиция дополнительно содержит пару ПЦР-праймеров, выполненных с возможностью амплификации с помощью ПЦР последовательности нуклеиновой кислоты, специфичной к микроорганизму, в совокупности присутствующих в композиции в концентрации от примерно 0,5 мкМ до примерно 50 мкМ, причем каждый ПЦР-праймер составляет от примерно 5 до примерно 50 нуклеотидов в длину. Более предпочтительно каждый праймер из указанной пары ПЦР-праймеров составляет от примерно 18 до 35 нуклеотидов в длину. Предпочтительно детектируемый микроорганизм представляет собой патоген, который может быть бактериальным, вирусным, грибковым и паразитарным патогеном. Более предпочтительно бактерия представляет собой микобактерию или вирус представляет собой вирус гриппа, такой как, например, штамм H1N1, H2N2, H3N3 или H5N1 вируса гриппа. Предпочтительно композиция дополнительно содержит контрольную нуклеиновую кислоту, присутствующую в концентрации от примерно 1 фг до примерно 1 нг, что обеспечивает качественное или количественное измерение ПЦР-амплификации. Предпочтительная контрольная нуклеиновая кислота содержит, например, последовательность SEQ ID NO:8, последовательность SEQ ID NO:12 или последовательность SEQ ID NO:21. Предпочтительно композиция может дополнительно содержать детекционный зонд, такой как, например, детекционный зонд, который специфично связывается с ПЦР-амплифицированной нуклеиновой кислотой, специфичной для указанного микроорганизма. Предпочтительная композиция по изобретению содержит примерно 50 мМ Tris; 70 мМ хлорида калия; примерно 3 мМ сульфата магния; примерно 45 мМ бетаина; примерно 0,03 мкг/мл бычьего сывороточного альбумина; примерно 0,1 мМ EDTA; примерно 0,05 мкМ красителя; пару ПЦР-праймеров с концентрацией примерно 8 мкМ. Предпочтительно один праймер из пары ПЦР-праймеров содержит последовательность нуклеиновой кислоты SEQ ID NO:2 или SEQ ID NO:5, а другой праймер из пары ПЦР-праймеров содержит последовательность нуклеиновой кислоты SEQ ID NO:3 или SEQ ID NO:6. Также предпочтительной является композиция, в которой детекционный зонд представляет собой специфичную для микобактерий последовательность, составляющую от примерно 20 до примерно 35 нуклеотидов в длину, и содержит последовательность SEQ ID NO:4 или SEQ ID NO:7.
Другой вариант осуществления настоящего изобретения включает готовые для ПЦР композиции для обнаружения микроорганизмов в биологическом образце, содержащие в качестве компонентов: термостабильную полимеразу; смесь дезоксинуклеотидтрифосфатов, содержащую примерно равные количества дАТФ, дЦТФ, дГТФ и дТТФ; хелатирующий агент; агент для осмолярности ПЦР; альбумин; по меньшей мере две соли; и буфер, который присутствует в композиции в концентрации по меньшей мере 50 мМ и имеет рН от примерно 6,5 до примерно 9,0, причем pKa буфера находится в пределах примерно одной единицы от рН буфера при выбранной температуре, причем компоненты объединены с безнуклеазной водой. Предпочтительно термостабильная полимераза присутствует в количестве от примерно 0,05 Ед. до примерно 10 Ед.; смесь дезоксинуклеотидтрифосфатов присутствует в композиции в концентрации от примерно 0,1 мМ до примерно 10 мМ; хелатирующий агент присутствует в композиции в концентрации от примерно 0,01 мМ до примерно 10 мМ; агент для осмолярности ПЦР присутствует в композиции в концентрации от примерно 1 мМ до примерно 10 М; альбумин присутствует в композиции в концентрации от примерно 5 нг/мл до примерно 1 мг/мл; по меньшей мере две соли совместно присутствуют в композиции в концентрации от примерно 50 мМ до примерно 10 М; и буфер присутствует в композиции в концентрации от примерно 1 мМ до примерно 10 М.
Другой вариант осуществления настоящего изобретения относится к способам обнаружения микроорганизмов в биологическом образце, включающим: приведение биологического образца в контакт с композицией по любому из п.п.1-22 с образованием смеси; проведение множества стадий циклических изменений температуры (термоциклирования) смеси с образованием продукта амплификации, который получен из нуклеиновой кислоты, специфичной для микроорганизма; определение присутствия или отсутствия продукта амплификации для определения присутствия или отсутствия микроорганизма в биологическом образце. Предпочтительно способ дополнительно включает обнаружение амплифицированной последовательности контрольной нуклеиновой кислоты и определение качества и количества амплификации, прошедшей за множество стадий термоциклирования. Также предпочтительно, биологический образец содержит биологический материал, полученный от человека, одно или более хаотропных соединений, один или более детергентов, один или более восстанавливающих агентов, один или более хелатирующих агентов и один или более буферов.
Другой вариант осуществления настоящего изобретения относится к способам, обеспечивающим обнаружение микроорганизма в биологическом образце, которые включают обеспечение готовой для ПЦР композиции, содержащей в качестве компонентов: термостабильную полимеразу, присутствующую в количестве от примерно 0,05 Ед. до примерно 1 Ед.; смесь дезоксинуклеотидтрифосфатов, содержащую примерно равные количества дАТФ, дЦТФ, дГТФ и дТТФ, совместно присутствующих в композиции в концентрации от примерно 0,1 мМ до примерно 1 мМ; один или более хелатирующих агентов, присутствующих в композиции в концентрации от примерно 0,01 мМ до примерно 1 мМ; один или более агентов для осмолярности ПЦР, присутствующих в композиции в концентрации от примерно 1 мМ до примерно 1 М; один или более альбуминовых белков, присутствующих в композиции в концентрации от примерно 5 нг/мл до примерно 100 нг/мл; одну или более солей, присутствующих в композиции в концентрации от примерно 50 мМ до примерно 1 М; и один или более буферов, присутствующих в композиции в концентрации от примерно 1 мМ до примерно 1 М и с рН от примерно 6,5 до примерно 9,0, причем pKa буфера находится в пределах примерно одной единицы от рН буфера при выбранной температуре, причем компоненты объединены с безнуклеазной водой. Предпочтительно рН буфера составляет от примерно 6,5 до 7,5, а pKa буфера находится в пределах 0,5 единицы от рН буфера при температуре окружающей среды. Предпочтительно способ дополнительно включает приведение биологического образца в контакт с композицией и проведение реакции термоциклирования на смеси. Предпочтительно один или более хелатирующих агентов включают этиленгликольтетрауксусную кислоту, гидроксиэтилэтилендиаминтриуксусную кислоту, диэтилентриаминпентауксусную кислоту, N,N-бис(карбоксиметил)глицин, этилендиаминтетрауксусную кислоту, безводный цитрат, цитрат натрия, цитрат кальция, цитрат аммония, бицитрат аммония, лимонную кислоту, цитрат диаммония, цитрат калия, цитрат магния, цитрат железистого аммония, цитрат лития или любую их комбинацию, один или более агентов для осмолярности ПЦР включают Ν,Ν,Ν-триметилглицин (бетаин), диметилсульфоксид (ДМСО), формамид, глицерин, неионные детергенты, дезоксиинозин, глицерин, 7-деазадезоксигуанозинтрифосфат, гидроксид натрия, полиэтиленгликоль, хлорид тетраметиламмония или любую их комбинацию, один или более альбуминов включают альбумин бычьей сыворотки, альбумин человеческой сыворотки, альбумин козьей сыворотки, альбумин млекопитающих или любую их комбинацию, одна или более солей включают хлорид калия, глутамат калия, хлорид магния, сульфат магния и любую их комбинацию, один или более буферов включают трис(гидроксиметил)аминометан (Tris), цитрат, 2-(N-морфолино)этансульфоновую кислоту (MES), N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновую кислоту (BES), 1,3-бис(трис(гидроксиметил)метиламино)пропан (Bis-Tris), 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES), 3-(N-морфолино)пропансульфоновую кислоту (MOPS), N,N-бис(2-гидроксиэтил)глицин (бицин), N-[трис(гидроксиметил)метил]глицин (трицин), N-2-ацетамидо-2-иминодиуксусную кислоту (ADA), N-(2-ацетамидо)-2-аминоэтансульфоновую кислоту (ACES), пиперазин-1,4-бис(2-этансульфоновую кислоту) (PIPES), бикарбонат, фосфат или любую их комбинацию.
Другой вариант осуществления изобретения относится к наборам, включающим композицию по изобретению, содержащуюся в стерильном сосуде, выполненном с возможностью добавления биологического образца и термоциклирования, и инструкции для определения присутствия или отсутствия патогена по результатам термоциклирования.
Другие варианты осуществления и преимущества изобретения изложены частично в нижеследующем описании и частично могут быть очевидны из этого описания или могут быть обнаружены при осуществлении изобретения на практике.
Описание чертежей
Фигура 1 иллюстрирует анализ с помощью ПЦР в реальном времени туберкулезной ДНК из положительных по мазку образцов мокроты, хранящихся в PrimeStore® в соотношении 1:1. Кроме того, эти же положительные по мазку образцы мокроты собирали на тампон, в результате получая от примерно 50 до примерно 400 мкл образца на тампон, и тампоны помещали в 1,5 мл PrimeStore®. ДНК экстрагировали из каждого образца мокроты в PrimeStore®, используя AMPLICOR® Respiratory Specimen Preparation Kit (AMPLICOR®, Roche Diagnostics, Basel, Switzerland) в соответствии с инструкциями производителя. 4 мкл выделенной ДНК использовали для ПЦР в реальном времени, используя набор LightCycler® Mycobacterium detection kit, в соответствии с инструкциями производителя. Полученные значения Cτ для каждого из образцов приведены в таблице 2;
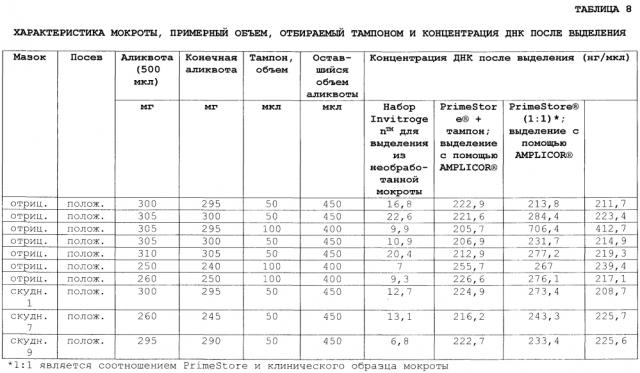
Фигура 2 иллюстрирует анализ с помощью ПЦР в реальном времени туберкулезной ДНК из семи отрицательных по мазку и положительных по культуре образцов мокроты и трех скудных (т.е. положительных по мазку, когда окрашивание едва видно на слайде) образцов на тампонах, хранящихся в PrimeStore®. ДНК выделяли, используя AMPLICOR® Respiratory Specimen Preparation Kit и Invitrogen™ iPrep™ Purelink™ Virus Kit (Carlsbad, CA, USA), в соответствии с инструкциями производителя. Использовали набор LightCycler® Mycobacterium detection kit в соответствии с инструкциями производителя. Полученные значения Cτ для каждого из образцов приведены в таблице 8;
На фигуре 3 показана диаграмма результатов ПЦР в реальном времени с использованием PrimeMix® Universal MTB Assay, компоненты которого после хранения при температуре -20°C помещали в комнатную температуру различное число раз, т.е. один, три, пять и десять раз, а затем использовали в PrimeMix® Universal MTB Assay;
На фигуре 4 показана диаграмма результатов анализа с помощью ПЦР в реальном времени, когда одноцепочечную ДНК внутреннего положительного контроля (IPC) детектировали в анализе PrimeMix® с использованием детекционных зондов, меченных либо 6-FAM (FAM), либо красителем VIC™;
На фигуре 5 показана диаграмма результатов анализа с помощью ПЦР в реальном времени, когда различные количества ДНК, выделенной у пациентов с туберкулезом, а именно, 2 мкл, 3 мкл, 4 мкл и 5 мкл матричной ДНК, использовали в PrimeMix® Universal MTB Assay;
На фигуре 6 показана диаграмма результатов ПЦР в реальном времени при проведении мультиплексного PrimeMix® Universal MTB Assay, в котором одноцепочечную ДНК внутреннего положительного контроля (IPC) добавляют к раствору, содержащему туберкулезный образец, по сравнению с моноплексным анализом, в котором исходный раствор содержит только биологический образец, полученный от пациента, и раствор для хранения, т.е. PrimeStore®;
На фигуре 7 показана диаграмма результатов анализа с помощью ПЦР в реальном времени, когда меняется концентрация внутреннего положительного контроля («IPC»), помещенного в PrimeStore®, т.е. 10-5, 10-6, 10-7 и 10-8 нг/мкл IPC помещали в одинаковое количество PrimeStore®. Зонды для IPC были помечены либо 6-FAM («IPC Fam»), либо красителем VIC™ («IPC Vic»). Также проводили мультиплексную реакцию, в которой специфичные к комплексу M. tuberculosis праймеры и зонды также добавляли в PrimeMix® (результаты приведены в колонке, названной «MTB в мультиплексном анализе») вместе с IPC-праймерами и зондами (результаты показаны в колонке, названной «IPC Vic в мультиплексном анализе»);
На фигуре 8 показана диаграмма результатов анализа с помощью ПЦР в реальном времени, когда исходное количество образца M. tuberculosis составляет 15 мкл и 150 мкл (10-кратная разница), причем каждый исходно хранят в 1,5 мл PrimeStore® (PS). Этот анализ проводили для IPC-зондов, меченных 6-FAM («IPC Fam») и красителем VIC™ («IPC Vic»), а также для моноплексного обнаружения M. tuberculosis («MTB») и мультиплексного обнаружения M. tuberculosis («MTB в мультиплексном анализе») и IPC, в котором зонд помечен красителем VIC™ («IPC Vic в мультиплексном анализе»);
На фигуре 9 показана диаграмма результатов анализа с помощью ПЦР в реальном времени, когда различные штаммы микобактерий, то есть пять различных штаммов M. tuberculosis, два различных штамма M. avium, один штамм M. intracellularae, один штамм M. gondii и один штамм M. kansasii, помещали в PrimeStore® и затем выделяли из него, а затем анализировали, используя как моноплексный («MTB моноплексный»), так и мультиплексный («MTB в мультиплексном анализе») форматы процедуры PrimeMix®. В моноплексном анализе используются только праймеры и зонды, специфичные к комплексу M. tuberculosis, тогда как в мультиплексном анализе используются как специфичные к комплексу M. tuberculosis праймеры и зонды, так и IPC-специфичные праймеры и зонды;
На фигуре 10 показана диаграмма результатов анализа с помощью ПЦР в реальном времени, когда количество M. tuberculosis из каждого конкретного очищенного штамма меняется, а именно 10-4, 10-3, 10-2, 10-1 представляют собой десятикратные разведения, в которых 10-1 представляет концентрацию ДНК 330 нг/мкл, 10-2 представляет концентрацию ДНК 33 нг/мкл, 10-3 представляет концентрацию ДНК 3,3 нг/мкл и 10-4 представляет концентрацию ДНК 0,33 нг/мкл. Проводили моноплексную реакцию, используя PrimeMix® Universal MTB Assay со специфичными к комплексу M. tuberculosis праймерами и зондами (результаты показаны в колонке «МТВ моноплексный»), а также проводили мультиплексный PrimeMix® assay, в котором присутствовали как специфичные к комплексу M. tuberculosis праймеры и зонды, так и IPC-специфичные праймеры и зонды (результаты показаны в колонках «МТВ в мультиплексном анализе» и «IPC в мультиплексном анализе»); и
На фигуре 11 показана диаграмма результатов анализа с помощью ПЦР в реальном времени, когда количество M. tuberculosis из конкретного очищенного штамма меняется, а именно 10-4, 10-3, 10-2, 10-1 представляют собой десятикратные разведения, в которых 10-1 представляет концентрацию ДНК 33 нг/мкл, 10-2 представляет концентрацию ДНК 3,3 нг/мкл, 10-3 представляет концентрацию ДНК 0,33 нг/мкл и 10-4 представляет концентрацию ДНК 0,033 нг/мкл, а для IPC-специфичного зонда используются различные метки - либо 6-FAM («IPC Fam»), либо краситель VIC™ («IPC Vic»).
На фигуре 12 показана диаграмма, изображающая значения пороговых циклов (СТ) относительно концентрации неацетилированного BSA (конечная концентрация в мг/мл).
Описание изобретения
Настоящее изобретение преодолевает эти и другие недостатки, присущие предшествующему уровню техники, обеспечивая полезные, неочевидные и новые композиции для безопасного сбора, обращения и транспортировки биологических образцов, предположительно содержащих патогенные микроорганизмы, а также способы быстрого обнаружения, идентификации и количественного анализа этих патогенов посредством молекулярно-биологического анализа нуклеиновых кислот. В частности, изобретение относится к способам специфичного обнаружения одного или более штаммов патогенных микроорганизмов, таких как бактерии, вирусы, грибки и паразиты. В конкретных вариантах применения изобретение охватывает диагностический продукт, который позволяет осуществлять сбор образца-мишени, подготовку образца-мишени для анализа, выделение геномного материала из образца и последующую обработку геномного материала для идентификации одного или более организмов, если они присутствуют, в биологическом образце. В сочетании с одним или более устройствами для сбора образцов композиции, раскрытые в настоящем документе, позволяют безопасные сбор, транспортировку и хранение биологических образцов, даже в случае образцов, собранных в удаленной местности или в «полевых» условиях, причем время от сбора образца до анализа образца может составлять от нескольких часов до нескольких дней или даже недель.
Изобретение дополнительно охватывает композиции и способы, которые позволяют упростить и ускорить сбор образцов, подготовку и молекулярное обнаружение микроорганизмов, особенно таких микроорганизмов, как возбудители гриппа и туберкулеза. В конкретных вариантах применения изобретение охватывает диагностический продукт, посредством которого образец собирают, транспортируют и быстро подготавливают для последующей ПЦР без необходимости в холодовой цепи или дорогостоящих и трудоемких дезактивации и эмульгирования образца. Молекулярно-диагностический продукт включает термостабильную полную ПЦР-смесь праймеров, зондов и ферментов в готовых к использованию растворе или суспензии. Этот диагностический продукт можно использовать в центральных лабораториях и с высокопропускными системами или в сельских или мобильных клиниках с минимальными возможностями и в отсутствие надежного энергоснабжения, или даже с ручным устройством. Изобретение также охватывает способ эпидемиологического наблюдения и контроля за вспышкой заболевания, отслеживания пандемии и эпидемии и секвенирование нуклеотидных последовательностей микроо