Способы конъюгации
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предложен способ приготовления очищенного конъюгата в растворе, включающий приведения в контакт майтансиноидной молекулы, содержащей тиоловую группу, с гетеробифункциональным линкерным реагентом для ковалентного присоединения линкера к майтансиноидной молекуле, затем конъюгацию антитела с майтансиноидной молекулой, связанной с линкерами, путем реакции полученной неочищенной смеси с антителом в растворе, имеющем рН от примерно 4 до примерно 9, и применение к полученной смеси тангенциальной поточной фильтрации, диализа, гелевой фильтрации, адсорбционной хроматографии, селективного осаждения или их комбинации для получения очищенного конъюгата. Способ по настоящему изобретению не требует проведения очистки промежуточных соединений, дает высокий выход конъюгатов высокой чистоты и гомогенности без межцепочечных поперечных сшивок и инактивированных остатков линкера и может найти дальнейшее применение в получении лекарственных препаратов на основе соответствующих конъюгатов. 8 з.п. ф-лы, 25 ил., 1 табл., 8 пр.
Реферат
Область техники
Это изобретение относится к новому способу конъюгации эффекторной группы (напр., цитотоксичного агента) или репортерной группы (напр., радиоактивной метки) со связывающимся с клеткой агентом, таким как антитело или его фрагмент, с помощью биофункционального линкера. Более конкретно, это изобретение относится к новому способу конъюгации эффекторной группы (напр., майтансиноид) или репортерной группы (напр., радиоактивной метки) со связывающимся с клеткой агентом (напр., антителом или его фрагментом) при посредстве биофункционального линкера, таким образом, что способ исключает этапы, которые приводят к образованию нежелательных гидролизованных молекул или нежелательных поперечно-сшитых молекул, образовавшихся в результате внутримолекулярных или межмолекулярных реакций.
Уровень техники
Конъюгаты связывающихся с клетками агентов, таких как антитела, с эффекторными группами, такими как маленькие цитотоксичные агенты или цитотоксичные белки, представляют огромный интерес для развития антираковой терапии (Richart, A.D., and Tolcher, A.W., 2007, Nature Clinical Practice, 4, 245-25). Эти конъюгаты являются опухолеспецифичными благодаря высокой специфичности отобранных антител против антигенов, экспрессирующихся на клеточной поверхности опухолевых клеток. При специфичном связывании с опухолевой клеткой, конъюгат антитела с цитотоксичным агентом проникает внутрь и разрушается внутри раковой клетки-мишени, таким образом высвобождая активный цитотоксичный агент, который ингибирует жизненно важные клеточные функции, такие как динамику миктротрубочек или репликацию ДНК, что приводит к гибели раковой клетки. В связывании антител с цитотоксичными агентами принимают участие различные линкеры, с целью обеспечить доставку агента внутрь клетки путем интернализации и процессирования конъюгата, в то же время поддерживая желаемую стабильность конъюгата в плазме. Эти линкеры включают дисульфидные линкеры, разработанные с различными степенями стерического несоответствия, влияющими на кинетику их восстановления внутриклеточным тиолом, расщепляемые пептидные линкеры, такие как валин-цитруллиновое соединение, и нерасщепляемые линкеры, такие как тиоэфирное соединение (Widdison, W., et al., J.Med. Chem., 2006, 49, 4392-4408; Erickson, H., et al., Cancer Res., 2006, 66, 4426-4433).
Конъюгаты связывающихся с клетками агентов, таких как антитела, с метками или репортерными группами, полезны для применения для иммуносцинтиграфии опухолей у пациентов с раком, применения в иммунологических анализах для диагностики различных болезней, терапии рака с использованием связанных с радиоактивными нуклидами конъюгатов, и применения в аффинной хроматографии для очистки биоактивных агентов, таких как белки, пептиды и олигонуклеотиды. Метки репортерных групп, которые конъюгируют со связывающимся с клетками агентами, включают флюрофоры и аффинные метки, такие как биотин.
Традиционный способ конъюгации связывающихся с клетками агентов, таких как антитела (Ат), с эффекторной группой (напр., цитотоксичным агентом) или репортерной группой (напр., радиоактивной меткой) посредством нерасщепляемого соединения (такого как тиоэфирное соединение) состоит из двух различных этапов реакций с антителом и требует использования этапа очистки. В первом реакционном этапе антитело реагирует с гетеробифункциональным линкером, несущим две различные химически активные группы (например, Х и Y). Например, в одном подходе, реакция химически активных остатков антител (таких как остатки аминокислоты лизин) с Х реактивной группой (такой как N-гидроксисукцинимидный сложный эфир) гетеробифункционального реагента приводит к образованию линкера с Y реактивной группой из одного или более химически активных остатков антитела (такой как остаток аминокислоты лизин). Первично модифицированный продукт антитела должен быть очищен от избытка линкера или гидролизированного реагента линкера перед переходом на следующий этап. На втором этапе реакции модифицированное линкером антитело, содержащее Y-реактивную группу (такую как малеимид или галоацетамид) реагирует с эффектором, таким как эффекторная группа (С) (напр., цитотоксичный агент), содержащим химически активную группу, такую как тиол, для создания конъюгата антитело-эффектор, который снова очищают на дополнительном этапе очистки (см., напр., патент США 5,208,020, 5,416,064, или 5,024,834). Таким образом, при вышеописанном способе необходимы по крайней мере два этапа очистки.
Другой подход, который включает два этапа реакции и очистки для конъюгации антитела с эффекторной или репортерной группой, использует реакцию остатков тиола в антителе (образованных благодаря модификации антитела с тиол-образующими реагентами, такими как 2-иминотиолан, или благодаря мутагенезу для включения чужеродных цистеиновых остатков, или благодаря расщеплению нативных дисульфидных связей) с гомобифункциональным линкером Y-L-Y, содержащим Y-реактивные группы (такие как малеимид или галоацетамид).
Основным препятствием для включения химически активной группы Y, такой как малеимид (или галоацетамид) в антитело или пептид является склонность химически активных малеимидных (или галоацетамидных) групп подвергаться внутри- или межмолекулярной реакции с нативными остатками гистидина, лизина, тирозина или цистеина в антителе или пептиде (Papini, A. et al., Int. J.Pept. Protein Res., 1992, 39, 348-355; Ueda, T. et al.. Biochemistry, 1985, 24, 6316-6322), и водной инактивации Y-малеимидной группы. Нежелаемая внутри- или межмолекулярная реакция малеимидных (или галоацетамидных) групп Y, включенных в антитело с нативными остатками гистидина, лизина или цистеина в антителе, и водная инактивация Y-малеимидной группы перед второй реакцией с эффекторной или репортерной группой С приводят к образованию поперечно-сшитых белков или гетерогенных конъюгатов и снижают эффективность второй реакции с эффекторной или репортерной группой С.Гетерогенный продукт конъюгации - поперечно-сшитый белок или пептид, образовавшийся вследствие нежелаемой реакции первично включенной группы Y (такой как малеимидная группа) с нативными группами в антителе или пептидах (таких как гистидин, лизин, тиозин или цистеин) или с неактивными остатками малеимида, образованными при водной инактивации, может обладать худшей активностью и стабильностью, чем желаемый гомогенный продукт конъюгации.
Способы конъюгации антител с тиол-содержащими цитотоксичными агентами благодаря дисудьфидным связям описаны выше (см., напр., патенты США 5,208,020, 5,416,064, 6,441,163, Патент США Публикация No. 2007/0048314 A1). Эти способы включают первичную реакцию антитела с гетерофункциональным реагентом, за которой следует вторая реакция с тиол-содержащим цитотоксичным агентом. Альтернативный способ описан в патенте США 6,441,163 В1, в котором связанный с дисульфидом химически активный сложный эфир цитотоксического агента вначале очищается и затем реагирует с антителом, но это включает дополнительную реакцию и этап очищения из-за содержащего тиоловую группу цитотоксичного агента перед этапом реакции с антителом.
Следующее препятствие для современного способа создания конъюгатов со связывающимся с клетками агентами - необходимость двух этапов очищения, которые понижают общий выход и также делают способ громоздким и сравнительно дорогим.
Учитывая вышеизложенное, в данной области техники существует потребность в разработке улучшенных способов приготовления композиций конъюгатов связывающегося с клетками агента и препарата, которые обладают высокой степенью чистоты и при их приготовлении можно исключить трудоемкие этапы, что сокращает время и делает способ более экономным. Изобретение предоставляет такой способ. Эти и другие преимущества изобретения, а также дополнительные особенности изобретения, будут раскрыты в описании изобретения, предоставляемого здесь.
Сущность изобретения
Настоящее изобретение описывает способ конъюгации для создания нерасщепляемых, соединенных тиэфирной связью конъюгатов с формулой C-L-CBA, где С представляет собой эффекторную или репортерную молекулу (напр., цитотоксичный агент или радиоактивную метку), L - линкер и СВА - связывающийся с клеткой агент (напр., антитело или его фрагмент), путем использования прямой реакции тиол-содержащего цитотоксичного агента (напр., майтансиноида) с гетеро- или гомо-бифункциональным реагентом (напр., расщепляемым или нерасщепляемым линкером), за которой следует смешивание неочищенной реакционной смеси со связывающимся с клеткой агентом (напр., антителом или его фрагментом), тем самым создавая неращепляемый соединенный тиэфирной связью конюъюгат путем способа, являющегося более эффективным, дающего больший выход и сравнительно более экономичного. Другое важное преимущество состоит в том, что такой способ конъюгации дает соединенный тиэфирной связью нерасщепляемый конъюгат, не имеющий внутри цепочки поперечно-сшитых белков или инактивированных остатков (напр., остатков малеимида или галоаетамида). Новые способы, раскрытые в этой заявке, могут применяться для приготовления любого конъюгата, представленного вышеупомянутой формулой.
Краткое описание чертежей
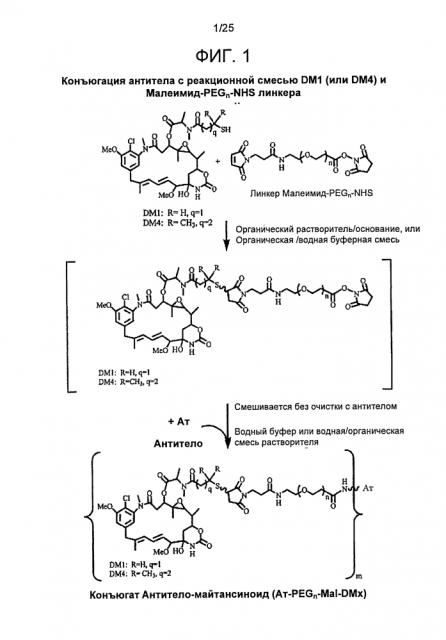
На фигуре 1 показана конъюгация антитела с реакционной смесью майтансиноида DM1 (или DM4) и Малеимида-PEGn-NHS линкера
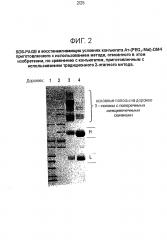
На Фигуре 2 показан SDS-PAGE в восстанавливающих условиях Ат-(PEG4-Mal)-DM4 конъюгатов, приготовленных с использованием способа, описанного в этом изобретении, по сравнению с конъюгатами, приготовленными с использованием традиционного 2-этапного способа. Каждая дорожка с образцом содержала 10 мкг белка; гель был окрашен кумасси голубым (Coomassie blue). Дорожки 1 и 2 содержали маркеры молекулярной массы. Дорожка 3 содержала конъюгат, приготовленный традиционным двухэтапным способом с 6.1 DM4 на Ат. Дорожка 4 содержала конъюгат, приготовленный способом, описанным в этом изобретении, и содержащий 6.2 DM4 на Ат.
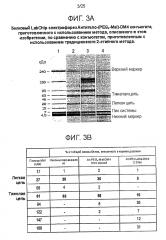
На Фигуре 3 показан белковый LabChip электрофорез конъюгата Ат-(PEG4-Mal)-DM4, приготовленного с использованием способа, описанного в этом изобретении, по сравнению с конъюгатом, приготовленным с использованием традиционного 2-этапного способа. А. Белковый LabChip электрофорез в восстанавливающих условиях (Agilent 2100 Bioanalyzer/Agilent Protein 230 kit) AT-(PEG4-Mal)-DM4 конъюгатов. Дорожка 1: маркер молекулярной массы; дорожка 2: AT-PEG4-Mal-DM4, 6.2 D/Ab, синтезированный с использованием способа, описанного в этом изобретении; лунка 3: AT-PEG4-Mal-DM4, 6.1 D/Ат, синтезированный с использованием 2 этапного способа конюъюгации; дорожка 4: неконъюгированное Ат (0,24 микрограмма общего белка на каждую дорожку). Полосы верхнего маркера, системного пика и нижнего маркера представляют дополнительные маркеры, добавленные из кита. В. Количественный анализ белковых полос из белкового LabChip электрофореза.
На Фигуре 4 показан MS конъюгата AT-(PEG4-Mal)-DM4, приготовленного с использованием способа, описанного в этом изобретении, по сравнению с конъюгатом, приготовленным с использованием традиционного 2-этапного способа. A. MS конъюгата, приготовленного по традиционному двухэтапному способу с 6.1 DM4 на Ат. Вследствие значительной гетерогенности конъюгата MS пики невозможно хорошо различить. В. MS конъюгата, приготовленного по способу, описанному в этом изобретении, и содержащего 6.2 DM4 на Ат. Вследствие гомогенности конъюгата,, MS пики хорошо различимы.
На Фигуре 5 показано связывание конъюгата анти-CanAg антитело-PEG4-Mal-DM1 с 6.7 DM1 на антитело (приготовленного с использованием способа, описанного в этом изобретении) по сравнению со связыванием немодифицированного антитела против CanAg антиген-экспрессирующих COL0205 клеток. Связывание было измерено в единицах флюоресценции.
На Фигуре 6 показана цитотоксичность in vitro конъюгата анти-CanAg Антитело-PEG4-Mal-DM1 с 6.7 DM1 на антитело (приготовленного с использованием способа, описанного в этом изобретении) против CanAg антиген-экспрессирующих COLO205 клеток. Конъюгат был добавлен к COLO205 клеткам и после 5 дней непрерывной инкубации с конъюгатом жизнеспособность клеток была подсчитана с использованием WST-оценки. Контрольный эксперимент для демонстрации специфичности конъюгата был проведен с использованием избытка неконъюгированных анти CanAg антител для блокирования связывания и цитотоксичности конъюгата против раковых клеток-мишеней.
На Фигуре 7 показана конъюгация антитела с реакционной смесью DM1 (или DM4) и Малеимид-сульфо-NHS линкером.
На Фигуре 8 показан SDS-PAGE в восстанавливающих условиях конъюгата Ат-(сульфо-Mal)-DM1, приготовленного с использованием способа, описанного в этом изобретении, по сравнению с конъюгатом, приготовленным с использованием традиционного 2-этапного способа. Каждая дорожка с образцом содержала 10 мкг белка; гель был окрашен кумасси голубым. Дорожка 1 содержала маркер молекулярной массы. Дорожки 3 и 5 содержали конъюгаты, приготовленные по способу, описанному в этом изобретении, и содержащие 3.6 и 5.6 DM1 на Ат, соответственно. Дорожки 2 и 4 содержали конъюгаты, приготовленные по традиционному двухэтапному способу и содержащие 4.0 и 5.7 DM1 на Ат, соответственно.
На Фигуре 9 показан белковый LabChip электрофорез конъюгата Ат-(сульфо-Mal)-DM1, приготовленного с использованием способа, описанного в этом изобретении, по сравнению с конъюгатом, приготовленным с использованием традиционного 2-этапного способа. А. Белковый LabChip электрофорез в восстанавливающих условиях (Agilent 2100 Bioanalyzer/Agilent Protein 230 kit) Ат-(сульфо-Mal)-DM1 конъюгатов. Дорожка 1: маркер молекулярной массы; дорожка 2: некогьюгировавшее Ат; дорожка 3: Ат-сульфо-Mal-DM1, 5.7 D/Ат, синтезированный с использованием 2-этапного способа конъюгации; дорожка 4: Ат-сульфо-Mal-DM1, 5.6 D/Ат, синтезированный с использованием способа, описанного в этом изобретении; 0,22 микрограмма общего белка, помещенного в лунку. Полосы верхнего маркера, системного пика и нижнего маркера представляют дополнительные маркеры, добавленные из набора. В. Количественный анализ белковых полос из белкового LabChip электрофореза.
На Фигуре 10 показано LC-MS сравнение конъюгата Антитело-(Сульфо-Mal)-DM1, приготовленного по способу, описанному в этом изобретении, и конъюгата, приготовленного по традиционному двухэтапному способу конъюгации. A. MS конъюгата с 3.6 DM1/Ab, приготовленного с использованием способа, описанного в этом изобретении, показывает гомогенный конъюгат с 1-6 DM1-несущим дискретным конъюгатными пиками. В. MS конъюгата с 4.0 DM1/Ab, приготовленного по традиционному двухэтапному способу конъюгации. MS для конъюгата, приготовленного по традиционному двухэтапному способу, показывает пики, соответствующие конъюгатам, и конъюгаты с гидролизованными или поперечно-сшитыми линкерами (такие как конъюгат с 2 DM1, плюс один L, 2L и 3L), указывающие на гетерогенный продукт.
На Фигуре 11 показано связывание анти-CanAg антитело-сульфо-Mal-DM1 конъюгата с 5.6 DM4 на антитело (приготовленного с использованием способа, описанного в этом изобретении) по сравнению со связыванием немодифицированного антитела против CanAg антиген-экспрессирующих COLO205 клеток. Связывание было измерено в единицах флюоресценции.
На Фигуре 12 показана цитотоксичность in vitro конъюгата анти-CanAg Антитело-сульфо-Mal-DM1 с 5.6 DM4 на антитело (приготовленного с использованием способа, описанного в этом изобретении) против CanAg антиген-экспрессирующих COLO205 клеток. Конъюгат был добавлен к COLO205 клеткам и после 5 дней непрерывной инкубации с конъюгатом жизнеспособность клеток была оценена с использованием WST-8 оценки. Контрольный эксперимент для демонстрации специфичности конъюгата был проведен с использованием избытка неконъюгированных анти CanAg антител для блокирования связывания и цитотоксичности конъюгата против раковых клеток-мишеней.
На Фигуре 13 показана конъюгация антитела с реакционной смесью DM1 или DM4) и сульфо-NHS SMCC линкер.
На Фигуре 14 показан SDS-PAGE в восстанавливающих условиях at-(SMCC)-DM1 конъюгата, приготовленного с использованием способа, описанного в этом изобретении, по сравнению с конъюгатом, приготовленным с использованием традиционного 2-этапного способа. Каждая дорожка с образцом содержала 10 микрограмм общего белка; гель был окрашен кумасси голубым (Coomassie blue). Дорожка 1 содержит маркер молекулярной массы, дорожка 2 содержит неконъюгированное Ат, дорожка 3 содержит конъюгат, приготовленный по традиционному двухэтапному способу с 3.1 DM1 на Ат и дорожка 4 содержит конъюгат, приготовленный по способу, описанному в этом изобретении с 3.1 DM1 на Ат.
На Фигуре 15 показан белковый LabChip электрофорез конъюгата At-(SMCC)-DM1, приготовленного с использованием способа, описанного в этом изобретении, по сравнению с конъюгатом, приготовленным с использованием традиционного 2-этапного способа. А. Белковый LabChip электрофорез в восстанавливающих условиях (Agilent 2100 Bioanalyzer/Agilent Protein 230 kit) Ат-SMCC-DMl конъюгатов. Дорожка 1: маркер молекулярной массы; дорожка 2: Ат-SMCC-DM1, 3.1 D/Ат, синтезированный с использованием способа, описанного в этом патенте; дорожка 3: неконъюгированное Ат; дорожка 4: Ат-SMCC-DM1, 3.1 D/Ат, синтезированный с использованием 2-этапного способа конъюгации; (0,24 микрограмма общего белка на каждую дорожку). Полосы верхнего маркера, системного пика и нижнего маркера представляют дополнительные маркеры, добавленные из набора. В. Количественный анализ белковых полос из белкового LabChip электрофореза.
На Фигуре 16 показано LC-MS сравнение конъюгата Антитело-(SMCC)-DM1, приготовленного по способу, описанному в этом изобретении, с конъюгатом, приготовленным по традиционному двухэтапному способу конъюгации. A. MS конъюгата, приготовленного по последовательному двухэтапному способу с 3.1 DM1 на Ат. Каждый основной пик конъюгата имеет связанные боковые пики, возникающие из-за присутствия гидролизованных и поперечно-сшитых линкерных фрагментов. В. MS конъюгата, приготовленного по способу, описанному в этом изобретении с 3.1 DM1 на Ат. Вследствие гомогенности конъюгата MS пики были хорошо различимы.
На Фигуре 17 показаны предполагаемые механизмы межцепочечного поперечного сшивания и инактивации малеимида во время конъюгации при традиционном 2-этапном способе.
На Фигуре 18 показан SDS PAGE в невосстанавливающих условиях конъюгата Ат-(сульфо-Mal)-ВМ4, приготовленного с использованием способа, описанного в этом изобретении, и погашение свободного DM4 тиола (после первичной реакции соединения DM4+NHS-сульфо-Mal гетеробифункциональный агент) с использованием 4-малеимидомасляной кислоты перед реакцией конъюгации с антителом. Каждый образец содержал 10 мкг белка; гель был окрашен кумасси голубым (Coomassie blue).. Дорожки 1 и 5 содержали маркеры молекулярной массы. Дорожка 2 содержала одно Ат. Дорожка 3 содержала конъюгат, приготовленный по способу, описанному в этом изобретении без добавления 4-малеимидомасляной кислоты. Дорожка 4 содержала конъюгат, приготовленный по способу, описанному в этом изобретении с добавлением 4-малеимидомасляной кислоты после первичного DM4+NHS-Сульфо-Mal гетеробифункционального реагента (предшествующего этапу конъюгации с антителом).
На Фигуре 19 показано приготовление конъюгата антитела с дисульфидной связью с использованием реакционной смеси DM1 (или DM4) и SPDB линкера.
На Фигуре 20 показано приготовление конъюгата антитело-майтансноид как с дисульфидным, так и с нерасщепляемым PEG4-Mal линкерами путем конъюгации антитела с неочищенной реакционной смесью DM1 (или DM4) и SPDB и NHS-PEG4-Mal линкерами.
На Фигуре 21 показан MS конъюгата антитело-майтансиноид как с дисульфидным, так и с нерасщепляемым PEG4-Mal линкерами (приготовленного путем конъюгации антитела с неочищенной реакционной смесью DM1, или DM4, и SPDB и NHS-PEG4-Mal линкерами).
На Фигуре 22 показана конъюгация антитела с реакционной смесью DM1 (или DM4) и SMCC линкером.
На Фигуре 23 показан MS конъюгата антитело - SMCC-DM1, приготовленного с использованием SMCC по способу, описанному в этом изобретении, содержащего в среднем 3.1 DM1 на антитело.
На Фигуре 24 показано приготовление конъюгата антитела с дисульфидной связью с использованием реакционной смеси DM1 (или DM4) и SSNPB линкера.
На Фигуре 25 показана конъюгация антитела с реакционной смесью DM1 (или DM4) и гетеробифункциональным линкером с алифатической линейной углеродной цепью
Детальное описание изобретения
Некоторые варианты воплощений изобретения детально описаны не будут, их примеры иллюстрируются в прилагаемых структурах и формулах. При том, что изобретение будет описано в сопровождении перечисленных вариантов воплощения это не означает, что изобретение ими ограничивается. Напротив, подразумевается, что изобретение покрывает все альтернативы, модификации и эквиваленты, которые можно включить в пределы притязаний настоящего изобретения, как определено объемом формулы изобретения. Специалист в данной области узнает многие способы и материалы, подобные или равноценные тем, что описаны здесь, которые можно использовать при осуществлении на практике данного изобретения.
Это изобретение описывает новый способ конъюгации тиол-содержащего эффектора (напр., цитотоксичного агента) или репортерной группы (напр., радиоактивной метки) со связывающимся с клеткой агентом (напр., антителом), в котором тиоловая группа, содержащая эффектор или репортер, вначале реагирует с бифункциональным линкерным реагентом в органическом, водном, или смешанным органическом/водном растворителе, после чего следует реакция с неочищенной реакционной смесью со связывающимся с клетками агентом в органическом, водном, или смешанным органическим/водном растворителях.
Сокращения
Сокращения, использованные в описаниях Схем и Примеров, следующие:
С = Эффектор или репортерная группа (напр., цитотоксичный агнет или радиоактивная метка)
L = Линкер (напр., расщепляемый или нерасщепляемый линкер)
Х = амин-реактивная группа (например, N-гидроксисукцимидный эфир (NHS сложный эфир), сульфо-NHS эфир, p-нитрофенола эфир, тетрафлюоросульфонат фенил эфир, 1-гидрокси-2-нитро-бензол-4-сульфокислоты эфир)
Y = Малеимид, или галоацетамид (йодацетамид, бромацетамид)
Yb - химически активная смешанная дисульфидная группа (напр., 2-пиридилдитио, 4-пиридилдитио, 2-нитро-пиридилдитио, 5-нитро-пиридилдитио, 2-карбокси-5-нитро-пиридилдитио)
X' = амидное соединение
Y' = тиоэфирное (R-S-R1) или селеноэфирное (R-Se-R1) соединение
Yb' = дисульфидное (R-S-S-R1) соединение
В одном варианте воплощения настоящего изобретения описан способ приготовления связанного тиэфирным линкером конъюгата связывающегося с клеткой агента с эффекторной или репортерной молекулой, способ включает в себя следующие этапы: а) контакт с гетеробифункциональным линкером формулы X-L-Y с тиол-содержащей эффекторной или репортерной молекулой С (например, а майтансиноид или радионуклид) в водном растворителе, органическом растворителе или смешанных органических/водных реакционных смесях, в результате чего получается промежуточный продукт с формулой X-L-Y'-C; b) смешивание реакционной смеси без очистки со связывающимся с клетками агентом, таким как антитело (Ат) для образования конъюгата с формулой AT-(X'-L-Y'-C)m, где L - замещенная или незамещенная линейная, разветвленная или цикличная алкильная, алкенильная, или алкинильная группа, несущая 1-10 атомов углерода, простая или замещенная арильная единица (заместитель выбирается из алкил, алкокси, галоген, нитро, флюоро, карбокси, сульфонат, фосфат, амино, карбонил, пиперидино) или полиэтиленгликоль содержащая единица (предпочтительно 1-500 PEG спейсер, или более предпочтительно 1-24 PEG спейсер, или еще более предпочтительно 2-8 PEG спейсер); Х и Y - амин- или тиол-реактивная группа, такая как N-гидроксисукцинимидный эфир и малеимид или галоацетамид; Ат - антитело; m - число от 1 до 20; X' - модифицированный Х сайт (напр., амидное соединение) реакции с антителом; Y' - модифицированный Y сайт (напр., тиоэфирное соединение) реакции с, например, цитотоксичным агентом или радиоактивной меткой эффекторной или репортерной группы; и с) очистка конъюгата путем тангенциальной поточной фильтрации, диализа или хроматографии (напр., гелевая фильтрация, ионообменная хроматография, хроматография с гидрофобным взаимодействием) или комбинация из этого. Предпочтительно, Y - тиол-реактивная группа, выбранная из малеимида или галоацетамида. Предпочтительно, L - линейная или разветвленная алкильная группа с 1-6 атомами углерода или 2-8 PEG спейсером. Предпочтительно, С - цитотоксичный агент, выбранный из майтансиноида, а СС-1065 аналога, таксана, а DHK-связывающего агента, и более предпочтительно это майтансиноид.
Эта реакционная последовательность представлена в формулах 1 и 2:
не включает никакой очистки промежуточного продукта X-L-Y'-C, и таким образом дает преимущество прямого смешивания его с антителом (неочищенный промежуточный продукт добавляется к антителу или антитело добавляется к неочищенному промежуточному продукту), тем самым делая способ предпочтительным для конъюгации, поскольку он исключает необходимость трудоемкого этапа очистки. Важно, что этот способ дает на выходе гомогенный конъюгат без поперечных сшивок между цепочками белка или инактивированных малеимидных остатков, в противоположность этому при традиционной двухэтапной реакции и последующей очистке наблюдаются поперечные сшивки между цепочками белка и инактивированные малеимидные остатки.
Реакция 1 может быть осуществлена при высоких концентрациях гетерофункционального линкера, X-L-Y, и эффекторная или репортерная группа С в водном растворителе, органическом растворителе или органических/водных реакционных смесях приводит к ускорению реакции по сравнению с более низкими концентрациями в водных растворителях для конъюгатов, приготовленных в ходе традиционной двухэтапной реакции и соответствующей очистки.
Промежуточный продукт X-L-Y'-C, образующийся в реакции 1, можно хранить неочищенном в замороженном виде, при низких температурах в водном растворителе с подходящим низким рН (напр., рН ~4-6), в органических растворителях, или в смешанных органических/водных реакционных смесях, или в лиофилизированном виде, в течение долгого периода, и можно позднее смешивать с раствором антитела для заключительной реакции конъюгации при более высоком уровне рН около 4-9, что добавляет преимущества такой последовательности реакций. Промежуточный продукт можно разводить, как указано, органическим растворителем или водным буфером, или смесью органического растворителя и водного буфере перед тем, как смешивать со связывающимся с клеткой агентом. Термин "около", используемый здесь в связи с численным значением, следует понимать как относящийся ко всем таким значениям, включая все числовые значения и незначительные их отклонения. Реакция промежуточного продукта X-L-Y'-C с антителом должна проводиться при значениях рН в промежутке от около 4 до около рН 9, предпочтительно при рН в промежутке от около 5 до 8,7, более предпочтительно при рН в промежутке от около 6,5 до около 8,5, при таких значениях рН как 6.5, 6.6, 6.7, 6.8, 6.9, 7.0, 7.1, 7.2, 7.3, 7.4, 7.5, 7.6, 7.7, 7.8, 7.9, 8.0, 8.1, 8.2, 8.3, 8.4, и 8.5, в таком диапозоне значений рН или незначительных от них отклонениях. Буферы, используемые для реакции антитела с промежуточным продуктом X-L-Y'-C при предпочтительных значениях рН от около 6.5 до 8.5 являются такими буферами с величинами pKa входящими в этот промежуток значений рН, как фосфатный и HEPES буфер. Эти предпочтительные буферы не должны обладать первичными или вторичными амино группами, или другими химически активными группами, которые могут реагировать с линкером Х (таким как N-гидроксисукцимидный эфир).
Стехиометрический или слабый избыток С по сравнению с гетеробифункциональным линкером X-L-Y используется в первой реакции для гарантии того, что вся Y группа (такая как малеимид) прореагировала, перед тем как неочищенная сместь добавляется к антителу. Может быть сделана необязательная дополнительная обработка погашающим реагентом (таким как 4-малеимидомасляная кислота, 3-малеимидопропионовая кислота, или N-этилмалеимид, или йодацетамид, или йодацетамидопропионовая кислота) для гарантии того, что весь непрореагировавший С инактивирован перед тем, как сделают смесь с антителом, чтобы минимизировать всю нежелательную тиол-дисульфидную внутрицепочечную реакцию с нативными дисульфидными группами антитела. После погашения полярно заряженными тиол-блокирующими реагентами (такими как 4-малеимидомасляная кислота или 3-малеимидопропионовая кислота), избыточный непрореагировавший С превращается в полярно заряженный аддукт, который легко можно отделить от ковалентно связанного конъюгата. Необязательно, конечная реакционная смесь 2, до очистки, обрабатывается нуклеофилами, такими как аминогруппа, содержащая нуклеофилы (напр., лизин, таурин, гидроксиламин) для блокирования всего непрореагировавшего линкера (X-L-Y'-C).
Альтернативный способ для реакции антитела с неочищенной первичной реакционной смесью майтансиноидов (DMx) и гетеробифункционального линкера включает смешивание первичной реакционной смеси DMx и гетеробифункционального линкера (перед завершением DMx-линкерной реакции) с антителом при низком рН (рН ~5), после чего следует добавление буфера или основания для увеличения рН до около 6.5-8.5 для реакции конъюгации.
Этот новый способ применяется для приготовления конъюгата антитела с цитотоксичным препаратом майтансиноид. Конъюгаты антитело-майтансиноид, приготовленные с использованием этого способа, кратко описанного в реакционной последовательности 1-2, неожиданно оказались значительно более гомогенными по сравнению с конъюгатами, приготовленными по традиционной двухэтапной реакции и соответствующей очистке, основываясь на характеристике конъюгатов на SDS-PAGE в восстанавливающих условиях, белковом LabChip электрофорезе, и масс-спектрометрии. Способ конъюгации, описанный в этом изобретении, который включает последовательность реакций 1-2, также не требует никакого промежуточного этапа очистки и, следовательно, значительно более удобен, чем традиционный двухэтапный способ.
Во втором варианте воплощения изобретения, способ приготовления соединенного тиэфирной связью конъюгата связывающегося с клеткой агента с эффекторной или репортерной молекулой описывается, включая следующие этапы: а) контакт гомобифункционального линкера с формулой Y-L-Y с тиол- или амин-содержащей эффекторной или репортерной группой С (такой как цитотоксичный агент) в водном растворителе, органическом растворителе или смешанных водных/органических реакционных смесях для получения Y-L-Y'-C, b) смешивание реакционной смеси без очистки с антителом в водном растворе или водной/органической смеси для получения конъюгата с формулой AT-(Y'-L-Y'-C)m, где, L определено выше; Y - тиол- или амин-реактивная группа, такая как малеимид или галоцетамид, или N-гидроксисукцимид или сульфо N-гидроксисукцимид; Ат - антитело; m - число от 1 до 20; Y' -модифицированный Y сайт (такой как тиоэфирный или амидный линкер) для реакции с антителом или модифицированным Y-сайтом (таким как тиоэфирная или амидная связь) для реакции с цитотоксичным агентом или эфекторной или репортерной группой и с) очистка конъюгата при помощи тангенциальной проточной фильтрации, диализа или хроматографии (гелевая фильтрация, ионообменная хроматография, хроматография гидрофобных взаимодействий) или их комбинация. Реакционная последовательность представлена в формулах 3 и 4:
не включает никакой очистки промежуточного продукта Y-L-Y'-C, и следовательно является выгодным способом конъюгации.
В третьем варианте воплощения способ приготовления соединенного тиэфирной связью конъюгата связывающегося с клеткой агента с эффекторной или репортерной молекулой описывается, включая следующие этапы: а) контакт гетеробифункционального линкера с формулой X-L-Yb с эффекторной или репортерной группой С (такой как цитотоксичный агент) в водном растворителе, органическом растворителе или смешанных водных/органических реакционных смесях для получения промежуточного продукта X-L-Yb'-C; б) смешивание реакционной смеси без очистки с антителом в водном растворе или водной/органической смеси для получения конъюгата с формулой AT-(X'-L-Yb'-C)m, где L определено выше; Yb - химически активный дисульфид, такой как пиридилдисульфид или нитропиридил дисульфид, Х - амино-реактивная группа, такая как N-гидроксисукцинимидный эфир или сульфо-N-гидроксисукцинимидный эфир; Ат - антитело; m - число от 1 до 20; Yb - модифицированный Y сайт (такой как амидный линкер) для реакции с антителом; Yb - модифицированный Yb-сайт (дисульфидный) для реакции с цитотоксичным агентом или эффекторной или репортерной группой; и в) очистка конъюгата при помощи тангенциальной проточной фильтрации, диализа или хроматографии (гелевая фильтрация, ионообменная хроматография, хроматография гидрофобных взаимодействий) или их комбинация. Реакционная последовательность представлена в формулах 5 и 6:
В четвертом варианте воплощения способ приготовления конъюгатов антитела с эффекторной или репортерной группами с двумя типами линкеров - нерасщепляемым (тиоэфирный линкер) и расщепляемым (дисульфидный линкер) описывается, включая следующие этапы: а) контакт X-L-Y и X-L-Yb линкеров с цитотоксичным агентом С для получения промежуточных соединений с формулой X-L-Y'-C и X-L-Yb'-C, б) смешивание реакционных смесей без очистки с антителом или последовательно, или одновременно, как показано в реакционной формуле 7-9:
с получением конъюгата Ат-(X'-L-Y'-C)m(X'-L-Yb'-C)m-, где определения X, L, Y', С, Yb', и m даны выше, и m' - число от 1 до 20; и в) очистка конъюгата производится путем тангенциальной поточной фильтрации, диализа или хроматографии (напр., гелевая фильтрация, ионообменная хроматография, хроматография с гидрофобным взаимодействием) или их комбинации. Эти два линкерных эффекторных промежуточных продукта (X-L-Y'-C и X-L-Yb'-C) смешиваются без очистки с антителом в различной последовательности (вначале X-L-Y'-C, затем X-L-Yb'-C, или вначале X-L-Yb'-C, затем X-L-Y'-C, или одновременно) в различных пропорциях.
Реакции 1, 3, 5 и 7-8 можно проводить при высоких концентрациях бифункционального линкера (X-L-Y, X-L-Yb или Y-L-Y) и эффекторной или репортерной группы С в водном растворителе, органическом растворителе или органических/водных реакционных смесях, что приводит к ускорению реакции по сравнению с более низкими концентрациями в водных растворителях для конъюгата, приготовленного в ходе традиционной двухэтапной реакции и соответствующей очистки, где растворимость реагентов ограничена.
Промежуточные продукты X-L-Y'-C, или Y-L-Y'-C, или X-L-Yb'-C, получаемые в реакциях 1, 3, 5, и 7-8 можно хранить в неочищенном замороженном виде, при низких температурах в водном растворителе с подходящим рН, в органических растворителях, или в смешанных органических/водных реакционных смесях, или в лиофилизированном виде, в течение долгого периода, и можно позднее смешивать с раствором антитела для заключительной реакции конъюгации, что добавляет преимущества такой последовательности реакций.
Стехиометрический или слабый избыток С по сравнению с гетеробифункциональным линкером X-L-Y или Y-L-Y, или X-L-Yb используется в первой реакции для гарантии того, что вся Y группа (такая как малеимид) прореагировала, перед тем как неочищенная сместь добавляется к антителу. Может быть сделана необязательная дополнительная обработка блокирующим реагентом (таким как 4-малеимидомасляная кислота или 3-малеимидопропионовая кислота, или N-этилмалеимид, или йодацетамид, или йодуксусная кислота) для гарантии того, что весь непрореагировавшая группа (такая как тиол) в С инактивирована перед тем, как сделают смесь с антителом, чтобы минимизировать всю нежелательную тиол-дисульфидную реакцию взаимообмена с нативными дисульфидными группами антитела. Погашение избыточного С с использованием полярно заряженных тиол-блокирующих реагентов, после первичной реакции С с бифункциональным линкером, превращает избыточный С в о