Конъюгаты белков свертывания крови
Иллюстрации
Показать всеГруппа изобретений относится к материалам и способам конъюгации полисиаловой кислоты (ПСК), содержащей активную аминоокси-группу, с окисленными углеводными фрагментами белка свертывания крови, включающей контактирование окисленного углеводного фрагмента с активированной ПСК в условиях, позволяющих конъюгацию. Конъюгация проводится путем инкубирования в буфере, содержащем окислитель, выбранный из группы, состоящей из периодата натрия (NaIO4), тетраацетата свинца (Pb(ОАс)4) и перрутената калия (KRuO4). Полученные вышеуказанным способом конъюгаты обладают высокой активностью. 4 н. и 12 з.п. ф-лы, 8 ил., 3 табл., 28 пр.
Реферат
Данная заявка претендует на приоритет в соответствии с предварительной заявкой U.S № 61/347136, поданной 21 мая 2010 и предварительной заявкой U.S. № 61/228828, поданной 27 июля 2009, которые включены в нее во всей полноте по ссылке.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к материалам и способам для конъюгирования водорастворимых полимеров с белками свертывания крови.
УРОВЕНЬ ТЕХНИКИ
Терапевтические полипептиды, в частности, белки, отвечающие за систему свертывания крови, включая фактор IX (фIX), фактор VIII (фVIII), фактор VIIa (фVIIa), фактор Фон Виллебранда (ФВф), фактор FV (фV), фактор X (фХ), фактор XI (фХI), фактор XII (фХII), тромбин (фII), протеин C, протеин S, tPA, PAI-1, тканевой фактор (Тф) и протеазу ADAMTS 13, быстро разрушаются протеолитическими ферментами и нейтрализуются антителами. Это способствует уменьшению их периода полужизни и времени циркуляции, что ограничивает их терапевтическую эффективность. Для достижения и поддержания желаемых терапевтических и профилактических эффектов этих белков системы свертывания требуется частое их введение в относительно высоких дозах. Как следствие, сложно достигнуть адекватного регулирования дозы, а необходимость частых внутривенных инъекций накладывает ограничения на образ жизни пациента.
Пегилирование полипептидных препаратов защищает их при циркуляции и улучшает их фармакодинамические и фармакокинетические профили (Harris and Chess, Nat Rev Drug Discov. 2003;2:214-21). Во время процесса пегилирования происходит присоединение повторяющихся единиц этиленгликоля (полиэтиленгликоля - ПЭГ) к полипептидному препарату. Молекулы ПЭГ обладают большим гидродинамическим объемом (в 5-10 раз превышающим размер глобулярных белков), хорошо растворимы в воде и гидратированы, нетоксичны, неиммуногенны и быстро выводятся из организма. Пегилирование молекул может способствовать устойчивости препаратов к ферментативному расщеплению, увеличивать период полужизни in vivo, уменьшать частоту введения доз, понижать иммуногенность, повышать физическую и термическую стабильность, растворимость, стабильность в жидком виде и уменьшать агрегацию. Первые пегилированные препараты были утверждены Управлением США по надзору за качеством пищевых продуктов и лекарственных средств (FDA) в начале 1990-х гг. С тех пор FDA утвердило ряд пегилированных препаратов для приема внутрь, парентерального введения и местного применения.
Полисиаловая кислота (ПСК), также называемая коломиновой кислотой (КК), является природным полисахаридом. Это гомополимер N-ацетилнейраминовой кислоты с α(2→8)-кетозидными связями, содержащий вицинальные диольные группы на своем невосстанавливающем конце. Она несет отрицательный заряд и встречается в организме человека. Она может быть легко получена с помощью бактерий в больших количествах и с предопределенными физическими характеристиками (Патент US No. 5846951). Поскольку бактериальная ПСК химически и иммунологически идентична человеческой, бактериальная ПСК неиммуногенна, даже при соединении с протеинами. В отличие от некоторых полимеров, ПСК подвергается биоразложению. При ковалентном соединении коломиновой кислоты с каталазой и аспарагиназой было выявлено увеличение стабильности этих ферментов в присутствии протеолитических энзимов плазмы крови. Сравнительные исследования in vivo с полисиалированной и немодифицированной аспарагиназой показали, что полисиалирование увеличивало время полужизни фермента (Fernandes and Gregoriadis, Int Biochimica Biophysica Acta 1341:26-34, 1997).
Приготовление конъюгатов путем ковалентного связывания водорастворимого полимера с терапевтическим протеином может осуществляться различными химическими способами. К примеру, связывание ПЭГ-производных с белками описано в работе Roberts et al. (Adv Drug Deliv Rev 2002;54:459-76). Один подход к связыванию водорастворимых полимеров с терапевтическими протеинами заключается в конъюгации полимеров с углеводными фрагментами молекул протеинов. Вицинальные гидроксильные (OH) углеводные группы протеинов могут быть легко окислены периодатом натрия (NaIO4) с образованием активных альдегидных групп (Rothfus et Smith, J Biol Chem 1963; 238:1402-10; van Lenten et Ashwell, J Biol Chem 1971;246:1889-94). Потом полимер можно соединить с альдегидными группами, используя реагенты, содержащие, например, активные гидразидные группы (Wilchek M and Bayer EA, Methods Enzymol 1987;138:429-42). Более современная технология заключается в использовании реагентов, содержащих аминоокси-группы, которые реагируют с альдегидными, формируя оксимные связи (WO 96/40662, WO 2008/025856).
Дополнительные примеры конъюгации водорастворимого полимера с терапевтическим протеином представлены в WO 06/071801, в котором описывается окисление углеводных фрагментов фактора Фон Виллебранда и последующее связывание с ПЭГ гидразидным способом; публикации US No. 2009/0076237, в которой описывается окисление рфVIII и последующее связывание с ПЭГ и иными водорастворимыми полимерами (например, ПСК, ГЭК (HES), декстран) гидразидным способом; WO 2008/025856, в котором описывается окисление различных факторов свертывания, в том числе, рфIX, фVIII и фVIIa и их с, например, ПЭГ, способом аминоокси-групп с формированием оксимных связей; и в патенте US No. 5621039, в котором описывается окисление фIX и последующее связывание с ПЭГ гидразидным способом.
Недавно был предложен улучшенный способ, заключающийся в мягком периодатном окислении сиаловых кислот с формированием альдегидных групп и последующем их взаимодействии с реагентом, содержащим аминоокси-группы, в присутствии каталитических количеств анилина (Dirksen A et Dawson PE, Bioconjugate Chem. 2008;19,2543-8; и Zeng Y et al., Nature Methods 2009;6:207-9). Катализ анилином значительно ускоряет образование оксимных связей, что позволяет использовать очень низкие концентрации реагента.
Несмотря на то, что способы конъюгирования водорастворимых полимеров с терапевтическими протеинами известны, остается необходимость в разработке материалов и способов для конъюгирования водорастворимых полимеров с протеинами, которые улучшали бы фармакокинетические и фармакодинамические свойства белка с минимизацией затрат на различные реагенты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает материалы и способы для конъюгации полимеров и белков, что улучшает фармакодинамические и фармакокинетические свойства белков, минимизирующие затраты, связанные с различными реагентами.
В одном воплощении изобретения, способ конъюгирования водорастворимого полимера с окисленным углеводным фрагментом белка свертывания крови включает контактирование окисленного углеводного фрагмента с активированным водорастворимым полимером в условиях, позволяющих конъюгацию; белок свертывания крови выбирается из группы, состоящей из фактора IX (фIX), фактора VIII (фVIII), фактора VIIa (фVIIa), фактора Фон Виллебранда (ФВф), фактора FV (фV), фактора X (фХ), фактора XI (фХI), фактора XII (фХII), тромбина (фII), протеина C, протеина S, tPA, PAI-1, тканевого фактора (Тф) и протеазы ADAMTS 13 или их биологически активных фрагментов, производных или вариантов; водорастворимый полимер, содержащий активную аминоокси-группу, выбирается из группы, состоящей из полиэтиленгликоля (ПЭГ), разветвленного ПЭГ, полисиаловой кислоты (ПСК), углеводов, полисахаридов, пуллулана, хитозана, гиалуроновой кислоты, хондроитинсульфата, дерматансульфата, крахмала, декстрана, карбоксиметил-декстрана, полиалкиленоксида (ПАО), полиалкиленгликоля (ПАГ), полипропиленгликоля (ППГ), полиоксазолина, полиакрилоилморфолина, поливинилового спирта (ПВС), поликарбоксилата, поливинилпирролидона, полифосфазена, полиоксазолина, сополимера полиэтилена с малеиновым ангидридом, сополимера полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформаля) (PHF), 2-метакрилоилокси-2'-этилтриметиламмонийфосфата (MPC); а углеводный фрагмент окисляется путем инкубирования в буфере, содержащем окислитель, выбранный из группы, состоящей из периодата натрия (NaIO4), тетраацетата свинца (Pb(OAc)4) и перрутената калия (KRuO4); причем оксимная связь формируется между окисленным углеводным фрагментом и активной аминоокси-группой водорастворимого полимера.
В еще одном воплощении изобретения, водорастворимый полимер согласно вышеупомянутому способу представляет собой ПСК. В связанном воплощении ПСК содержит 5-500 или 10-300 единиц сиаловой кислоты. В еще одном воплощении, белок свертывания крови согласно вышеупомянутому способу представляет собой фIX. В ином воплощении, белок свертывания крови согласно вышеупомянутому способу представляет собой фVIIa. В другом воплощении, белок свертывания крови согласно вышеупомянутому способу представляет собой фVIII. В еще одном воплощении, вышеупомянутый способ проводится с использованием в качестве окислителя периодата натрия (NaIO4). В ином воплощении, окисленные углеводные фрагменты белка свертывания крови согласно вышеупомянутому способу расположены на участке активационного пептида белка свертывания крови.
В другом воплощении изобретения, вышеупомянутый способ осуществляется с ПСК, приготовленной путем взаимодействия активированного аминоокси-сшивающего агента с окисленной ПСК;
причем аминоокси-сшивающий агент выбран из группы, состоящей из:
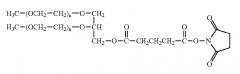
сшивающего агента 3-оксопентан-1,5-диоксиамина, имеющего следующую формулу
и
сшивающего агента 3,6,9-триоксоундекан-1,11-диоксиамина, имеющего следующую формулу
,
а ПСК окислена путем инкубирования с окислителем, чтобы образовать терминальные альдегидные группы на невосстанавливающем конце ПСК. В ином воплощении, вышеупомянутый способ выполняется с активированным аминоокси-сшивающим агентом, содержащим 1-50 этиленгликолевых единиц.
В ином воплощении, вышеуказанный способ выполняется с использованием в качестве аминоокси-сшивающего агента 3-оксопентан-1,5-диоксиамина. В связанном воплощении окислителем выступает NaIO4.
В еще одном воплощении изобретения, вышеупомянутый способ выполняется путем контактирования окисленных углеводных фрагментов и активированных водорастворимых полимеров в буфере, содержащем нуклеофильный катализатор, выбранный из группы, состоящей из анилина и производных анилина.
В ином воплощении изобретения, вышеупомянутый способ содержит этап восстановления оксимной связи конъюгированного белка свертывания крови, выполняемый путем инкубирования конъюгированного белка свертывания крови в буфере, содержащем восстановитель, выбранный из группы, состоящей из цианоборогидрида натрия (NaCNBH3) и аскорбиновой кислоты (витамин C). В связанном воплощении, в качестве восстановителя используется цианоборогидрид натрия (NaCNBH3).
В другом воплощении изобретения, используется модифицированный белок свертывания крови, полученный по указанному выше способу.
В еще одном воплощении изобретения, используется модифицированный фIX, содержащий молекулу фIX или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПСК, соединенную с молекулой фIX, причем указанная аминоокси-ПСК соединена с фIX через один и более углеводных фрагментов.
В другом воплощении изобретения, используется модифицированный фVIIa, содержащий молекулу фVIIa или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПСК, соединенную с молекулой фVIIa, причем указанная аминоокси-ПСК соединена с фVIIa через один и более углеводных фрагментов.
В еще одном воплощении изобретения, используется модифицированный фVIII, содержащий молекулу фVIII или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПСК, соединенную с молекулой фVIII, причем указанная аминоокси-ПСК соединена с фVIII через один и более углеводных фрагментов.
В еще одном воплощении изобретения, используется модифицированный фIX, содержащий молекулу фIX или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПЭГ, соединенную с молекулой фIX, причем указанный аминоокси-ПЭГ соединен с фIX через один и более углеводных фрагментов.
В другом воплощении изобретения, используется модифицированный фVIIa, содержащий молекулу фVIIa или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПЭГ, соединенную с молекулой фVIIa, причем указанный аминоокси-ПЭГ соединен с фVIIa через один и более углеводных фрагментов.
В еще одном воплощении изобретения, используется модифицированный фVIII, содержащий молекулу фVIII или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПЭГ, соединенную с молекулой фVIII, причем указанный аминоокси-ПЭГ соединен с фVIII через один и более углеводных фрагментов.
В ином воплощении, водорастворимый полимер содержит аминоокси-сшивающий агент; указанный водорастворимый полимер выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), разветвленного ПЭГ, полисиаловой кислоты (ПСК), углеводов, полисахаридов, пуллулана, хитозана, гиалуроновой кислоты, хондроитинсульфата, дерматансульфата, крахмала, декстрана, карбоксиметил-декстрана, полиалкиленоксида (ПАО), полиалкиленгликоля (ПАГ), полипропиленгликоля (ППГ), полиоксазолина, полиакрилоилморфолина, поливинилового спирта (ПВС), поликарбоксилата, поливинилпирролидона, полифосфазена, полиоксазолина, сополимера полиэтилена с малеиновым ангидридом, сополимера полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформаля) (PHF), 2-метакрилоилокси-2'-этилтриметиламмонийфосфата (MPC); а указанный аминоокси-сшивающий агент выбран из группы, состоящей из: сшивающего агента 3-оксопентан-1,5-диоксиамина, имеющего формулу
и
сшивающего агента 3,6,9-триоксоундекан-1,11-диоксиамина, имеющего формулу
В ином воплощении, указанный способ выполняется таким образом, что аминоокси-сшивающий агент содержит 1-50 этиленгликолевых единиц.
ФИГУРЫ
На фигуре 1 показана первичная структура фактора свертывания крови IX.
На фигуре 2 показано связывание окисленного рфIX с аминоокси-ПСК.
На фигуре 3 показан синтез водорастворимых диаминоокси-сшивающих агентов 3-оксопентан-1,5-диоксиамина и 3,6,9-триоксоундекан-1,11-диоксиамина.
На фигуре 4 показано приготовление аминоокси-ПСК.
На фигуре 5 представлено аналитическое исследование конъюгата ПСК-рфIX способом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) с окрашиванием красителем Кумасси.
На фигуре 6 представлено аналитическое исследование конъюгата ПСК-рфIX с детектированием анти-фIX и анти-ПСК антителами.
На фигуре 7 показана активность нативного рфIX и конъюгата ПСК-рфIX в зависимости от времени после инфузии.
На фигуре 8 показаны уровни ПСК-рфVIII и Advate в зависимости от времени после инфузии.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Фармакологические и иммунологические свойства терапевтических протеинов могут быть улучшены путем химического модифицирования и конъюгации с полимерными соединениями, например, полиэтиленгликолем (ПЭГ), разветвленный ПЭГ, полисиаловая кислота (ПСК), углеводами, полисахаридами, пуллуланом, хитозаном, гиалуроновой кислотой, хондроитинсульфатом, дерматансульфатом, крахмалом, декстраном, карбоксиметил-декстраном, полиалкиленоксидом (ПАО), полиалкиленгликолем (ПАГ), полипропиленгликолем (ППГ), полиоксазолином, полиакрилоилморфолином, поливиниловым спиртом (ПВС), поликарбоксилатом, поливинилпирролидоном, полифосфазеном, полиоксазолином, сополимером полиэтилена с малеиновым ангидридом, сополимером полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформалем) (PHF), 2-метакрилоилокси-2'-этилтриметиламмонийфосфатом (MPC). Свойства получаемых конъюгатов обычно сильно зависят от структуры и размера полимера. Как правило, в данной отрасли предпочтительно использовать полимеры определенного размера или имеющие узкий интервал размеров. Синтетические полимеры типа ПЭГ легко могут быть синтезированы в узком интервале размеров, в то время как ПСК может быть подвергнута очистке с получением полимерных молекул в узком интервале размеров. Также, реактивы для пегилирования с конкретными полимерными цепями и узким интервалом распределения размеров, присутствуют на рынке и имеются в продаже по доступным ценам.
Добавление растворимого полимера, например, полисиалирование - подход к улучшению свойств белков системы свертывания крови, например, фIX, а также иных белков свертывания (например, ФВф, фVIIa (см., к примеру, US 2008/0221032A1, включенный в настоящую заявку посредством ссылки) и фVIII).
БЕЛКИ СИСТЕМЫ СВЕРТЫВАНИЯ КРОВИ
Как указывалось здесь, изобретение охватывает белки свертывания крови, включая фактор IX (фIX), фактор VIII (фVIII), фактор VIIa (фVIIa), фактор Фон Виллебранда (ФВф), фактор FV (фV), фактор X (фХ), фактор XI (фХI), фактор XII (фХII), тромбин (фII), протеин C, протеин S, tPA, PAI-1, тканевой фактор (Тф) и протеазу ADAMTS 13, но не ограничиваясь ими. Термин «белок свертывания крови», используемый в этом документе, относится к любому белку из фактора IX (фIX), фактора VIII (фVIII), фактора VIIa (фVIIa), фактора Фон Виллебранда (ФВф), фактора FV (фV), фактора X (фХ), фактора XI (фХI), фактора XII (фХII), тромбина (фII), протеина C, протеина S, tPA, PAI-1, тканевого фактора (Тф) и протеазы ADAMTS 13, проявляющему биологическую активность, аналогичную активности нативного белка свертывания крови.
Каскад свертывания крови разделен на три отдельных сегмента: внутренний, внешний, а также общий пути (Schenone et al., Curr Opin Hematol. 2004;11:272-7). Каскад включает ряд ферментов (проферментов) сериновых протеаз и белковые кофакторы. При необходимости неактивный профермент-предшественник превращается в активную форму, которая, в свою очередь, преобразует следующий фермент каскада.
Внутренний путь включает в себя факторы свертывания VIII, IX, X, XI и XII. Инициация внутреннего пути происходит тогда, когда прекалликреин, низкомолекулярный кининоген, фактор XI (фХI) и фактор XII (фХII) вступают в контакт с отрицательно заряженной поверхностью. Также требуются кальций и фосфолипиды, секретируемые из тромбоцитов.
Внешний путь запускается при повреждении внутренних стенок кровеносных сосудов. Обнажается мембранный гликопротеин тканевой фактор, который связывается с циркулирующим фактором VII (фVII) и с малыми присутствующими количествами его активированной формы фVIIa. Это связывание приводит к полной конверсии фVII в фVIIa и, последовательно, в присутствии кальция и фосфолипидов, конверсию фактора IX (фIX) в фактор IXa (фIXa) и фактора X (фХ) в фактор Xa (фХа). Ассоциирование фVIIa с тканевым фактором усиливает протеолитическую активность путем перемещения сайтов связывания фVII с субстратами (фIX и фХ) в более доступное положение и путем индукции изменения конформации, усиливающей ферментативную активность фVIIa.
Активация фХ - общая точка обоих путей. Вместе с фосфолипидами и кальцием факторы Va (фVa) и Xa преобразуют протромбин в тромбин (комплекс протромбиназы), который затем разрезает фибриноген с образованием мономеров фибрина. Мономеры полимеризуются, формируя волокна из фибрина. Фактор XIIIa (фХIIIa) ковалентно связывает эти волокна друг с другом, формируя жесткую сеть.
Превращение фVII в фVIIa также катализируется рядом протеаз, включая тромбин, фIXa, фХа, фактор XIa (фХIa), фактор XIIa (фХIIa). Для ингибирования ранних стадий каскада ингибитор пути тканевого фактора воздействует на комплекс фVIIa/тканевой фактор/фХа.
A. Полипептиды
Одна из особенностей настоящего изобретения - то, что в качестве исходного материала используется белок системы свертывания крови, который может быть получен из человеческой плазмы, либо произведен способами рекомбинантной инженерии, согласно патентам US No. 4757006; US No. 5733873; US No. 5198349; US No. 5250421; US No. 5919766; а также EP 306968. Как здесь описано, термин белок системы свертывания крови относится к любой молекуле свертывания крови, проявляющей активность, связанную с активностью нативного белка свертывания крови. В одном из воплощений изобретения, молекула белка системы свертывания крови представляет собой белок свертывания крови полной длины.
Подразумеваемые молекулы белков свертывания крови включают протеины, имеющие полную длину, предшественников протеинов полной длины, биологически активные субъединицы или фрагменты протеинов полной длины, а также биологически активные производные или варианты какой-либо из этих форм белков свертывания крови. Итак, к белкам свертывания крови относят те, которые (1) имеют аминокислотную последовательность, более чем на примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 91%, примерно 92%, примерно 93%, примерно 94%, примерно 95%, примерно 96%, примерно 97%, примерно 98% или примерно 99% идентичную с участком из, по меньшей мере, около 25, около 50, около 100, около 200, около 300, около 400 и более аминокислот полипептида, закодированного эталонной нуклеиновой кислотой или приведенного здесь; и/или (2) специфически связываются с антителами, например, поликлональными или моноклональными антителами, сформированными против иммуногена, содержащего эталонную аминокислотную кислотную последовательность, описанную здесь, иммуногенный фрагмент или консервативно модифицированный вариант.
Согласно данному изобретению, термин «рекомбинантный белок свертывания крови» относится к любому белку свертывания крови, полученному по технологии рекомбинантной ДНК. В некоторых воплощениях термин включает описанные здесь белки.
Термин «эндогенный белок свертывания крови», используемый в этом документе, включает белки свертывания крови, полученные от млекопитающих, предназначенные для терапии. В это понятие также включаются белки свертывания крови, транскрибируемые на трансгенной или иной чужеродной ДНК, присутствующей в указанном млекопитающем. Термин «экзогенный белок свертывания крови», использованный здесь, включает белки свертывания крови, полученные не от млекопитающих, предназначенные для терапии.
Термины «полученный из плазмы белок свертывания крови» и «плазматический», используемые в этом документе, включают все формы белков, обнаруживаемые в крови млекопитающих, которые способны участвовать в каскаде коагуляции.
Термины «биологически активное производное» или «биологически активный вариант», используемые в этом документе, включают любые производные или варианты молекулы, имеющие аналогичные с ней функциональные или биологические свойства, например, связывающие свойства, либо аналогичную с ней структуру, например, пептидный скелет или основную полимерную единицу.
«Аналог», «вариант» или «производное» - соединение, в значительной степени сходное по структуре и имеющее такую же биологическую активность, что и природное, хотя и имеющее отличия. К примеру, вариант полипептида - полипептид, в значительной степени сходный по структуре и имеющий такую же биологическую активность, что и эталонный полипептид. Варианты и аналоги отличаются по составу аминокислотных последовательностей в сравнении с природными полипептидами, из которых был получен аналог, основываясь на одной и более мутациях, включая (i) делецию одного и большего количеств аминокислотных остатков на одном и более концах полипептида или на одном и более внутренних участках последовательности природного полипептида (например, фрагменты), (ii) вставку или добавку одной и большего количества аминокислот на одном и более концах полипептида (как правило, «добавление» или «слияние») или на одном и более внутренних участках (как правило, «вставка») последовательности природного полипептида (iii) замещение одной и большего количества аминокислот в последовательности природного полипептида на другие аминокислоты. В качестве примера, «производное» относится к полипептиду, имеющему аналогичную или в значительной степени сходную структуру с эталонным полипептидом, который был модифицирован, например, химически.
Варианты и аналоги полипептидов включают инсерционные варианты, при которых один и большее количество аминокислотных остатков добавлены к аминокислотной последовательности белка свертывания крови согласно изобретению. Вставки могут быть расположены на одном или обоих концах протеина, либо могут располагаться во внутренних участках аминокислотной последовательности белка свертывания крови. Инсерционные варианты с дополнительными остатками на одном или обоих концах включают, например, слитые белки и белки, включающие аминокислоты с группами-метками и иные меченые аминокислоты. В одном случае, молекул белка свертывания крови содержит N-терминальный остаток Мет, особенно, если молекула экспрессируется рекомбинантно в бактериальных клетках, например, E. coli.
Делеционные варианты отличаются тем, что из полипептидной последовательности белка свертывания крови, описанного здесь, удалены один или более аминокислотных остатков. Делеции могут быть расположены на одном или обоих концах протеина, либо могут быть обусловлены удалением одного и большего количества остатков из внутренних участков аминокислотной последовательности белка свертывания крови. Делеционные варианты, таким образом, включают фрагменты полипептидной последовательности белка свертывания крови.
Заместительные варианты характеризуются тем, что один или более аминокислотных остатков в последовательности белка свертывания крови удалены и замещены другими остатками. В одном случае, замены могут быть консервативными по природе, консервативные замены этого типа хорошо известны в отрасли. Также, изобретение охватывает замены, которые неконсервативны. Примеры консервативных замещений описаны в Lehninger, [Biochemistry, 2nd Edition; Worth Publishers, Inc., New York (1975), pp.71-77] и представлены ниже.
КОНСЕРВАТИВНЫЕ ЗАМЕЩЕНИЯ
| ХАРАКТЕРИСТИКА РАДИКАЛА | АМИНОКИСЛОТА |
| Неполярные (гидрофобные): | |
| A. Алифатические | A L I V P |
| B. Ароматические | F W |
| C. Серосодержащие | M |
| D. Граничные | G |
| Незаряженные полярные: | |
| A. Гидроксильные | S T Y |
| B. Амидные | N Q |
| C. Сульфгидрильные | C |
| D. Граничные | G |
| Положительно заряженные (основные) | K R H |
| Отрицательно заряженные (кислотные) | D E |
Альтернативный перечень консервативных вариантов замен приведен ниже.
КОНСЕРВАТИВНЫЕ ЗАМЕНЫ II
| ИСХОДНЫЙ ОСТАТОК | ПРИМЕРЫ ЗАМЕНЫ |
| Ала (A) | Вал, Лей, Иле |
| Арг (R) | Лиз, Глн, Асн |
| Асн (N) | Глн, Гис, Лиз, Арг |
| Асп (D) | Глу |
| Цис (C) | Сер |
| Глн (Q) | Асн |
| Глу (E) | Асп |
| Гис (H) | Асн, Глн, Лиз, Арг |
| Иле (I) | Лей, Вал, Мет, Ала, Фен, |
| Лей (L) | Иле, Вал, Мет, Ала, Фен |
| Лиз (K) | Арг, Глн, Асн |
| Мет (M) | Лей, Фен, Иле |
| Фен (F) | Лей, Вал, Иле, Ала |
| Про (P) | Гли |
| Сер (S) | Тре |
| Тре (T) | Сер |
| Три (W) | Тир |
| Тир (Y) | Три, Фен, Тре, Сер |
| Вал (V) | Иле, Лей, Мет, Фен, Ала |
B. Полинуклеотиды
Нуклеиновые кислоты, кодирующие белки системы свертывания, включают в рамках изобретения, к примеру, гены, пре-мРНК, мРНК, кДНК, полиморфные варианты, аллели, искусственных и природных мутантов, но не ограничиваясь ими.
Полинуклеотиды, кодирующие белки системы свертывания, также включают в рамках изобретения, к примеру, но не ограничиваясь ими, те, которые (1) специфически гибридизированы в жестких гибридизационных условиях с нуклеиновой кислотой, кодирующей аминокислотную последовательность, описанную здесь, а также их консервативно модифицированные варианты; (2) имеют нуклеотидную последовательность с более чем 95%, около 96%, около 97%, около 98%, около 99%, и больше идентичностью нуклеотидной последовательности на участке с, по меньшей мере, около 25, около 50, около 100, около 150, около 200, около 250, около 500, около 1000 и более нуклеотидов (вплоть до полной длины из 1218 нуклеотидов зрелого белка), с эталонной последовательностью нуклеиновой кислоты, описанной здесь. Примером условий “жестких гибридизационных” условий служит гибридизация при 42°C в 50% формамиде, 5× SSC (цитрат и хлорид натрия), 20 мМ Na×PO4, pH 6,8; и отмывка в 1×SSC при 55°C в течение 30 минут. Следует понимать, что в зависимости от длины и содержания ГЦ-нуклеотидов гибридизируемых последовательностей, эти примерные условия могут быть изменены. Для определения приемлемых условий гибридизации приемлемы стандартные в данной области техники формулы. См. Sambrook et al., Molecular Cloning: A Laboratory Manual (Second ed., Cold Spring Harbor Laboratory Press, 1989) §§ 9.47-9.51.
«Природные» полинуклеотидные или полипептидные последовательности, как правило, происходят от млекопитающих, включая, но не ограничиваясь ими, приматов, к примеру, человека; грызунов, к примеру, крыс, мышей, хомяков; от коров, свиней, лошадей, иных млекопитающих. Нуклеиновые кислоты и белки в рамках изобретения могут быть рекомбинантными молекулами (к примеру, гетерологическими, кодирующими последовательность дикого типа или ее варианты, или не встречающимися в природе).
В ряде воплощений изобретения, вышеуказанные полипептиды и полинуклеотиды являются следующими белками системы свертывания крови.
Фактор VIIa
фVII (также известный как стабильный фактор или проконвертин) является гликопротеином, относящимся к группе витамин К-зависимых сериновых протеаз, обладающим ключевой ролью в гемостазе и свертывании крови (Eigenbrot, Curr Protein Pept Sci. 2002;3:287-99).
фVII синтезируется в печени и секретируется в виде одноцепочечного гликопротеина с массой 48 кДа. фVII, как и все гликопротеины, относящиеся к группе витамин К-зависимых сериновых протеаз, имеет доменную структуру, содержащую аминотерминальный домен гамма-карбоксиглутаминовой кислоты (Gla) с 9-12 остатками, ответственными за взаимодействие белка с липидными мембранами, карбокситерминальный домен сериновой протеазы (каталитический домен), а также два домена, аналогичные доменам фактора роста эпидермиса, содержащие ион кальция, отвечающие за взаимодействие с тканевым фактором. Гамма-глутамилкарбоксилаза катализирует карбоксилирование остатков Gla на аминотерминальном участке молекулы. Действие карбоксилазы зависит от восстановленной формы витамина К, который при этом окисляется до эпоксидной формы. Обратное превращение эпоксида витамина К в восстановленную форму происходит под действием витамин-К-эпоксид-редуктазы.
Основная часть фVII циркулирует в крови в виде профермента, активация этой формы происходит при разрезании пептидной связи между 152-м остатком аргинина и 153-м остатком изолейцина. Результирующий активированный фVIIa состоит из NH2-конечной легкой цепи (20 кДа) и COOH-конечной тяжелой цепи (30 кДа), связанных единственной дисульфидной цепью (Цис 135 с Цис 262). Легкая цепь содержит мембран-связывающий Gla-домен, тяжелая цепь содержит каталитический домен.
Концентрация фVII в плазме обусловлена генетическими факторами и факторами окружающей среды, и составляет около 0,5 мг/мл (Pinotti et al., Blood. 2000;95:3423-8). Различные фVII генотипы могут привести к средним уровням фVII, отличающимся в несколько раз. Уровень фVII в плазме повышается у здоровых женщин во время беременности, кроме того, он повышается с возрастом, выше у женщин и у лиц с гипертриглицеридемией. фVII имеет самый короткий период полужизни из всех факторов-прокоагулянтов (3-6 ч). У здоровых людей средняя концентрация фVIIa равна 3,6 нг/мл, период полужизни циркулирующего фVIIa относительно велик (2,5 ч) в сравнении с остальными факторами свертывания крови.
Наследственная недостаточность фVII - редкое аутосомное рецессивное нарушение системы свертывания крови, распространенность которого в популяции оценивается в 1 случай на 500000 людей (Acharya et al., J Thromb Haemost. 2004;2248-56). Приобретенная недостаточность фVII из-за применения ингибиторов также очень редка. Описаны случаи недостаточности после применения таких препаратов, как цефалоспорины, пенициллины, антикоагулянты для приема внутрь. Кроме того, приобретенная недостаточность фVII отмечалась при иных состояниях: миеломе, сепсисе, апластической анемии, при терапии интерлейкином-2 и антитимоцитарным глобулином.
К эталонным полинуклеотидным и полипептидным последовательностям относятся, например, последовательности с номерами доступа GenBank J02933 для геномной последовательности, M13232 для кДНК (Hagen et al. PNAS 1986; 83: 2412-6), и P08709 для полипептидной последовательности (ссылки включены в настоящую заявку во всей полноте). Описано множество полиморфизмов фVII, например, см. Sabater-Lleal et al. (Hum Genet. 2006; 118:741-51) (ссылка включена в настоящую заявку во всей полноте).
Фактор IX
фIX - витамин-К-зависимый протеин плазмы, участвующий во внутреннем пути коагуляции крови путем превращения фХ в его активную форму в присутствии ионов кальция, фосфолипидов и фVIIIa. Предоминантная каталитическая способность фIX аналогична сериновым протеазам со специфичностью к связи аргинин-изолейцин в фХ. Активация фIX происходит под действием фХIa, который отрезает активационный пептид от фIX, формируя активированную молекулу фIX, содержащую две цепи, связываемы одной или большим количеством дисульфидных связей. Дефекты фIX - причина рецессивной гемофилии B, сцепленной с X-хромосомой.
Гемофилия A и B - наследственные заболевания, которые характеризуются дефицитом полипептидов фVIII и фIX, соответственно. Первопричина дефицита зачастую лежит в мутациях в генах фVIII и фIX, которые расположены в X-хромосоме. Традиционная терапия гемофилии часто заключается во внутривенном введении смешанной плазмы или полуочищенных белков системы свертывания, полученных от людей с нормальной функцией. Эти препараты могут быть загрязнены патогенными агентами или вирусами, например, инфекционными прионами, ВИЧ, парвовирусом, гепатитом A, гепатитом C. Вследствие этого, имеется острая потребность в лекарственных средствах, при производстве которых не используется человеческая сыворотка.
Уровень понижения активности фIX прямо пропорционален тяжести гемофилии B. Текущая терапия гемофилии B заключается в замене недостающего белка полученным из плазмы или рекомбинантным фIX (так называемая заместительная терапия фIX).
Полинуклеотидные и полипептидные последовательности фIX приведены, к примеру, в базе UniProtKB/Swiss-Prot, номер доступа P00740, базе US Pat. номер 6531298, а также на фигуре 1.
Фактор VIII
Фактор свертываемости VIII (фVIII) циркулирует в плазме при очень низкой концентрации, он связан нековалентно с фактором Фон Виллебранда (ФВф). Во время гемостаза, фVIII отделяется от ФВф и действует как кофактор при активации фХ, медиируемой фактором IX (фIXa) посредством увеличения скорости активации в присутствии кальция и фосфолипидов или клеточных мембран.
фVIII синтезируется в виде одноцепочечного предшественника с массой примерно 270-330 кДа и с доменной структурой A1-A2-B-A3-C1-C2. При извлечении из плазмы (т.н., «полученный из плазмы» или «плазматический»), фVIII состоит из тяжелой цепи (A1-A2-B) и легкой (A3-C1-C2). Молекулярная масса легкой цепи равна 80 кДа, в то время как, вследствие протеолиза В-домена, вес тяжелой цепи варьируется в интервале 90-220 кДа.
фVIII также синтезируется рекомбинантным способом для терапии нарушений свертываемости крови. Для определения потенциальной эффективности рекомбинантного фVIII (рфVIII) как терапевтического средства были разработаны различные анализы in vitro. Эти анализы имитируют эффекты эндогенного фVIII in vivo. Обработка фVIII in vitro приводит к быстрому подъему и последующему спаду его прокоагулянтной активности, по данным анализов in vitro. Эта активация и деактивация согласуется со специфическим ограниченным протеолизом тяжелой и легкой цепей, что видоизменяет доступность различных связывающих эпитопов фVIII, например, позволяя фVIII отсоединяться от ФВф и связываться с фосфолипидной поверхностью или изменять способность к связыванию с определенными моноклональными антителами.
Нехватка или дисфункция фVIII ассоциированы с наиболее частым нарушением свертываемости