Новые октапептидные соединения и их терапевтическое применение
Иллюстрации
Показать всеИзобретение относится к новым октапептидным соединениям общей формулы (I), которые имеют хорошее сродство к некоторым подтипам рецепторов соматостатина. Соединения предназначены для лечения патологических состояний или заболеваний, в которые вовлечены один или несколько рецепторов соматостатина. Изобретение относится также к фармацевтическим композициям, содержащим указанные продукты, и к их применению для получения лекарства. 4 н. и 13 з.п. ф-лы, 9 пр.
R-AA1-цикло-(AA2-Tyr3-D-TRP4-AA5-Val6-Cys7)-Thr8-NH2 (I)
Реферат
Настоящее изобретение относится к новым октапептидным соединениям. Так как эти продукты имеют хорошее сродство к некоторым подтипам рецепторов соматостатина, они особенно интересны для лечения патологических состояний или болезней, в которых вовлечены один или несколько рецепторов соматостатина. Изобретение относится также к фармацевтическим композициям, содержащим указанные продукты, и к их применению для получения лекарства.
Соматостатин (SST) является циклическим тетрадекапептидом, который был выделен впервые из гипоталамуса в качестве вещества, ингибирующего гормон роста (Brazeau P. et al., Science 1973, 179, 77-79). Он играет также роль нейромедиатора в мозгу (Reisine T. et al., Neuroscience 1995, 67, 777-790; Reisine et al., Endocrinology 1995, 16, 427-442). Гетерогенность биологических функций соматостатина и соотношения структура-активность этих пептидных аналогов привели к открытию 5 подтипов рецепторов, связанных с мембраной (Yamada et al., Proc. Natl. Acad. Sci. USA, 89, 251-255, 1992; Raynor, K. et al, Mol. Pharmacol., 44, 385-392, 1993). Молекулярное клонирование позволило показать, что биоактивность соматостатина напрямую зависит от этих пяти подтипов рецепторов.
В настоящее время активно исследуются функциональные роли этих рецепторов. Предпочтительная активация подтипов 2 и 5 была связана с подавлением в аденомах, секретирующих эти гормоны, гормона роста GH (акромегалия), гормона TSH и пролактина, но точную роль каждого подтипа еще предстоит определить.
Из патологических расстройств, связанных с соматостатином (Moreau J.P. et al., Life Sciences, 1987, 40, 419; Harris A.G. et al., The Européen Journal of Medicine, 1993, 2, 97-105), можно назвать, например, акромегалию, аденомы гипофиза, болезнь Кушинга, гонадотропиномы и пролактиномы, катаболические побочные эффекты глюкокортикоидов, диабет, диабетическую ретинопатию, диабетическую нефропатию, гипертиреоз, гигантизм, опухоли гастроэнтеропанкреатической эндокринной системы, в том числе карциноидный синдром, ВИП-ому, инсулиному, незидиобластоз, гиперинсулинемию, глюкагоному, гастриному и синдром Золлингера-Эллисона, GRF-ому, а также острое кровотечение из варикозно расширенных вен пищевода, желудочно-пищеводный рефлюкс, гастродуоденальный рефлюкс, панкреатит, энтерокожные и панкреатические фистулы, а также диареи, стойкие диареи при синдроме приобретенного иммунодефицита, хроническую секреторную диарею, диарею, связанную с синдромом раздраженного кишечника, расстройства, связанные с гастриновысвобождающим пептидом, вторичные патологии кишечных имплантатов, портальную гипертензию, а также кровотечения из расширенных вен у больных циррозом, желудочно-кишечные кровотечения, кровотечения из гастродуоденальной язвы, болезнь Крона, системные склерозы, демпинг-синдром, синдром "малого кишечника", гипотензию, склеродермию и медуллярную карциному щитовидной железы, болезни, связанные с гиперпролиферацией клеток, такие, как рак и, в частности, рак молочной железы, рак простаты, рак щитовидной железы, а также рак поджелудочной железы и колоректальный рак, фиброзы, в частности, фиброз почки, фиброз печени, фиброз легкого, фиброз кожи, а также фиброз центральной нервной системы, а также фиброз носа и фиброз, вызванный химиотерапией, и другие терапевтические области, как, например, головная боль, в том числе, головная боль, связанная с опухолями гипофиза, боли, панические атаки, химиотерапия, рубцевание ран, почечная недостаточность в результате задержки роста, ожирение и задержка роста, связанная с ожирением, задержка внутриутробного развития, дисплазия скелета, синдром Нунан, синдром остановки дыхания во сне, болезнь Грейвса, поликистозная болезнь яичников, псевдокисты и асциты поджелудочной железы, лейкемия, менингиома, раковая кахексия, ингибирование H.pylori, псориаз, а также болезнь Альцгеймера. Можно также назвать остеопороз.
В настоящее время все возрастающее внимание уделяют пептидам, обладающим сродством к рецептором соматостатина. Так, ланреотид очень интенсивно изучался для лечения болезней, связанных с гормоном роста (Cendros JM, Peraire C, Troconiz IF, Obach R. Pharmacokinetics and population pharmacodynamic analysis of lanreotide. Autogel. Metabolism. 2005 Oct, 54(10), 1276-81.)
Октапептидные соединения, состоящие из ланреотида, модифицированного в положении 4, были описаны в международной патентной заявке PCT/FR09/001162.
Таким образом, основной целью является потребность в поиске альтернатив существующим решениям. Настоящее изобретение вписывается в эти рамки.
Так, заявители предлагают новые октапептидные соединения, обладающие хорошим сродством к рецепторам соматостатина.
Таким образом, объектом настоящего изобретения является октапептидное соединение общей формулы (I)
R-AA1-цикло-(AA2-Tyr3-D-Trp4-AA5-Val6-Cys7)-Thr8-NH2 (I)
в которой AA1 обозначает аминокислотный остаток, связанный с радикалом R и аминокислотой AA2 согласно формуле
в которой
R1 обозначает нафтильный радикал, возможно замещенный одним или несколькими алкильными радикалами;
R обозначает атом водорода или алкильный или ацетильный радикал;
AA2 обозначает аминокислотный остаток, связанный с аминокислотами AA1 и Tyr3 согласно формуле
в которой n2 обозначает целое число от 1 до 2;
AA5 обозначает аминокислотный остаток, связанный с аминокислотами Trp4 и Val6 согласно формуле
в которой R5 и R'5 независимо означают атом водорода или алкильный или ацетильный радикал, и n5 обозначает целое число от 1 до 4;
при условии, что:
- если AA2 обозначает остаток аминокислоты цистеина, то
- либо AA5 обозначает остаток аминокислоты лизина, а AA1 не является остатком аминокислоты нафтилаланина;
- либо AA1 обозначает остаток аминокислоты нафтилаланина, и AA5 не является остатком аминокислоты лизина;
- либо AA1 не является остатком аминокислоты нафтилаланина, а AA5 не является остатком аминокислоты лизина;
- если AA2 не является остатком аминокислоты цистеина, то AA1 обозначает остаток аминокислоты нафтилаланина, и AA5 обозначает остаток аминокислоты лизина,
и при условии, что все аминокислоты могут иметь конфигурацию D или L,
или фармацевтически приемлемая соль этого соединения.
Согласно настоящему изобретению, под аминокислотным остатком подразумевают радикал, который образует аминокислоту, участвующий своими аминогруппами и кислотными группами в пептидных связях. Так, аминокислотный остаток, содержащий X как боковую цепь, будет иметь в качестве остатка радикал формулы -NH-CH(X)-C(O)-.
Согласно настоящему изобретению, аминокислоты, представленные в общей формуле их трехбуквенным кодом в качестве кислот как таковых или же в качестве кислотных остатков, могут, если не уточняется, находиться как в D-, так и в L-конфигурации.
Кроме того, согласно настоящему изобретению и в соответствии с правилами, обозначение пептидов, приводимых их последовательностями аминокислот, представленными их трехбуквенным кодом, относится к аминокислотам в L-конфигурации, если отсутствуют уточнения, тогда как аминокислоты в D-конфигурации указываются явно буквой D, предшествующей трехбуквенному коду рассматриваемой аминокислоты.
В контексте настоящего изобретения под алкилом, если не дается дополнительных уточнений, понимают линейный или разветвленный алкильный радикал, содержащий от 1 до 6 атомов углерода, такой, как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил или гексил, предпочтительно с 1-4 атомами углерода.
Согласно настоящему изобретению, выражение "фармацевтически приемлемая соль" определяет соли присоединения неорганических кислот, такие, как гидрохлорид, гидробромид, гидройодид, сульфат, фосфат, дифосфат и нитрат, или органических кислот, такие, как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат и стеарат. Для других примеров фармацевтически приемлемых солей можно сослаться на "Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217.
Согласно настоящему изобретению, аминокислоты являются известными специалисту аминокислотами в конфигурации D или L, представленными здесь их обычной номенклатурой, и синтетическими аналогами, модифицированными в боковых цепях указанных аминокислот, в том числе:
D-2-Nal1, Ac-D-2-Nal1, CH3-D-2-Nal1 обозначают аланин, замещенный в положении β нафтильным радикалом, соответственно незамещенным и замещенным на его аминогруппе ацетильным или метильным радикалом в позиции 1;
Hcy обозначает гомоцистеин, то есть цистеин, боковая цепь которого продлена метиленовым звеном;
Orn обозначает орнитин, то есть лизин, боковая цепь которого укорочена на одно метиленовое звено;
Dab обозначает диаминомасляную кислоту, то есть лизин, боковая цепь которого укорочена на два метиленовых звена;
Dap обозначает диаминопропионовую кислоту, то есть лизин, боковая цепь которого укорочена на три метиленовых звена;
Lys(Ac) и (Me)2Lys обозначают лизин, замещенный на аминогруппе его боковой цепи соответственно одним или несколькими ацетильными или метильными радикалами.
Предпочтительно, n5 является целым числом от 1 до 4, и еще более предпочтительно, n5 обозначает целое число от 3 до 4.
Предпочтительно, AA2 обозначает остаток аминокислоты цистеина, то есть n2 равно 1.
Предпочтительно, AA2 не является остатком аминокислоты цистеина, то есть n2 равно 2.
Предпочтительно, AA1 не является остатком аминокислоты нафтилаланина, то есть R обозначает алкильный или ацетильный радикал, и AA5 обозначает остаток аминокислоты лизина, то есть n5 равно 4, и R5 и R'5 обозначают атомы водорода.
Предпочтительно, AA1 обозначает остаток аминокислоты нафтилаланина, то есть R обозначает атом водорода, и AA5 не является остатком аминокислоты лизина, то есть либо n5 есть целое число от 1 до 3, либо n5 равно 4, и R5 и R'5 обозначают алкильный или ацетильный радикал.
Предпочтительно, AA1 не является остатком аминокислоты нафтилаланина, то есть R обозначает алкильный или ацетильный радикал, и AA5 не является остатком аминокислоты лизина, то есть либо n5 есть целое число от 1 до 3, либо n5 равно 4, а R5 и R'5 обозначают алкильный или ацетильный радикал.
Предпочтительно, AA1 обозначает аминокислотный остаток, выбранный из 2-Nal, Ac-2-Nal и CH3-2-Nal. Предпочтительно, AA1 находится в D-конфигурации.
Предпочтительно, AA2 обозначает аминокислотный остаток, выбранный из Cys и Hcy.
Предпочтительно, AA5 обозначает аминокислотный остаток, выбранный из Lys, Lys(Ac), Orn, (CH3)2Lys, Dab и Dap.
Предпочтительно, октапептидное соединение общей формулы (I) выбрано из:
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys(Ac)5-Val6-Cys7)-Thr8-NH2
Ac-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys(Ac)5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Orn5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-(Me)2Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Hcy2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2
Ac-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2
CH3-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Dab5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Dap5-Val6-Cys7)-Thr8-NH2
или является фармацевтически приемлемой солью этого соединения.
Более предпочтительно, октапептидное соединение общей формулы (I) выбрано из:
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Orn5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-(Me)2Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Hcy2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2 и
Ac-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2
или является фармацевтически приемлемой солью этого соединения.
Еще более предпочтительно, октапептидное соединение общей формулы (I) является H-D-2-Nal1-цикло(Hcy2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2 или фармацевтически приемлемой солью этого соединения.
Объектом изобретения является также лекарство, содержащее определенное выше соединение согласно изобретению.
Объектом изобретения является также фармацевтическая композиция, содержащая определенное выше соединение согласно изобретению, в частности, когда это соединение применяется в качестве действующего вещества.
Объектом изобретения является также терапевтическая композиция, содержащая определенное выше соединение общей формулы (I) в качестве действующего вещества в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентов.
Объектом изобретения является также применение определенного выше октапептидного соединения общей формулы (I) для получения лекарства.
Объектом изобретения является также определенное выше применение, в которой лекарство предназначено для лечения патологии, выбранной из заболеваний, связанных с гормоном роста.
Наконец, изобретение относится к применению определенного выше соединения для получения лекарства, предпочтительно лекарства, предназначенного для лечения патологий, в которые вовлечены один или несколько рецепторов соматостатина, таких, как акромегалия, для лечения нейроэндокринных опухолей, диабетической ретинопатии, лечения сосудов, суставов и кожи; и предпочтительно для лечения акромегалии или нейроэндокринных опухолей.
Терапевтическая композиция по изобретению может находиться в твердой форме, например, порошки, гранулы, таблетки, желатиновые капсулы, липосомы или суппозитории. Подходящими твердыми наполнителями могут быть, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, поливинилпирролидин и воск.
Терапевтическая композиция согласно изобретению может также находиться в жидкой форме, например, растворы, эмульсии, суспензии или сиропы. Подходящими жидкими наполнителями могут быть, например, вода, органические растворители, такие, как глицерин или гликоли, а также их смеси, в различных пропорциях, в воде.
Введение композиции по изобретению можно осуществлять топически, через рот, парентерально, путем внутримышечной, подкожной инъекции и т.д.
Если только не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют значение, обычно понятное специалисту в области, к которой относится изобретение.
Нижеследующая экспериментальная часть приводится для иллюстрации представленных выше методик и никоим образом не должна рассматриваться как ограничивающая сферу действия изобретения.
Экспериментальная часть
1. Описание синтеза
1.1 Используемое оборудование
ВЭЖХ-МС:
Используется система марки Waters (2525) с онлайновым дегазатором и автоматизированной системой впрыска (2767). Используют градиент воды и ацетонитрила в качестве элюента, с 0,1% муравьиной кислоты. Детектирование элюированных соединений проводят с помощью диодной матрицы (2996), испарительного детектора светорассеяния (DEDL) и масс-спектрометра (см. ниже). Используют колонку с обращенной фазой, привитой C18, модель X-Bridge 100×4,6 мм с размером частиц 3,5 мкм и размером пор 13,5 нм. Скорость течения установлена на 1 мл/мин, объем впрыска 20 мкл.
Используют масс-спектрометр Micromass ZQ марки Waters. Ионизацию проводят электрораспылением с температурой источника 120°C и напряжением конуса 20 В. Образец вводят непрерывно со скоростью 0,3 мл/мин. Анализатор является анализатором квадрупольного типа (модель ZQ2000). Спектры снимаются с помощью программы Mass Lynx 4.0 в диапазоне m/z 100-1000 для органических молекул и 100-2000 для пептидов.
Препаративная ВЭЖХ:
Для очистки пептидов применяются две системы. Одна - это описанная выше система, оборудованная колонкой с обращенной фазой C18, модель X-Bridge 150×19 мм с размером частиц 5 мкм и размером пор 13,5 нм. Скорость 17 мл/мин. Вторая система, Waters 2545, похожа на предыдущую, но не оборудована масс-спектрометром. Используется колонка Thermo Hypurity, обращеннофазового типа (привитая C18) размером 21,2×250 мм. В качестве элюента используют смесь воды и ацетонитрила с 0,1% TFA при скорости течения 20 мл/мин. Обе системы препаративной ВЭЖХ используются в изократическом режиме после определения оптимальных условий.
ЯМР-анализ:
Анализ по ядерному магнитному резонансу проводится на спектрометре Bruker Advance 400 Ultrashield. Частоты анализа 400 МГц для протона и 100 МГц для углерода-13. Спектры снимаются при температуре окружающей среды, химические сдвиги выражены в ppm, а постоянные связи - в Гц. Мультиплетность указывается следующим образом: с = синглет, шир.с = широкий синглет, д = дублет, шир.д = широкий дублет, дд = дублет дублетов, ддд = сдвоенный дублет дублетов, т = триплет, шир.т= широкий триплет, кв = квадруплет, д.кв = раздвоенный квадруплет, м = мультиплет.
Анализ МСВР:
Измерения точных масс осуществлялись на времяпролетном масс-спектрометре (LCT от Micromass®, Англия), оборудованном источником электрораспыления (источник Z-spray) в положительном режиме. Внешний эталон, позволяющий измерить точную массу, вводится параллельно образцу в непрерывном режиме (конфигурация Lockspray™). Здесь в качестве эталона используется лейцинэнкефалин, который дает ион [M+Na]+ при m/z=578,2591. Разрешение этого прибора составляет 6500, результаты приводятся с отклонением от теоретической массы менее 5 мДа. Прибор управляется программой Masslynx 4.0®. Образец, растворенный в воде, впрыскивается в поток смеси, состоящей из 50% воды и 50% метанола, через ВЭЖХ, снабженную автоматическим устройством для отбора проб (Alliance 2795 от Waters®, Англия), скорость протекания 200 мкл/мин. Объем впрыска составляет 10 мкл. Напряжение в капилляре равно 2800 В. Напряжение конуса составляет 40 В. Температура источника 120°C. Температура десольватации 250°C. Расход газа десольватации (азот) равен 500 л/ч. Расход газа на конусе (азот) 20 л/ч. TDC останов: 100 мВ.
ИК-спектрометрия
Инфракрасные спектры пептидов снимаются методом ослабленного полного внутреннего отражения и методом Фурье-преобразования. Используется прибор Bruker IFS 66, оборудованный модулем 45°N Znse ATR, непрерывно продуваемым азотом. 10 мкл раствора осаждают на кристалл и усредняют по тридцати сканированиям с разрешением 4 см-1. Сигнал от воды вычитается из необработанного спектра с помощью компьютерной программы OPUS 4.2.
Лиофилизатор
Используется лиофилизатор Christ Alpha 2-4 LD plus, соединенный с лопастным насосом, позволяющим достичь вакуума около 15 мкбар. Водные растворы образцов отверждают в жидком азоте перед подсоединением к этому устройству.
Микроскопия
ПЭМ типа Microscope Phillips CM-20, работающий на 200 кВ, и СЭМ типа Leo-Gemini, электронно-эмиссионная пушка (field emission gun).
Используемые реактивы
Смола для пептидного синтеза получена от Novabiochem, отделение Merk Bioscience (Schwalbach, Германия). Ионообменная смола получена из лабораторий Bio-Rad (Hercules, США).
Используемую воду дважды деионизировали, применяя ионообменную систему Milli-Q Plus от Millipore (Billerica, США). Растворители для синтеза и для очистки покупали у Aldrich и VWR (West Chester, США) и, если не указано обратное, использовали без очистки.
Аминокислоты были закуплены у Bachem (Weil am Rhein, Германия), Fluka (Buchs, Швейцария), Acros Organics (Geel, Бельгия) и NeoMPS (Strasbourg, Франция).
Аминокислоты-предшественники, доступные для приобретения:
Аминокислоты Fmoc-Lys(Ac)-OH, Ацетил-β-(2-нафтил)-D-аланин, Fmoc-Orn(Boc)-OH, Fmoc-Homocys(Trt)-OH, Fmoc-Dab(Boc)-OH, Fmoc-Dap(Boc)-OH имеются в продаже.
Синтез аминокислоты N-метил-Boc-D-2-Nal-OH
К суспензии 2,4 г (60 ммоль) NaH (60% в минеральном масле) в 80 мл безводного ТГФ, находящегося при 0°C, добавляют 3,2 г (10 ммоль) Boc-D-2-Nal-OH, растворенного в 20 мл безводного ТГФ. Реакционную среду перемешивают 15 минут при 0°C, затем по каплям добавляют 10 мл (160 ммоль) MeI. После этого реакцию продолжают в течение 4 ч при 0°C, после чего добавляют 5 мл MeI, затем реакционную среду доводят до температуры окружающей среды, после чего оставляют перемешиваться на всю ночь. Реакционную среду нейтрализуют при 0°C 20 мл насыщенного раствора NH4Cl, затем THF и MeI выпаривают в роторном испарителе. Потом добавляют 100 мл гексана, водную фазу собирают, промывают 2 раза 100 мл гексана. Добавляют 100 мл этилацетата и водную фазу подкисляют (pH 2), затем водную фазу экстрагируют 3 раза 100 мл этилацетата. Затем органические фазы объединяют, сушат над Na2SO4, фильтруют, затем выпаривают. Затем ожидаемый продукт кристаллизуют из смеси гексан/этилацетат (1,82 г, 55%).
1H-ЯМР (CD3OD): δ 1,22 (с, 6H, tBu), 1,27 (с, 3H, tBu), 2,72 (с, 3H, Me), 3,42-3,49 (м, 1H), 4,78 (дд, 1H, J=4,1, J=11,5), 4,97 (дд, 1H, J=4,7, J=11,5), 7,37-7,46 (м, 3H), 7,67 (с, 1H), 7,76-7,82 (м, 3H).
MS (ESI): m/z 330,0 [M+H]+.
Синтез аминокислоты Fmoc-Nε,ε-диметиллизина (согласно Int. J. Peptide Res. Ther. (2006) 12, 187-193)
203 мг (0,5 ммоль) гидрохлорида Fmoc-Lys-OH растворяют в 10 мл этанола и раствор доводят до 0°C. Добавляют 86 мкл (1,1 ммоль) формальдегида (37%-ный раствор) и все это удерживают при 0°C в течение 15 минут. Затем добавляют 95 мг (1,5 ммоль) NaBH3CN, и реакция продолжается 15 минут при 0°C, после чего добавляют 86 мкл формальдегида и 95 мг NaBH3CN и оставляют реакцию продолжаться на 4 часа при 0°C. Добавляют 10 мл 1н раствора HCl, полученный осадок отфильтровывают, затем раствор высушивают досуха и полученное соединение очищают хроматографией (элюент MeOH/H2O 95/5), получая 110 мг ожидаемого соединения (с очень малым количеством триметилированного лизина).
1H-ЯМР (CD3OD): δ 1,4-1,9 (м, 6H); 2,7 (с, 6H); 2,91 (т, J=7,7, 2H); 4,02 (дд, J=5,3, J=7,1, 1H); 4,19 (т, J=6,8, 1H); 4,22-4,35 (м, 2H); 7,28-7,32 (м, 2H); 7,38 (т, J=7,2, 2H); 7,63-7,72 (м, 2H); 7,79 (д, J=7,5, 2H).
MS (ESI) m/z: 397,0 [M+H]+.
1-3. Приготовление октапептидных соединений
1.3.1 Общая процедура синтеза пептидов
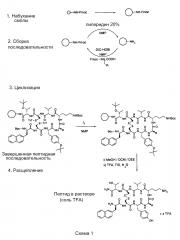
Синтез включает 4 основных этапа, как показывает схема 1:
1/ Отливка смолы
Смолу 4-(2',4'-диметоксифенилфлуоренилметоксикарбонил-аминометил)-феноксиацетамидо-норлейцил-(4-метил)-бензгидриламин - полистирольное основание - дивинилбензол (Rink Amide MBHA) вводят в шприц, снабженный спеченным стеклом, краном на одном конце и пробкой на другом. Шприц заполняют NMP и смесь осторожно встряхивают в течение 1 ч. Затем растворитель удаляют фильтрацией.
2/ Сочетание аминокислот
Аминокислоты соединяют друг с другом в желаемом порядке посредством реакции сочетания. Аминокислоту (2 экв) вводят вместе с 1-гидроксибензотриазолом (HOBt, 2,2 экв) и N,N-диизопропилкарбодиимидом (DIC, 2,2 экв) в N-метилпирролидинон (NMP, 5 мл/г смолы) в пробирку и встряхивают несколько минут. Затем эту смесь соединяют со смолой в ее сосуде. Реакционную смесь перемешивают полтора часа, затем фильтруют. Используется метод двойного сочетания: реакционную смесь фильтруют при глубине прохождения реакции около 50% и снова вводят свежие реагенты, чтобы оптимизировать скорость реакции и чистоту конечного продукта. Второй этап состоит в удалении защиты с введенной новой аминокислоты, чтобы позволить осуществить новое сочетание. Удаление защиты реализуется тремя обработками пиперидином в NMP (20% об./об.), 5 мл/г смолы с последующими тремя промывками NMP (10 мл/г смолы). Чтобы контролировать реакцию, 5 мкл фильтрата, соответствующего первой обработке, затем 10 мкл, соответствующего двум следующим, а также первой промывке, то есть всего 4 образца, вводят в 2 мл пиперадина перед измерением УФ-поглощения на 290 нм. Между каждым этапом проводят три промывки смолы посредством NMP (10 мл/г смолы). Таким образом, этот этап сборки состоит из двух реакций: реакция сочетания аминокислот и реакция удаления защиты с группы Fmoc, которые реализуют неоднократно до достижения пептидной последовательности.
3/ Формирование дисульфидного мостика
После того как последовательность собрана, пептид нужно циклизовать путем образования дисульфидного мостика. Дисульфидный мостик образуют тремя обработками дииодидом 1 экв в NMP (5 мл/г смолы) в течение соответственно 2 мин, 3 мин и 5 мин. Затем смолу промывают 5 раз DCM и 5 раз NMP, чтобы удалить избыток йода, удерживаемого в смоле (10 мг/г смолы).
4/ Расщепление
Смолу необходимо подготовить к расщеплению посредством двух промывок NMP, двух промывок метанолом (MeOH), двух промывок дихлорметаном (DCM) и двух промывок этиловым эфиром (DEE) (10 мл на грамм смолы). Затем смолу ваккумируют одни сутки. Расщепление осуществляют в стеклянной колбе, снабженной магнитной мешалкой. Реакционная смесь состоит из трифторуксусной кислоты (TFA, 10 мл/г смолы), а также триизопропилсилана (TIS) и воды (3% и 2% об./об.). Реакционную среду перемешивают 4 ч при температуре окружающей среды. Затем среду фильтруют через спеченное стекло и твердую фазу дважды промывают TFA. Затем фильтрат выпаривают, получая очень густую белую жидкость. Ее растворяют в смеси вода-ацетонитрил 1:1, чтобы лиофилизовать. После этого этапа пептид находится в виде трифторацетатной соли.
1.3.2 Очистка
Очистка проводится методом препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ). Стационарная фаза называется обращенной, так как она привита алкильными цепями C18. Подвижная фаза состоит из фиксированной (изократической) смеси воды и ацетонитрила с 0,1% TFA или 1% муравьиной кислоты, которые служат для нейтрализации остаточных непривитых силанольных групп, которые могут иметься в стационарной фазе.
Пептид для впрыска в препаративную ВЭЖХ нужно растворить в смеси воды с ацетонитрилом. Сначала проводилось изучение растворимости на малом количестве. Оно позволяет установить оптимальное процентное содержание ацетонитрила и максимальное количество пептида. Идеальными условиями являются как можно меньшее процентное содержание ацетонитрила с очень высокой концентрацией пептида и прозрачный результирующий раствор.
После очистки собирают фракции, содержащие очищенный пептид, и выпаривают в вакууме. Затем чистый пептид извлекают большим количеством растворителя, который требуется выпарить, прежде чем перейти к лиофилизации. Этот пептид находится обычно в виде трифторацетатной соли до обмена с ацетатом перед физико-химическим анализом.
1.3.3 Ионный обмен
Обмен проводят на смоле сильного анионообменного типа (AG1-X8 Biorad). Сначала 245 мг этой смолы промывают три раза 10 мл уксусной кислоты 1,6н, затем три раза 10 мл уксусной кислоты 0,16 М. Затем вводят 20 мг пептида в форме соли TFA в 4 мл воды и содержимое сосуда перемешивают вращением в течение 1 ч. Затем жидкость отфильтровывают и смолу промывают два раза 1 мл дистиллированной воды. Собранные фракции затем лиофилизуют.
1.4. Примеры
Продукты были охарактеризованы описанными выше классическими методами, известными специалисту.
Пример 1: H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Orn5-Val6-Cys7)-Thr8-NH2
Пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке: Fmoc-L-Thr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH, затем Fmoc-L-Val-OH, затем Fmoc-L-Orn(Boc)-OH, затем Fmoc-D-Trp-OH, затем Fmoc-L-Tyr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH и, наконец, Boc-β-(2-нафтил)-D-Ala-OH.
Соединение циклизуют путем образования дисульфидного мостика, затем отделяют от смолы, очищают и, наконец, получают в виде ацетата согласно описанной ранее методике, получая соединение H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Orn5-Val6-Cys7)-Thr8-NH2.
ВЭЖХ: tr = 8,65 мин
МСВР (H2O) m/z=1082,46102 [M+H]+ (расч. 1082,45866)
1H-ЯМР (400 МГц, D2O): δ 0,3-0,44 (м, 1H); 0,49-0,64 (м, 1H); 0,76 (д, J=8, 3H); 0,78 (д, J=7, 3H); 1-1,12 (м, 1H); 1,06 (д, J=6,5, 3H); 1,45-1,57 (м, 1H); 1,94-2,07 (м, 1H); 2,31 (дд, J=4, J=14,7, 1H); 2,36-2,5 (м, 3H); 2,54-2,68 (м, 2H); 2,77 (д, J=7,5, 2H); 2,82-2,95 (м, 2H); 3,19 (дд, J=9, J=13,6, 1H); 3,33 (дд, J=6, J=13,6, 1H); 3,74 (дд, J=4, J=10,8, 1H); 3,82 (д, J=9,6, 1H); 4,04-4,14 (м, 2H); 4,17 (д, J=3,8, 1H); 4,24 (дд, J=6, J=8,7, 1H); 4,49 (т, J=7,5, 1H); 4,61-4,76 (м, 3H); 6,69 (д, J=8,5, 2H); 6,97 (д, J=8,5, 2H); 6,97-7,05 (м, 2H); 7,1 (шир.т, J=7,5, 1H); 7,29-7,45 (м, 4H); 7,65 (шир.с,1H); 7,72-7,81 (м, 3H).
Пример 2: H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Nε,ε-диметил-Lys5-Val6-Cys7)-Thr8-NH2(H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-(Me)2Lys5-Val6-Cys7)-Thr8-NH2)
Пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке: Fmoc-L-Thr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH, затем Fmoc-L-Val-OH, затем Fmoc-(Me)2Lys-OH, затем Fmoc-D-Trp-OH, затем Fmoc-L-Tyr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH и, наконец, Boc-β-(2-нафтил)-D-Ala-OH.
Соединение циклизуют путем образования дисульфидного мостика, затем отделяют от смолы, очищают и, наконец, получают в виде ацетата согласно описанной ранее методике, получая соединение H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Nε,ε-диметил-Lys5-Val6-Cys7)-Thr8-NH2.
ВЭЖХ: tr=10,48 мин
МСВР (H2O) m/z=1124,50620 [M+H]+ (расч. 1124,50561)
1H-ЯМР (400 МГц, D2O): δ -0,03-0,1 (м, 1H); 0,17-0,31 (м, 1H); 0,76 (д, J=7,2, 3H); 0,78 (д, J=7, 3H); 0,97-1,18 (м, 3H); 1,07 (д, J=6,3, 3H); 1,38-1,51 (м, 1H); 1,95-2,07 (м, 1H); 2,25-2,33 (м, 1H); 2,36-2,69 (м, 5H); 2,63 (с, 6H); 2,78 (шир.д, J=7,3, 2H); 2,78-2,95 (м, 2H); 3,13 (дд, J=9,5, J=12,8, 1H); 3,27 (дд, J=5,9, J=13,3, 1H); 3,7 (дд, J=2,1, J=9,9, 1H); 3,81 (д, J=9,6, 1H); 4,05-4,16 (м, 3H); 4,18 (д, J=3,6, 1H); 4,5 (т, J=7,5, 1H); 4,64-4,73 (м, 3H); 6,7 (д, J=8,4, 2H); 6,95-7,05 (м, 4H); 7,1 (т, J=7,5, 1H); 7,33 (т, J=8,4, 2H); 7,36-7,45 (м, 3H); 7,63 (шир.с,1H); 7,70-7,75 (м, 1H); 7,77 (д, J=8,6, 1H).
Пример 3: N-метил-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2(CH3-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2)
Раскрываемый пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке: Fmoc-L-Thr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH, затем Fmoc-L-Val-OH, затем Fmoc-L-Lys(Boc)-OH, затем Fmoc-D-Trp-OH, затем Fmoc-L-Tyr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH и, наконец, Boc-N-Метил-D-(2-нафтил)-Ala-OH.
Соединение циклизуют путем образования дисульфидного мостика, затем отделяют от смолы, очищают и, наконец, получают в виде ацетата согласно описанной ранее методике, получая соединение N-метил-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2.
ВЭЖХ: tr=8,83 мин
МСВР (H2O) m/z=1110,48991 [M+H]+ (расч. 1110,48996)
1H-ЯМР (400 МГц, D2O): δ -0,05-0,1 (м, 1H); 0,2-0,32 (м, 1H); 0,76 (д, J=6,4, 3H); 0,78 (д, J=6,4, 3H); 0,94-1,16 (м, 3H); 1,08 (д, J=6,4, 3H); 1,35-1,48 (м, 1H); 1,96-2,09 (м, 1H); 2,16 (дд, J=3,8, J=14,8, 1H); 2,35 (дд, J=9,3, J=14,8, 1H); 2,39-2,64 (м, 4H); 2,52 (с, 3H); 2,69-2,96 (м, 4H); 3,16 (дд, J=10,2, J=13,3, 1H); 3,38 (дд, J=5, J=13,3, 1H); 3,65 (дд, J=3,5, J=11, 1H); 3,78 (д, J=9,8, 1H); 4,06-4,19 (м, 3H); 4,22 (д, J=4, 1H); 4,5 (т, J=7,6, 1H); 4,55-4,75 (м, 3H); 6,68 (д, J=8,5, 2H); 6,95-7,03 (м, 3H); 7,09 (т, J=7,2, 1H); 7,29 (дд, J=1,3, J=8,4, 1H); 7,33 (д, J=8,2, 1H); 7,37-7,44 (м, 3H); 7,62 (шир.с, 1H); 7,68-7,73 (м, 1H); 7,75-7,8 (м, 2H).
Пример 4: H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Dab5-Val6-Cys7)-Thr8-NH2
Пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке: Fmoc-L-Thr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH, затем Fmoc-L-Val-OH, затем Fmoc-Dab(Boc)-OH, затем Fmoc-D-Trp-OH, затем Fmoc-L-Tyr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH и, наконец, Boc-β-(2-нафтил)-D-Ala-OH.
Соединение циклизуют путем образования дисульфидного мостика, затем отделяют от смолы, очищают и, наконец, получают в виде ацетата согласно описанной ранее методике, получая соединение H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Dab5-Val6-Cys7)-Thr8-NH2.
ВЭЖХ: tr=8,68 мин
МСВР (H2O) m/z=1068,44355 [M+H]+ (расч. 1068,44301)
1H-ЯМР (400 МГц, D2O): 0,76 (д, J=6,7, 3H); 0,77 (д, J=6,7, 3H); 1,06 (д, J=6,4, 3H); 1,21-1,36 (м, 1H); 1,37-1,47 (м, 1H); 1,78-1,9 (м, 2H); 1,96-2,08 (м, 1H); 2,34 (дд, J=3,8, J=14,8, 1H); 2,46 (дд, J=9,7, J=14,8, 1H); 2,54-2,68 (м, 2H); 2,78 (д, J=7,4, 2H); 2,91 (д, J=8,3, 2H); 3,16 (дд, J=9,2, J=13,5, 1H); 3,29 (дд, J=5,6, J=13,5, 1H); 3,82 (д, J=9,8, 1H); 3,86 (дд, J=3,2, J=11, 1H); 4,03-4,13 (м, 2H); 4,13-4,21 (м, 2H); 4,49 (т, J=7,4, 1H); 4,63-4,78 (м, 3H); 6,69 (д, J=8,4, 2H); 6,97 (д, J=8,5, 2H); 6,99-7,06 (м, 2H); 7,11 (т, J=7,5, 1H); 7,35 (дд, J=1, J=8,5, 1H); 7,37 (д, J=8,2, 1H); 7,38-7,44 (м, 2H); 7,65 (шир.с, 1H); 7,70-7,82 (м, 3H).
Пример 5: H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Dap5-Val6-Cys7)-Thr8-NH2
Пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке: Fmoc-L-Thr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH, затем Fmoc-L-Val-OH, затем Fmoc-Dap(Boc)-OH, затем Fmoc-D-Trp-OH, затем Fmoc-L-Tyr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH и, наконец, Boc-β-(2-нафтил)-D-Ala-OH.
Соединение циклизуют путем образования дисульфидного мостика, затем отделяют от смолы, очищают и, наконец, получают в виде ацетата согласно описанной ранее методике, получая соединение H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Dap5-Val6-Cys7)-Thr8-NH2.
ВЭЖХ: tr=8,65 мин
МСВР (H2O) m/z=1054,42780 [M+H]+ (расч. 1054,42736)
1H-ЯМР (400 МГц, D2O): 0,76 (д, J=6,7, 3H); 0,77 (д, J=6,7, 3H); 1,06 (д, J=6,4, 3H); 1,21-1,36 (м, 1H); 1,37-1,47 (м, 1H); 1,78-1,9 (м, 2H); 1,96-2,08 (м, 1H); 2,34 (дд, J=3,8, J=14,8, 1H); 2,46 (дд, J=9,7, J=14,8, 1H); 2,54-2,68 (м, 2H); 2,78 (д, J=7,4, 2H); 2,91 (д, J=8,3, 2H); 3,16 (дд, J=9,2, J=13,5, 1H); 3,29 (дд, J=5,6, J=13,5, 1H); 3,82 (д, J=9,8, 1H); 3,86 (дд, J=3,2, J=11, 1H); 4,03-4,13 (м, 2H); 4,13-4,21 (м, 2H); 4,49 (т, J=7,4, 1H); 4,63-4,78 (м, 3H); 6,69 (д, J=8,4, 2H); 6,97 (д, J=8,5, 2H); 6,99-7,06 (м, 2H); 7,11 (т, J=7,5, 1H); 7,35 (дд, J=1, J=8,5, 1H); 7,37 (д, J=8,2, 1H); 7,38-7,44 (м, 2H); 7,65 (шир.с, 1H); 7,70-7,82 (м, 3H).
Пример 6: H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-N-Ac-Lys5-Val6-Cys7)-Thr8-NH2(H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys(Ac)5-Val6-Cys7)-Thr8-NH2)
Пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке: Fmoc-L-Thr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH, затем Fmoc-L-Val-OH, затем Fmoc-Lys(Ac)-OH, затем Fmoc-D-Trp-OH, затем Fmoc-L-Tyr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH и, наконец, Βοc-β-(2-нафтил)-D-Ala-OH.
Соединение циклизуют путем образования дисульфидного мостика, затем отделяют от смолы, очищают и, наконец, получают в виде ацетата согласно описанной ранее методике, получая соединение H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-N-Ac-Lys5-Val6-Cys7)-Thr8-NH2.
ВЭЖХ: tr=10,58 мин
МСВР (H2O) m/z=1138,4886 [M+H]+ (расч. 1138,4854)
1H-ЯМР (400 МГц, D2O/CD3CN): δ 0,45-0,59 (м, 1H); 0,62-0,73 (м, 1H); 1,10 (д, J=6,7, 3H); 1,13 (д, J=6,7, 3H); 1,3-1,45 (м, 3H); 1,36 (д, J=6,4, 3H); 1,7-1,82 (м, 1H); 2,07 (с, 3H); 2,35-2,45 (м, 1H); 2,87 (д, J=6,9, 1H); 3-3,28 (м, 4H); 3,54 (д, J=7,1, 1H); 4,08 (дд, J=3,1, J=10,7, 1H); 4,19 (д, J=9,4, 1H); 4,37-4,47 (м, 2H); 4,5 (д, J=3,4, 1H); 4,75-4,8 (м, 2H); 5,25-5,29 (м, 2H); 6,99 (д, J=8,4, 2H); 7,26-7,39 (м, 5H); 7,63 (д, J=8,1, 1H); 7,67-7,76 (м, 4H); 8 (с, 1H); 8,07-8,12 (м, 3H).
Пример 7: N-Ac-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-N-Ac-Lys5-Val6-Cys7)-Thr8-NH2(Ac-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys(Ac)5-Val6-Cys7)-Thr8-NH2)
Пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке: Fmoc-L-Thr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH, затем Fmoc-L-Val-OH, затем Fmoc-Lys(Ac)-OH, затем Fmoc-D-Trp-OH, затем Fmoc-L-Tyr(tBu)-OH, затем Fmoc-L-Cys(Trt)-OH и, наконец, Ac-β-(2-нафтил)-D-Ala-OH.
Соединение циклизуют путем образования дисульфидного мостика, затем отделяют от смолы, очищают и, наконец, получают в виде ацетата согласно описанной ранее методике, получая соединение N-Ac-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-N-Ac-Lys5-Val6-Cys7)-Thr8-NH2.
ВЭЖХ: tr=12,75 мин
МСВР (H2O) m/z=1202,4800 [M+Na]+ (расч. 1202,4779)
1H-ЯМР (400 МГц, D2O/CD3CN): δ 0,28-0,40 (м, 1H); 0,41-0,58 (м, 1H); 0,86 (д, J=6,7, 3H); 0,89 (д, J=6,7, 3H); 1,13 (д, J=6,4, 3H); 1,55-1,65 (м, 1H); 1,81 (с, 3H); 1,85 (с, 3H); 2,16-2,22 (м, 1H); 2,73-2,94 (м, 7H); 3-3,07 (м, 1H); 3,29 (дд, J=5,7, J=13,8, 1H); 3,89 (дд, J=3,1, J=11, 1H); 4 (д, J=9,3, 1H); 4,13-4,22 (м, 2H); 4,24 (д, J=3,8, 1H); 4,53 (дд, J=6,9, J=8, 1H); 4,77 (дд, J=5,7, J=8,9, 1H); 5,22 (дд, J=4,7, J=9,6, 1H); 5,29 (дд, J=7,3, J=7,9, 1H); 6,69 (д, J=8,4, 2H); 6,99-7,11 (м, 5H); 7,36 (д, J=8, 1H); 7,41-7,49 (м, 4H); 7,73-7,82 (м, 4H).
Пример 8: H-D-2-Nal1-цикло(HomoCys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2(H-D-2-Nal1-цикло(Hcy2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2)
Пептид получен согласно описанному выше протоколу путем последовательности сочетания, удаления защиты с группы Fmoc (9-флуоренилметилоксикарбонил) и сочетания со следующей аминокислотой на твердой подложке в следующем порядке