Способ лечения больных неалкогольным стеатогепатитом на фоне метаболического синдрома
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для лечения больных неалкогольным стеатогепатитом (НАСГ) на фоне метаболического синдрома (МС). На фоне комплексной терапии проводят 11-дневный инфузионный курс терапии препаратом ремаксол. При сохранении у больного гиперферментемии дополнительно проводят курс лечения препаратом цитофлавин по 1 таблетке 3 раза в день в течение не менее 10 дней в месяц на протяжении не менее 6 месяцев, таких курсов проводят от 1 до 3. В случае сохранения у больного гиперферментемии 11-дневный курс инфузионной терапии ремаксолом повторяют 1 раз в 6 месяцев, с последующим приемом цитофлавина по вышеуказанной схеме до нормализации гепатоспецифических ферментов и регрессии гипертриглицеридемии. Способ позволяет повысить эффективность лечения, ускорить регрессию гиперферментемии и гипертриглицеридемии. 1 табл., 3 пр.
Реферат
Изобретение относится к области медицины, а именно к гепатологии, и может использоваться при лечении больных неалкогольным стеатогепатитом (НАСГ) на фоне метаболического синдрома (МС).
В настоящее время неалкогольная жировая болезнь печени (НЖБП) является одним из наиболее широко распространенных заболеваний печени в мире. Так, по данным эпидемиологических исследований НЖБП страдает 10-40% населения земного шара [1; 2; 3; 4]. В ряде случаев НЖБП является первым органным поражением при МС и серьезным предиктором развития и прогрессирования сахарного диабета, кардиоваскулярной патологии [2; 5; 6].
Понятие НЖБП объединяет спектр поражений печени, включающий стеатоз печени, неалкогольный стеатогепатит (НАСГ), стеатофиброз и стеатоцирроз [2; 4; 6; 7]. Проведенные исследования показали, что НАСГ - состояние печени, тесно ассоциированное с компонентами МС, и является печеночной манифестацией данной патологии [2; 7; 8]. Частота развития НАСГ у пациентов с МС составляет 37,5% случаев [9]. У пациентов с ожирением НАСГ встречается в 20-47% случаев, с сахарным диабетом 2 типа - в 15% случаев, с дислипидемией - в 20-80% случаев [2]. Как известно, отсутствие соответствующей терапии НАСГ в 5-25% случаев неминуемо приводит к прогрессии НЖБП до стадии цирроза печени, развитию портальной гипертензии, печеночно-клеточной недостаточности и гепатоцеллюлярной карциномы [2; 6; 10].
Установлено, что НАСГ играет значимую роль в инициации и усугублении атерогенной дислипидемии [2; 6; 11], что увеличивает риск развития ИБС и таких сердечно-сосудистых осложнений как острый инфаркт миокарда (ОИМ) и острое нарушение мозгового кровообращения (ОНМК) [2; 5]. Кроме того, НАСГ уделяют большое значение в прогрессии нарушений углеводного обмена [2; 6]. Длительно существующая гипергликемия также сопровождается повышенным риском кардиоваскулярных осложнений. Таким образом, наличие одновременно нарушений нескольких видов обменов при НАСГ на фоне МС диктует необходимость применения комплексной патогенетической терапии, направленной не только на улучшение функционального состояния печени, но и коррекцию коморбидных состояний, в частности атерогенную дислипидемию.
Как известно, развитие НАСГ связывают с гипотезой «параллельных множественных ударов» (multiple parallel hits), согласно которой патогенез НЖБП представляет собой обобщающую модель взаимодействия таких факторов как инсулинорезитентность (ИР), активация процессов перекисного окисления липидов (ПОЛ), системная продукция провоспалительных цитокинов (ФНОα, ИЛ-6, -8 и др.) и синтез адипоцитокинов жировой тканью (лептин, резистин, адипонектин) [1].
Основными факторами патогенеза НЖБП является инсулинорезистентноть и оксидативный стресс [2; 3; 6; 8]. В условиях инсулинорезистентности активируются процессы липолиза и мобилизируются из периферических тканей жирные кислоты. Избыточное количество свободных жирных кислот (СЖК) поступает в печень, что приводит к жировому перерождению печеночной паренхимы и формированию стеатоза. Значение в развитии жировой дегенерации печени также играет синтез триглицеридов de novo и уменьшение экспорта липидов из печеночной паренхимы [2; 3].
Определяющую роль в патогенезе оксидативного стресса при НАСГ уделяют митохондриальной дисфункции [2; 3; 6]. Известно, что митохондрии участвуют в таких основных метаболических процессах как синтез жирных кислот, β-окисление, окислительное фосфолирирование и сигнальные пути клеточной гибели. Так, в матриксе митохондрий СЖК подвергаются β-окислению с последующей их утилизацией в цикле Кребса и образованием восстановленных форм НАДН и ФАДН2, выполняющих перенос электронов на цитохромы дыхательной цепи, и необходимых для осуществления процессов окислительного фосфолирирования с образованием АТФ [2; 12]. Поэтому митохондрии играют центральную роль в энергетическом обмене клетки [12].
В условиях инсулинорезистентности и избыточного поступления СЖК в гепатоциты усиливаются процессы β-окисления СЖК, что приводит к увеличению образования активных форм кислорода (АФК) в процессе окислительного фосфолирирования [2; 3]. Чрезмерное образование реактогенных АФК вызывает повреждение митохондриальной ДНК и ферментов, приводит к нарушению нормального функционирования дыхательной цепи - подавлению или разобщению окислительного фосфолирирования [2; 3] с последующим снижением аэробного дыхания и синтеза АТФ. Разобщение окислительного фосфолирирования также возможно под действием ряда биологически активных веществ, синтезируемых в избытке при НАСГ, в частности ФНО-α [3; 13]. Подавление или разобщение окислительного фосфолирирования приводит к переключению энергопродукции на анаэробный гликолиз и развитию лактацидоза, что еще более усугубляет патологический процесс, т.к. радикал-образующие системы митохондрий и микросом являются pH-зависимыми [14]. В условиях сниженной энергопродукции и лактацидоза полноценная трансформация метаболитов в циклах анаэробного и аэробного гликолиза резко затруднена, что дополнительно влечет усиление синтеза активных форм кислорода [15] и интенсификации процессов ПОЛ с развитием оксидативного стресса и антиоксидантной недостаточности.
Кроме того, в условиях избыточного поступления СЖК на фоне митохондриальной дисфункции, сопровождающейся нарушением β-окисления СЖК, клеточного дыхания и процессов эстерификации, окисление СЖК происходит по альтернативному пути - в микросомальных и пероксисомальных структурах клетки, что сопровождается образованием свободных радикалов и усилением оксидативного стресса [2; 3; 6].
Продукты свободно-радикальных реакций и промежуточные метаболиты усугубляют имеющуюся митохондриальную дисфункцию - усиливают функциональные нарушения и способствуют структурной дезорганизации в митохондриях с последующей активацией сигнальных путей и гибели клетки путем апоптоза или некробиоза [2; 14]. Избыточное образование продуктов ПОЛ, являясь одним из факторов прогрессирования НАСГ, способствует развитию и усугублению воспалительных изменений в печени, а также активации процессов фиброгенеза [2; 6; 8]. Именно эффектами ПОЛ объясняется основная часть наблюдаемых гистологических изменений в ткани печени, в том числе фибротических процессов [2; 8].
Таким образом, коррекция таких патологических состояний, как митохондриальная дисфункция и нормализация энергетического обмена клетки способствует уменьшению выраженности оксидативного стресса и интенсификации процессов ПОЛ, восстановлению функциональной активности клеток печени [8] и регрессии процессов фиброзирования паренхимы печени. В связи с этим является перспективным использование в комплексной терапии НАСГ лекарственных средств, направленных на коррекцию энергопродукции, митохондриальной дисфункции и метаболических нарушений в клетке.
В настоящее время не существует единого алгоритма терапии НАСГ. Современные подходы к лечению НАСГ, главным образом, направлены на устранение или ослабление факторов риска прогрессирования НАСГ (похудание, борьба с гиподинамией, коррекция гиперлипидемии, гипергликемии, отмена потенциально гепатотоксичных препаратов) [8; 16]. На выбор лекарственных препаратов влияет выраженность клинических проявлений заболевания, биохимических синдромов и наличие сопутствующих патологических состояний, в частности атерогенной дислипидемии и гипергликемии.
Для терапии пациентов с НАСГ на фоне МС используют препараты с разной патогенетической направленностью. Так, большое распространение получило применение лекарственных средств, повышающих чувствительность периферических тканей к инсулину - инсулинсенситайзеров. Данная группа препаратов оказывает влияние на основной патогенетический механизм развития МС и НАСГ - инсулинорезистентность. Однако, несмотря на перспективность использования инсулинсенситайзеров в комплексной терапии МС и НАСГ, их применение ограничено возможным развитием гепато- и нефротоксических эффектов. Так, по данным производителей в 7-10% случаев имеет место развитие синдрома цитолиза как основного побочного явления препаратов группы метформина. В то время как в клинической практике эти осложнения наблюдаются гораздо чаще [17].
В настоящее время имеются исследования, указывающие на положительный эффект терапии статинами пациентов с НЖБП. Однако применение данной группы препаратов также ограничено у пациентов с МС и НЖБП в виду возможного развития гепатотоксичности [18; 19].
На сегодняшний день при хронических заболеваниях печени различной этиологии наиболее широко используемой группой гепатопротекторных препаратов являются лекарственные средства растительного происхождения, содержащие флавоноиды расторопши [20]. Существуют единичные клинические исследования по изучению эффективности этой группы препаратов при НАСГ и МС. Кроме того, имеются данные о слабом влиянии этих препаратов на гистологическую картину в ткани печени и выживаемость пациентов [2].
Достаточно распространенной группой препаратов для лечения НАСГ являются эссенциальные фосфолипиды (ЭФЛ) [20, 21]. Предполагают, что действие ЭФЛ обусловлено восполнением дефицита фосфолипидов клеточных мембран. Однако положительное влияние только за счет стабилизации мембранных структур клетки без воздействия на другие звенья патогенеза НАСГ зачастую являются недостаточными [20].
В настоящее время в формировании НЖБП доказана роль синдрома избыточного бактериального роста и эндоксинемии. Однако применение лекарственных препаратов, направленных исключительно на коррекцию дисбиоза кишечника, не может эффективно нивелировать разнонаправленные механизмы развития и прогрессирования НАСГ, а также значимо влиять на другие патогенетически важные компоненты МС [2].
В качестве прототипа нами выбран способ медикаментозного лечения НАСГ на фоне метаболического синдрома, заключающийся в применении метаболического корректора Ремаксола по 400 мл внутривенно ежедневно в течение 11 дней в составе комплексной стандартной терапии [22].
Выбор в качестве прототипа данного лекарственного препарата обусловлен его универсальным воздействием на такие важные звенья патогенеза НЖБП и МС как митохондриальная дисфункция и оксидативный стресс. Доказано положительное влияние ремаксола на течение НАСГ на фоне МС, заключающееся в уменьшении основных клинико-биохимических синдромов, атерогенной дислипидемии.
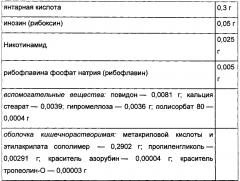
Ремаксол представляет собой комплексный лекарственный препарат, эффекты которого обусловлены входящими в его состав янтарной кислотой, метионином, инозином и никотинамидом. Благодаря содержанию метионина в комбинации с другими активными веществами в составе ремаксола, происходит синтез эндогенного S-аденозил-L-метионина. S-аденозил-L-метионин участвует в трех типах биохимических реакций - трансметилировании (синтез фосфатидилхолина, повышающего текучесть и пластичность мембран), транссульфурировании (синтез глутатиона - важнейшего клеточного антиоксиданта, детоксикация желчных кислот) и аминопропилировании (синтез полиаминов, участвующих в формировании структур рибосом, регенерации клеточных органелл при их повреждении) [2; 23; 24]. Доказано положительное влияние при НАСГ S-аденозил-L-метионина на гиперпродукцию провоспалительных цитокинов [2; 23; 24]. Наличие антиоксидантного эффекта S-аденозил-L-метионина обусловлено его участием в синтезе глутатиона, которому отводится ключевая роль в защите клеток печени от оксидативного стресса.
Наряду с метионином активным веществом лекарственного препарата ремаксол является янтарная кислота. Янтарная кислота обладает прямым модифицирующим действием на клеточный метаболизм путем активации аэробного гликолиза, усиления окислительных процессов в цикле Кребса, увеличения внутриклеточного фонда макроэргических соединений (АТФ и креатинфосфата), интенсификации перехода глюкозы в гликоген, активации ферментов первой линии свободно-радикальной защиты (супероксиддисмутазы и каталазы). Потенцирующие эффекты других биологически активных компонентов ремаксола способствуют восстановлению дыхательной цепи митохондрий (никотинамид), усилению синтеза макроэргических молекул (инозин).
К недостаткам прототипа можно отнести недостаточную эффективность 11-дневного инфузионного курса ремаксола для достижения полной нормализации основных клинико-биохимических синдромов и атерогенной дислипидемии (гипертриглицеридемии) у пациентов с НАСГ и МС в виду своей непродолжительности, а также отсутствие эквивалентной лекарственной формы препарата для последующего перорального приема с целью улучшения достигнутого терапевтического результата.
Техническим результатом изобретения является воздействие на основные механизмы патогенеза НАСГ у пациентов с НАСГ и МС, что повысит эффективность лечения за счет более эффективной регрессии гиперферментемии и атерогенной дислипидемии (гипертриглицеридемии).
Технический результат изобретения достигается тем, что способ лечения больных неалкогольным стеатогепатитом на фоне метаболического синдрома заключается в проведении комплексной терапии, на фоне которой проводят 11-дневный инфузионный курс терапии лекарственным препаратом ремаксол, после чего при сохранении у больного гиперферментемии после проведения 11-дневного вышеуказанного курса лечения дополнительно проводят курс лечения лекарственным препаратом цитофлавином, который принимают перорально по 1 таблетке 3 раза в день в течение не менее 10 дней в месяц на протяжении не менее 6 месяцев, таких курсов проводят от 1 до 3. В случае сохранения у больного гиперферментемии 11-дневный курс инфузионной терапии ремаксолом на фоне вышеуказанной комплексной терапии повторяют 1 раз в 6 месяцев, с последующим приемом цитофлавина по вышеуказанной схеме до нормализации гепатоспецифических ферментов и регрессии гипертриглицеридемии. При сохранении гиперферментемии после 3 курсов лечения (через 18 месяцев) предложенную терапию прекращают.
Способ осуществляется следующим образом.
Пациентам с НАСГ на фоне МС в составе комплексной общепринятой терапии (растворы электролитов, витамины, ферменты, растительные лекарственные препараты на основе расторопши, эссенциальные фосфолипиды, гипотензивные препараты) проводят курс терапии метаболическим корректором ремаксолом в течение 11 дней по 400 мл ежедневно капельно. При сохранении у больного гиперферментемии по окончанию инфузионного курса, дополнительно в терапию включают прием перорального сукцинатсодержащего цитопротектора цитофлавина по 1 таблетке 3 раза в день в течение 10 дней каждого месяца на протяжении 6 месяцев, таких курсов проводят от 1 до 3. В случае сохранения у больного гиперферментемии курс инфузионной терапии ремаксолом на фоне комплексной терапии НАСГ повторяют 1 раз в 6 месяцев с последующим приемом цитофлавина по вышеуказанной схеме до нормализации гепатоспецифических ферментов и регрессии гипертриглицеридемии, при сохранении гиперферментемии после 3 курсов лечения (через 18 месяцев) предложенную терапию прекращают. Таким образом, продолжительность терапии составляет от 6 до 18 месяцев.
Каждые 3 месяца пациент выполняет контрольные исследования клинического, биохимического анализа крови и липидограммы. В случае регрессии основных клинико-биохимических синдромов, а также нормализации гипертриглицеридемии эффект считается достигнутым.
Отличительные существенные признаки изобретения:
- После 11-дневного курса инфузионной терапии лекарственным препаратом ремаксол, проводимого на фоне комплексного стандартного лечения пациентов с НАСГ на фоне метаболического синдрома, при сохранении у больного гиперферментемии дополнительно проводят курс лечения цитофлавином перорально.
- Цитофлавин принимают по 1 таблетке 3 раза в день не менее 10 дней каждого месяца на протяжении не менее 6 месяцев, до достижения регрессии гиперферментемии. Таких курсов проводят от 1 до 3. В случае сохранения у больного гиперферментемии после проведенного лечения курс инфузионной терапии ремаксолом на фоне общепринятой терапии НАСГ повторяют 1 раз в 6 месяцев с последующим приемом цитофлавина по вышеуказанной схеме до нормализации гепатоспецифических ферментов и регрессии гипертриглицеридемии, при сохранении клинико-биохимических синдромов через 18 месяцев, указанную терапию прекращают.
Причинно-следственная связь между отличительными существенными признаками и достигаемым результатом:
- Сукцинатсодержащие препараты Ремаксол и цитофлавин относят к группе субстратных антигипоксантов, фармакологические эффекты которых обусловлены наличием янтарной кислоты, и направлены на коррекцию митохондриальной дисфункции и восстановление утраченной в условиях гипоксии и оксидативного стресса, энергосинтезирующей функции клеток [2; 8; 15; 16].
Являясь продуктом пятой и субстратом шестой реакции цикла трикарбоновых кислот, янтарная кислота (ЯК) (сукцинат) выполняет каталитическую функцию по отношению к циклу Кребса, снижает концентрацию в крови других интермедиатов цикла (лактата, пирувата, цитрата). Избыточное количество сукцината в клетке приводит к быстрому его окислению и ресинтезу клетками АТФ. Кроме того, уменьшение скорости продукции лактата свидетельствует о снижении интенсивности анаэробного гликолиза и восстановлении потребления кислорода тканями за счет усиления транспорта электронов в дыхательной цепи митохондрий, то есть восстановлении клеточного дыхания [2; 25].
Окисление ЯК осуществляется ферментом сукцинатдегидрогеназой, располагающейся на внутренней стороне мембраны митохондрий. Активность сукцинатдегидрогеназы не зависит от концентрации НАД/НАДН+ и возрастает в условиях торможения НАД-зависимого транспорта электронов, сохраняя тем самым энергосинтезирующую функцию клетки даже в условиях нарушенного НАД-зависимого дыхания. Таким образом, мощность энергопродукции, использующей сукцинат, значительно превосходит другие системы энергообеспечения клеток [2; 25].
Янтарная кислота способствует интенсификации процессов потребления кислорода тканями за счет усиления транспорта электронов в митохондриях и повышения трансмембранного градиента концентрации кислорода, уменьшения оксигенации цитоплазмы и ядра [2; 25; 26]. Таким образом, янтарная кислота восстанавливает клеточное дыхание, препятствует развитию лактацидоза и активации pH-зависимых радикал-образующих систем митохондрий, способствует снижению накопления токсичных метаболитов кислорода, стабилизируя структуру и функциональную активность митохондрий. Восстановление НАД-зависимого клеточного дыхания и способность интенсифицировать утилизацию кислорода тканями характеризуют антигипоксическое действие янтарной кислоты и ее солей.
Положительное влияние инфузионной терапии метаболического корректора Ремаксола на течение НАСГ и МС описано ранее. Однако инфузионный курс сукцинатсодержащим лекарственным препаратом Ремаксолом приводил к улучшению течения заболевания, но был недостаточным для достижения регрессии стеатогепатита и его перехода в стеатоз печени (нормализации гепатоспецифических ферментов), что, скорее всего, обусловлено небольшой продолжительностью курса (согласно инструкции по применению рекомендуемая длительность курса лечения не превышает 12 дней). В связи с вышеизложенным, в заявленном способе терапевтический эффект применения Ремаксола усилен последующим регулярным приемом перорального сукцинатсодержащего лекарственного препарата. Так как в настоящее время отсутствуют эквивалентные Ремаксолу лекарственные препараты для перорального применения, то для осуществления поставленных задач был предложен прием сукцинатсодержащего цитопротектора Цитофлавина.
Цитофлавин представляет собой комплексный цитопротектор, особенности фармакологического действия которого обусловлены входящими в его состав активными веществами, обладающими однонаправленным влиянием на разные энергосинтезирующие системы организма. Основным компонентом цитофлавина является янтарная кислота, положительное влияние которой на значимые звенья патогенеза НАСГ и МС (митохондриальную дисфункцию и оксидативный стресс) были описаны выше. Синергичным действием обладают входящие в его состав никотинамид, рибоксин (инозин) и рибофлавин [15]. При изучении механизмов фармакологического действия цитофлавина было установлено, что этот препарат способствует ликвидации явлений гипоксии и эндотоксикоза, а также снижает интенсивность свободно-радикального окисления, развивающихся при НАСГ, в частности уменьшается концентрация МДА в сыворотке крови [27].
Неспецифичность терапевтических эффектов янтарной кислоты обеспечивает ее положительное влияние на нарушения липидного обмена, сопровождающие НАСГ и МС.
Известно, что имеется тесная взаимосвязь между НЖБП и атерогенной дислипидемией. [2; 6]. При этом наибольшее значение отводят гипертриглицеридемии и гиперхолестеринемии [28]. Так, в условиях инсулинорезистентности и гиперинсулинемии увеличивается продукция триглицеридов, возрастает секреция ЛПОНП на фоне снижения их катаболизма, образуются модифицированные ЛПНП, снижается уровень ЛПВП [11].
Доказано благоприятное воздействие препаратов янтарной кислоты на процессы атерогенеза у пациентов с НАСГ и МС, включая возможность коррекции атерогенной дислипидемии, в частности гипертриглицеридемии [8; 16]. Возможным патогенетическим механизмом наличия дополнительного гиполипидемического эффекта сукцинатсодержащих лекарственных препаратов является нормализация таких метаболических процессов в клетке как β-окисления СЖК, митохондральное дыхание и эстерификация СЖК.
Положительное влияние на атерогенную дислипидемию, в том числе гипертриглицеридемию, является важным дополнительным фармакологическим свойством сукцинатсодержащих лекарственных препаратов в условиях полиорганного поражения при НАСГ и МС и наличия повышенных рисков кардиоваскулярных осложнений.
ЦИТОФЛАВИН®.
ЛАТИНСКОЕ НАЗВАНИЕ: CYTOFLAVIN®.
ДЕЙСТВУЮЩЕЕ ВЕЩЕСТВО: ИНОЗИН + НИКОТИНАМИД + РИБОФЛАВИН + ЯНТАРНАЯ КИСЛОТА.
ATX: N07XX Препараты для лечения заболеваний нервной системы другие.
Фармакологическая группа: метаболическое средство [Другие нейротропные средства в комбинации].
Нозологическая классификация (МКБ-10):
- Е63 Физические и умственные перегрузки
- F48.0 Неврастения
- I67.2 Церебральный атеросклероз
- I67.4 Гипертензивная энцефалопатия
- I67.9 Цереброваскулярная болезнь неуточненная
- I69.3 Последствия инфаркта мозга
- R45.4 Раздражительность и озлобление
- R53 Недомогание и утомляемость
Состав:
Описание лекарственной формы. Таблетки: круглые двояковыпуклые, покрытые оболочкой красного цвета. На поперечном срезе видны два слоя. Ядро - от желтого до желто-оранжевого цвета.
Фармакологическое действие: метаболическое.
Фармакодинамика. Фармакологические эффекты обусловлены комплексным воздействием входящих в состав препарата Цитофлавин® компонентов.
Янтарная кислота - эндогенный внутриклеточный метаболит цикла Кребса, выполняющий в клетках организма универсальную энергосинтезирующую функцию. При участии кофермента флавинадениндинуклеотида (ФАД) янтарная кислота митохондриальным ферментом сукцинатдегидрогеназой быстро трансформируется в фумаровую кислоту и далее в другие метаболиты цикла трикарбоновых кислот. Стимулирует аэробный гликолиз и синтез АТФ в клетках. Конечным продуктом метаболизма янтарной кислоты в цикле Кребса является двуокись углерода и вода. Янтарная кислота улучшает тканевое дыхание за счет активации транспорта электронов в митохондриях.
Рибофлавин (витамин В2) является коферментом ФАД, активирующим сукцинатдегидрогеназу и другие окислительно-восстановительные реакции цикла Кребса.
Никотинамид (витамин РР) - амид никотиновой кислоты. Никотинамид в клетках, путем каскада биохимических реакций, трансформируется в форму никотинамидадениннуклеотида (НАД) и его фосфата (НАДФ), активируя никотинамидозависимые ферменты цикла Кребса, необходимые для клеточного дыхания и стимуляции синтеза АТФ.
Инозин является производным пурина, предшественником АТФ. Обладает способностью активировать ряд ферментов цикла Кребса, стимулируя синтез ключевых ферментов-нуклеотидов: ФАД и НАД.
Таким образом, все компоненты препарата Цитофлавин® являются естественными метаболитами организма и стимулируют тканевое дыхание. Метаболическая энергокоррекция, антигипоксическая и антиоксидантная активность препарата, определяющие его фармакологические свойства и лечебную эффективность, обусловлены взаимодополняющим действием янтарной кислоты, инозина, никотинамида и рибофлавина.
Показания препарата ЦИТОФЛАВИН®. У взрослых в комплексной терапии: последствия инфаркта мозга; другие цереброваскулярные болезни (церебральный атеросклероз, гипертензивная энцефалопатия); неврастения (повышенная раздражительность, утомляемость, утрата способности к длительному умственному и физическому напряжению).
Противопоказания. Индивидуальная непереносимость компонентов препарата. Не рекомендуется применение у детей до 18 лет в связи с недостаточностью данных об эффективности и безопасности. С осторожностью: болезни органов пищеварения (эрозии, язвы желудка и/или двенадцатиперстной кишки, гастриты и дуодениты (в стадии обострения); артериальная гипотензия; нефролитиаз; сопутствующая подагра; гиперурикемия. Если у пациента одно из перечисленных заболеваний, перед приемом препарата необходимо проконсультироваться с врачом.
Побочные действия. Головная боль, боли или дискомфорт в эпигастральной области. Возможны аллергические реакции в виде кожной гиперемии и зуда. К нежелательным реакциям относятся: транзиторная гипогликемия, гиперурикемия, обострение сопутствующей подагры.
Способ применения и дозы. Внутрь, по 2 табл. 2 раза в сутки с интервалом между приемами 8-10 ч. Таблетки следует принимать не менее чем за 30 мин до еды, не разжевывая, запивая водой (100 мл). Рекомендован прием препарата в утреннее и дневное время суток (не позднее 18 ч). Продолжительность курса лечения - 25 дней. Назначение повторного курса возможно с интервалом не менее 1 мес.
В литературе описана способность цитофлавина (за счет наличия в своем составе инозина) стимулировать аденозинергические рецепторы, что сопровождается снижением концентрации адгезивных молекул ICAM-1, а также ограничивает активность воспалительных цитокинов, в том числе ФНОα [15]. Имеются данные о применении цитофлавина в составе комплексной терапии НАСГ с целью устранения таких патогенетически важных синдромов как эндогенная «метаболическая» интоксикация и иммунотоксикоз за счет снижения у пациентов с НАСГ уровня МДА, диеновых конъюгатов, а также циркулирующих иммунных комплексов [27]. Цитофлавин принимали по 2-3 таблетки 2 раза в день, курс лечения - 20-25 дней. Однако данных о применении цитофлавина в составе комплексной терапии НАСГ с целью нормализации основных клинико-биохимических синдромов (цитолиза и холестаза), а также регрессии атерогенной дислипидемии (гипертриглицеридемии) нет. Указанная цель достигается в заявляемом способе за счет использования предложенной вышеуказанной схемы лечения.
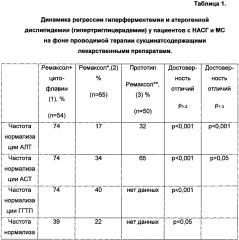
Совокупность отличительных существенных признаков является новой и позволяет комплексно воздействовать на основные звенья патогенеза НАСГ на фоне МС, что повышает эффективность лечения, по сравнению со способом прототипом, на 57% по данным полной регрессии гиперферментемии и на 17% - по результатам нормализации гипертриглицеридемии.
Приводим примеры из клинической практики:
Клинический пример №1.
Пациент Б., 48 лет, находился на стационарном лечении в октябре 2013 г. в клинике внутренних болезней и нефрологии СЗГМУ им. И.И. Мечникова по поводу НАСГ на фоне МС. Из анамнеза заболевания известно, что при плановом обследовании по данным биохимического анализа крови выявлен синдром цитолиза, (АЛТ - 69 Ед/л, ACT - 45 Ед/л), antiHCV и HBsAg отрицательные. По данным эластографии печени (Fibroscan, ECHOSENS S.А.) общий результат эластичности печени составил 14,4 кПа, что соответствовало цирротической стадии хронического диффузного заболевания печени (F IV по METAVIR). В сентябре 2013 г. с целью окончательной верификации диагноза выполнена пункционная гепатобиопсия. При исследовании гепатобиоптата выявлено: единичные портальные тракты расширены, фиброзированы со слабовыраженной лимфогистиоцитарной инфильтрацией, многочисленными короткими и полными порто-портальными септами, внутридольковым очаговым фиброзом и фиброзом центральных вен, синусоиды расширены с немногочисленными скоплениями сегментоядерных лейкоцитов, гепатоциты с диффузным крупнокапельным ожирением и единичными рассеянными внутридольковыми фокальными некрозами, умеренным ядерным полиморфизмом. Таким образом, морфологическая картина соответствовала стеатогепатиту с минимальной активностью (ИГА - 3б) и тяжелым фиброзом. За время нахождения в стационаре по данным клинического анализа крови выявлена тромбоцитопения - 174*109/л, как проявление начальных проявлений портальной гипертензии (гиперспленизма). На момент поступления в стационар по данным биохимического анализа крови - синдром цитолиза (АЛТ - 60 Е/л, ACT - 32 Е/л), гипертриглицеридемия - 1,9 ммоль/л. По данным УЗИ органов брюшной полости - гепатомегалия, ультразвуковые - признаки жирового гепатоза, диффузных изменений поджелудочной железы.
Состояние расценили как неалкогольный стеатогепатит минимальной степени активности (гепатобиопсия от 09.2013 г.) с начальными проявлениями портальной гипертензии (гиперспленизм) на фоне МС.
За время нахождения в стационаре пациенту проводилась стандартная комплексная терапия, включающая прием растворов электролитов, витаминов группы В, ферментов (панкреатина), растительных лекарственных препаратов на основе расторопши (гепабене), эссенциальных фосфолипидов (эссливер форте), гипотензивных препаратов (эналаприла), с применением метаболического корректора Ремаксола по 400 мл внутривенно ежедневно в течение 11 дней. На фоне проводимой терапии наблюдалась регрессия тромбоцитопении (тромбоциты - 254*109/л), свидетельствующая о регрессии гиперспленизма (как проявления портальной гипертензии), уменьшение синдрома цитолиза (АЛТ - 56 Ед/л, ACT - 38 Ед/д). В связи с сохраняющейся биохимической активностью заболевания после курса инфузионной терапии метаболическим корректором ремаксолом к терапии добавлен пероральный прием сукцинатсодержащего цитопротектора цитофлавина по 1 табл. 3 раза в день 10 дней каждого месяца на протяжении 6 месяцев. В виду наличия у пациента тяжелого фиброза печени было проведено 2 курса терапии по предложенной схеме (последовательного применения ремаксола с последующим переходом на цитофлавин в течение 6 месяцев). После окончания второго курса лечения по данным биохимического анализа крови выявлена регрессия синдрома цитолиза (АЛТ - 41 Ед/л, ACT - 34 Ед/л) и гипертриглицеридемии (ТГ - 1,37 ммоль/л), наблюдавшихся ранее у пациента. При проведении повторной эластометрии печени (Fibroscan, ECHOSENS S.А.) выявлено уменьшение фиброзных изменений печени до F I по METAVIR (общий результат эластичности печени составил 6,4 кПа). Полученные данные свидетельствуют не только о нормализации основных гепатоспецифических ферментов и гипертриглицеридемии, но и об уменьшении фиброзных изменений печени, включая случаи тяжелого фиброза.
Клинический пример №2.
Пациентка М., 49 лет, в январе 2012 г. находилась на лечении в клинике внутренних болезней и нефрологии СЗГМУ им. И.И. Мечникова. Из анамнеза заболевания известно, что с 2010 г по данным УЗИ органов брюшной полости выявлены диффузные изменения паренхимы печени по типу стеатоза, по данным биохимического анализа крови наблюдался синдром цитолиза (с максимальным повышением АЛТ до 185 Ед/л) и холестаза (с максимальным повышением ГГТП до 460 Е/л), вирусные маркеры (antiHCV и HBsAg) - отрицательные, аутоиммунная панель печени -без отклонений от нормы. Алкогольный анамнез не отягощен. Неоднократно получала курсы гепатопротекторной терапии без значимого эффекта. На момент поступления в стационар по данным биохимического анализа крови выявлен синдром цитолиза (АЛТ - 68 Е/л, ACT - 36 Е/л), синдром холестаза (ГГТП - 247 Ед/л), атерогенная дислипидемия (общий холестерин - 8,2 ммоль / л, триглицериды - 2,75 ммоль / л). По данным эластографии печени (Fibroscan, ECHOSENS S.А.) общий результат эластичности печени составил 3,5 кПа, что соответствовало F 0 по METAVIR. Состояние расценили как неалкогольный стеатогепатит, синдром холестаза. В дальнейшем пациентке была выполнена гепатобиопсия, по результатам которой диагноз НАСГ подтвержден (ИГА по Knodell - 3 балла). В связи с активностью основного заболевания от применения гиполипидемических лекарственных препаратов решено воздержаться.
За время нахождения в стационаре пациентке проводилась стандартная комплексная терапия, включающая прием растворов электролитов, витаминов группы В, ферментов (панкреатина), растительных лекарственных препаратов на основе расторопши (гепабене), эссенциальных фосфолипидов (эссливер форте), гипотензивных препаратов (эналаприла), с применением метаболического корректора с гепатопротективной активностью Ремаксола по 400 мл внутривенно ежедневно в течение 11 дней. На фоне лечения отмечена регрессия синдрома цитолиза (АЛТ - 35 Ед/л, ACT - 28 Ед/л), уменьшение синдрома холестаза (ГГТП - 113 Ед/л), снижение гиперхолестеринемии до 7,4 ммоль/л. Однако в связи с сохраняющимся синдромом холестаза и гипертриглицеридемией после окончания курса инфузионной терапии рекомендован прием сукцинатсодержащего цитопротектора цитофлавина по 1 табл. 3 раза в день 10 дней каждого месяца на протяжении 6 месяцев. В связи с наличием у больной синдрома холестаза, отягощающего течение основного заболевания было проведено 3 курса терапии по предложенной схеме (последовательного применения ремаксола с последующим переходом на цитофлавин в течение 6 месяцев). Уже в середине 1-ого курса лечения наблюдалась положительная динамика в виде регрессии гипертриглицеридемии, нормализация всех биохимических показателей (АЛТ - 15,7 Ед/л, ACT - 22,6 Ед/л, ГГТП - 54 Ед/л) была отмечена после третьего курса выше указанной терапии. Полученные данные свидетельствуют о переходе неалкогольного стеатогепатита в стеатоз печени в виду полной регрессии основных клинико-биохимических синдромов и отсутствия фиброзных изменений в печени, а также нормализации гипертриглицеридемии на фоне предложенного способа терапии.
Клинический пример №3.
Пациентка Ф., 60 лет, в сентябре 2013 г. находилась на лечении в клинике внутренних болезней и нефрологии СЗГМУ им. И.И. Мечникова. Из анамнеза заболевания известно, что с 2008 г по данным УЗИ органов брюшной полости выявлены диффузные изменения паренхимы печени по типу стеатоза, липоматоз поджелудочной железы. С 2009 г. по данным биохимического анализа крови наблюдался синдром цитолиза (АЛТ - 85 Ед/л, ACT - 65 Ед/л) и холестаза (ГГТП - 180 Ед/л), вирусные маркеры (antiHCV и HBsAg) -отрицательные, аутоиммунная панель печени - без отклонений от нормы. Алкогольный анамнез не отягощен. Состояние было расценено как НАСГ на фоне МС: избыточная масса тела, артериальная гипертензия, дислипидемия, нарушение толерантности к глюкозе. Неоднократно получала курсы гепатопротекторной терапии без значимого эффекта. В дальнейшем пациентке для окончательной верификации патологии выполнена гепатобиопсия, по результатам которой подтвержден диагноз НАСГ (гистологическое заключение: хронический стеатогепатит со слабой активностью, ИГА по Knodell - 7 баллов, стадия по Desmet - 1). Больная неоднократно получала инфузионную терапию гепатопротективными лекарственными препаратами, однако значимого эффекта не наблюдалось. На момент поступления в клинику по данным биохимического анализа крови выявлен синдром цитолиза (АЛТ - 87 Е/л, ACT - 47 Е/л), синдром холестаза (ГГТП - 216 Ед/л), атерогенная дислипидемия (общий холестерин - 5,8 ммоль / л, триглицериды - 1,8 ммоль / л). П