Жидкие вакцины для множественных серогрупп менингококков
Иллюстрации
Показать всеГруппа изобретений раскрывает водные иммуногенные композиции, которые, после введения субъекту, способны индуцировать иммунный ответ, являющийся бактерицидным в отношении, по меньшей мере, серогруппы W135 N. meningitidis и профилактическим против заболевания, вызванного Н. influenzae типа b, включающие конъюгированный капсульный сахаридный антиген серогруппы W135 и конъюгированный капсульный сахаридный антиген Н. influenzae типа b(Hib); где указанный капсульный сахаридный антиген Hib конъюгирован с мутантом дифтерийного токсина CRM197 или столбнячным анатоксином и сахарид серогруппы W135 конъюгирован с дифтерийным анатоксином, а также способ иммунизации против бактериального менингита, включающий введение вышеуказанных композиций, и их применение для производства лекарственных средств. Группа изобретений обеспечивает защиту широкого спектра против инфекции серогруппы B, а также общую активность против серогруппы W135 менингококка. 8 н. и 55 з.п. ф-лы, 9 табл.
Реферат
Все цитируемые документы приведены здесь в качестве ссылки в полном объеме.
Область техники
Настоящее изобретение относится к иммунизации против бактериальных менингитов и, конкретно, к комбинированной иммунизации против бактериальных менингитов, вызванных множественными патогенами.
Предшествующий уровень техники
N.meningitidis представляет собой неподвижный, грамотрицательный патоген человека, заселяющий глотку и вызывающий менингит (и, иногда, сепсис в отсутствие менингита). Он вызывает как эндемическое, так и эпидемическое заболевание. После введения конъюгированной вакцины против Haemophilus influenzae типа B (Hib), N.meningitidis является основной причиной бактериальных менингитов в США. Третьим патогеном, ответственным за бактериальные менингиты, является Streptococcus pneumoniae, но в настоящее время доступна эффективная вакцина (PrevNar™ [1]). Как и Hib-вакцина, пневмококковая вакцина основана на конъюгированных капсульных сахаридных антигенах.
Исходя из капсульного полисахарида организма, идентифицировали различные серогруппы N.meningitidis, включая (A, B, C, H, I, K, L, 29E, W135, X, Y и Z). Серогруппа A представляет собой патоген, наиболее часто вовлеченный в эпидемическое заболевание в Африке к югу от Сахары. Серогруппы B и C ответственны за подавляющее большинство случаев в Соединенных Штатах и в наиболее развитых странах. Серогруппы W135 и Y ответственны за остальные случаи в Соединенных Штатах и в развитых странах. Хотя капсульный полисахарид является эффективным защитным иммуногеном, каждая серогруппа нуждается в отдельном сахаридном антигене, и данный подход не подходит для иммунизации против серогруппы B. Таким образом недавний успех с конъюгированными сахаридными вакцинами против серогруппы C (Menjugate™ [2], Meningitec™ и NeisVac-C™) не повлиял на заболевание, вызванное серогруппами A, B, W135 или Y; напротив, показано селективное давление в пользу проявления данных серогрупп в качестве основных причин менингококкового заболевания.
В течение многих лет известна и лицензирована для применения на человеке пригодная для инъекций тетравалентная вакцина из капсульных полисахаридов серогрупп A, C, Y и W135 [3,4]. В данной вакцине полисахариды не конъюгированы и присутствуют в соотношении по весу 1:1:1:1 [5], с 50 мкг каждого очищенного полисахарида. Несмотря на эффективность для подростков и взрослых, у детей она индуцирует слабый иммунный ответ и короткую продолжительность защиты, и ее нельзя применять [например, ссылка 6]. Кроме того, вакцины страдают недостатком необходимости восстановления из лиофилизированной формы во время применения.
Доказано, что трудно получить вакцину для серогруппы B. Тестированы вакцины на основе везикул из наружной мембраны [например, ссылка 7], но, как правило, защита ограничена штаммом, применяемым для получения вакцины.
Таким образом, остается необходимость в вакцине для детей, защищающей против менингококковых серогрупп A, C, W135 и Y, и также вакцины, не требующей разбавления перед введением. Кроме того, остается необходимость в вакцине с широким спектром защиты против серогруппы B.
Описание изобретения
Изобретение соответствует всем этим различным требованиям и основано на восьми отдельных результатах. Во-первых, авторы изобретения обнаружили, что конъюгированные капсульные сахариды менингококковых серогрупп C, W135 и Y являются безопасными и иммуногенными для человека, когда объединены в однократной дозе. Во-вторых, авторы обнаружили, что данный эффект сохраняется при добавлении конъюгированного капсульного сахарида серогруппы A. В-третьих, авторы обнаружили, что данные конъюгированные антигены можно стабильно объединять в однократной водной дозе без необходимости лиофилизации. В-четвертых, авторы обнаружили, что широкой защиты против инфицирования серогруппой B можно достичь применением малого числа определенных полипептидных антигенов. В-пятых, авторы обнаружили, что указанные полипептидные антигены можно объединять с сахаридными антигенами без потери защитной эффективности для любой из пяти серогрупп. В-шестых, авторы обнаружили, что эффективность сохраняется даже при добавлении Hib-конъюгата. В-седьмых, авторы обнаружили, что эффективность конъюгата серогруппы W135 увеличивается при добавлении белковых антигенов, происходящих из штамма серогруппы B. Наконец, авторы изобретения обнаружили, что при добавлении Hib-конъюгата к менингококковым конъюгатам увеличивается общая активность против серогруппы W135 менингококка.
Таким образом, изобретение относится к водной иммуногенной композиции, которая после введения субъекту способна индуцировать иммунный ответ, бактерицидный в отношении серогрупп B, C, W135 и Y N.meningitidis, причем композиция состоит из (i) конъюгированного капсульного сахаридного антигена серогруппы C; (ii) конъюгированного капсульного сахаридного антигена серогруппы W135; (iii) конъюгированного капсульного сахаридного антигена серогруппы Y; и (iv) одного или нескольких полипептидных антигенов серогруппы B. Водная композиция может также индуцировать иммунный ответ, бактерицидный в отношении серогруппы A N.meningitidis, и, таким образом, может дополнительно содержать (v) конъюгированный капсульный сахаридный антиген серогруппы A.
Изобретение относится также к водной иммуногенной композиции, которая после введения субъекту способна индуцировать иммунный ответ, который является (a) бактерицидным против по меньшей мере серогруппы W135 N.meningitidis и (b) защитным против заболевания, вызванного H.influenzae типа b, где композиция состоит из (i) конъюгированного капсульного сахаридного антигена серогруппы W135; (ii) конъюгированного капсульного сахаридного антигена H.influenzae типа b. Композиция дополнительно может содержать конъюгированные капсульные сахаридные антигены серогрупп C и Y и, не обязательно, A. Она дополнительно может содержать полипептидные антигены серогруппы B N.meningitidis.
Предпочтительными сахаридными антигенами являются олигосахариды.
Серогруппы C, W135 и Y
Технологии получения капсульных полисахаридов из менингококков известны много лет и, как правило, включают в себя способ, предусматривающий стадии осаждения полисахаридов (например, с применением катионного детергента), фракционирования этанолом, холодной фенольной экстракции (для удаления белка) и ультрацентрифугирования (для удаления LPS) [например, см. ссылку 8].
Более предпочтительный способ [9] предусматривает осаждение полисахарида, с последующим растворением осажденного полисахарида с применением низшего спирта. Осаждение можно проводить с применением катионного детергента, такого как соли тетрабутиламмония и цетилтриметиламмония (например, бромистые соли) или бромида гексадиметрина и солей миристилтриметиламмония. Особенно предпочтительным является бромид цетилтриметиламмония ('CTAB') [10]. Растворения осажденного вещества можно достичь применением низшего спирта, такого как метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол, 2-метилпропан-2-ол, диолы и т.д., но этанол особенно пригоден для растворения CTAB-полисахаридных комплексов. Этанол можно добавлять к осажденному полисахариду для получения конечной концентрации этанола между 50% и 95% (исходя из общего содержания этанола и воды).
После перерастворения полисахариды можно дополнительно обрабатывать для удаления примесей. Это особенно важно в ситуациях, где неприемлемо даже незначительное загрязнение (например, при получении вакцины для человека). Как правило, это предусматривает одну или несколько стадий фильтрации, например, можно применять объемную фильтрацию, фильтрацию через активированный уголь, фильтрацию по размеру и/или ультрафильтрацию.
После фильтрации для удаления загрязнений полисахариды можно осадить для дальнейшей обработки и/или переработки. Это легко осуществить обменом катионов (например, добавлением солей кальция или натрия).
После очистки капсульные полисахариды конъюгируют с белками-носителями, как описано ниже.
Дополнительные и альтернативные способы очистки и конъюгации менингококковых сахаридов описаны в ссылках 11 и 12.
В качестве альтернативы очистке капсульные сахариды согласно изобретению можно получить путем полного или частичного синтеза, например, синтез Hib описан в ссылке 13, и синтез MenA в ссылке 14.
Сахарид может быть химически модифицированным, например, O-ацетилирован или де-O-ацетилирован. Любое такое де-O-ацетилирование или гиперацетилирование может присутствовать в конкретных положениях в сахариде. Например, большинство штаммов серогруппы C обладают O-ацетильными группами в положении C-7 и/или C-8 остатков сиаловой кислоты, но приблизительно у 15% клинических изолятов данные O-ацетильные группы отсутствуют [15,16]. По-видимому, ацетилирование не влияет на защитную эффективность (например, в отличие от продукта Menjugate™, в продукте NeisVac-C™ применяют де-O-ацетилированный сахарид, но обе вакцины эффективны). Сахарид серогруппы W135 представляет собой полимер дисахаридных звеньев сиаловой кислоты-галактозы. Сахарид серогруппы Y подобен сахариду серогруппы W135, за исключением того, что повторяющееся дисахаридное звено содержит глюкозу вместо галактозы. Подобно сахаридам серогруппы C, сахариды MenW135 и MenY обладают изменяющимся O-ацетилированием, но по сиаловой кислоте в положениях 7 и 9 [17]. Любые такие химические модификации предпочтительнее проводить перед конъюгацией, но альтернативно или дополнительно можно проводить во время конъюгации.
Сахариды из различных серогрупп предпочтительнее очищать отдельно, и затем их можно объединить до или после конъюгации.
Серогруппа A
Композиции согласно изобретению могут содержать конъюгированный капсульный сахаридный антиген серогруппы A. Сахарид можно очистить и конъюгировать таким же способом, как для серогрупп C, W135 и Y (см. выше), хотя он структурно отличается - в то время как капсулы серогрупп C, W135 и Y основаны на сиаловой кислоте (N-ацетилнейраминовой кислоте, NeuAc), капсула серогруппы A основана на N-ацетилманнозамине, являющемся природным предшественником сиаловой кислоты. Сахарид серогруппы A особенно чувствителен к гидролизу, и его нестабильность в водной среде означает, что (a) иммуногенность жидких вакцин против серогруппы A со временем уменьшается, и (b) контроль качества более труден из-за высвобождения продуктов гидролиза сахарида в вакцине.
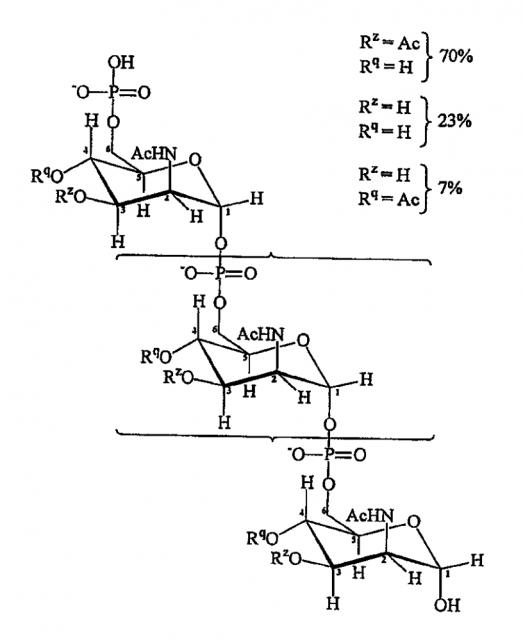
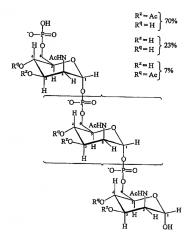
Природный капсульный сахарид MenA представляет собой гомополимер (α1→6)-связанный N-ацетил-D-маннозамино-1-фосфат с частичным O-ацетилированием по C3 и C4. Главной гликозидной связью является 1-6 фосфодиэфирная связь, затрагивающая полуацетальную группу Cl и спиртовую группу C6 D-маннозамина. Средняя длина цепи составляет 93 мономера. Она имеет следующую формулу:
Авторы изобретения получили модифицированный сахаридный антиген, сохраняющий иммуногенную активность природного сахарида серогруппы A, но гораздо более стабильный в воде. Гидроксильные группы, соединенные с атомами углерода 3 и 4 в моносахаридном звене, заменили на защитную группу [ссылка 18].
Число моносахаридных звеньев, имеющих защитные группы вместо гидроксилов, может различаться. Например, защитные группы могут иметь все или в основном все моносахаридные звенья. В качестве альтернативы защитные группы могут иметь по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% моносахаридных звеньев. Защитные группы могут иметь по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 ,27, 28, 29 или 30 моносахаридных звеньев.
Подобным образом может изменяться число защитных групп в моносахаридном звене. Например, число защитных групп в любом конкретном моносахаридном звене может составлять 1 или 2.
Концевое моносахаридное звено может иметь или не иметь защитную группу вместо своего природного гидроксила. Предпочтительнее оставлять свободную аномерную гидроксильную группу в концевом моносахаридном звене для предоставления возможности дальнейших реакций (например, конъюгации). Аномерные гидроксильные группы можно перевести в аминогруппы (-NH2 или -NH-E, где E представляет собой защищающую азот группу) путем восстановительного аминирования (например, с применением NaBH3CN/NH4Cl), и затем можно окислить после перевода других гидроксильных групп в защитные группы.
Защитные группы для замещения гидроксильных групп можно вводить напрямую посредством реакции дериватизации гидроксильной группы, т.е. путем замещения атома водорода гидроксильной группы другой группой.
Подходящие производные гидроксильных групп, действующие как защитные группы, представляют собой, например, карбаматы, сульфонаты, карбонаты, сложные эфиры, простые эфиры (например, силиловые эфиры или алкиловые эфиры) и ацетали. Некоторые конкретные примеры таких защитных групп представляют собой аллил, Aloc, бензил, BOM, трет-бутил, тритил, TBS, TBDPS, TES, TMS, TIPS, PMB, MEM, MOM, MTM, THP и др. Другие защитные группы, не вводимые напрямую и полностью замещающие гидроксильную группу, включают в себя C1-12-алкил, C3-12-алкил, C5-12-арил, C5-12-арил-C1-6-алкил, NR1R2 (Rl и R2 определены в следующем абзаце), H, F, Cl, Br, CO2H, CO2(C1-6-алкил), CN, CF3, CCl3 и т.д.
Предпочтительные защитные группы имеют формулу -O-X-Y или -OR3, где X представляет собой C(O), S(O) или SO2; Y представляет собой C1-12-алкил, C1-12-алкокси, C3-12-циклоалкил, C5-12-арил или C5-12-арил-C1-6-алкил, каждый из которых, не обязательно, можно заменить 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2H, CO2(C1-6-алкила), CN, CF3 или CCl3; или Y представляет собой NRlR2; R1 и R2 независимо выбирают из H, Cl-12-алкила, C3-12-циклоалкила, C5-12-арила, C5-12-арил-C1-6-алкила; или Rl и R2 можно объединить для формирования C3-12-насыщенной гетероциклической группы; R3 представляет собой C1-12-алкил, или C3-12-циклоалкил, каждый из которых, не обязательно, можно заменить 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2(C1-6-алкила), CN, CF3 или CCl3; или R3 представляет собой C5-12-арил или C5-12-арил-C1-6-алкил, каждый из которых, не обязательно, можно заменить 1, 2, 3, 4 или 5 группами, выбранными из F, Cl, Br, CO2H CO2(C1-6-алкила), CN, CF3 или CCl3. Когда R3 представляет собой C1-12-алкил или C3-12-циклоалкил, он, как правило, замещен 1, 2 или 3 группами, как определено выше. Когда Rl и R2 объединены для формирования C3-12-насыщенной гетероциклической группы, это означает, что Rl и R2 вместе с атомом азота формируют насыщенную гетероциклическую группу, содержащую любое число атомов углерода между 3 и 12 (например, C3, C4, C5, C6, C7, C8, C9, Cl0, CII, C12). Гетероциклическая группа может содержать 1 или 2 гетероатома (таких как N, O или S), отличных от атома азота. Примерами C3-12-насыщенной гетероциклической группы являются пирролидинил, пиперидинил, морфолинил, пиперазинил, имидазолидинил, азетидинил и азиридинил.
Защитные группы -O-X-Y и -OR3 можно получить из групп -OH посредством общепринятых процедур дериватизации, таких как реакция гидроксильной группы с ацилгалогенидом, алкилгалогенидом, сульфонилгалогенидом и т.д. Следовательно, атом кислорода в -O-X-Y предпочтительнее представляет собой атом кислорода гидроксильной группы, в то время как группа -X-Y в -O-X-Y предпочтительно замещает атом водорода гидроксильной группы.
В качестве альтернативы защитные группы можно вводить посредством реакции замещения, такой как замещение по типу Mitsonobu. Эти и другие способы получения защитных групп из гидроксильных групп хорошо известны.
Более предпочтительно, защитная группа представляет собой -OC(O)CF3 [19], или карбаматную группу -OC(O)NRlR2, где Rl и R2 выбраны независимо из C1-6-алкила. Более предпочтительно, R1 и R2 представляют собой метил, т.е. защитная группа представляет собой -OC(O)NMe2. Карбаматная защитная группа оказывает стабилизирующий эффект на гликозидную связь и может быть получена в мягких условиях.
Предпочтительные модифицированные сахариды MenA содержат n моносахаридных звеньев, где по меньшей мере h% моносахаридных звеньев не имеют -OH-групп в обоих положениях 3 и 4. Величина h составляет 24 или более (например, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 98, 99 или 100) и предпочтительнее составляет 50 или более. Отсутствующие -OH-группы предпочтительнее представляют собой защитные группы как определено выше.
Другие предпочтительные модифицированные сахариды MenA содержат моносахаридные звенья, где по меньшей мере s моносахаридных звеньев не имеют -OH в положении 3 и не имеют -OH в положении 4. Величина s составляет по меньшей мере 1 (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90). Отсутствующие -OH-группы предпочтительнее представляют собой защитные группы как определено выше.
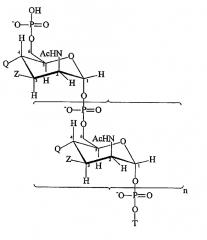
Модифицированные сахариды MenA, пригодные для применения согласно изобретению, обладают формулой:
где
n представляет собой целое число от 1 до 100 (предпочтительно целое число от 5 до 25, более предпочтительно 15-25);
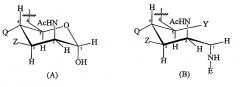
T выбран из формулы (A) или (B):
каждая группа Z независимо выбрана из OH или защитной группы, как определено выше; и
каждая группа Q независимо выбрана из OH или защитной группы, как определено выше;
Y выбран из OH или защитной группы, как определено выше;
E представляет собой H или защитную группу азота;
и где более чем приблизительно 7% (например, 8%, 9%, 10% или более) групп Q представляют собой защитные группы.
Каждая из n+2 групп Z может быть одинаковой или отличаться одна от другой. Подобным образом, каждая из n+2 групп Q может быть одинаковой или отличаться одна от другой. Все группы Z могут представлять собой OH. Альтернативно по меньшей мере 10%, 20%, 30%, 40%, 50% или 60% групп Z могут являться OAc. Предпочтительнее, приблизительно 70% групп Z являются OAc, а остальные группы Z представляют собой OH или защитные группы, как определено выше. По меньшей мере 7% групп Q представляют собой защитные группы. Предпочтительно по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или даже 100% групп Q представляют собой защитные группы.
Предпочтительными защитными группами являются группы, поглощающие электрон. Не желая связывать себя теорией, авторы считают, что гликозидные связи нестабильны к гидролизу из-за содействия внутримолекулярных нуклеофильных атак гидроксильной группы сахарида на гликозидную связь (т.е. посредством формирования циклического промежуточного соединения). Чем больше нуклеофильность гидроксильной группы, тем больше тенденция к внутримолекулярной нуклеофильной атаке. Поглощающая электрон защитная группа оказывает эффект делокализации отдельной пары кислорода, таким образом уменьшая нуклеофильность кислорода и уменьшая тенденцию к внутримолекулярной нуклеофильной атаке.
Следовательно, для защиты против серогруппы A водные композиции могут содержать модифицированный сахарид MenA, как определено выше.
Предпочтительные композиции согласно изобретению можно хранить 28 суток при 37°C и после этого периода менее чем f% начального общего количества конъюгированного сахарида MenA становится неконъюгированным, где f составляет 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5 или ниже.
Ковалентная конъюгация
Капсульные сахариды в композициях согласно изобретению, как правило, конъюгируют с белком-носителем (белками-носителями). Как правило, конъюгация улучшает иммуногенность сахаридов, так как превращает их из T-независимых антигенов в T-зависимые антигены, что позволяет примирование для иммунологической памяти. Конъюгация особенно полезна для педиатрических вакцин и является хорошо известным способом [например, рассматриваемым в ссылках 20-29].
Предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийный анатоксин или столбнячный анатоксин, или мутант дифтерийного токсина CRM197 [30-32]. Другие пригодные белки-носители включают в себя белок наружной мембраны N.meningitidis [33], синтетические пептиды [34, 35], белки теплового шока [36, 37], белки возбудителя коклюша [38, 39], цитокины [40], лимфокины [40], гормоны [40], факторы роста [40], искусственные белки, содержащие множественные эпитопы CD4+ T-клеток человека для разных полученных из патогенов антигенов [41], таких как белок N19 [42], белок D из H.influenzae [43, 44], пневмолизин [45], поверхностный белок пневмококка PspA [46], железосвязывающие белки [47], токсин A или B из C.difficile [48], мутантные бактериальные токсины (например, холерный токсин 'CT' или термолабильный токсин 'LT' E.coli), такие как CT с заменой Glu-29 [49], и т.д. Предпочтительными носителями являются дифтерийный анатоксин, столбнячный анатоксин, белок D H.influenzae и особенно CRM197.
В композиции согласно изобретению можно применять более одного белка-носителя, например, чтобы уменьшить риск подавления носителем. Так, различные белки-носители можно применять для различных серогрупп, например, сахариды серогруппы A можно конъюгировать с CRM197, в то время как сахариды серогруппы C можно конъюгировать со столбнячным анатоксином. Можно также применять более одного белка-носителя для конкретного сахаридного антигена, например, сахариды серогруппы A могут присутствовать в двух группах, некоторые конъюгированные с CRM197, а другие конъюгированные со столбнячным анатоксином. Однако, как правило, предпочтительнее применять один и тот же белок-носитель для всех серогрупп, и CRM197 является предпочтительным выбором.
Один белок-носитель может нести более одного сахаридного антигена [50]. Например, один белок-носитель можно конъюгировать с сахаридами серогрупп A и C. Для достижения этой цели сахариды можно смешивать перед реакцией конъюгации. Однако, как правило, предпочтительнее получать отдельные конъюгаты для каждой серогруппы.
Предпочтительными являются конъюгаты с соотношением сахарид:белок (мас./мас.) между 1:5 (т.е. избыток белка) и 5:1 (т.е. избыток сахарида). Предпочтительными являются соотношения между 1:2 и 5:1, как наиболее предпочтительными являются соотношения между 1:1,25 и 1:2,5. Избыток белка-носителя может являться предпочтительным для MenA и MenC.
Конъюгаты можно применять совместно со свободным белком-носителем [51]. Когда данный белок-носитель присутствует в композиции согласно изобретению и в свободной, и в конъюгированной форме, неконъюгированная форма предпочтительнее составляет не более 5% общего количества белка-носителя в композиции в целом, и более предпочтительно, присутствует менее чем в 2% масс.
Можно применять любую подходящую реакцию конъюгации, с любым подходящим линкером, где необходимо.
Как правило, перед конъюгацией сахарид активируют или вводят функциональные группы. Активация может предусматривать, например, цианирующие реагенты, такие как CDAP (т.е. тетрафторборат 1-циано-4-диметиламинопиридина [52, 53 и т.д.]). Другие подходящие способы предусматривают карбодиимиды, гидразиды, активные сложные эфиры, норборнан, p-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS, EDC, TSTU (см. также введение к ссылке 27).
Соединения через линкерную группу можно осуществить с применением любой известной процедуры, например, процедур, описанных в ссылках 54 и 55. Один тип соединения привлекает восстановительное аминирование полисахарида, соединяя полученную аминогруппу с одним концом линкерной группы адипиновой кислоты и затем, соединяя белок с другим концом линкерной группы адипиновой кислоты [25, 56, 57]. Другие линкеры включают в себя B-пропионамид [58], нитрофенилэтиламин [59], галоидангидриды галоидзамещенных кислот [60], гликозидные соединения [61], 6-аминокапроновую кислоту [62], ADH [63], C4-C12-группы [64] и т.д. В качестве альтернативы применению линкера можно применять прямое связывание. Прямое связывание с белком может предусматривать окисление полисахарида с последующим восстановительным аминированием с белком, как описано, например, в ссылках 65 и 66.
Предпочтительным является процесс, предусматривающий введение аминогрупп в сахарид (например, замещением концевых =O групп на -NH2) с последующей дериватизацией сложным диэфиром адипиновой кислоты (например, сложным диэфиром адипиновой кислоты и N-гидроксисукцинимида) и реакцией с белком-носителем. Другая предпочтительная реакция предусматривает активацию CDAP с белком-носителем D, например, для MenA или MenC.
После конъюгации свободные и конъюгированные сахариды можно разделить. Существует множество подходящих способов, предусматривающих гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [см. также ссылки 67 и 68 и т.д.].
Когда композиция согласно изобретению содержит конъюгированный олигосахарид, предпочтительно, чтобы получение олигосахарида предшествовало конъюгации.
После конъюгации способы согласно изобретению могут предусматривать стадию измерения уровня неконъюгированного белка-носителя. Один из способов проведения данного измерения предусматривает капиллярный электрофорез [69] (например, в свободном растворе), или мицеллярную электрокинетическую хроматографию [70].
После конъюгации способы согласно изобретению могут предусматривать стадию измерения уровня неконъюгированного сахарида. Один из способов проведения данного измерения предусматривает HPAEC-PAD [67].
После конъюгации способы согласно изобретению могут предусматривать стадию отделения конъюгированного сахарида от неконъюгированного сахарида. Один из способов разделения этих сахаридов предусматривает применение способа, избирательно осаждающего один из компонентов. Предпочтительным является осаждение конъюгированного сахарида, чтобы оставлять неконъюгированный сахарид в растворе, например, обработка деоксихолатом [67].
После конъюгации способы согласно изобретению могут предусматривать стадию измерения размера молекул и/или молярной массы конъюгата. В частности, можно измерять распределение. Один из способов проведения данных измерений предусматривает эксклюзионную хроматографию с детекцией многоугловой светорассеивающей фотометрией и дифференциальной рефрактометрией (SEC-MALS/RI) [71].
Олигосахариды
Как правило, капсульные сахариды применяют в форме олигосахаридов. Их легко получают фрагментацией очищенного капсульного полисахарида (например, гидролизом), как правило, с последующей очисткой фрагментов желаемого размера.
Предпочтительно проводить фрагментацию полисахаридов для получения конечной средней степени полимеризации (DP) олигосахарида менее 30 (например, между 10 и 20, предпочтительно около 10 для серогруппы A; между 15 и 25 для серогрупп W135 и Y, предпочтительно около 15-20; между 12 и 22 для серогруппы C и т.д.). DP можно легко измерить ионообменной хроматографией или колориметрическими анализами [72].
Если проводят гидролиз, гидролизат, как правило, сортируют по размеру для удаления коротких олигосахаридов [73]. Этого можно достичь различными способами, такими как ультрафильтрация с последующей ионообменной хроматографией. Олигосахариды со степенью полимеризации меньшей или равной приблизительно 6 предпочтительно удаляют для серогруппы A, и со степенью полимеризации меньшей или равной приблизительно 4 предпочтительно удаляют для серогрупп W135 и Y.
Химический гидролиз сахаридов, как правило, предусматривает обработку кислотой или основанием при условиях, общепринятых в данной области. Условия деполимеризации капсульных сахаридов до составляющих их моносахаридов известны в данной области. Один из способов деполимеризации предусматривает применение перекиси водорода [11]. Перекись водорода добавляют к сахариду (например, для достижения конечной концентрации H2O2 1%) и затем смесь инкубируют (например, приблизительно при 55°C) до достижения желаемого уменьшения длины цепи. Уменьшение можно сопровождать в течение долгого времени отбором образцов из смеси и затем измерением (среднего) размера молекул сахарида в образце. Затем деполимеризацию можно остановить быстрым охлаждением, сразу после достижения желаемой длины цепи.
Серогруппа B
Вакцины против патогенов, таких как вирус гепатита B, дифтерия и столбняк, как правило, содержат один белковый антиген (например, поверхностный антиген HBV или столбнячный анатоксин). Напротив, бесклеточная коклюшная вакцина, как правило, содержит по меньшей мере три белка B.pertussis, а пневмококковая вакцина PrevNar™ содержит семь отдельных конъюгированных сахаридных антигенов. Другие вакцины, такие как клеточные коклюшные вакцины, вакцина против кори, инактивированная полиовакцина (IPV) и менингококковые вакцины OMV по самой своей природе представляют собой сложные смеси большого числа антигенов. Таким образом, от интересующего патогена зависит, можно ли обеспечить защиту против него посредством отдельного антигена, небольшого числа определенных антигенов или сложной смеси неопределенных антигенов.
Как упомянуто выше, доказано, что трудно получить вакцину для серогруппы B. Вакцины, основанные на OMV, демонстрируют ограниченную эффективность. Кроме того, в OMV присутствует большое число неопределенных антигенов, что в сочетании с их изменчивой природой означает наличие для OMV различных проблем контроля качества.
Авторы изобретения обнаружили, что можно достичь широкого спектра защиты против инфекции серогруппой B, и этого можно достичь применением малого числа определенных полипептидных антигенов серогруппы B, и таким образом композиции согласно изобретению содержат один или несколько полипептидных антигенов, таких что композиция может индуцировать иммунный ответ, бактерицидный против двух или более (например, 2 или 3) гипервирулентных линий A4, ET-5 и линии 3 N.meningitidis серогруппы B.
Опубликованы последовательности генома менингококков серогрупп A [74] и B [75, 76], и подходящие антигены можно выбрать из кодируемых полипептидов [например, ссылки 77-82]. Кандидатов на роль антигенов модифицировали для улучшения гетерологичной экспрессии [ссылки 83-85].
Одна из предпочтительных композиций содержит белок Tbp и белок Hsf [86]. Hsf представляет собой белок-автотранспортер [87-89], известный также как nhhA [89], GNA0992 [77] или NMB0992 [75]. Tbp представляет собой белок, связывающий трансферрин [90-93], и охватывает TbpA, TbpB и формы TbpA и TbpB с высокой и низкой молекулярной массой. Tbp охватывает отдельные белки, описанные выше, и комплексы данных белков и любых других белков и их комплексов, способных связывать трансферрин. Хотя Tbp может относиться к формам TbpA или TbpB с высокой или низкой молекулярной массой, предпочтительнее, чтобы присутствовали формы TbpA и/или TbpB и с высокой, и с низкой молекулярной массой. Наиболее предпочтительно присутствие TbpA с высокой и с низкой молекулярной массой.
Другая предпочтительная композиция содержит липоолигосахарид серогруппы B (LOS) [94]. LOS можно применять в дополнение к полипептиду (полипептидам) серогруппы B или вместо него/них.
Другая предпочтительная композиция содержит по меньшей мере один антиген, выбранный из каждой по меньшей мере двух различных категорий белков, обладающих различными функциями у Neisseria. Примеры таких категорий белков включают в себя: адгезины, белки-автотранспортеры, токсины, интегральные белки наружной мембраны и железосвязывающие белки. Данные антигены могут быть выбраны следующим образом, с применением номенклатуры ссылки 95: по меньшей мере один адгезин Neisseria, выбранный из группы, включающей в себя FhaB, NspA, PilC, Hsf, Hap, MafA, MafB, Omp26, NMB0315, NMB0995, NMB1119 и NadA; по меньшей мере один автотранспортер Neisseria, выбранный из группы, включающей в себя Hsf, Hap, протеазу IgA, AspA и NadA; по меньшей мере один токсин Neisseria, выбранный из группы, включающей в себя FrpA, FrpC, FrpA/C, VapD, NM-ADPRT(NMB1343) и любой или оба из LPS иммунотипа L2 и LPS иммунотипа L3; по меньшей мере один Fe-связывающий белок Neisseria, выбранный из группы, включающей в себя TbpA, TbpB, LbpA, LbpB, HpuA, HpuB, Lipo28 (GNA2132), Sibp, NMB0964, NMB0293, FbpA, Bcp, BfrA, BfrB и P2086 (XthA); по меньшей мере один мембраносвязанный белок Neisseria, предпочтительно белок наружной мембраны, в частности, интегральный белок наружной мембраны, выбранный из группы, включающей в себя PilQ, OMP85, FhaC, NspA, TbpA, LbpA, TspA, TspB, TdfH, PorB, MItA, HpuB, HimD, HisD, GNA1870, OstA, HlpA (GNA1946), NMB1124, NMB1162, NMB1220, NMB1313, NMB1953, HtrA, и PLDA (OMPLA). Указано, что данные сочетания антигенов Neisseria приводят к неожиданному улучшению эффективности вакцины против инфекции Neisseria [95].
Особенно предпочтительные композиции включают в себя один или несколько из следующих пяти антигенов [96]: (1) белок 'NadA', предпочтительно, в олигомерной форме (например, в тримерной форме); (2) белок '741'; (3) белок '936'; (4) белок '953'; и (5) белок '287'.
'NadA' (адгезин A Neisseria) из MenB обозначен как белок '961' в ссылке 80 (SEQ ID 2943 и 2944) и как 'NMB1994' в ссылке 75 (см. также инвентарные номера GenBank: 11352904 и 7227256). Детальное исследование белка можно найти в ссылке 97. При применении согласно изобретению NadA может принимать различные формы. Предпочтительные формы NadA представляют собой усеченные или делетированные варианты, такие как описаны в ссылках 83-85. В частности, предпочтительнее NadA без C-концевого мембранного якоря (например, с делецией остатков 351-405 для штамма 2996 для получения SEQ ID NO: 1 здесь), который иногда обозначен здесь с применением надстрочного индекса 'C', например, NadA(C). Экспрессия NadA без его домена мембранного якоря в E.coli приводит к секреции белка в культуральную жидкость, сопровождаемой удалением его 23-мерного лидерного пептида (например, чтобы оставить 327-мер для штамма 2996 [SEQ ID NO: 2 здесь]). Полипептиды без их лидерных пептидов иногда обозначены здесь с применением надстрочного индекса 'NL', например, NadA(NL) или NadA(C)(NL). Предпочтительные полипептиды NadA обладают аминокислотной последовательностью, которая (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO: 2; и/или (b) содержит фрагмент из по меньшей мере n последовательных аминокислот SEQ ID NO: 1, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). В предпочтительных фрагментах для (b) отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO:1 (например, NadA(C), NadA(NL), NadA(C)(NL)). Другие предпочтительные фрагменты содержат эпитоп из SEQ ID 1, и особенно предпочтительным фрагментом из SEQ ID 1 является SEQ ID 2. Эти различные последовательности включают в себя варианты NadA (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Различные последовательности NadA показаны на фигуре 9 ссылки 98.
Белок '741' из MenB описан в ссылке 80 (SEQ ID 2535 и 2536) и как 'NMB1870' в ссылке 75 (см. также инвентарный номер GenBank GI:7227128). Соответствующий белок серогруппы A [74] имеет инвентарный номер GenBank 7379322. 741 в природе является липопротеином. При применении согласно изобретению белок 741 может принимать различные формы. Предпочтительные формы 741 представляют собой усеченные или делетированные варианты, такие как описаны в ссылках 83-85. В частности, N-конец 741 может быть делетирован до его полиглициновой последовательности и включая ее (т.е. с делецией остатков 1-72 для штамма MC58 [SEQ ID NO: 3 здесь]), которая иногда обозначена здесь с применением приставки 'ΔG'. Данная делеция может улучшать экспрессию. Делеция удаляет также участок липидизации 741. Предпочтительные последовательности 741 обладают аминокислотной последовательностью, которая: (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO: 3; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из SEQ ID NO: 3, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из 741. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO: 3. Эти последовательности включают в себя варианты 741 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Различные последовательности 741 можно найти в SEQ ID 1-22 ссылки 85, в SEQ ID 1-23 ссылки 99, и в SEQ ID 1-299 ссылки 100.
Белок '936' серогруппы B описан в ссылке 80 (SEQ ID 2883 и 2884) и как 'NMB2091' в ссылке 75 (см. такж