Способ оценки состояния здоровья человека при прогнозировании течения инфекционного заболевания
Иллюстрации
Показать всеИзобретение относится к микроэкологии и иммунологии и может использоваться для интегральной оценки состояния здоровья человека при прогнозировании инфекционного заболевания. Сущность способа оценки состояния здоровья человека состоит в том, что при прогнозировании течения инфекционного заболевания оценивают показатели микробиотопа слизистых открытых полостей и определяют на их основе степень нарушения микробиотопа слизистых полостей как показатель степени нарушения микробиоценоза биотопа слизистых открытых полостей, в зависимости от полученного результата судят о состоянии здоровья человека и прогнозируют течение инфекционного заболевания. 3 ил., 15 табл., 4 пр.
Реферат
Изобретение относится к микроэкологии и иммунологии и может использоваться для интегральной оценки состояния здоровья человека при прогнозировании инфекционного заболевания.
Реактивность организма - способность организма отвечать на воздействия внешней среды изменением своей жизнедеятельности, что обеспечивает его адаптацию к различным условиям обитания. Резистентность тесно связана с реактивностью организма, представляя собой одно из основных ее следствий и выражений. Реализация механизмов резистентности организма обеспечивается, как правило, не одним каким-либо органом или системой, а взаимодействием комплекса различных органов и физиологических систем, включая все звенья регуляторных процессов. Резистентность организма может определяться относительно стабильными свойствами различных органов, тканей и физиологических систем, в т.ч. не связанными с активными реакциями на данное воздействие. Значительные колебания индивидуальной резистентности могут быть связаны с особенностями реактивности организма во время его взаимодействия с повреждающим агентом. Резистентность может понижаться при недостатке, избытке или качественной неадекватности биологически значимых факторов (питания, двигательной активности, трудовой деятельности, информационной нагрузки и стрессовых ситуаций, различных интоксикаций, экологических факторов и др.). В формирования резистентности решающее значение занимают активные защитно-приспособительные реакции, направленные на сохранение гомеостаза при потенциально вредных воздействиях факторов внешней среды или неблагоприятных сдвигах во внутренней среде организма. Эффективность таких реакций и, следовательно, степень резистентности к различным факторам зависит от врожденных и приобретенных индивидуальных особенностей организма. Резистентность изменяется в процессе онтогенеза, причем ее возрастная динамика по отношению к различным воздействиям неодинакова, однако в целом она оказывается наиболее высокой в зрелом возрасте и снижается по мере старения организма. Различают неспецифическую и специфическую резистентность. Под неспецифической резистентностью понимают способность организма противостоять воздействию разнообразных по своей природе факторов. Специфическая резистентность характеризует высокую степень противодействия организма воздействию определенных факторов или их близких групп, устойчивость против различных болезнетворных воздействий [1].
Известен способ прогнозирования частоты развития у детей острых инфекционных заболевания на первом году жизни (патент РФ №2431147) с определением на первые и пятые сутки после рождения иммунного статуса: абсолютного числа лимфоцитов, носителей маркеров дифференцировки CD3, CD4, CD8, CD19, СД56, СД95, фагоцитарный показатель, концентрации IgA, IgM, IgG и после определения индекса прогнозирования с помощью уравнения судят о вероятности возникновения того или иного количества инфекционных заболеваний.
Известен способ прогнозирования тяжести течения инфекционных заболеваний ротоглотки у детей, (патент РФ №2231073 предусматривающий определение количества секреторного иммуноглобулина А в слюне методом радиальной иммунодиффузии в геле и при значении sIgA ниже 0,4 мг/мл прогнозируют тяжелое течение заболевания.
Недостатком обоих способов изобретения является отсутствие микроэкологических факторов оценки состояния здоровья, учитываемых при прогнозе течения или частоты возникновения инфекционных заболеваний.
Задачей настоящего изобретения является способ оценки состояния здоровья человека при прогнозировании течения инфекционного заболевания.
Сущность изобретения состоит в следующем:
Для оценки состояния здоровья при прогнозировании течения инфекционного заболевания оценивают показатели микробиотопа слизистых открытых полостей. На их основе определяют степень нарушения микробиотопа слизистых открытых полостей как показатель степени нарушения микробиоценоза биотопа слизистых открытых полостей. В зависимости от полученного результата судят о состоянии здоровья человека и прогнозируют течение инфекционного заболевания. При этом, полноценное здоровье прогнозируют при отсутствии верификации возбудителя и клинических проявлений инфекционного процесса и регистрации первой или второй степени микробиоценоза биотопа слизистых открытых полостей;
- продромальный период инфекционного заболевания прогнозируют при отсутствии верификации возбудителя и клинических проявлений инфекционного процесса и регистрации третьей или четвертой степени микробиоценоза биотопа слизистых открытых полостей;
- благоприятное течение заболевания прогнозируют при наличии клинических проявлений инфекционного процесса и/или верификации возбудителя и регистрации третьей или четвертой степени микробиоценоза биотопа слизистых открытых полостей;
- хроническое течение заболевания прогнозируют при наличии клинических проявлений инфекционного процесса и/или верификации возбудителя и регистрации первой или второй степени микробиоценоза биотопа слизистых открытых полостей.
В настоящее время накоплен большой фактический материал о роли микрофлоры в жизнедеятельности человека и в формировании его реактивности и антиинфекционной резистентности. Нормальная микрофлора способствует поддержанию необходимого барьерного уровня слизистых оболочек, кожи и образует первую линию защиты от инфекций, а также выполняет ряд других важных функций в организме человека. Изменения в видовом составе микрофлоры не только свидетельствуют о нарушении бактериального равновесия в разных микробиотопах, но и являются показателями функциональных и анатомических повреждений определенных структурно-физиологических мест организма [2]. Микробиоценоз является весьма чувствительным индикатором, реагирующим количественными и качественными изменениями на любые сдвиги внешней и внутренней среды [3]. Известно, что исследование микрофлоры организма- это высокоинформативный и доступный метод оценки состояния здоровья человека, коррелирующий с другими клиническими и лабораторными показателями. Разрабатываются региональные значения норм микрофлоры, которые отличаются от общероссийских, показана зависимость микробиоценоза от возраста. Установлено, что в процессе развития человека наблюдаются определенные критические периоды, когда на антигенное воздействие иммунная система дает неадекватный или парадоксальный ответ [4]. Было показано, что каждому периоду критического развития иммунной системы детей соответствует определенная микрофлора кишечника. При этом во всех периодах отмечается угнетение индигенной микрофлоры и увеличение условно-патогенной микрофлоры (УПМ) [5].
Любое заболевание, по сути, является следствием нарушенного гомеостаза. Дисбиотические нарушения появляются задолго до клинических проявлений болезни и являются отражением иммунологической реактивности макроорганизма. В этой связи микрофлора является его важнейшим фактором и патологию любой локализации следует рассматривать в связи с состоянием микробиоценозов. Изменения качественного и количественного состава микрофлоры толстой кишки в виду иммуностимулирующей функции индигенной микрофлоры, в свою очередь, ведет к снижению иммунологической реактивности организма [6, 7]. В связи с этим, возникает вопрос, что является первичным: либо процесс начинается с изменения микрофлоры и ведет к развитию иммунодефицита, отражаясь на течении основной болезни, либо снижение иммунологической реактивности макроорганизма под влиянием неблагоприятных факторов среды провоцирует развитие дисбактериоза. С современных позиций нарушение нормальной микрофлоры, состояние иммунного статуса и проявление болезни рассматривается в единстве, причем роль пускового механизма в каждом конкретном случае может принадлежать любому из этих компонентов триады: дисбактериозу, иммунному статусу и патологическому процессу. Дисбактериоз может быть следствием развития иммунодефицитов или сопровождать болезнь [5]. В свете взаимообусловленности микроэкологических и иммунологических сдвигов макроорганизма актуальным являются работы по экологической иммунологии. Микроэкологические нарушения в организме человека, в определенной степени, можно считать пусковыми механизмами при нарушениях липидного обмена и патологических процессов, связанных с ними, таких как атеросклероз, желчнокаменная болезнь, функциональные расстройства органов пищеварения и другие. Микроэкологические подходы к пониманию их развития могут явиться отправной точкой создания новых методов лечения. Человеку свойственен только ему присущий микроэкологический гомеостаз, поэтому возможны и другие проявления микроэкологического кризиса. Отсутствие четкого разграничения между условным патогеном и комменсалом дает основание полагать, что неограниченная колонизация организма любым видом бактерий, способным выживать в организме человека, может приводить к развитию патологии. Ведущую роль в развитии таких осложнений играет, по-видимому, не вирулентность самого возбудителя, а состояние иммунологической реактивности организма. Так у иммунокомпрометированных лиц слабовирулентные или авирулентные микроорганизмы (кандиды и пневмоцисты) могут вызывать тяжелые и часто фатальные поражения. Ряд заболеваний, в том числе и опухолевый процесс, или цитостатическая терапия могут нарушить баланс между микробом и хозяином. Повреждение кожи, слизистых или иммунной системы при онкологическом заболевании, а также использование цитостатиков, лучевой терапии, наличие различных устройств, таких как внутривенные катетеры являются факторами риска для возникновения нозокомиальных (внутрибольничных, госпитальных) инфекций. Разнообразные неблагоприятные воздействия вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики микробиоценозов открытых полостей. У детей, находившихся на искусственном вскармливании, аутофлора кишечника чаще вызывает эндогенные инфекционные процессы. Инфекции могут быть вызваны как нормальной эндогенной микрофлорой, так и экзогенными микроорганизмами, колонизирующими больных в процессе нахождения в клинике. Антибиотики, подавляющие анаэробную микрофлору ЖКТ, увеличивают риск последующей колонизации как УПМ, так и патогенной микрофлорой. Во взаимоотношениях макроорганизма с его микрофлорой в неблагоприятных условиях, вызванных различными воздействиями на организм (например, стресс) или на микробиоту (массивная антибиотикотерапия), симбиоз может превращаться в отношения взаимной агрессии. При этом оба участника обладают достаточным потенциалом, чтобы нанести друг другу существенный ущерб или «расчистить дорогу» для внедрения в организм настоящих патогенных микроорганизмов. В частности, эпителий может вырабатывать бактериостатические и бактерицидные ферменты (лизоцим, лактоферрин), в него начинают проникать активированные фагоцитирующие клетки (нейтрофилы). В свою очередь, это вызывает ответ в форме активации «ударного» ферментативного аппарата бактерий (нейраминидазы, гиалуронидазы), высвобождение эндотоксина и синтез прочих атрибутов вирулентности. Является доказанным фактом, что нарушение экологического баланса и возникновение дисбактериозов приводят не только к увеличению возможности заражения "официальными" патогенами, но и возникновению инфекционного заболевания, вызываемого представителями как факультативной, так и облигатной части нормальной микрофлоры [5]. В настоящее время возрастает удельный вес инфекционных заболеваний, этиологическими агентами которых являются условно-патогенные микроорганизмы (УПМ) нормальной микрофлоры человеческого организма, такие как стафилококки, стрептококки, эшерихии, серрации, клебсиеллы, энтеробактеры, протеи. Приобретение ими патогенных свойств в определенной степени обусловлено появлением у них островков патогенности (ОП). Под ОП принято понимать фрагменты DNA, размерами от 1 до 10 kb («островки») или от 10-20 до 200 kb («острова»), включающие дискретные гены вирулентности и обнаруживаемые только у патогенных микроорганизмов. Указанные фрагменты DNA отличаются от «core genome» по содержанию % G+C, как правило, фланкированы малыми прямыми нуклеотидными повторами (DR-directly repead) и часто ассоциированы с 3′ областью локусов различных транспортных RNA (tRNA). Детерминанты ОП способны распространяться среди родственных видов бактерий при конъюгации, трансдукции или трансформации. Такая мобильность ОП связана с тем, что они могут входить в состав бактериофагов, транспозонов или плазмид. Именно интеграция, стабилизация и экспрессия генов вирулентности, входящих в состав ОП, и лежит в основе формирования новых свойств, в том числе вирулентных, у родственных непатогенных видов бактерий различных таксономических групп [8]. Регистрация и нарастание инфицированности УПМ при дисбактериозах являются объективными критериями их выраженности. Следовательно, дисбактериоз - любые качественные и количественные изменения типичной для данного биотопа микрофлоры человека и животных, возникающие в результате воздействия на макро- и микроорганизм различных факторов экзогенного и эндогенного характера, влекущие за собой клинические проявления со стороны макроорганизма или являющиеся следствием каких-либо патологических процессов в организме. Дисбиоз-микробиологический дисбаланс в организме, который со временем проявляет себя местными симптомами, а затем и общими нарушениями, которые отягощают течение различных заболеваний. Дисбактериозы различной локализации, как правило, обусловлены микроэкологическими и иммунологическими нарушениями, способствующими развитию инфекционных процессов. Любой инфекционный процесс в слизистой оболочке, независимо от этиологии, развивается по одному и тому же сценарию. Первый этап - это адгезия микробов в пристеночном муцине или на эпителиальных клетках, которая обеспечивается специальными структурами возбудителя. Закрепившись, микроорганизмы начинают размножаться, что приводит к патологической колонизации слизистой - это второй этап инфекционного процесса (дисбактериоз). Следующий, третий этап инфекционного процесса - это инвазия микроорганизмов, когда они преодолевают защитный барьер слизистой оболочки и проникают в эпителиальные клетки или подлежащую ткань, вызывая при этом местную иммунную реакцию (колит, вагинит, фарингит и др.). При преодолении местного защитного барьера возможна генерализация инфекции. Патогенность отдельных видов бактерий зависит от наличия или отсутствия представителей других видов [9]. Поэтому при оценке микробиоценозов биотопов слизистых открытых полостей необходимо учитывать количественный и видовой состав как микроорганизмов, свободно располагающихся в просвете, так и адгезированных к эпителиальным поверхностям (пристеночная область).
Микробиоценоз биотопов слизистых открытых полостей макроорганизма - динамическая микроэкологическая система, компонентами которой является макроорганизм, его микрофлора (совокупность типичных для определенного биологического вида и конкретного биотопа ассоциаций микроорганизмов) и окружающая среда, характеризующаяся способностью к саморегуляции, которая является интегральной частью организма («дополнительным органом») хозяина и местного иммунитета, в частности, и выполняет или регулирует многочисленные функции макроорганизма. Показатели состояния микробиоценозов биотопов слизистых открытых полостей отражают состояние реактивности макроорганизма - способность организма отвечать на воздействия внешней среды изменением своей жизнедеятельности, что обеспечивает его адаптацию к различным условиям обитания. Слизистые открытых полостей макроорганизма представляют собой единую систему. Состояние микробиоценоза и барьерной функции слизистых можно оценивать по выраженности колонизационной резистентности (КР) открытых полостей организма - физиологический феномен - способности микрофлоры и макроорганизма в кооперации защищать экосистему слизистых от патогенных микроорганизмов.
Оценка микробиоценоза биотопа слизистых открытых полостей может быть проведена согласно методологии, изложенной в пособии утвержденном Учебно-методическим объединением (10), а также согласно новой медицинской технологии (11). Заявляемое изобретение подтверждается на следующих примерах.
Пример 1. Оценка состояния здоровья по состоянию микробиоценоза биотопа ротоглотки при бронхитах у детей.
Клинически обследовано 194 ребенка в возрасте от 3 до 10 лет: из них 51 ребенок - с острым и 15 детей - с хроническим бронхитом (средний возраст больных детей - 4,0±2,2 года); группу контроля составили 128 клинически здоровых детей в возрасте 3-10 лет (средний возраст - 5,0±2,9 года). Всего было обследовано 49 мальчиков и 47 девочек. Оценку микробиоценоза биотопа ротоглотки проводили согласно методологии, изложенной в пособии утвержденном Учебно-методическим объединением (10).
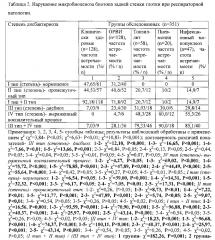
При бронхитах у детей при анализе ассоциации патогенных вирусных и внутриклеточных бактериальных агентов выявлено (табл. 1), что частота инфицированности ими была наивысшей при остром бронхите и достоверные различия по χ2 по сравнению с хроническим бронхитом и клинически здоровыми пациентами выявлены при инфицировании аденовирусами (P<0,05). Различия в обсемененности слизистой задней стенки глотки (ЗСГ) индигенными микроорганизмами в контрольной группе и больных бронхитами детей не достоверны как по количественному содержанию, так и по частоте встречаемости; однако они превышали показатели нормоценоза. По частоте выявляемости УПМ при бронхитах у детей выявлены достоверные различия (χ2) по частоте инфицирования S. aureus и грибами рода Candida при остром бронхите по сравнению с хроническим бронхитом и клинически здоровыми пациентами (p<0,05). Увеличение интенсивности колонизации задней стенки глотки УПМ также достоверно выше было при остром бронхите по сравнению с хроническим бронхитом и клинически здоровыми пациентами (p<0,05). Высеваемость УПМ в титре 6 lg КОЕ/г и выше может свидетельствовать о приобретении ею вирулентности.
У 13 детей было выявлено (табл. 2) достоверное (p<0,05) увеличение уровня IgM в слюне. Это свидетельствует о том, что на начальной стадии заболевания при остром бронхите на слизистых идет активная стимуляция местного иммунного ответа. Значения IgM были 1,0±0,8 мкг/мг общего белка. Отличительной особенностью детей с острым бронхитом являлась более высокая, чем у здоровых, концентрация IgG в слюне, которая составила 8,6±5,6 мкг/мг общего белка. Достоверное (p<0,001) повышение уровня IgG в слюне было выявлено у 32 больных детей. Это говорит о прямой взаимосвязи количества IgG в слюне со степенью выраженности воспалительного процесса, которое имеет место при остром бронхите, так как относительно высокие концентрации уровня IgG в слюне обусловлены просачиванием IgG плазменного происхождения через поверхность воспаленного эпителия.
У 28 детей выявлено достоверное (p<0,001) повышение уровня sIgA, которое составило 29,0±25,6 мкг/мг общего белка и у 5 детей было обнаружено достоверное (p<0,05) повышение уровня IgA в слюне, которое составило 0,5±0,2 мкг/мг общего белка. Это может указывать на возможность активирующего действия вирусов, бактерий и внутриклеточных патогенов на синтез иммуноглобулинов, так как данные иммуноглобулины в слизи действуют как первая линия иммунной защиты слизистых, нейтрализующая патогены. Особенно их количество увеличивается при возникновении острой формы бронхита. Также достоверно (p<0,001) увеличивался уровень свободного секреторного компонента (sc) - у 21 больного ребенка по сравнению с детьми контрольной группы. Он составил 35,2±25,0 мкг/мг общего белка. Показатели нарушения проницаемости слизистой ротоглотки у детей с острым бронхитом также были достоверно увеличены по сравнению со здоровыми детьми, у которых соотношение sIgA/IgG слюны составляло 1,04. Соотношение sIgA/IgG слюны у детей с острым бронхитом составляло 3,7 (p<0,001), а соотношение sIgA/альбумин увеличивалось до 0,05 (p<0,001) по сравнению со здоровыми детьми, у которых оно составляло 0,01. Выраженное увеличение показателей соотношений sIgA/IgG, sIgA/альбумин и содержания альбумина указывает на местный синтез иммуноглобулинов и одновременное поступление IgG и IgM из сыворотки крови, а выявление sIgA и sc обусловлено их местным синтезом.
При сопоставлении частоты определения типа микробиоценоза биотопа (табл. 3) ротоглотки у детей с острым и хроническим бронхитом по сравнению с клинически здоровыми детьми (нормоценоз - у 48,1% пациентов, промежуточный тип - у 44,4% пациентов, дисбиоз - у 7,4% пациентов) выявлены достоверные различия. При остром бронхите нормоценоз регистрировался у 21,6% (p<0,05), промежуточный тип микробиоценоза - у 11,8% (р<0,01), дисбиоз - у 35,3% (р<0,05), выраженный воспалительный процесс - у 31,4% (р<0,01) пациентов. При хроническом бронхите нормоценоз регистрировался у 20,0% (р<0,05), промежуточный тип микробиоценоза - у 20,0% (р<0,01), дисбиоз- у 33,3% (р<0,05), выраженный воспалительный процесс - у 26,7% (р<0,01) пациентов. Достоверных различий по типу микробиоценоза ротоглотки между острым и хроническим бронхитом не выявлено. Патогенетическое действие ассоциации обусловлено суммированием воздействий каждого из ассоциатов с разнонаправленными механизмами их влияния на клетки макроорганизма.
У клинически здоровых детей: I или II тип (степень) микробиоценоза биотопа задней стенки глотки (табл. 3) превалирует, выявление у них III и IV типов микробиценоза биотопа задней стенки глотки свидетельствует о продромальном периоде заболевания инфекционного заболевания (продромальном состоянии макроорганизма). При остром бронхите: III или IV тип (степень) микробиоценоза биотопа задней стенки глотки превалирует (благоприятное течение), выявление I или II типа (степени) микробиоценоза биотопа задней стенки глотки (неблагоприятное течение) свидетельствует об угнетении антиинфекционной резистентности и возможной хронизации инфекционного процесса. При хроническом бронхите: III или IV тип (степень) микробиоценоза биотопа задней стенки глотки (благоприятное течение) указывает на обострение инфекционного процесса, выявление I или II типа (степени) микробиоценоза биотопа задней стенки (неблагоприятное течение) свидетельствует об угнетении антиинфекционной резистентности и возможной хронизации инфекционного процесса.
При проведении терапии установление степени нарушений микробиоценоза биотопа задней стенки глотки повышает информативность оценки ее эффективности за счет выявления механизмов ее лечебного эффекта: при клинической эффективности проводимой терапии регистрировался переход к показателям физиологической нормы - выявлялись I или II типы (степени) микробиоценоза биотопа задней стенки глотки; продолжение регистрации у части больных III и IV типов микробиоценоза биотопа задней стенки глотки указывало на необходимость продолжения лечения.
Пример 2. Оценка состояния здоровья по состоянию микробиоценоза биотопа ротоглотки при респираторной патологии.
Обследован 351 ребенок в возрасте от 2 месяцев до 15 лет (в том числе: клинически здоровые дети - 128, острый тонзиллит (ангина) - 58, ОРВИ - 128, пневмония - 20, инфекционный мононуклеоз с гнойно-воспалительным поражением ротоглотки - 47). Оценку микробиоценоза биотопа ротоглотки проводили согласно методологии, изложенной в пособии утвержденном Учебно-методическим объединением (10).
Постоянная (облигатная) микрофлора данного биотопа в основном представлена альфа- и гамма-гемолитическими стрептококками (105-106 КОЕ/мл) и нейссериями (102-104 КОЕ/мл). Добавочную группу составляют стафилококки, коринебактерии и гемофилы, выделяемые у 26,9-46,2% здоровых детей, в количестве 101-104 КОЕ/мл. К случайным (транзиторным) микроорганизмам отнесены Bacillus, грибы рода Candida, Micrococcus, синегнойная палочка, грамотрицательные энтеробактерии в количестве не выше 101-102 КОЕ/мл, в 1,9-25,0%). У подавляющего числа здоровых детей (99%) на задней стенке глотки (ЗСГ) был зарегистрирован рост альфа-гемолитического стрептококка в ассоциации с нейссериями. Причем у половины из них другие виды микробов не обнаруживались. При гнойном или катаральном воспалительном процессе в ротоглотке обнаружено угнетение облигатной ассоциации альфа-гемолитического стрептококка и нейссерий, образующих защитную биопленку. Дисбиоз локуса развивался в 75-100% случаев. Он имел определенные особенности в зависимости от характера инфекционного процесса. Наиболее выраженное угнетение пролиферации облигатных бактерий было обусловлено местным гнойно-воспалительным процессом при ангине и системным поражением при пневмонии (рис. 1). Именно при данной патологии чаще всего отсутствовали микробы, выделялись монокультуры или ассоциации микроорганизмов, состоящие только из добавочных и/или транзиторных представителей с высокой вероятностью их этиологической значимости, обнаруживались отрицательные посевы (рис. 2). Наиболее устойчивым компонентом облигатной ассоциации был стрептококк, отсутствие нейссерий либо снижение их количества наблюдалось значительно чаще.
Сравнительный анализ полученных результатов обнаружил достоверные различия в состоянии микроэкологии задней стенки глотки в группах клинически здоровых детей и пациентов с респираторной патологией (табл. 1). Инициация инфекционного процесса респираторными вирусами способствовала преимущественной пролиферации грамотрицательных бактерий (особенно клебсиеллы) в больших количествах (более 104 КОЕ/мл), а также их ассоциаций (р=0,000, рис. 2, табл. 1.). Синегнойная палочка выделялась только у часто болеющих детей (ЧБД) либо больных пневмонией. Лечение в стационаре способствовало нарастанию частоты обнаружения грамотрицательных микробов в 2-3 раза вне зависимости от этиологии инфекционного процесса. Обнаружение грамотрицательных бактерий у клинически здоровых детей являлось следствием перенесенной ОРВИ (20% против 0, р<0,001) и сохранялось до двух месяцев. Наиболее часто грамотрицательные бактерии высевались со слизистой ротоглотки у детей первого года жизни (р=0,002) или часто болеющих (р=0,004). Пролиферация грибов рода Candida, особенно в больших количествах (более 102 КОЕ/мл), была характерна для больных инфекционным мононуклеозом, пневмонией, ЧБД - особенно младших возрастных групп (р=0,000), активировалась на фоне антибактериальной терапии и расценивалась как неблагоприятный фактор, поскольку отсутствовала у здоровых детей из группы эпизодически болеющих.
Стафилококки, в том числе S. aureus, на слизистой ротоглотки с равной частотой встречались у здоровых и больных детей (за исключением пациентов с пневмонией, у которых они обнаруживались достоверно реже). Чаще S. aureus (47,4 против 9,4%, р<0,01) высевался при гнойно-воспалительном процессе в ротоглотке у детей с массивными наложениями на миндалинах или сопутствующими гнойными очагами инфекции. Назначение антибактериальной терапии не снижало частоту выделения и среднюю обсемененность S. aureus после лечения (22% и 17,8%, 4,17±0,52 и 5,06±0,55 lg КОЕ/мл). На наш взгляд, его обнаружение на слизистой ротоглотки не должно рассматриваться как однозначное показание к лечению при отсутствии клинических признаков болезни либо при инфекционном процессе, если одновременно присутствуют облигатные бактерии. Значение следует придавать обнаружению монокультуры стафилококка, особенно S. aureus, при условии наличия гнойно-воспалительного процесса в ротоглотке. Установлено, что отсутствие альфа-гемолитических стрептококков и/или нейссерий, обнаружение синегнойной палочки, грибов рода Candida и спорообразующих анаэробов, а также грамотрицательных бактерий нескольких видов или их монокультур является признаком глубокого дисбиоза и требует внимания педиатра. Оценка выраженности дисбиоза ротоглотки у детей, не имеющих признаков острой инфекции на момент обследования, должна проводиться с учетом клинического состояния пациентов их преморбидного состояния и анамнеза. Внимание следует уделять частоте эпизодов ОРВИ в году, срокам и тяжести последнего заболевания, а также наличию хронической патологии ЛОР-органов, поскольку именно наличие этих клинических признаков коррелировало с глубиной дисбиотических нарушений в ротоглотке.
В состав комплексного лечения и реабилитации пациентов включались иммунотропные средства. В качестве одного из современных иммуномодуляторов использован препарат Кипферон® суппозитории для вагинального или ректального введения. Кипферон® представляет собой композицию из комплексного иммуноглобулинового препарата (КИП) с высоким содержанием специфических IgG, IgA и IgM и рекомбинантного человеческого IFN-α-2b. Содержащийся в препарате рекомбинантный человеческий IFN-α-2b вызывает активацию местного иммунитета, позволяет эффективно устранять очаги воспаления, а КИП - уменьшает количество УПМ и устойчиво восстанавливает нормальную микрофлору, как минимум на протяжении 2-3 месяцев. У детей с ОРВИ, получавших Кипферон®, после лечения в 3 раза снизилась частота высева S. aureus (от 33,3% до 10%, р<0,05). Не отмечено угнетения облигатных микроорганизмов. В 2 раза реже регистрировалась транзиторная микрофлора. В группе сравнения, в динамике лечения, возросло число несвойственных для данного биотопа микроорганизмов, в том числе выявлялись ранее отсутствовавшие гемолизирующая кишечная палочка и грибы рода Candida. У больных тонзиллитом после лечения в 6 раз уменьшилась частота высева S. aureus (от 20% до 3,3%, р<0,05), реже (6,6% против 24,2%, р<0,05), чем в контроле, обнаруживались грамотрицательные энтеробактерии. У больных инфекционным мононуклеозом лечение Кипфероном® способствовало улучшению микробиологических показателей, в том числе снижению числа детей с высоким уровнем (3-6) микробных ассоциантов на слизистой ротоглотки, элиминации S. aureus (от 53,3% до 23,1%), грибов рода Candida, бета-гемолитического стрептококка группы А (от 20% до 0%, р<0,05).
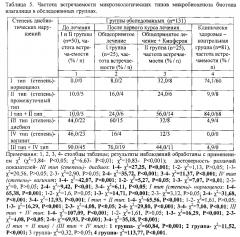
У клинически здоровых детей: I или II тип (степень) микробиоценоза биотопа задней стенки глотки (табл. 2) превалирует, выявление у них III и IV типов микробиоценоза биотопа задней стенки глотки может рассматриваться как маркер продромального периода инфекционного заболевания. При остром ОРВИ: III или IV тип (степень) микробиоценоза биотопа задней стенки глотки (благоприятное течение), выявление I или II типов (степеней) микробиоценоза биотопа задней стенки глотки за счет вирусного компонента заболевания (неблагоприятное течение) свидетельствует о угнетении антиинфекционной резистентности и возможной хронизации инфекционного процесса. При тонзиллите: III или IV тип (степень) микробиоценоза биотопа задней стенки глотки превалирует (благоприятное течение), выявление I или II типов (степеней) микробиоценоза биотопа задней стенки глотки (неблагоприятное течение) свидетельствует о угнетении антиинфекционной резистентности и возможной хронизации инфекционного процесса. При пневмонии: III или IV тип (степень) микробиоценоза биотопа задней стенки глотки превалирует (благоприятное течение), выявление I или II типов (степеней) микробиоценоза биотопа задней стенки глотки (неблагоприятное течение) свидетельствует об угнетении антиинфекционной резистентности и возможной хронизации инфекционного процесса. При инфекционном мононуклеозе: III или IV тип (степень) микробиоценоза биотопа задней стенки глотки превалирует (благоприятное течение), выявление I или II типов (степеней) микробиоценоза биотопа задней стенки глотки (неблагоприятное течение) свидетельствует о угнетении антиинфекционной резистентности и возможной хронизации инфекционного процесса.
При проведении терапии установление степени нарушений микробиоценоза биотопа-задней стенки глотки повышает информативность оценки ее эффективности за счет выявления механизмов ее лечебного эффекта: при клинической эффективности проводимой терапии регистрировался переход к показателям физиологической нормы - выявлялись I или II типы (степени) микробиоценоза биотопа задней стенки глотки; продолжение регистрации у части больных III и IV типов микробиоценоза биотопа задней стенки глотки указывало на необходимость продолжения лечения.
Пример 3. Оценка состояния здоровья по состоянию микробиоценоза биотопа влагалища при уреаплазмозе.
Обследовано 50 женщин с установленной уреаплазменной моно- и микст-инфекцией. Лечение больных I группы (25 пациентов) включало только антибактериальные препараты широкого спектра действия (тиберал, доксициклин, вильпрофен, фторхинолоны), противогрибковые препараты (нистатин, низорал, дифлюкан), витамины С и Е, местное лечение (свечи "Тержинан"). Во II группе (25 больных) в приведенный выше курс лечения был включен препарат "Кипферон, суппозитории". Контрольная группа (группа сравнения) включала 81 клинически здоровых женщин. Оценку микробиоценоза влагалища (Вл) проводили согласно методологии(10), а также согласно новой медицинской технологии (11).
Исследованием на наличие уреаплазм выявлен высокий титр возбудителя >104 КОЕ/мл - у 100% больных. Установлены у 6 больных уреаплазменная моноинфекция и у 44 больных - сочетанный характер инфицирования. При микст-инфекциях наблюдалось образование 2-7 - компонентных ассоциаций патогенных агентов.
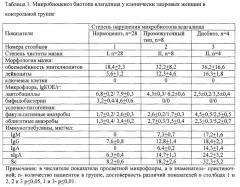
В контрольной (табл. 1 ) группе клинически здоровых женщин нормоценоз определялся у 70%, промежуточный тип и дисбиоз - у 20% и 10% обследованных, соответственно. При нормоценозе в контрольной группе при I степени чистоты мазка в просветной и в пристеночной областях доминировали лактобациллы, выделявшиеся в 100% случаев в количестве 6,8±0,2 lg КОЕ/г и 7,9±0,3 lg КОЕ/г, соответственно. Бифидобактерии выявлялись в 42% случаев в количестве 3,2±04 lg КОЕ/г - в просветной области, и в количестве 4,6±0,6 lg КОЕ/г - в пристеночной области. Количество УПМ, представленной аэробными и анаэробными стрептококками, не превышало 3 lg КОЕ/г, при средних значениях 1,7±0,2 lg КОЕ/г и 2,6±0,3 lg КОЕ/г - в просветной области, 1,3±0,4 lg КОЕ/г и 3,4±0,2 lg КОЕ/г - в пристеночной области, соответственно. При промежуточном типе микробиоценоза биотопа Вл при II степени чистоты мазка в просветной и пристеночной области Вл обнаруживались факультативно-анаэробные стрептококки в количестве 2,6±0,2 lg КОЕ/г и 1,7±0,3 lg КОЕ/г и пептострептококки - в количестве 2,7±0,3 lg КОЕ/г и 3,5±0,4 lg КОЕ/г, соответственно. Количество лактобацилл снижалось до 4,3±0,3 lg КОЕ/г в просветной и до 6,2±0,6 lg КОЕ/г в пристеночной области, бифидобактерии не выделялись.
Дисбиоз Вл сопровождался значительным снижением количества лактобацилл (интенсивность колонизации просветной области - 2,5±0,2 lg КОЕ/г, пристеночной области - 3,5±0,4 lg КОЕ/г). На фоне снижения уровня лактобацилл при II степени чистоты мазка в просветной и пристеночной областях выявлялись коагулазо-отрицательный стафилококк в концентрации 5 lg КОЕ/г и 3 lg КОЕ/г, Е. coli и грибы рода Candida- в концентрации 4 lg КОЕ/г и 2 lg КОЕ/г и пептострептококки - в концентрации 2,3±0,3 lg КОЕ/г и 5,2±0,7 lg КОЕ/г, соответственно. Процент встречаемости УПМ в контрольной группе составлял для пептострептококков - 52,5%, аэробных стрептококков - 32,5%, стафилококк, кишечная палочка и грибы рода Candida выявлялись у 7,5% обследованных. УПМ при промежуточном типе и дисбиозе выявлялись в монокультуре или в 2-х компонентных ассоциациях. В контрольной группе содержание лактобацилл при промежуточном II типе микробиоценоза (у 20% пациентов) при р≤0,05 и дисбиозе (III тип; у 10% пациентов) при р≤0,01 было достоверно ниже по сравнению с нормоценозом (I тип микробиоценоза; у 70% пациентов), а по сравнению с типом II при дисбиозе при р≤0,05. Содержание УПМ достоверно выше по сравнению с типом I при типе II (р≤0,05) и типе III (р≤0,01), а по сравнению с типом II при типе III (р≤0,05). Содержание факультативных анаэробов достов