Способ лечения асцитной формы рака
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения асцитной формы рака. Для этого мышам-опухоленосам линии СВА весом 20-35 г, несущим развитый асцит, парентерально вводят цитостатик циклофосфан в 0, 36, 72 часа каждый раз в дозе 100 мг/кг, а через 18, 54, 90 часов после каждой инъекции циклофосфана, соответственно. Также мышам-опухоленосам вводят интраперитонеально препарат ДНК, состоящий из композиции препаратов нативной двуцепочечной ДНК человека в дозе 3.0 мг и смеси нативной и кросс-линкированной двуцепочечной ДНК спермы лосося в соотношении 5:3 в дозе 3 мг суммарно в количестве 6.0 мг на инъекцию, независимо от веса мышей-опухоленосов. Изобретение обеспечивает повышение эффективности лечения асцитной формы рака, заключающееся в предотвращении появления вторичного асцита за счет разработанной схемы введения препаратов ЦФ и ДНК. 2 з.п. ф-лы, 1 табл., 7 ил.
Реферат
Изобретение относится к медицине, в частности к онкологии, и может быть использовано для лечения асцитных форм злокачественных новообразований.
Онкологические заболевания занимают второе место по общей смертности после сердечно-сосудистых заболеваний, а страх перед возможностью возникновения злокачественного новообразования имеет глубокий социальный резонанс. Статистические данные свидетельствуют о том, что заболеваемость онкологическими заболеваниями ежегодно растет, и при этом прослеживается явная тенденция к «омоложению рака».
Известны способы лечения онкологических заболеваний, основанные на применении химиотерапевтических препаратов, применяемых для лечения злокачественных заболеваний различных групп: алкилирующие препараты, антиметаболиты, противоопухолевые антибиотики, алкалоиды и другие биологические активные вещества растительного происхождения, а также ферментные и гормональные препараты [1].
В мировой практике разработаны и переведены в стандарты основные способы лечения больных со злокачественными новообразованиями.
Общепринятой терапией, вне зависимости от происхождения рака и его формы, является использование различных схем циторедуцирующего воздействия. Циторедуцирующая терапия с применением цитостатиков, являющаяся основой лечения раков, направлена на удаление видимой массы опухоли. Как следует из огромной клинической практики, угроза рецидивов в ближайшие 5 лет при такой терапии достигает 30-50%. Этот факт связан с присутствием в неотрансформированной ткани популяции клеток, обладающих потенциалом стволовых клеток [2, 3].
К одной из наиболее труднолечимых форм рака, связанной с терминальной стадией развития заболевания, относится асцитная форма. Злокачественный (малигнизированный) асцит - это патологическое накопление жидкости в брюшной или плевральной полости, развивающееся вследствие опухолевого поражения брюшины или легких. Асцит вызывает значительный дискомфорт и приводит к различным функциональным нарушениям у пациентов в запущенных стадиях онкологического заболевания и является сложной клинической проблемой. Малигнизированный асцит составляет примерно 10% среди всех случаев асцита и наиболее часто развивается при раке молочной железы, яичников, желудка, поджелудочной железы и толстой кишки [4].
В онкологической клинике асцитные формы рака являются грозным осложнением и, в подавляющем большинстве случаев, приводят к гибели пациентов. Смерть таких больных наступает даже при отсутствии отдаленных метастазов и прогрессии опухоли.
Для лечения асцитных форм рака используется несколько общепринятых способов лечения, позволяющих продлить и улучшить "качество" жизни пациентов [5].
Один из известных способов [6-8] основан на том, что производят пункцию с последующим удалением экссудата и вводят в полость противоопухолевые препараты и стероидные гормоны, наиболее эффективными из которых признаны цисплатин, адриамицин, тиоТЭБ и циклофосфан (ЦФ) [6-8].
Недостатком такого способа является относительно низкая эффективность, в результате чего для большинства больных он дает лишь кратковременный паллиативный эффект [9], что определяет ограниченность их применения.
Известен также способ лечения асцита, основанный на комбинированном применении двух препаратов, диоксадэта и цисплатина [10].
Сравнительное изучение противоопухолевой активности цитостатиков диоксадэта, цисплатина и их комбинации проводилось на модели асцитной опухоли яичника у 38 крыс-самок Вистар. Асцитная опухоль яичника перевивалась внутрибрюшинно в количестве 5×106 клеток на крысу. Диоксадэт и цисплатин вводили внутрибрюшинно однократно через 48 ч после перевивки опухоли яичника в максимально переносимых дозах: 1,5 и 4,0 мг/кг массы тела соответственно. В комбинации диоксадэт и цисплатин вводили по той же схеме, но в дозах, составляющих половину от максимально переносимой дозы. Противоопухолевые эффекты препаратов оценивали по увеличению продолжительности жизни животных. В контрольной группе крыс, не получавших лечения, средняя продолжительность жизни составила 16±6,3 дня. Диоксадэт и цисплатин проявили сравнимую противоопухолевую активность, увеличив среднюю продолжительность жизни на 63,1% и 48,1% соответственно. Средняя продолжительность жизни при введении комбинации препаратов значимо увеличилась на 107,5%, что равно сумме эффектов каждого препарата в отдельности.
Недостатком этого способа лечения также является относительно низкая его эффективность, поскольку, как подтвердили результаты экспериментальных исследований, при его применении не удается полностью остановить развитие асцита, а лишь тормозится его рост, увеличивая при этом продолжительность жизни животных примерно в два раза [10].
Кроме того, известен способ внутрибрюшинной химиотерапии больных асцитным раком яичников III-IV стадий [11, 12], согласно которому в предоперационном периоде амбулаторно проводят иммунокоррекцию путем внутрибрюшинного введения Т-активина по 1 ампуле в день - 100 мкг, в течение 10 дней с одномоментным внутрибрюшинным введением химиопрепаратов: в 1-й день 1-2 г ЦФ, во 2-й день 150-200 мкг препарата, производного платины, в зависимости от веса больной.
Этот способ характеризуется меньшей токсичностью и большей эффективностью, что позволяет значительно увеличить процент регрессии, операбельности и резектабельности опухоли, а также продолжительность жизни больных асцитной формой рака яичников III-IV стадии заболевания (на 16-26%) по сравнению с другими методами химиотерапии.
Однако способ направлен только на предоперационную подготовку больных, позволяющий создать условия большей операбельности и резектабельности опухоли, а также увеличить продолжительность жизни пациентов на 16-20%, и не обеспечивает надежно полную эрадикацию первичного асцита и не предотвращает его повторное появление.
Поэтому описанный выше способ лечения также недостаточно эффективен.
Помимо указанных выше, известен способ лечения распространенного рака яичника [13], сущность которого заключается в том, что в послеоперационном периоде инкубируют асцитическую жидкость больного с различными сочетаниями цитостатиков в присутствии рихлокаина в концентрации 0,005 мг на 1 мл инкубационной смеси и при обнаружении резкого увеличения числа мертвых клеток в асцитической жидкости выбирают эту комбинацию цитостатиков для дальнейшей внутрибрюшинной химиотерапии с предварительным внутрибрюшинным введением рихлокаина в суммарной дозе 10-30 мл 0,5% раствора.
Способ позволяет повысить противоопухолевое действие внутрибрюшинно введенных цитостатиков в сочетании с рихлокаином, осуществляется индивидуальный подбор схемы химиотерапии, способствующий улучшению состояния больных, снижению токсичности, удлинению срока стойкой ремиссии, нормализации ряда структурно-функциональных показателей крови, а также исключается использование неэффективных лекарственных средств.
Однако недостаточная эффективность и ограниченность области применения этого способа связана с тем, что оценка и выбор эффективности цитостатического лекарственного средства определяется при ex vivo обработке асцита прямым добавлением цитостатика, значительно сужая тем самым спектр лекарственных препаратов цитостатического ряда, часть которых проявляет свою противораковую активность в форме метаболитов, генерируемых в печени, например, ЦФ. Поэтому и этот способ недостаточно эффективен и не решает задачу полной эрадикации первичного асцита и предотвращения его повторного появления.
Известны также способы лечения раков, в том числе асцитных, основанных на проведении химиотерапией сверхмалыми дозами противоопухолевых цитостатиков [14, 15]. Для феномена сверхмалых доз установлен ряд общих закономерностей, присущих разным биологически активным веществам, в том числе лекарственным препаратам. Эти закономерности обнаружены при исследовании зависимостей «доза/эффект» в большом диапазоне доз. В наиболее простом, схематичном виде, эти зависимости являются бимодальными: эффект постоянно регистрируется при определенной «обычной» (для эндогенных веществ - «физиологической», для лекарственных препаратов - «терапевтической») дозе (обычно порядка 10-2-10-6 М, т.е. мг/кг, г/кг); при постепенном уменьшении дозы эффект снижается и в определенном интервале низких доз он становится небольшим или не регистрируется совсем («мертвая зона»). При дальнейшем уменьшении дозы и переходе в область сверхмалых доз вновь начинает регистрироваться эффект, который достигает максимума при определенной, характерной для данного вещества, сверхмалой дозе. В определенных ситуациях этот эффект может быть близким к эффекту «терапевтической дозы», меньше или даже больше его, иметь тот же или противоположный знак (например, ингибирование при «терапевтической дозе» может смениться на стимулирование при сверхмалой дозе). Во многих случаях наблюдаются более сложные полимодальные зависимости эффекта от дозы в интервале от терапевтических до сверхмалых доз. В этих случаях на кривой «доза/эффект» регистрируются несколько пиков эффекта и несколько «мертвых зон». Перечень биологически активных веществ различной природы, для которых уже доказана эффективность в сверхмалых дозах, составляет более сотни наименований, и он постоянно увеличивается. В этот список входят внутренние биорегуляторы (различные пептиды, гормоны), токсины, а также разнообразные синтетические соединения и вещества природного происхождения. Для целого ряда веществ, в том числе стандартных противоопухолевых препаратов, показано наличие противоопухолевой активности при использовании в сверхмалых дозах. Способность сверхмалых дох биологически активных веществ модифицировать противоопухолевый эффект терапевтических доз цитостатиков показана на примере совместного применения синтетического антиоксиданта фенозана и доксорубицина у мышей с асцитной лейкемией Р-388. Установлено, что комбинация фенозана в разных дозах (10-7-10-17 М) с терапевтической (1,4×10-3 М, 8 мг/кг) дозой доксорубицина приводит к увеличению эффекта по сравнению с использованием доксорубицина в виде монотерапии. Выживаемость животных, получавших фенозан в дозах 10-7 и 10-9 М, а также в значительно меньших (10-12 и 10-17 М) дозах, была существенно выше выживаемости мышей, получавших только доксорубицин. При использовании промежуточной (10-11 М) дозы фенозана не только не наблюдалось усиление эффекта доксорубицина, но даже имело место его полное отсутствие. Эти данные хорошо согласуются с отмеченными выше общими закономерностями действия сверхмалых доз биологически активных веществ.
Однако этот способ лечения также имеет ограниченную область применения, поскольку противоопухолевая активность сверхмалых доз показана не для всех изученных противоопухолевых препаратов и реализовывалась не на всех опухолевых моделях.
Известен и способ лечения опухолевых плевритов [16], включающий виутриплевральное введение противоопухолевых препаратов, причем у больного производят забор аутокрови в количестве 100-150 мл в стерильный флакон с гемоконсервантом "Глюгицир", центрифугируют при Vоб=1500 об/мин в течение 30 мин, отбирают 20 мл надосадочной плазмы, растворяют в ней разовую дозу цитостатика для внутриплеврального введения, инкубируют при 37°C в течение 30 мин, оставшиеся во флаконе клеточную часть и плазму реинфузируют, затем под местной анестезией производят пункцию плевральной полости, максимально эвакуируют плевральный выпот и вводят приготовленную аутоплазму с цитостатиком внутриплеврально, при необходимости процедуру повторяют.
При внутриплевральном введении цитостатиков на аутоплазме возможно сочетание с системной химиотерапией.
Указанный способ недостаточно эффективен, поскольку, обеспечивая стабильную на протяжении 8 месяцев ремиссию в развитии первичного асцита, не гарантирует от развития вторичного асцита в отдаленной (1-3 года) перспективе.
Наиболее близким к предложенному является способ [17], основанный на совместном воздействии цитостатика циклофосфана и препарата фрагментированной ДНК человека, при котором мышам линии СВА весом 20-35 г, несущим развитый асцит, парентерально вводится циклофосфан в дозе 200 мг/кг и далее в течение 12 часов каждый час после введения циклофосфана вводят интраперитонеально препарат ДНК, состоящий из смеси препаратов фрагментированной ДНК человека и кросс-линкированной ДНК человека, обработанной нитроген-мустардом.
Особенностью способа является то, что в качестве препарата ДНК используют смесь препаратов фрагментированной ДНК человека и кросс-линкированной ДНК человека размером 300-6000 пар оснований, а в препарате кросс-линкированной ДНК на 1000 пар оснований приходится 80-120 межцепочечных сшивок.
Наиболее близкое техническое решение основано на воздействии на стволовые инициирующие раковые клетки асцитной формы опухоли (на примере Кребс-2), при котором происходит эрадикация (уничтожение) популяции раковых клеток, обладающих инициирующими свойствами (стволовые-туморогенные раковые клетки). Для этого используется эффект совместного воздействия цитостатика циклофосфана (ЦФ) и препарата двуцепочечной ДНК.
Однако наиболее близкое техническое решение также обладает относительно низкой эффективностью лечения, поскольку при его использовании применяются многоразовые инъекции препарата ДНК, что вызывает токсический эффект, при этом временной интервал действия препарата не ориентирован на интерференцию репаративного процесса гомологичной рекомбинации в стволовых инициирующих раковых клетках, что в значительной степени ограничивает терапевтический эффект от такой терапии и не предполагает полного вылечивания от асцитной формы рака.
Задача, решаемая в настоящем изобретении, направлена на повышение эффективности лечения путем увеличения эрадикации стволовых инициирующих раковых клеток с целью полной элиминации первичного ракового асцита и уменьшения возможности появления вторичного асцита, или полного вылечивания от асцитной формы рака.
Требуемый технический результат заключается в повышении эффективности лечения асцитной формы рака путем повышения эрадикации стволовых инициирующих раковых клеток, элиминации первичного ракового асцита и предотвращения появления вторичного асцита на основе использования теоретически обоснованных и экспериментально подтвержденных авторами четких временных интервалов применения препаратов ЦФ и ДНК в соответствии с вновь выявленными и описанными биологическими свойствами стволовых инициирующих раковых клеток.
Поставленная задача решается, а требуемый технический результат достигается в способе лечения асцитной формы рака, основанном на совместном воздействии цитостатика циклофосфана и препарата двуцепочечной ДНК, при котором, согласно изобретению, мышам-опухоленосам линии СБА весом 20-35 г, несущим развитый асцит, парентерально вводят цитостатик циклофосфан в 0, 36, 72 часа каждый раз в дозе 100 мг/кг, а через 18, 54, 90 часов после каждой инъекции циклофосфана, соответственно, мышам-опухоленосам вводят интраперитонеально препарат ДНК, состоящий из композиции препаратов нативной двуцепочечной ДНК человека в дозе 3.0 мг и смеси нативной и кросс-линкированной двуцепочечной ДНК спермы лосося в соотношении 5:3 в дозе 3 мг суммарно в количестве 6.0 мг на инъекцию, независимо от веса мышей-опухоленосов.
Кроме того, требуемый технический результат достигается тем, что для достижения максимального терапевтического действия на восьмые сутки после первой инъекции циклофосфана вводят дополнительно циклофосфан в дозе 100 мг/кг и через 18 часов препарат ДНК суммарно в количестве 6 мг.
Кроме того, требуемый технический результат достигается тем, что интраперитонеально препарат ДНК в количестве 6 мг на инъекцию вводят однократно в объеме 500 мкл из расчета половины объема четырехсуточного асцита, соответствующего 1 мл и 1/20 веса животного, содержащего ~200 млн раковых клеток.
Сущность предложенного способа заключается в следующем.
Вначале проводят разрушение комметированных раковых клеток возбуждением трех последовательных без перерыва полных циклов репарации межцепочечных сшивок, индуцируемых инъекциями циклофосфана в 0, 36, 72 часа в дозе по 100 мг/кг. При этом эрадикация стволовых инициирующих раковых клеток осуществляется одновременно на фоне инъекций циклофосфана путем инъекции препарата ДНК в 18, 54, 90 часов (через 18 часов после каждой инъекции циклофосфана), соответственно, при которых вторая и третья инъекции циклофосфана будут индуцировать вторую и третью волну двуцепочечных разрывов в раковых клетках, находящихся в этот момент в поздней S/G2/M фазе клеточного цикла, а так же в раковых клетках, находящихся в момент первой инъекции циклофосфана в G2/M фазах клеточного цикла и не чувствительных, по этой причине, к обработке ДНК, т.е. вторая и третья обработки ЦФ будут индуцировать вторую и третью волну двуцепочечных разрывов в уже арестованных стволовых инициирующих раковых клетках, повторно запирая их выход из состояния ареста, и одновременно будут индуцироваться межцепочечные сшивки и арест клеточного цикла у другой части стволовых инициирующих раковых клеток, находившихся при первой обработке цитостатиком в нечувствительной G2/M фазе клеточного цикла и перешедших в G1/S чувствительную фазу.
Таким образом, к концу цикла лечения индуцируется апоптоз всех коммутированных раковых клеток и происходит синхронизация в поздней S/G2/M всех стволовых раковых клеток, успешно преодолевших терапевтические процедуры. При этом для каждой последующей инъекции препарата ДНК используется точка 18 часов после каждой инъекции циклофосфана, представляющая собой точку разделения двух фаз процесса репарации межцепочечных сшивок, индуцированных циклофосфаном, в которой закладывается процесс разрушения стволовых инициирующих раковых клеток по двум независимым модам в форме интерференции конечных интермедиатов репаративной фазы NER одной составляющей препарата ДНК, и интерференции начальных интермедиатов репаративной фазы гомологичной рекомбинации второй составляющей препарата ДНК. После проведения первого цикла лечения проводят аналогичный первому второй цикл через 7-9 суток после начала первого цикла, т.е. в момент начала масштабного разрушения комметированных раковых клеток и синхронизации в G2/M, и переходу в следующую по очередности S фазу TAMRA+ стволовых инициирующих раковых клеток.
В целом, предложенный способ основан на естественной способности свободно расположенных в асцитном бульоне не объединенных в компартменты стволовых (инициирующих) раковых клеток Кребс-2 интернализовать экзогенные экстраклеточные фрагменты двуцепочечной ДНК, на участии интернализованных фрагментов в репаративном процессе при репарации межцепочечных сшивок в фазе NER и гомологичной рекомбинации после действия цитостатических препаратов кросс-линкирующего ряда (ЦФ), а также на определенной временной интервальной схеме, определяемой вновь открытыми биологическими свойствами стволовых инициирующих раковых клеток Кребс-2.
В современной литературе отсутствуют указания на предлагаемый способ убийства стволовых раковых клеток и эрадикации развитого асцита и возможности предотвращения развития вторичного асцита на протяжении 190 суток (на модели асцитной формы рака Кребс-2) после начала заболевания. Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает критерию практической (промышленной) применимости.
На чертеже представлены следующие иллюстрирующие материалы.
На фиг. 1 - корреляция противоракового эффекта совместных обработок ЦФ и препаратами ДНК со стадией репарации межцепочечных сшивок, индуцированных действием ЦФ, полученная на клетках асцитной формы опухоли Кребс-2 (данные на графиках приведены в сравнении с контролем и действием только ЦФ, где А - схематическое изображение стадий репаративного процесса в клетках асцита Кребс-2 и наложение на него режимов введения препаратов двуцепочечной ДНК (линия от 0 до 12 часов и от 18 до 30 часов, соответственно); линия от 0 до 12 часов - введение нативного препарата ДНК человека, линия от 18 до 30 часов - введение смеси кросс-линкированной и нативной ДНК лосося (ssDNAmix) в соотношении 3/5; В - схематическое изображение интермедиатов репарации межцепочечных сшивок, расположенных в соответствии с фазами формирования и репарации двуцепочечных разрывов: 1 - появление межцепочечной сшивки, 2 - остановка репликативной вилки в месте повреждения, 3, 4 - обнаружение межцепочечной сшивки NER системой клетки и формирование двуцепочечного разрыва, 5 - транслокация аддукта и репаративный синтез прямой цепи ДНК, осуществляемый либо путем TLS, либо по гомологичной матрице, 6 - второй раунд NER, вырезание аддукта, 7 - репаративный синтез обратной цепи ДНК, 8 - процессинг 3′-конца двуцепочечного разрыва, 9, 10 - инвазия процессированного 3′-конца двуцепочечного разрыва в гомологичный участок цепи ДНК и восстановление репликативной вилки; С - 1, 2, 3, 4 - динамика появления опухолей при перевивке в виде солидных внутримышечных трансплантатов клеток, обработанных in vivo ЦФ и препаратами ДНК, где количество перевиваемых клеток указано над графиком, 5 - динамика гибели экспериментальных животных с асцитной формой опухоли Кребс-2 после проведенных обработок, где количество исходно привитых клеток асцита указано над графиком, 1-3 - экспериментальные группы животных, получавшие в сочетании с ЦФ препарат ДНК человека (hDNA), 4, 5 - экспериментальные группы животных, получавшие в сочетании с ЦФ препарат ДНК спермы лосося (ssDNAmix); D - слева мышь из группы «CP + ssDNAmix (18-30)» (фиг. 2, С4, кривая «Hp + ssDNAmix (18-30)»), у которой через 270 дней после прививки графта трансплантат так и не развился, справа - мышь из контрольной группы на 20-й день после прививки опухоли, стрелками указано место прививки трансплантата; Е - обобщенная схема обработки экспериментальных мышей ЦФ и препаратами ДНК и точки забора клеток для последующей трансплантации здоровым животным в виде солидных опухолей.
На фиг. 2 - цитофлуоресцентный (А) и проточноцитометрический (В) анализ интервализации Alu-TAMRA ДНК в стволовые инициирующие раковые клетки асцитной опухоли Кребс-2, красный сигнал (TAMRA) - интернализация меченного ДНК зонда, синим окрашены ядра клеток флуоресцентным красителем DAPI; Merge - объединенные (TAMRA/DAPI) имиджи. С - анализ содержания TAMRA+ ДНК в асците у индивидуальных мышей (control 1-6) на протяжении его развития до 15 суток, где нижние графики (sum 1, sum 2) - объединенные результаты по трем животным.
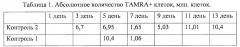
На фиг. 3 - анализ клеточного цикла асцитных клеток у мышей после обработки исследуемым терапевтическим режимом; А - схема эксперимента, где кривые соответствуют фазам репаративного процесса NER и гомологичной рекомбинации при репарации межцепочечных сшивок, индуцированных ЦФ, 0, 36 и 72 часа - точки введения цитостатика, 18, 54 и 90 часов - точки введения препарата двуцепочечной ДНК. Пунктиром обозначена принципиальная схема репарации МЦС, подробно рассмотренная на фигуре 1. В - плоты, полученные на основе анализа асцитных раковых клеток 3-х индивидуальных мышей, демонстрирующие изменения в клеточном цикле; С - суммарный график по трем животным (слева), графическое изображение изменений в клеточном цикле (справа); D - графики изменения процента TAMRA+ клеток в асците после проведенных обработок циклофосфаном, где показаны изменения у индивидуальных животных (СР1-5; n=5) и суммарный обобщающий график (sum); Е - цитологический анализ состояния клеток на 7-е сутки от начала терапии (2) по сравнению с контролем (1).
На фиг. 4 - анализ динамики количества CD34+ клеток в асцитном варианте мышиной опухоли Кребс-2 после обработки ЦФ и препаратом двуцепочечной ДНК, где «ЦФ» - однократная инъекция ЦФ (200 мг/кг), «ЦФ+ДНК» - инъекция ЦФ (200 мг/кг) и 12 инъекций препарата ДНК через каждый час после инъекции ЦФ по 0,5 мг за инъекцию, «ДНК» - 12 ежечасных инъекций препарата ДНК по 0,5 мг на инъекцию, «Контроль» - интактный асцит до обработок, 0 - время инъекции ЦФ или первой инъекции ДНК; А - FACS анализ количества CD34+ клеток в асците Кребс-2, развивающемся в мыши, в контроле (до инъекций) и через 24 часа после инъекций ЦФ или ЦФ+ДНК; В - анализ количества CD34+ клеток в асците Кребс-2, развивающемся в мыши, в контроле и через 24 часа после инъекций ЦФ, ЦФ+ДНК или ДНК при помощи флуоресцентной микроскопии; С - FACS анализ количества CD34+ клеток в асците Кребс-2, развивающемся в мыши, в контроле (до инъекций) и через 12 и 48 часов после инъекций ЦФ или ЦФ+ДНК; D - схематичное изображение изменения количества CD34+ клеток в течение двух суток в асците Кребс-2 на фоне инъекций ЦФ, ЦФ+ДНК и ДНК, где график построен с учетом результатов трех независимых экспериментов (Л-С).
На фиг. 5 - А - синергичное действие ЦФ и препарата двуцепочечной ДНК в режиме «три ЦФ+ДНК», не предусматривающее финальной терапевтической инъекции; В - синергичное действие ЦФ и препарата двуцепочечной ДНК в режиме «три ЦФ+ДНК + четвертая инъекция ЦФ+ДНК» в момент времени полного восстановления асцитных раковых клеток от воздействия первоначальной процедуры (на 14 сутки от первой инъекции ЦФ). AI - активация адаптивного иммунного ответа препаратом «Панаген». ВМС - трансплантация костного мозга. 1 - терапевтическая схема; 2 - график резорбции асцита, ремиссии и рецидива; 3 - график гибели животных; 4 - плоты, демонстрирующие среднюю продолжительность жизни.
На фиг. 6 - А - синергичное действие ЦФ и препарата двуцепочечной ДНК в режиме «три ЦФ+ДНК + четвертая инъекция ЦФ+ДНК» в терминальную точку терапии в момент разрушения комметированных раковых клеток и выхода из ареста в G2/M стволовых инициирующих раковых клеток Кребс-2 на 8 сутки от первой инъекции ЦФ. (1) динамика гибели животных и (2) регрессии асцита в экспериментальных группах (ЦФ и группа после проведенной терапии); В - схема эксперимента; С - синергичное действие ЦФ и препарата двуцепочечной ДНК в режиме «три ЦФ+ДНК + четвертая инъекция ЦФ+ДНК» в терминальную точку терапии в момент разрушения комметированных раковых клеток и выхода из ареста в G2/M стволовых инициирующих раковых клеток Кребс-2 (на 12 сутки от первой инъекции ЦФ). (1) динамика гибели животных и (2) регрессии асцита в экспериментальных группах (ЦФ и группа после проведенной терапии).
На фиг. 7 - А - общая схема событий, произошедших с экспериментальными животными после проведенной терапевтической процедуры и до 150 суток эксперимента; В - демонстрация мышей до терапии (левая группа панелей), в момент регрессии асцита (на 17 сутки от первой инъекции ЦФ) и вылеченных мышей на 150 сутки эксперимента (правая группа панелей).
Актуальность данного изобретения подтверждается тем, что, несмотря на достигнутые успехи в химиотерапии злокачественных опухолей и, в частности, асцитных форм рака существует проблема, не позволяющая сформировать четкое законченное представление о правильности выбранной стратегии лечения и средств воздействия на малегнизированные клетки. Такой проблемой является отсутствие понимания всей совокупности биологических свойств опухолевых клеток и в первую очередь стволовых инициирующих раковых клеток.
В этой связи наиболее важным является вопрос чувствительности туморогенных стволовых клеток к выбранной терапии. Все цитостатики, так или иначе, разрушают комметированные раковые клетки, и при этом в настоящее время не существует адекватного, простого подхода в определении эффективности воздействия выбранного лечения на стволовые инициирующие раковые клетки.
В этой связи подходы, позволяющие контролировать процесс эрадикации стволовых инициирующих раковых клеток и строящие свою стратегическую платформу на четком знании определенных биологических закономерностей стволовых инициирующих раковых клеток, являются тем важным инструментом, позволяющим осознанно применять терапевтические процедуры, основной целью которых является эрадикация стволовых инициирующих раковых клеток и тем самым лишение опухоли туморогенного начала. Кроме этого, оценка состояния популяции стволовых инициирующих раковых клеток позволяет следить за эффективностью терапии и корректировать лечебную тактику.
В этой связи разработка новых терапевтических стратегий эрадикации туморогенного начала опухоли, основанных на знании принципиально новых биологических свойств стволовых инициирующих раковых клеток асцитных опухолей, является актуальной задачей, а нахождение адекватных методов терапии позволит сделать скачок в лечении злокачественных асцитных раков.
Ниже приводятся экспериментальные доказательства обнаружения возможности полного вылечивания от асцитной формы рака на модели асцитной формы рака мышей Кребс-2.
Используемые методики
Экспериментальные животные
В экспериментах использовались мыши линии CBA/Lac и С57В1, которые разводились в условиях вивария при Институте цитологии и генетики СО РАН. Животные содержались в клетках, по 5-10 особей в каждой, и имели свободный доступ к воде и пище.
Опухолевая модель
В экспериментах использовали мышиную опухолевую модель Кребс-2. Для получения асцитной формы опухоли клетки перевивали мышам внутрибрюшинно (в/б) по 2 млн клеток в 200 мкл физиологического раствора. Для формирования солидных опухолей Кребс-2 клетки перевивали внутримышечно в заднюю правую лапу в необходимом количестве в 100 мкл среды RPMI-1640 или PBS. В ходе экспериментов, как только опухоли начинали пальпироваться (примерно через 5-7 дней после прививки в контроле), каждые 1-2 дня проводили измерение их объема с помощью штангенциркуля. Объем опухоли рассчитывали, используя стандартную формулу: длина × высота × ширина.
Введение препаратов циклофосфана и (экзогенной) ДНК
Цитостатик ЦФ вводили мышам внутрибрюшинно в дозе 100-200 мг/кг массы тела в зависимости от эксперимента. Препараты фрагментированной ДНК (ДНК человека и ДНК спермы лосося) и кросс-линкированной ДНК, обработанной нитроген-мустардом, вводили внутрибрюшинно в дозе 0,5-1 мг на инъекцию ежечасно или каждые 2 часа (суммарно по 6 мг ДНК на мышь). Временные интервалы введения препаратов либо описаны непосредственно в тексте, либо изображены схематически на соответствующих фигурах.
Получение препарата ДНК человека и лосося
Геномную ДНК человека выделяли безфенольным методом из плацентарного материала и гидролизовали ультразвуком до фрагментов размером 200-6000 п.о. в соответствии с регламентом производства фармакопейного препарата «Панаген» (ЛСР №004429/08 от 09.06.2008). Препарат охарактеризован и не содержит стероидных гормонов, РНК, имеет отрицательные результаты ПЦР анализов на присутствие ДНК вируса гепатита В, РНК вируса гепатита С, ДНК ВИЧ, РНК ВИЧ.
Препарат ДНК спермы лосося получали аналогичным образом из молок лосося.
Подготовка препарата ДНК, кросс-линкированной нитроген мустардом.
Способ получения кросс-линкированной ДНК приведен в работе [19].
Определение количества CD34+ клеток в асцитной (форме) опухоли Кребс-2 при помощи проточной цитометрии и микроскопического анализа.
Клетки асцита Кребс-2 отбирали у животных после соответствующих обработок, промывали PBS и осаждали при 4°C, 400 g в течение 5 мин. После осаждения центрифугированием клетки ресуспендировали в PBS с 0,1% NaN3, 1% FBS (Fetal Bovine Serum) и подсчитывали в камере Горяева. К 1 млн клеток добавляли 4 мкг антител (FITC Rat anti-Mouse CD34, BD Pharmingen) и, соответственно, 4 мкг изотип-контроля (FITC Rat IgG2a, к Isotype Control, BD Pharmingen) и инкубировали в течение 40 мин при 4°C в 200 мкл среды. Процент клеток CD34+ определяли либо при помощи проточного цитофлуориметра BD FACSAria относительно результатов изотип-контроля в каждом образце, либо обработанные указанным выше способом клетки асцита Кребс-2 промывали PBS и наносили цитоспином на предметное стекло (1000 об/мин в течение 1 мин). Затем на полученный препарат наносили ~10 мкл Antifade DABCO, накрывали покровным стеклом и анализировали при помощи флуоресцентного микроскопа Axioskop 2 Plus (Zeiss) с использованием программы AxioVision.
Мечение ДНК флюорохромом TAMRA
Метод мечения ДНК флуорохромом TAMRA в реакции ПЦР подробно описан в статье [18].
Анализ перевивочного потенциала клеток асцита Кребс-2, обработанных in vivo.
Мыши с развитым асцитом Кребс-2 (4-7 суток после прививки) получали внутрибрюшинные инъекции цитостатика ЦФ (100-200 мг/кг) и препаратов ДНК (суммарно по 6 мг по схемам, приведенным в каждом конкретном эксперименте). В определенный интервал времени после проведенных обработок у животных забирали асцит, клетки осаждали при 400 g в течение 5 мин (4°C), ресуспендировали, подсчитывали в камере Горяева и перевивали интактным животным в мышцы задней правой лапы в 100 мкл среды RPMI-1640 или PBS. Количество перевиваемых клеток в экспериментах варьировалось. Животным контрольных групп перевивали аналогичное количество клеток асцита Кребс-2, не подвергнутого обработкам.
Анализ перевивочного потенциала клеток асцита Кребс-2, обработанных in vivo ЦФ и ex vivo препаратами ДНК.
Отличие настоящего подхода от предыдущего заключается в том, что экспериментальным животным единовременно прививали клетки асцита Кребс-2 в количестве, соответствующем количеству клеток, содержащихся в 4-суточном асците, развившемся в мыши после прививки 2 млн клеток (~200 млн клеток).
Мышь с развившейся асцитной опухолью получала внутрибрюшинную инъекцию ЦФ в дозе 100 мг/кг. Через 18 часов у нее отбирали асцит, клетки осаждали при 400 g в течение 5 мин, ресуспендировали и подсчитывали в камере Горяева. Далее клетки смешивали со смесью препаратов кросс-линкированной и нативной ДНК лосося в соотношении 3/5 (ssDNAmix) из расчета 0,5 мг/мышь и прививали по 200 млн клеток экспериментальным животным, получившим также предварительную инъекцию ЦФ (100 мг/кг) за 18 часов до прививки асцита. После этого мыши получили инъекции аналогичной дозы смеси препаратов ДНК еще 11 раз (режим 18-30).
Анализ доставки TAMRA-меченой ДНК в клетки асцита Кребс-2.
Клетки асцита Кребс-2 отбирали у мыши и осаждали центрифугированием в течение 5 мин, 400 g при 4°C и промывали средой RPMI-1640 один раз. Затем клетки подсчитывали в камере Горяева. 1 млн клеток инкубировали в 200 мкл этой же среды с 10 или 1000 нг TAMRA-меченой ДНК в течение часа при комнатной температуре. Затем клетки осаждали центрифугированием, промывали небольшим объемом среды и осадок ресуспендировали в конечном объеме среды. Далее количество клеток, захвативших TAMRA-меченую ДНК, анализировали при помощи проточного цитофлуориметра BD FACSAria (Becton Dickinson, США). При этом процент TAMRA+ клеток оценивали относительно контроля, т.е. клеток, инкубировавшихся в среде без добавления TAMRA-меченой ДНК.
Введение препаратов циклофосфана, экзогенной ДНК и антибиотика гентамицина.
Цитостатик ЦФ вводили мышам внутрибрюшинно в дозе 50-100 мг/кг массы тела одно-, дву-, трех- или четырехкратно в зависимости от эксперимента. Препараты фрагментированной ДНК (ДНК человека и ДНК спермы лосося) и кросс-линкированной ДНК, обработанной нитроген-мустардом, или их смесь (в соотношении кросс-линкированная/нативная 1/3 или 3/5) вводили внутрибрюшинно в дозе 0,5-1 мг на инъекцию каждые 1, 2 или 3 часа (суммарно по 6 мг ДНК на мышь за 12 часов). Временные интервалы введения препаратов либо описаны непосредственно в тексте, либо изображены схематически на соответствующих фигурах. Антибиотик гентамицин вводили животным внутрибрюшинно по 0,2 мг/мышь каждые 1-2 суток в течение месяца относительно начала эксперимента.
Активация адаптивного иммунитета
Для активации у экспериментальных животных адаптивного иммунитета вводили препарат нативной ДНК человека через 1, 2 и 3 суток после последней инъекции ЦФ по 500 мкг/мышь.
Пересадка клеток костного мозга
Для получения клеток костного мозга использовали здоровых мышей-доноров той же линии. Клетки костного мозга вымывали PBS из больших берцовых костей, промывали средой RPMI-1640, подсчитывали в камере Горяева и перевивали в хвостовую вену экспериментальным животным в количестве 200 тыс клеток на мышь.
Гистологоанатомический анализ тканей и органов мышей
Кусочки органов фиксировали в 4%-ном