Новые синтетические пептиды и их применение
Иллюстрации
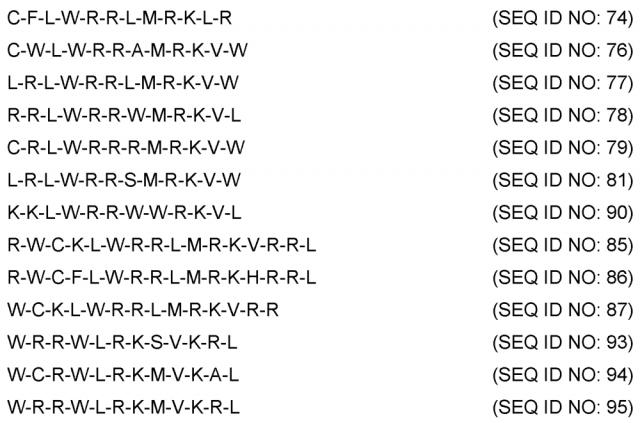
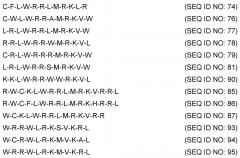
Показать всеИзобретение относится к области биотехнологии, конкретно к новым пептидам на основе лактоферрина человека, и может быть использовано в медицине. Синтезируют пептиды, характеризующиеся последовательностью CFLWRRLMRKLR (SEQ ID NO: 74);CWLWRRAMRKVW (SEQ ID NO: 76); LRLWRRLMRKVW (SEQ ID NO: 77);RRLWRRWMRKVL (SEQ ID NO: 78); CRLWRRRMRKVW (SEQ ID NO: 79); LRLWRRSMRKVW (SEQ ID NO: 81); KKLWRRWWRKVL (SEQ ID NO: 90); RWCKLWRRLMRKVRRL (SEQ ID NO: 85);RWCFLWRRLMRKHRRL(SEQ ID NO: 86); WCKLWRRLMRKVRR(SEQ ID NO: 87); WRRWLRKSVKRL(SEQ ID NO: 93); WCRWLRKMVKAL(SEQ ID NO: 94) или WRRWLRKMVKRL(SEQ ID NO: 95). Пептиды по изобретению способны эффективно ингибировать синтез TNF-α в стимулированных LPS моноцитах человека, что позволяет их использовать в терапии инфекций или воспалений кожи и кожных структур. 2 н. и 5 з.п. ф-лы, 5 ил., 9 табл., 5 пр.
Реферат
Область изобретения
Настоящее изобретение относится к новым пептидам и их применению, в частности, для лечения и/или предотвращения инфекций, воспалений, боли, ран, шрамов и/или опухолей.
Предшествующий уровень техники
Лактоферрин представляет собой одноцепочечный связывающий металл гликопротеин с молекулярной массой 77 кДа. Выявлено, что структурный домен лактоферрина, отвечающий за бактерицидные свойства, представляет собой расщепляемый пепсином фрагмент, который называют лактоферрицин (см. например, Bellamy W., et al., Identification of the bactericidal domain of lactoferrin, Biochim. Biophys. Acta 1121: 130-136, 1992, и Bellamy W., et al., Antibacterial spectrum of lactoferricin B, a potent bactericidal peptide derived from N-terminal region of bovine lactoferrin, J. Appl. Bact. 73: 472-479, 1992).
Лактоферриновые рецепторы присутствуют во многих типах клеток, включая моноциты и макрофаги, стимулирующиеся лектином лимфоциты периферической крови человека, клетки щеточной каемки и клетки опухолевых линий.
Несколько патентных публикаций описывают возможное применением лактоферрина для лечения инфекций или воспалений. Например, в WO 98/06425 описано, что лактоферрин и лактоферрицин можно использовать для лечения и предотвращения инфекций, воспалений и опухолей.
EP 629347 описывает противомикробное средство, содержащее (A) гидролизат лактоферрина и/или один или несколько противомикробных пептидов, полученных из лактоферринов, и (B) одно или несколько соединений, выбранных из группы, состоящей из металл-хелатирующих белков, токоферола, циклодекстрина, сложных эфиров глицерина и жирной кислоты, спирта, ЭДТА или их солей, аскорбиновой кислоты или ее соли, лимонной кислоты или ее соли, полифосфорной кислоты или ее соли, хитозана, цистеина и холевой кислоты в качестве эффективных компонентов. Данное противомикробное средство предназначено обработки продуктов, и особенно для безопасной обработки, например, пищевых продуктов или лекарственных средств. Таким образом, средство по данной публикации представляет собой новый консервант. В публикации приведены несколько пептидных последовательностей, и некоторые из них сходны с пептидами по изобретению, хотя между ними существуют несколько важных различий, описанных ниже.
US 5304633 описывает противомикробные пептиды, изолированные из гидролизатов лактоферрина человека и быка. Изоляция пептидов, соответствующих аминокислотам от 12 до 47 и от 17 до 41 лактоферрина человека, описана отдельно.
JP 7145196 описывает получение антибактериальных пептидов посредством гидролиза лактоферрина. Получение пептида, соответствующего аминокислотам от 17 до 41 лактоферрина человека, описано отдельно.
JP 8040925 описывает фармацевтические композиции, содержащие полученные из лактоферрина пептиды, и их применение для лечения повреждений роговицы, особенно кератита. Пептиды, соответствующие аминокислотам от 17 до 41, от 12 до 58 и от 19 до 38 лактоферрина человека описаны отдельно.
JP 7274970 описывает рекомбинантное получение антибактериальных пептидов, полученных из лактоферрицина, отдельно описано получение пептидов, соответствующих аминокислотам от 18 до 42 лактоферрина человека.
JP 8143468 описывает полученные из лактоферрина пептиды и их применение в качестве противоязвенных лекарственных средств, пептид, соответствующий аминокислотам от 19 до 33 лактоферрина человека, описаны отдельно.
WO 00/01730 описывает пептиды, полученные из лактоферрина человека, и их применение для лечения инфекций и воспалений.
EP 1228097 описывает пептиды, полученные непосредственно из N-конца лактоферрина человека, и их применение в качестве противомикробных средств.
EP 1151009 описывает пептиды, содержащие последовательность, соответствующую аминокислотам от 35 до 50 лактоферрина человека и обладающие противомикробной и/или эндотоксин-нейтрализующей активностью.
WO 2006/047744 описывает иммуномодуляторные пептиды, полученные из N-концевой части лактоферрина человека, содержащие, по меньшей мере, 33 аминокислоты и несущие на N-конце и C-конце четыре замены на положительно заряженные аминокислоты.
WO 2009/050279 описывает мутированные лактоферриновые пептиды и их противомикробную активность.
WO 2009/062898 описывает лактоферриновые пептиды, несущие замену на аргинин, и их противомикробную и противовоспалительную активность.
Сущность изобретения
Настоящее изобретение относится к новым пептидам с улучшенной противомикробной и/или противовоспалительной активностью. Пептиды по настоящему изобретению конструируют на основе аминокислотной последовательности SEQ ID NO: 1, соответствующей аминокислотам от 13 до 30 зрелого лактоферрина человека.
Q-P-E-A-T-K-C-F-Q-W-Q-R-N-M-R-K-V-R (SEQ ID NO: 1)
Первый вариант осуществления изобретения относится к пептидам, содержащим, по меньшей мере, аминокислотную последовательность
X1-X2-X3-W-X5-R-X7-X8-X9-K-X11-X12 (SEQ ID NO: 2)
где
X1 представляет собой C, L, W, K или R
X2 представляет собой C, F, K, W или R
X3 представляет собой L или R
X5 представляет собой L, K или R
X7 представляет собой N, S, A, L, W, K или R
X8 представляет собой M, W или S
X9 представляет собой R или V
X11 представляет собой V, A, H, L или R, и
X12 представляет собой R, L или W
и функциональным эквивалентам этих пептидов.
Пептиды могут предпочтительно дополнительно содержать аминокислоты W или R-W на N-конце.
Пептиды могут предпочтительно дополнительно содержать аминокислоты R или R-L на C-конце.
Предпочтительно пептиды согласно первому варианту осуществления изобретения содержат, по меньшей мере, аминокислотную последовательность
X1-X2-X3-W-X5-R-X7-X8-X9-K-X11-X12 (SEQ ID NO: 3)
где
X1 представляет собой W, K или R
X2 представляет собой C, K или R
X3 представляет собой L или R
X5 представляет собой L или R
X7 представляет собой W или K
X8 представляет собой M или W
X9 представляет собой R или V
X11 представляет собой V, A или R, и
X12 представляет собой R или L
и функциональные эквиваленты этих пептидов.
Пептиды могут предпочтительно дополнительно содержать аминокислоты W или R-W на N-конце.
Пептиды могут предпочтительно дополнительно содержать аминокислоты R или R-L на C-конце.
Более предпочтительно пептиды согласно первому варианту осуществления изобретения выбраны из пептидов, содержащих аминокислотную последовательность, выбранную из аминокислотных последовательностей
и функциональных эквивалентов этих пептидов.
Наиболее предпочтительно пептиды согласно первому варианту осуществления изобретения выбраны из пептидов;
и функциональных эквивалентов этих пептидов.
Второй вариант осуществления изобретения относится к пептидам, содержащим, по меньшей мере, аминокислотную последовательность
X1-X2-X3-X4-X5-X6-X7-X8-Q-W-X11-R-X13-L-R-K-V-X18 (SEQ ID NO: 4)
где
X1 представляет собой Q, R или N
X2 представляет собой S, R или K
X3 представляет собой E, R или L
X4 представляет собой A, R или F
X5 представляет собой T, K, R, H, Q или E
X6 представляет собой K, T или S
X7 представляет собой R, F или L
X8 представляет собой F, K или A
X11 представляет собой L, R или A
X13 представляет собой N или Q и
X18 представляет собой L, R или A
и функциональным эквивалентам этих пептидов.
Пептиды могут предпочтительно дополнительно содержать аминокислотную последовательность K-R на N-конце.
Пептиды могут предпочтительно дополнительно содержать аминокислотную последовательность K-R, W-W или G-P на C-конце.
Предпочтительно пептиды согласно второму варианту осуществления изобретения содержат, по меньшей мере, аминокислотную последовательность
X1-S-X3-X4-X5-X6-X7-X8-Q-W-X11-R-N-L-R-K-V-X18 (SEQ ID NO: 5)
где
X1 представляет собой Q, R или N
X3 представляет собой E, R или L
X4 представляет собой A, R или F
X5 представляет собой T, K, R, Q или E
X6 представляет собой K, T или S
X7 представляет собой R, F или L
X8 представляет собой F, K или A
X11 представляет собой L, R или A, и
X18 представляет собой L, R или A
и функциональные эквиваленты этих пептидов.
Пептиды могут предпочтительно дополнительно содержать аминокислотную последовательность K-R на N-конце.
Пептиды могут предпочтительно дополнительно содержать аминокислотную последовательность K-R, W-W или G-P на C-конце.
Более предпочтительно пептиды согласно второму варианту осуществления изобретения выбраны из пептидов, содержащих аминокислотную последовательность, выбранную из аминокислотных последовательностей
и функциональных эквивалентов этих пептидов.
Наиболее предпочтительно пептиды согласно второму варианту осуществления изобретения выбраны из пептидов
и функциональных эквивалентов этих пептидов.
Дополнительные предпочтительные пептиды по изобретению представляют собой
и функциональные эквиваленты этих пептидов.
Длина пептидов по изобретению предпочтительно составляет от 12 до 100 аминокислотных остатков, например, предпочтительно от 12 до 50 аминокислотных остатков или от 12 до 30 аминокислотных остатков, более предпочтительно от 12 до приблизительно 25 аминокислотных остатков, наиболее предпочтительно от 12 до 20 аминокислотных остатков, например, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных остатков.
Пептиды по изобретению содержат стандартные двадцать генетически закодированных аминокислот. Они могут также содержать одну или несколько аминокислот в соответствующей стереоизомерной D-форме, по сравнению с природной V-формой.
В заявке для обозначения аминокислот используют однобуквенные или трехбуквенные символы. Эти символы, хорошо известные специалистам в данной области, означают следующее: A = Ala = аланин, C = Cys = цистеин, D = Asp = аспарагиновая кислота, E = Glu = глутаминовая кислота, F = Phe = фенилаланин, G= Gly = глицин, I- Ile = изолейцин, K = Lys = лизин, M= Met = метионин, N = Asn = аспарагин, P = Pro = пролин, Q = Gln = глутамин, R = Arg = аргинин, S = Ser = серин, T = Thr = треонин, V = Val = валин, W = Trp = триптофан.
Строчные буквы используют для обозначения соответствующих D-аминокислот.
Функциональные эквиваленты пептидов по изобретению могут содержать вставки или делеции одной или нескольких аминокислот, таких как вставки или делеции 1-5, вставки или делеции 1, 2, 3, 4 или 5.
Функциональные эквиваленты пептидов по изобретению могут также содержать замены. Замены могут быть как консервативными, так и неконсервативными. Консервативные замены представляют собой замену аминокислоты конкретного общего класса (например, кислая аминокислота, основная аминокислота и т.д.) на другую аминокислоту того же общего класса. Например, гидрофобную аминокислоту можно заменять на другую гидрофобную аминокислоту, например, Trp можно заменять на Leu. Положительно заряженную аминокислоту можно заменять на другую положительно заряженную аминокислоту, например, Arg можно заменять на Lys, в таких заменах как 1-5, 1, 2, 3, 4 или 5.
На фиг. 1 представлены различные классы аминокислот.
Функциональные эквиваленты пептидов по изобретению могут также содержать другие не встречающиеся в природе аминокислоты, при условии, что полипептид сохраняет желаемое функциональное свойство. Такие не встречающиеся в природе аминокислоты могут включать α,α-дизамещенные аминокислоты, N-алкил-аминокислоты или другие варианты, имитирующие конкретную природную аминокислоту.
Например, в функциональных эквивалентах пептидов по изобретению лизин (K/Lys) можно предпочтительно заменять на Dap (диаминопропионовая кислота), Dab (2,4-диаминобутановая кислота), Orn (орнитин) или Hyl (5-гидроксилизин), аргинин (R/Arg) можно предпочтительно заменять на Har (гомоаргинин), аланин (A/Ala) можно предпочтительно заменять на Aib (α-аминоизомасляная кислота) или Abu (2-аминобутановая кислота), валин (V/Val) можно предпочтительно заменять на Nva (норвалин) или Iva (изовалин), лейцин (L/Leu) можно предпочтительно заменять на Nle (норлейцин) или Cha (3-циклогексилаланин), серин (S/Ser) можно предпочтительно заменять на Hse (гомосерин), цистеин (C/Cys) можно предпочтительно заменять на Hcy (гомоцистеин), гистидин (H/His) можно предпочтительно заменять на Hhs (гомогистидин) или 3-MH (3-метилгистидин), фенилаланин (F/Phe) можно предпочтительно заменять на Phg (2-фенилглицин), пролин (P/Pro) можно предпочтительно заменять на Hyp (4-гидроксипролин).
Таким образом, функциональные эквиваленты пептидов представляют собой пептиды, последовательность которых идентична более чем на 70%, например, более чем на 75%, предпочтительно более чем на 80%, например, более чем на 85%, наиболее предпочтительно более чем на 90%, например, более чем на 93, 94, 95, 96, 97, 98 или 99%, пептиду, выбранному из пептидов
Процент идентичности двух аминокислотных последовательностей определяют следующим способом. Сначала сравнивают аминокислотную последовательность с, например, SEQ ID NO: 1 с применением программы BLAST 2 Sequences (BI2seq) из специальной версии BLASTZ, содержащей BLASTN версии 2.0.14 и BLASTP версии 2.0.14. Эта специальная версия BLASTZ доступна на веб-сайте правительственного национального центра биотехнологической информации США с адресом ncbi.nlm.nih.gov. Инструкции, объясняющие, как использовать программу BI2seq, можно найти в файле readme, который прилагается к BLASTZ. BI2seq проводит сравнение двух аминокислотных последовательностей с применением алгоритма BLASTP. Для сравнения двух аминокислотных последовательностей выбирают следующие опции BI2seq: -i соответствует файлу, содержащему первую аминокислотную последовательность, подлежащую сравнению (например, C:\seq1.txt); -j соответствует файлу, содержащему вторую аминокислотную последовательность, подлежащую сравнению (например, C:\seq2.txt); -p соответствует blastp; -o соответствует желаемому имени файла (например, C:\output.txt); все остальные опции соответствуют значениям по умолчанию. Например, для получения выходного файла, содержащего сравнение двух аминокислотных последовательностей, можно использовать следующую команду: C:\BI2seq -i c:\seq1.txt -j c:\seq2.txt -p blastp -o c:\output.txt. Если две сравниваемые последовательности имеют гомологичные участки, то указанный выходной файл будет представлять эти гомологичные участки в виде выровненных последовательностей. Если две сравниваемые последовательности не имеют гомологичных участков, то указанный выходной файл не будет содержать выровненных последовательностей. После выравнивания число совпадений определяют посредством подсчета числа позиций, в которых идентичный нуклеотид или аминокислотный остаток представлен в обеих последовательностей.
Процент идентичности определяют посредством деления числа совпадений на длину последовательности, представленной в идентифицированной последовательности, с последующим умножением полученного значения на 100. Например, если последовательность сравнивают с последовательность, представленной в SEQ ID NO: 1 (длина последовательности, представленной в SEQ ID NO: 1, составляет 18), а число совпадений составляет 16, то последовательность имеет процент идентичности 89% (т.е. 16÷18*100=89) с последовательностью, представленной в SEQ ID NO: 1.
Кроме того, слияние пептидов по изобретению с другими полипептидами, например, глутатион-S-трансферазой, белком A, олиго -гистидиновой меткой для упрощения этапа очистки, или с эпитопом, распознаваемым антителом, таким как эпитоп Myc-метка, также включены в настоящее изобретение.
Слияния, которые включают другие желаемые признаки, которые являются полезными, например, для детектирования или изоляции пептида или усиления клеточного захвата пептида, также включены в изобретение. Примеры таких компонентов слияния представляют собой молекулу биотина, молекулу стрептавидина, радиоактивную молекулу, флуоресцентную молекулу, такую как маленький флуорофор или флуорофор с зеленым флуоресцентным белком GFP, иммуногенную метку, липофильную молекулу или полипептидный домен, которые способны усилить клеточный захват пептида.
Функциональные эквиваленты пептидов по изобретению могут также содержать химически модифицированные или производные аминокислоты, например, полученные посредством модификации полиэтиленгликолем, амидирования, этерификации, ацилирования, ацетилирования и/или алкилирования.
Существуют и могут применяться различные способы прикрепления PEG. Например, полиэтиленгликоль (PEG) можно прикреплять к N-концевой аминогруппе или к аминокислотным остаткам с помощью реактивных амино- или гидроксильных групп (Lys, His, Ser, Thr и Tyr) непосредственно или с применением γ-аминомасляной кислоты в качестве линкера. PEG также можно соединять с карбоксильной (Asp, Glu, C-конец) или сульфгидрильной (Cys) группами.
Функциональные эквиваленты пептидов по изобретению могут также содержать химические производные аминокислот, полученных посредством реакции с функциональным участком. Такие производные молекулы включают молекулы, в которых свободные аминогруппы изменены таким образом, чтобы формировать амин-гидрохлориды, p-толуол-сульфонильные группы, карбоксибензоксильные группы, т-бутил-оксикарбонильные группы, хлорацетильные группы или формильные группы. Свободные карбоксильные группы можно изменять с получением солей, метиловых и этиловых сложных эфиров или других типов сложных эфиров и гидразидов. Свободные гидроксильные группы можно изменять с получением O-ацильных или O-алкильных производных.
Функциональные эквиваленты пептидов по изобретению могут также содержать пептидомиметические варианты пептидов. Пептидомиметик представляет собой соединение, которые имитирует конформацию и определенные характеристики пептида. Например, пептидомиметики включают пептиды с обратными связями (-CO-NH-). Кроме того, пептидомиметики включают варианты, в которых аминокислотные остатки связаны посредством связи γ(CH2NH), которая замещает общепринятую амидную связь. Кроме того, пептидомиметики также включают омега-аминокислоты, в которых амино- и карбоксильные группы разделены полиметиленовыми структурными единицами различной длины.
Пептиды по изобретению могут включать модификации, такие как амидирование, амино-терминальное ацилирование (например, ацетилирование или амидирование тиогликолевой кислотой), терминальное карбоксиламидирование (например, аммиаком или метиламином) и другие терминальные модификации, где N-или C-концевые области пептида блокированы с целью уменьшения чувствительности к экзопротеолитическому расщеплению. Затем посредством ацетилирования N-конца и амидирования C-конца пептиды лишают зарядов на концах. При условии, что рецепторы связывают соответствующие последовательности LF (где отсутствуют заряды на N-конце и C-конце), кэпированные пептиды лучше связываются, поскольку они в этом отношении более сходны с нативным белком, чем некэпированные пептиды.
Пептиды по изобретению могут быть помечены на C-конце триптофаном для повышения активности, как описано в Pasupuleti et al. Biochim Biophys 2009 Acta 1790:800-8.
Кроме того, при его наличии, остаток цистеина в пептидах можно замещать ацетамидометил-цистеином. Кроме того, пептиды по изобретению могут быть представлены в циклической форме, полученной посредством образования дисульфидного мостика между двумя цистеинам в последовательности. Кроме того, пептиды по изобретению могут включать лактамы.
Пептиды по изобретению являются подходящими для лечения и/или предотвращения инфекций, воспалений, опухолей, боли, ран и/или шрамов. Термин "лечение", применяемый в настоящем документе, относится к восстановлению, реверсии, ослаблению, смягчению, минимизации, подавлению или прекращению вредного воздействия состояния болезни, прогресса заболевания или другого аномального состояния, а термин "предотвращение", применяемый в настоящем документе, относится к минимизации, сокращению или подавлению риска развития или прогресса состояния болезни или других аномальных или пагубных состояний.
Инфекции, подлежащие лечению пептидами или медицинскими продуктами или медицинскими устройствами по изобретению, включают инфекции, которые вызывают все типы патогенов, такие как бактерии, вирусы, грибы и т.д. Пептиды по изобретению можно использовать для нанесения на/обработки различных медицинских устройств для сокращения/предотвращения связанных с медицинскими устройствами инфекций.
Также возможно лечить различные типы воспаления. Воспаление представляет собой комплексный феномен, который характеризуется, например, аномальным "покраснением" и опухолью тканей и органов, болью и жаром в поврежденных участках, расширением капилляров, проникновением лейкоцитов и т.д. Воспаление преимущественно вызывается воздействием бактериальных и других токсичных агентов и физическими повреждениями. Аллергическое воспаление представляет собой важный патофизиологический признак нескольких нарушений или медицинских состояний, включая аллергическую астму, атопический дерматит, аллергический ринит и несколько глазных аллергических заболеваний.
Таким образом, один из аспектов настоящего изобретения предоставляет способы лечения и/или предотвращения инфекций, воспалений, опухолей, боли, ран и шрамов, где эффективное количество пептида по изобретению, и его функциональные варианты, вводят пациенту. Указанный пептид можно формулировать для пероральной, системной, парентеральной, местной или локальной доставки. Кроме того, указанный пептид можно включать в пищевые продукты или включать в детские питательные смеси.
Кроме того, другой аспект настоящего изобретения предоставляет пептиды по изобретению для применения в лечении и/или предотвращении инфекций, воспалений, опухолей, боли, ран и шрамов. Указанный пептид можно формулировать для перорального введения, системного введения, парентерального введения, местного введения или локального введения. Кроме того, указанный пептид можно включать в пищевые продукты или включать в детские питательные смеси.
Кроме того, другой аспект настоящего изобретения предоставляет пептиды по изобретению для получения медицинского продукта или медицинского устройства для лечения и/или предотвращения инфекций, воспалений, опухолей, боли, ран и шрамов. Указанный медицинский продукт можно формулировать для перорального введения, системного введения, парентерального введения, местного введения или локального введения. Кроме того, медицинский продукт/медицинское устройство можно включать в пищевые продукты или включать в детские питательные смеси.
Воспаление проявляется во множестве форм и опосредовано рядом различных цитокинов и других химических сигналов. Эти медиаторы воспаления включают фактор некроза опухоли-α (TNF-α), интерлейкин-1 (IL-1), интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), интерферон-гамма (IFN-γ) и различные колониестимулирующие факторы (CSFs).
Посредством ингибирования инфекций и модулирования воспалительного ответа пептиды можно использовать для лечения и/или предотвращения образования ран и/или шрамов. Как указано выше, пептиды по изобретению также являются подходящими для лечения опухолей.
Пептиды по изобретению можно также использовать в чистом виде или включать в состав медицинского устройства, медицинского продукта или фармацевтической композиции. Медицинский продукт или медицинское устройство или фармацевтическая композиция по изобретению могут также содержать вещества, применяемые для облегчения получения фармацевтического препарата или введения препаратов. Такие вещества хорошо известны специалистам в данной области и могут, например, представлять собой фармацевтически приемлемые адъюванты, носители и консерванты.
Таким образом, один из аспектов настоящего изобретения предоставляет фармацевтические композиции, содержащие пептид по изобретению.
Другой аспект изобретения предоставляет фармацевтические композиции, содержащие пептид по изобретению для применения в лечении и/или предотвращении инфекций, воспалений, опухолей, боли, ран и шрамов.
Пептиды по изобретению можно применять для перорального введения, системного введения, парентерального введения, местного введения или локального введения.
Пептиды, медицинские продукты, медицинское устройство и фармацевтическую композицию по изобретению можно вводить пациенту перорально, системно, парентерально, местно или локально.
Термин "пациент", применяемый в настоящем документе, относится к любому индивидууму с риском развития или страдающим от состояния болезни, прогресса заболевания или другого аномального или пагубного состояния.
Системное введение является подходящим, например, для лечения инфекций мочевыводящих путей, колита и опухолей. Системное введение можно проводить посредством перорального, назального, легочного, ротоглоточного, внутривенного, внутриартериального, внутриполостного, внутримышечного, подкожного, трансдермального, суппозиторного (включая ректальный) или других способов введения, известных специалистам в данной области.
Местное введение является подходящим, например, для лечения инфекций и воспалений кожи или кожных структур, респираторных инфекций, любых инфекций и воспалений слизистых оболочек и т.д. Местное введение можно проводить посредством локального, чрескожного, перорального, назального, вагинального, глазного, ушного, легочного или ротоглоточного способа введения. Для лечения местных инфекций или воспалений пептиды или медицинские продукты по изобретению можно, например, включать в состав геля, крема, мази, раствора или пасты, порошка/раствора для ингаляции, ушного или глазного раствора/суспензии/мази.
В способе по изобретению пациенту вводят эффективное количество пептида по изобретению. Термин "эффективное количество", применяемый в настоящем документе, относится к количеству, достаточному для лечения или предотвращения состояния болезни, прогресса заболевания или других аномальных или пагубных состояний.
Пептиды или медицинские продукты или медицинское устройство и способы по изобретению особенно хорошо подходят для лечения и/или предотвращения инфекций мочевыводящих путей и колитов, инфекций и воспалений кожи и кожных структур, инфекций и воспалений наружного уха, ушного канала, внутреннего уха и глаза и дыхательной системы, хронических и острых ран, но несколько других воспалительных и инфекционных заболеваний также поддаются лечению по настоящему изобретению, такие как воспалительные заболевания кишечника, ревматоидный артрит, артроз, состояния, вызванные вирусом ВИЧ-1, состояния, вызванные вирусом CMV, и состояния, вызванные грибами, например, видами Candida, такими как Candida albicans и Candida krusei, Aspergillus и Cryptococcus neoformans. Этот список не предназначен для ограничения объема изобретения.
Пептиды, медицинские продукты, медицинское устройство и способы по изобретению также хорошо подходят для профилактического применения, сокращая риск развития воспалительных или инфекционных заболеваний у пациентов с повышенным риском приобретения таких осложнений.
Пептиды по настоящему изобретению подходят для противовоспалительных и иммуномодуляторных терапий, которые в качестве неограничивающих примеров включают:
1) В широком смысле лечение воспаления и/или медицинского состояния, обусловленного воспалением, и в частности,
2a) Кишечник; болезнь Крона, колит, язвенный колит,
2b) Суставы; ревматоидный артрит, артрит, артроз, локальные нарушения мышц, включая мышечные спазмы, разрывы мышц, повреждения мышц, напряжение мышц, растяжение мышц,
2c) Дерматология; псориаз, экзема, дерматит, акне,
2d) Сердце; перикардит, эндокардит,
2e) Боли; (более подробно описано ниже в пункте 2f),
2f) Нервная система; болезнь Альцгеймера, рассеянный склероз, синдром запястного канала, дисковая грыжа, цервикальная ризопатия, паралич Белла, острое повреждение спинного мозга, компрессия спинного мозга, спинальный стеноз, постгерпетическая невралгия, вирусный энцефалит, вирусный менингит, болезнь Меньера, полиомиелит и осложнения полиомиелита, хроническая воспалительная демиелинизирующая полинейропатия, полинейропатия, невралгия тройничного нерва, хронические эпилептические нарушения,
2g) Сенсорные органы; глаукома,
2h) Слизистые оболочки (воспаление, обусловленное химиотерапией/лучевой терапией),
2i) Аллергия,
2j) Аутоиммунные заболевания.
Пептиды по изобретению также подходят для предотвращения и лечения боли и шрамов, обусловленных состояниями и процедурами, которые в качестве неограничивающих примеров включают:
3a) хирургические процедуры на различных тканях, таких как кожа, мышцы, сухожилия, нервная ткань, кровеносные сосуды, и в различных органах организма, таких как глаза, уши, голосовые связки, кисти рук, спинной мозг, брюшная полость, полость грудной клетки, внутричерепная полость, ротовая полость, гинекологические процедуры, эндометриоз, фимоз,
3b) акне,
3c) гипертрофические шрамы & келоидные рубцы,
3d) плеврит,
3e) перитонеальный диализ,
3f) острые и хронические рана.
Пептиды по изобретению также как полагают, обладают антиангиогенным эффектом и, таким образом, подходят для лечения:
4a) злокачественной опухоли,
4b) ревматоидного артрита.
Пептиды по изобретению обладают противоинфекционным эффектом и подходят для предотвращения и лечения:
5a) Антибактериальные эффекты:
Инфекции верхних и нижних дыхательных путей (тонзиллит, синусит, пневмония, хроническое обструктивное заболевание легких, кистозный фиброз и т.д.)
Глазные инфекции (например, конъюнктивит)
Инфекции мочевыводящих путей
Заболевания, передающиеся половым путем (включая противомикробное покрытие презервативов)
Инфекции половых путей (включая вагиноз, вагинит, цервицит, эндометрит, инфекционные заболевания тазовых органов)
Инфекции желудочно-кишечного тракта (системные инфекции, начинающиеся в ЖКТ)
Инфекции центральной нервной системы
Инфекции кожи и кожных структур, такие как вторично инфицированные травматические повреждения, включая инфекции операционных ран, воспаление или абсцесс подкожной клетчатки, вторично инфицированный дерматоз, импетиго и карбункулы или фурункулез (включая грамположительные и грамотрицательные бактерии, стафилококки, например, MRSA, стрептококки, госпитальные инфекции, раны, ожоги), мышц, суставов (например, септический артрит), костей и гемопоэтической системы
Инфекции, связанные с ротовой полостью, глазами, внутренним и наружным ухом и ушным каналом, включая пародонтит, гингивит
5b) Противовирусные эффекты:
Верхние и нижние дыхательные пути
Заболевания, передающиеся половым путем
Инфекции желудочно-кишечного тракта (системные инфекции, начинающиеся в ЖКТ)
Инфекции центральной нервной системы
5c) Противогрибковые эффекты:
Верхние и нижние дыхательные пути (такие как афты, кандидоз слизистых оболочек)
Мочеполовые пути (такие как вульвовагинальный кандидоз, баланит)
Инфекции желудочно-кишечного тракта (системные инфекции, начинающиеся в ЖКТ)
Инфекции центральной нервной системы
Инфекции кожи и кожных структур (такие как кандидоз слизистых оболочек), дерматоз и экзема.
Наиболее предпочтительно пептиды по настоящему изобретению используют для лечения, профилактики и/или предотвращения импетиго, ожоговых ран, инфицированных царапин, инфицированных рваных ран, ссадин, рожи, воспаления подкожной клетчатки, абсцессов, фурункулов, карбункулов, зашитых ран, инфекций операционных ран, вторично инфицированного дерматоза: атопического дерматита, псориаза и аллергического контактного дерматита, укусов животных, вызванных катетером инфекций.
Пептиды, медицинские продукты, медицинское устройство и способы по изобретению можно применять как по отдельности, так и в комбинации друг с другом или в комбинации с общепринятой терапией.
По настоящему изобретению также можно включать пептиды в эффективном количестве в любые виды пищевых продуктов или напитков с целью уменьшения инфекций и/или воспалений у пациентов с повышенным риском развития таких состояний в результате основного заболевания, низкой массы тела при рождении или медицинских процедур. Например, можно включать пептиды в эффективном количестве в питательные детские смеси с целью ингибирования неблагоприятных эффектов бактерий, таких как потеря массы тела, вызванная воспалением в результате заражения бактериями, вирусами или грибами детей. Если пептиды по изобретению используют в пищевых продуктах, например, для питания, особенно предпочтительно использовать пептиды натурального происхождения.
Поскольку пептиды по изобретению обладают противомикробными эффектами, их также можно использовать в качестве консервантов в различных пищевых и медицинских продуктах, таких как гели, кремы, мази, пасты, растворы, эмульсии и т.д.
Изобретение далее раскрыто в следующих примерах. Эти примеры предназначены только для иллюстрации изобретения и не должны рассматриваться как ограничивающие объем изобретения.
ОПИСАНИЕ ФИГУР
Фиг. 1. Представлены различные классы аминокислот, демонстрирующие сходство в отношении гидрофобности, размера и заряда.
Фиг. 2. Вид сверху на спираль, соответствующую участку пептида SEQ ID NO: 1, а именно KCFQWQRNMRKVR
Фиг. 3. Диаграмма рассеяния, показывающая выделение кластера пептидов класса 2. Пептиды нанесены на график согласно их физико-химическим свойствам. Пептиды с TNF-ингибирующей активностью (при концентрации пептида 40 мкМ) можно найти в трех кластерах: кластеры A, B и C.
Фиг. 4. Дозозависимый эффект пептида 232 (SEQ ID NO:78) (A) и пептида 220 (SEQ ID NO:67) (B) на бактериальную колонизацию инфицированных резекционных ран у крыс. Раны, инфицированные MRSA (CCUG 41879) и обработанные соответствующим пептидом в H2O, в концентрациях 0,1, 0,5 и 2 мг/мл, демонстрировали значительное уменьшение количества бактерий в зависимости от дозы. Результаты представлены в виде относительного выживания бактерий (%) по сравнению с контрольной группой ± SEM (n=15 ран). Статистическую значимость определяли посредством t-теста Стьюдента. *=p<0,05, **=p<0,01, ***=p<0,001.
Фиг. 5. Дозозависимый эффект пептида 232 (SEQ ID NO:78) (A) и пептида 220 (SEQ ID NO:67) (B) на бактериальную колонизацию инфицированных ран в коже свиньи. Раны, инфицированные S. aureus в PBS/сыворотке (50/50) и обработанные соответствующим пептидом в H2O в концентрациях 0,1, 0,5 и 2 мг/мл, демонстрировали значительное уменьшение количества бактерий в зависимости от дозы. Результаты представлены в виде относительного выживания бактерий (%) по сравнению с контрольной группой ± SEM (n=10 ран). Статистическую значимость определяли посредством t-теста Стьюдента. *=p<0,05, **=p<0,01, ***=p<0,001.
ПРИМЕРЫ
Пример 1. Тестирование пептида 1
Получали и тестировали два класса производных от лактоферрина пептидов. Активные пептиды идентифицировали во всех классах.
Новые варианты пептидов получали на основе измеренной противовоспалительной и противомикробной активности пептидов с последовательностями, сходными с SEQ ID NO: 1. Кроме того, учитывали структурные особенности соответствующих последовательностей этих пептидов. На практике это означало поддержание и повышение спиральности пептидов. Для первого этапа тестирования получали новые варианты пептидов класса 1 посредством встраивания N-кэпов (i, i+3) и лейционвых вставок (i, i+4), которые предназначены для повышения стабильности спирали. Кроме того, амфипатические свойства спиралей модифицировали посредством встраивания полярных положительно заряженных аминокислот в определенные позиции. Новые варианты пептидов класса 2 получали посредством усиления положительно заряженных и гидрофобных участков пептидов. Таким образом, усиливали амфипатические свойства пептидов (фиг. 2). На основе этих способов приблизительно 50 пептидов заказывали в виде библиотеки PEPscreen (Sigma) и тестировали на противовоспалительную и противомикробную активность.
Противовоспали