Способ дифференциации токсигенных и атоксигенных штаммов холерных вибрионов 01 серогруппы по ингибирующей активности
Иллюстрации
Показать всеИзобретение относится к области медицинской микробиологии и касается способа дифференциации токсигенных и атоксигенных штаммов холерных вибрионов О1 серогруппы по ингибирующей активности. Способ включает стадии: а) смешивают в одной емкости объемом 100 мл стерильную водопроводную воду и клетки двух штаммов холерных вибрионов токсигенных (ctx+tcA+) и атоксигенных (ctx-tcA-) в соотношении 1:1 до конечной концентрации 104 м.к. на мл, пробу инкубируют при 25°С 24, 72 часа или более; б) вносят 0,5 мл жидкости после инкубации в микропробирки объемом 1,5 мл и выделяют ДНК; в) проводят амплификацию ДНК со специфическими праймерами к INDEL-гену cheA, имеющими следующие последовательности
,
г) проводят анализ продуктов амплификации с помощью электрофореза в 10% полиакриламидном геле; д) дифференцируют полученный результат по наличию специфических аллелей для каждого из штаммов - атоксигенных, имеющих размер 193 п.о., и токсигенных -169 п.о., наглядность присутствия которых дает возможность делать вывод о наличии ингибирующей активности или ее отсутствии у исследуемых штаммов. Изобретение позволяет быстро определять способность выживать в водных объектах штаммов холерных вибрионов и может быть использовано для мониторинга вод водоемов на наличие токсигенных штаммов холерных вибрионов и предотвращения холеры. 2 з.п. ф-лы, 1 ил., 2 табл., 3 пр.
Реферат
Предлагаемое изобретение относится к области медицинской микробиологии, связанной с изучением холерных вибрионов, а именно к определению ингибирующей способности между токсигенными и атоксигенными штаммами холерных вибрионов, выделенных от людей и из воды поверхностных водоемов.
На территории Российской Федерации из воды поверхностных водоемов постоянно выделяют атоксигенные штаммы холерных вибрионов, имеются единичные случаи выделения из воды и от людей завозных токсигенных штаммов (1, 2). Поэтому для практического здравоохранения наиболее действенным способом контроля и предотвращения холеры является постоянный мониторинг вод водоемов на наличие токсигенных штаммов возбудителя. Значимость атоксигенных штаммов холерных вибрионов, циркулирующих в поверхностных водоемах, не установлена. Кроме того не установлена их роль в подавлении размножения и сохранения токсигенных штаммов в воде водоемов. Это обстоятельство объяснимо отсутствием простых способов генодиагностики с целью определения ингибирующей активности токсигенных и атоксигенных штаммов Vibrio cholerae.
Известен способ изучения взаимодействия токсигенных и атоксигенных штаммов Vibrio cholerae (3), заключающийся в том, что смесь токсигенного и атоксигенного штаммов Vibrio cholerae в различных комбинациях и сроках инкубации высевают на два варианта питательной среды (с антибиотиками и без них), затем определяют число выросших колоний на каждой из питательных сред и по разности показателей определяют число клеток каждого штамма, после чего делают вывод о их конкурентных взаимоотношениях.
Однако для осуществления известного способа необходимо из исследуемого штамма различными способами селекционировать антибиотикорезистентный вариант, что требует затрат времени, питательных сред и антибиотиков. Кроме того, в процессе мутагенеза не исключена возможность мутационного изменения и других генов изучаемого вибриона. Поэтому результат, полученный таким способом на мутантном штамме, следует с большой осторожностью интерполировать в отношении исходного природного штамма.
За прототип выбран способ дифференциации штаммов Vibrio vulnificus типов А и В с помощью ПЦР (4), в котором используют два набора специфических олигонуклеотидных праймеров к гену 16S РНК, при этом для выявления Vibrio vulnificus типа А ПЦР проводили с праймерами VvAF1 и VvAR1, a для выявления типа В использовали пару праймеров VvBF1 и VvBR1, технология способа заключается в том, что из анализируемой пробы выделяют ДНК, которую исследуют в ПЦР с двумя наборами праймеров, а учет реакции проводят с помощью электорофореза по появлению специфического фрагмента, а именно в случае пары VvAF1 + VvAR1 размер фрагмента составляет 245 пар оснований, а с парой VvBF1 + VvBR1 - 841 пару оснований.
Недостатком способа является то, что его нельзя применять к штаммам Vibrio cholerae сероваров O1 и O139, так как у этих штаммов отсутствуют гены, на которых корректно осуществляется посадка праймеров VvAF1 + VvAR1 и VvBF1 + VvBR1.
Технической задачей предлагаемого изобретения является разработка простого, эффективного способа дифференциации токсигенных и атоксигенных штаммов холерных вибрионов для быстрого определения способности токсигенных штаммов выживать в водных объектах.
Поставленная задача достигается тем, что дифференциацию токсигенных и атоксигенных штаммов холерных вибрионов O1 серогруппы проводят по ингибирующей активности, включая следующие стадии:
а) смешивают в одной емкости объемом 100 мл стерильную водопроводную воду и клетки двух штаммов холерных вибрионов токсигенных (ctx+tcA+) и атоксигенных (ctx-tcA-) в соотношении 1:1 до конечной концентрации 104 м.к. на мл, пробу инкубируют при 25°С 24, 72 часа или более;
б) вносят 0,5 мл жидкости после инкубации в микропробирки объемом 1,5 мл и выделяют ДНК;
в) проводят амплификацию ДНК со специфическими праймерами к INDEL-гену cheA, имеющими следующие последовательности
г) проводят анализ продуктов амплификации с помощью электрофореза в 10% полиакриламидном геле;
д) дифференцируют полученный результат по наличию специфических аллелей для каждого из штаммов - атоксигенных, имеющих размер 193 п.о., и токсигенных - 169 п.о., наглядность присутствия которых дает возможность делать вывод о наличии ингибирующей активности или ее отсутствии у исследуемых штаммов.
При этом, инкубационная смесь объемом 25 мкл для амплификации состоит из следующих реагентов:
- 1,5 мМ Mg-буфера,
- 0,2 мМ смеси дНТФ,
- 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера),
- 25 нг ДНК-матрицы,
- 0,25 ед. ДНК-полимеразы,
- оставшийся объем - вода.
Кроме того реакция ПЦР проходит с соблюдением следующих температурных режимов: денатурация при 95°С - 3 мин (1 цикл); затем 35 циклов: денатурация при 95°С - 20 с, отжиг при 60°С - 20 с, элонгация при 72°С - 20 с; синтез при 72°С - 7 мин (1 цикл).
Способ осуществляется следующим образом.
Для проведения способа были сконструированы новые специфические праймеры на INDEL-гены Vibrio cholerae (Таблица 1). Последние представляют собой вставки-делеции (insertions/deletions) коротких фрагментов ДНК, при этом аллели локуса cheA могут иметь размер фрагмента 193 п.о. или размер фрагмента 169 п.о. Токсигенные штаммы (ctx+tcpA+) содержат только аллель размером 169 п.о., атоксигенные штаммы несут аллель размером 193 п.о. (см. таблицу 2).
В таблице 2 отражено распределение аллелей INDEL-гена у токсигенных О1 серогруппы (ctx+tcpA+) и атоксигенных O1 (ctx-tcpA-) штаммов Vibrio cholerae, выделенных в различные периоды на территории Российской Федерации.
Изучают взаимную ингибирующую активность ctx+tcpA+ и ctx-tcpA- штаммов в следующей последовательности:
Первоначально готовят по стандарту мутности 1-млрдные взвеси исследуемых штаммов в физиологическом растворе. Во флакон емкостью 100 мл, содержащий 50 мл стерильной водопроводной воды вносят взвесь ctx-tcpA-и ctx+tcpA+ исследуемых культур в соотношении 1:1 до конечной концентрации каждого 104 клеток в мл. Флакон инкубируют при комнатной температуре. В различные интервалы времени (0, 24, 72 или более часов) из флакона отбирают пробы для выделения ДНК или для двух последовательных пассажей через пептонную воду для определения жизнеспособных клеток вибрионов. Для пассажа 0,5 мл пробы добавляют к 4,5 пептонной воды. Пробы пептонной воды инкубируют 3 часа при 37°С. Затем из отобранных проб воды из флакона и пептонной воды после подращивания выделяют ДНК согласно Методическим указания МУ 1.3.1791-9 «Организация работы при исследовании методом ПЦР материала, инфицированного микроорганизмами 1 и 2 группы патогенности-М.2003-38 с. Для этого 0,5 мл пробы прогревают 30 минут при 100°С.
Следующим этапом проводят амплификацию исследуемой ДНК со специфическими праймерами к INDEL-локусу cheA.
Амплификацию проводят по следующей схеме: денатурация при 95°С - 3 мин (1 цикл); затем 35 циклов: денатурация при 95°С - 20 с, отжиг при 60°С - 20 с, элонгация при 72°С - 20 с; синтез при 72°С - 7 мин (1 цикл).
Инкубационная смесь объемом 25 мкл содержит: 1,5 мМ Mg-буфер, 0,2 мМ смеси дНТФ, 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера), 25 нг ДНК-матрицы, 0,25 ед. ДНК-полимеразы, оставшийся объем - вода. Анализ продуктов амплификации проводят с помощью электрофореза в 10% полиакриламидном геле.
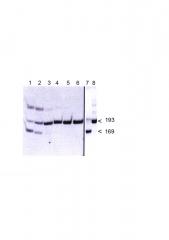
Результат амплификации с праймерами cheA оценивают по появлению продукта амплификации, специфичного для каждого штамма (см. фото).
На фото виден, результат электрофореза в 10% геле полиакриламида продуктов амплификации смеси, содержащей два штамма V. cholerae со специфическими праймерами к INDEL-гену cheA, 1 - распределение аллелей в исходной смеси нетоксигенного ctx-tcpA - штамма V. cholerae 55 и токсигенного ctx+tcpA+ штамма V. cholerae 81 в «нулевой точке», 2, 3 - первый и второй пассаж исходной смеси в пептонной воде в течение 3 часов при 37°С, 4 - инкубация исходной смеси 24 часа при 25°С; 5 и 6 - первый и второй пассаж смеси в пептонной воде в течение 3 часов при 37°С, 7 - ДНК из ctx+tcpA+ клеток токсигенного штамма 81 содержат аллель размером 169 п.о., 8 - ДНК из ctx-tcpA- клеток нетоксигенного штамма 55 содержат аллель размером 193 п.о.
Примеры конкретного выполнения
Пример 1
Штамм Vibrio cholerae O1 81 (ctx+tcpA+) был выделен летом 2014 года из реки Темерник, г. Ростов-на-Дону и несет аллель локуса cheA 169 п.о. Штамм Vibrio cholerae O1 55 (ctx- tcpA-) был выделен летом 2014 года из реки реки Неман, г. Калининград и несет аллель локуса cheA размером 193 п.о. Штаммы культивируют 18 часов на агаре Мартена (рН 8,5) при 37°С.
После этого осуществляют по вышеописанной технологии изучение взаимной ингибирующей активности, а именно выделяют ДНК и проводят ПЦР со специфическими праймерами к INDEL-гену cheA. Результат амплификации с праймерами cheA оценивается по появлению продукта амплификации, специфичного для каждого штамма. В случае наличия конкурентной активности (штамм 55 ингибирует штамм 81) после совместного культивирования исчезает аллель, соответствующий подавляемому штамму(см. фото).
Из фото видно, что в отличие от исходной смеси, после инкубации смеси и пассажей через пептонную воду начинает доминировать полоса аллели гена cheA. Это доказывает, что нетоксигенный штамм V. cholerae 55 при совместной инкубации подавляет токсигенный ctx+tcpA+ штамм V. cholerae 81.
Вывод. Нетоксигенный штамм V. cholerae 55 при совместной инкубации подавляет токсигенный ctx+tcpA+ штамм V. cholerae 81.
Пример 2
1. Исследуют штаммы Vibrio cholerae O1 3644 ctx+tcpA+, который был выделен в августе 1970 года из сточных вод г. Астрахани. Штамм 3644 несет аллель размером 169 п.о. локуса cheA. Штамм Vibrio cholerae 55 ctx-tcpA- был выделен летом 2014 года из реки Неман, г. Калининград и несет аллель размером 193 п.о. локуса cheA.
Дальнейшие исследования проводят, как описано в Примере 1.
Результат амплификации с праймерами cheA оценивается по появлению продукта амплификации, специфичного для каждого штамма. Алелль, соответствующая Vibrio cholerae 3644, ctx+ исчезает через 14 суток совместного культивирования, что указывает на наличие конкурентной активности штамма 55 в отношении штамма 3644.
Вывод. Нетоксигенный штамм V. cholerae 55 при совместном культивировании через 14 суток подавляет токсигенный ctx+ штамм V. cholerae 3644.
Пример 3
Исследуют штаммы Vibrio cholerae O1 3265 ctx+ который был выделен в летом 2014 года от больного человека в г. Москве. Штамм 3265 несет аллель размером 169 п.о. локуса cheA. Штамм Vibrio cholerae O1 55 был выделен летом 2014 года из реки Неман, г. Калининград и несет аллель локуса cheA размером 193 п.о.
Дальнейшие исследования проводят, как описано в Примере 1.
Результат амплификации с праймерами cheA оценивается по появлению продукта амплификации, специфичного для каждого штамма. Алелль, соответствующая Vibrio cholerae 55 ctx- исчезает через 14 суток совместного культивирования, что указывает на наличие подавления токсигенным штаммом Vibrio cholerae 3265 нетоксигенного штамма 55.
Таким образом, по результатом изучения ингибирующей активности можно сделать вывод, что изученные токсигенные штаммы Vibrio cholerae 81 (ctx+tcpA+), Vibrio cholerae 3644 (ctx+tcpA+) и Vibrio cholerae 3265 (ctx+tcpA+) различаются по способности противостоять ингибирующей активности атоксигенных штаммов вибрионов. Штаммы Vibrio cholerae 81, Vibrio cholerae 3644 погибают, а токсигенный штамм Vibrio cholerae 3265 выживает.
Следовательно, штамм Vibrio cholerae 3265 (ctx+tcpA+) обладает максимальной способностью противостоять ингибирующей активности нетосигенных вибрионов и представляет максимальную угрозу при попадании в воду открытых водоемов.
Использование предлагаемого изобретения позволит за счет простого способа генной диагностики эффективно осуществлять мониторинг вибриофлоры поверхностных водоемов путем определения ее роли в подавлении размножения и предотвращении сохранения токсигенных холерных вибрионов в воде поверхностных водоемов.
Источники информации
1. Ежова М.И., Кругликов В.Д., Водопьянов А.С., Водопьянов C.O., Шестиалтынова И.С., Олейников И.П., Непомнящая Н.Б., Подойницына О.А. ХОЛЕРНЫЕ ВИБРИОНЫ O1 СЕРОГРУППЫ, ВЫДЕЛЕННЫЕ ИЗ ВОДНЫХ ОБЪЕКТОВ РОСТОВА-НА-ДОНУ В ХОДЕ МОНИТОРИНГА В 2008-2012. // Проблемы особо опасных инфекций. 2013. №4. С.56-59.
2. Водопьянов А.С., Мазрухо А.Б., Водопьянов C.O., Мишанькин Б.Н., Кругликов В.Д., Архангельская И.В., Олейников И.П., Зубкова Д.А., Монахова Е.В., Григоренко Л.В. VNTR-генотипирование штаммов Vibrio cholerae, выделенных из объектов внешней среды на территории Российской Федерации в 2012 году. // Журн. микробиол., 2014, 2, С. 46-51.
3. Paul К, Ghosh Α., Sengupta N. and Chowdhury R. Competitive Growth Advantage of Nontoxigenic Mutants in the Stationary Phase in Archival Cultures of Pathogenic Vibrio cholerae Strains // INFECTION AND IMMUNITY, 2004, Vol. 72, No. 9, P. 5478-5482.
4. Katrina V. Gordon, Michael C. Vickery, Angelo DePaola, Christopher Staley, and Valerie J. Harwood. Real-Time PCR Assays for Quantification and Differentiation of Vibrio vulnificus Strains in Oysters and Water. // APPLIED AND ENVIRONMENTAL MICROBIOLOGY, 2008, Vol. 74, No. 6, P. 1704-1709.
1. Способ дифференциации токсигенных и атоксигенных штаммов холерных вибрионов O1 серогруппы по ингибирующей активности, включающий следующие стадии:а) смешивают в одной емкости объемом 100 мл стерильную водопроводную воду и клетки двух штаммов холерных вибрионов токсигенных (ctx+ tcA+) и атоксигенных (ctx- tcA-) в соотношении 1:1 до конечной концентрации 104 м.к. на мл, пробу инкубируют при 25°С 24, 72 ч или более;б) вносят 0,5 мл жидкости после инкубации в микропробирки объемом 1,5 мл и выделяют ДНК;в) проводят амплификацию ДНК со специфическими праймерами к INDEL-гену cheA, имеющими следующие последовательностиcheA up - ACTTCGCGAGATTCATCAGAAcheA dn - CTGTTTCTAGTGATGCGAAAGC,г) проводят анализ продуктов амплификации с помощью электрофореза в 10% полиакриламидном геле;д) дифференцируют полученный результат по наличию специфических аллелей для каждого из штаммов - атоксигенных, имеющих размер 193 п.о., и токсигенных -169 п.о., наглядность присутствия которых дает возможность делать вывод о наличии ингибирующей активности или ее отсутствии у исследуемых штаммов.
2. Способ по п. 1, отличающийся тем, что инкубационная смесь объемом 25 мкл для амплификации состоит из следующих реагентов:1,5 мМ Mg-буфера,0,2 мМ смеси дНТФ,1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера),25 нг ДНК-матрицы,0,25 ед. ДНК-полимеразы,оставшийся объем - вода;
3. Способ по п. 1, отличающийся тем, что реакция ПЦР проходит с соблюдением следующих температурных режимов: денатурация при 95°С - 3 мин (1 цикл); затем 35 циклов: денатурация при 95°С - 20 с, отжиг при 60°С - 20 с, элонгация при 72°С - 20 с; синтез при 72°С - 7 мин (1 цикл).